随着人们对环境保护和可持续发展关注度的提高,燃料乙醇生产过程中存在的废水排放污染和水处理成本高等问题日益凸显[1]。每生产1 t燃料乙醇约产生20 t废水[2],且随着燃料乙醇生产规模扩大,待处理废水量也逐年增加。燃料乙醇清洁生产迫在眉睫。
燃料乙醇生产过程产生的废水包括清液和二次凝水等。其中,清液含有丰富的营养物质,若能被回用作为酵母菌的发酵培养基溶剂,可以降低生产用水成本[3];二次凝水具有固形物含量少、金属离子浓度低等特点,具有再生回用潜力[4]。但是,乙醇生产废水中可能含有对酵母菌生长和生产乙醇具有抑制作用的有机酸等组分。这些有机酸的来源包括发酵培养基组分和酵母菌细胞自身的新陈代谢产物[5-6]。目前,尚未见清液中有机酸种类和含量的报道,但Sagne等[7]和Couallier等[8]在二次凝水中已检测出甲酸、乙酸、丙酸、丁酸、戊酸和己酸,且乙酸、丙酸、丁酸、戊酸和己酸对酵母菌发酵表现出不同程度的抑制作用。这些有机酸属于弱电解质,在水溶液中发生不完全解离[9]。其中,未解离的有机酸通过扩散方式进入胞内,并在胞内发生解离,导致胞内质子浓度增加,膜电位降低;为维持最佳胞内酸碱水平,细胞必须通过ATP产生更多能量,使过量的质子被运出胞外;当培养基中的营养物质供给不足时,细胞代谢水平降低,酵母菌发酵过程受阻[2, 10]。因此,去除部分有机酸有利于酵母菌生长和发酵[6]。目前,发酵废水的处理方法主要有膜分离和离子交换等[7, 11-13]。膜分离法对小分子化合物的选择性分离仍较困难,且存在膜污染等问题;离子交换法的处理速率快,但需要筛选合适的树脂,即要求粒度均匀、强度好、耐温性能好、水处理量大等[14-15]。因此,本研究以夏季和秋季燃料乙醇生产过程的清液和二次凝水为研究对象,分析样品中的有机酸种类及含量,解析不同有机酸对酵母菌生长和乙醇生产的影响,并对D318离子交换树脂处理前后水样回用于乙醇发酵过程的结果进行比较,评价清液和二次凝水回用于酵母菌乙醇发酵过程的可行性。
1 材料与方法 1.1 材料水样:二次凝水和清液分别于2019年5月(夏季)和8月(秋季)取自中粮生物化学(安徽)股份有限公司的乙醇生产车间。
菌株:酿酒酵母Saccharomyce cerevisiae NJ-2019,分离自安琪耐高温酿酒高活性干酵母, 燃料乙醇工业生产菌株。
试剂:酵母膏、蛋白胨、葡萄糖、氢氧化钠、盐酸,琥珀酸、乙酸、丙酸、乳酸、柠檬酸、延胡索酸、苹果酸、磷酸二氢钾、磷酸均为国产分析纯。乙腈和甲醇为国产色谱级。
仪器:离心机(Avanti J-26S XP,Beckman)、恒温培养箱(LRH-150型,上海一恒科学仪器有限公司)、恒温摇床(QHZ-98BS型,常州普天仪器制造有限公司)、超净工作台(YJ-VS-2型,无锡一净净化设备有限公司)、酶标仪(Multiskan FC型,Thermo Fisher Scientific)、液相色谱(1290型,Agilent)、生物传感仪(SBA-40C型,山东微生物研究所)。
1.2 方法 1.2.1 种子培养培养基:1%酵母膏,2%蛋白胨,2%葡萄糖。
培养条件:自然pH值,温度30℃,200 r/min,培养至对数生长中期,作为备用菌种。
1.2.2 乙醇发酵培养基:1%酵母膏,2%蛋白胨,20%葡萄糖。
培养条件:分别以纯水、清液、二次凝水,以及处理后的清液和二次凝水为溶剂配制发酵培养基,用2%盐酸溶液或者2%氢氧化钠溶液调整培养基pH值至3.7;接种(接种量为10%)后置30℃,100 r/min摇床发酵;每隔4—6 h取样,于600 nm处测定样品OD值;将样品在8 000×g条件下离心,取上清液,用SBA-40C生物传感仪检测上清液中的乙醇浓度和葡萄糖浓度[16-17]。
1.2.3 有机酸的测定(1) 标准溶液配制
以流动相溶解各种有机酸标准品,定容至25 mL容量瓶中,此溶液为1.0 mg/mL单标储备液。其中,乙酸、琥珀酸、丙酸、苹果酸和柠檬酸流动相为甲醇-水(V:V=55:45),延胡索酸流动相为乙腈-0.4%磷酸二氢钾溶液(V:V=20:80),乳酸流动相为0.05%磷酸-甲醇(V:V=90:10)。临用前用流动相稀释浓度依次为0.2,0.4,0.6,0.8,1.0 mg/mL标准液,测定3组平行数据,取平均值绘制标准曲线。
(2) 样品测定
乙酸、琥珀酸、丙酸、苹果酸和柠檬酸用液相色谱法测定:色谱柱为Prevail有机酸分析柱(5 μm,250 mm×4.6 mm, Grace, USA),流动相流速为1 mL/min,进样体积为20 μL,柱温为25℃,利用紫外检测器检测,波长为215 nm。其中,琥珀酸、丙酸和柠檬酸的最低检出限为0.05 g/L;乙酸、苹果酸的最低检出限为0.02 g/L。
延胡索酸:采用C18色谱柱, 流动相:乙腈-0.4%磷酸二氢钾溶液(V:V=20:80),检测波长210 nm,其他条件同上。延胡索酸的最低检出限为0.000 5 g/L。
乳酸:C18色谱柱, 流动相为0.05%磷酸-甲醇(V:V=90:10),检测波长为210 nm,其他条件同上。乳酸的最低检出限为0.02 g/L。
1.2.4 单一种有机酸对乙醇生产的影响为评估清液和二次凝水的回用潜力,分别考察单一种有机酸对酿酒酵母S.cerevisiae NJ-2019生长和发酵生产乙醇的影响。根据清液和二次凝水样品有机酸检测结果,分别设置单一种有机酸在发酵培养基中的初始浓度梯度,考察其对酵母OD600值和乙醇产量的影响。培养基中初始有机酸浓度为0时的OD600值和乙醇产量计为100%。
1.2.5 清液和二次凝水直接回用对乙醇生产的影响在1.2.4节的试验基础上,进一步考察混合有机酸对乙醇生产的影响。以纯水为溶剂配制发酵培养基作为对照;以混合有机酸-水溶液为溶剂配制发酵培养基,使培养基中乙酸、丙酸、乳酸、柠檬酸、琥珀酸的浓度与样品清液或二次凝水相同,获得模拟清液和模拟二次凝水;分别以清液和二次凝水样品为溶剂,配制发酵培养基。将上述发酵培养基用于发酵生产乙醇,研究其对酿酒酵母S.cerevisiae NJ-2019生长和发酵生产乙醇的影响。其中酿酒酵母S.cerevisiae NJ-2019比生长速率μ被定义为单位质量的细胞在单位时间内所增加的细胞质量,
| $ \mu = \left( {\ln {N_t} - \ln {N_0}} \right)/t, $ | (1) |
其中,μ为比生长速率,h-1;N0、Nt分别为培养前后的生物量,t为时间,h。
1.2.6 有机酸的分离利用大孔弱碱性阴离子交换树脂(D318,安徽皖树化工有限公司)对夏季取样的清液和二次凝水进行静态吸附处理,即将树脂与待处理液体以质量体积比1:20充分混匀,密塞,置于水浴振荡器中,30℃振荡2 h,然后过滤获得滤液。滤液用流动相稀释,离心、定容、摇匀后,经0.45 μm滤膜过滤后测定其有机酸含量。
1.2.7 处理后的清液和二次凝水回用对乙醇生产的影响以处理后的水样作为溶剂,配制酿酒酵母S.cerevisiae NJ-2019的发酵培养基; 以未处理清液和二次凝水为溶剂时的酵母菌比生长速率为对照,测定和比较酵母菌培养8 h时的比生长速率, 以及发酵8 h时的乙醇产量。
2 结果与分析 2.1 标准曲线测定结果根据测试结果计算和拟合得到的乙酸、琥珀酸、丙酸、苹果酸、柠檬酸、延胡索酸和乳酸的回归方程和相关系数如表 1所示。从表 1可以看出,7种有机酸在浓度为0.2—1.0 mg/mL时,液相色谱的峰面积与其浓度均呈线性关系,且此测试条件下获得的相关系数均大于0.999 5。说明该测试方法适用于含7种有机酸的样品检测。
| 有机酸 Organic acids |
回归方程 Regression equations |
相关系数 Correlation coefficients |
| 乙酸 Acetic acid |
y=477.85x-0.25 | R2=1.000 0 |
| 琥珀酸 Succinic acid |
y=675.35x-1.67 | R2=0.999 8 |
| 丙酸 Propionic acid |
y=484.15x-1.99 | R2=0.999 9 |
| 苹果酸 Malic acid |
y=848.3x-0.46 | R2=1.000 0 |
| 柠檬酸 Citric acid |
y=1244.9x-2.67 | R2=1.000 0 |
| 延胡索酸 Fumaric acid |
y=114044x+66.61 | R2=0.999 8 |
| 乳酸 Lactic acid |
y=719x+1.78 | R2=1.000 0 |
2.2 样品中有机酸含量测定结果
如表 2所示,乙酸、乳酸、丙酸和柠檬酸是清液中的主要有机酸。现有报道中,乙酸、琥珀酸、乳酸、丙酸、延胡索酸、苹果酸和柠檬酸对酵母菌产生抑制作用的临界浓度分别为2,2,4,1.5,10,5和15 g/L[2, 18-20]。表明清液中的乙酸、乳酸、丙酸和柠檬酸可能是酵母菌生长和发酵的抑制剂。乙酸和乳酸是二次凝水样品中的主要有机酸,且含量低于目前报道的抑制临界浓度,表明二次凝水可能具有良好的回用潜力。
| 水样 Water samples |
季节 Seasons |
乙酸 Acetic acid |
琥珀酸 Succinic acid |
乳酸 Lactic acid |
丙酸 Propionic acid |
延胡索酸 Fumaric acid |
苹果酸 Malic acid |
柠檬酸 Citric acid |
| 清液 Supernatant |
夏季 Summer |
2.83±0.02 | 0.42±0.03 | 7.02±0.02 | 2.28±0.02 | - | - | 2.12±0.03 |
| 秋季 Autumn |
0.54±0.02 | - | 2.06±0.04 | 0.20±0.01 | 0.01±0.01 | 0.29±0.01 | 1.19±0.02 | |
| 二次凝水 Secondary condensate |
夏季 Summer |
0.81±0.01 | - | 0.03±0.01 | - | - | - | - |
| 秋季 Autumn |
0.18±0.01 | - | - | - | - | - | - | |
| 注:“-”表示低于检出限 Note:"-" indicated that the sample concentration was lower than the detection limit |
||||||||
2.3 单一种有机酸对乙醇生产的影响 2.3.1 乙酸
根据夏季和秋季的清液和二次凝水样品中检测到的乙酸浓度,设计乙酸在培养基中的初始浓度梯度为0.0,0.2,1.0,3.0 g/L,考察乙酸浓度对酵母OD600值和乙醇产量的影响。结果如图 1所示:当初始乙酸浓度从0.0 g/L递增至3.0 g/L时,菌体OD600值略有降低,而乙醇产量无明显变化。当初始乙酸浓度为0.2 g/L时,OD600值降低2.46%;初始乙酸浓度为3.0 g/L时,OD600值降低4.16%。表明乙酸单独存在于发酵培养基中时,对酿酒酵母S.cerevisiae NJ-2019发酵生产乙醇未表现出明显的抑制作用。

|
| 图 1 乙酸对酿酒酵母S.cerevisiae NJ-2019生长及其发酵生产乙醇的影响 Fig. 1 Effects of acetic acid on the growth and ethanol production of S.cerevisiae NJ-2019 |
2.3.2 乳酸
根据夏季和秋季的清液和二次凝水样品中检测到的乳酸浓度,设计乳酸在培养基中的初始浓度分别为0.0,0.2,2.0,7.0 g/L,考察乳酸浓度对酵母OD600值和乙醇产量的影响。结果如图 2所示:当乳酸初始浓度在0.0—2.0 g/L时,乳酸对酵母OD600值和乙醇产量无显著影响;当乳酸初始浓度为7.0 g/L时,OD600值降低8.15%,乙醇产量降低4.66%,表明培养基中乳酸初始浓度达到7.0 g/L时,单一的乳酸可以明显抑制乙醇生产。

|
| 图 2 乳酸对酿酒酵母S.cerevisiae NJ-2019生长及其发酵生产乙醇的影响 Fig. 2 Effects of lactic acid on the growth and ethanol production of S.cerevisiae NJ-2019 |
2.3.3 丙酸对乙醇生产的影响
根据夏季和秋季的清液和二次凝水样品中检测到的丙酸浓度,设计丙酸在培养基中的初始浓度分别为0.0,0.2,1.0,2.5 g/L,考察丙酸浓度对酵母OD600值和乙醇产量的影响。结果如图 3所示:当丙酸初始浓度在0.0—0.2 g/L时,丙酸对OD600值和乙醇产量无显著影响;当丙酸初始浓度为1.0 g/L时,OD600值降低20.71%,乙醇产量降低16.49%,表明培养基中丙酸浓度达到1.0 g/L时,单一的丙酸对乙醇生产抑制作用明显。

|
| 图 3 丙酸对酿酒酵母S.cerevisiae NJ-2019生长及其发酵生产乙醇的影响 Fig. 3 Effects of propionic acid on the growth and ethanol production of S.cerevisiae NJ-2019 |
2.3.4 柠檬酸对乙醇生产的影响
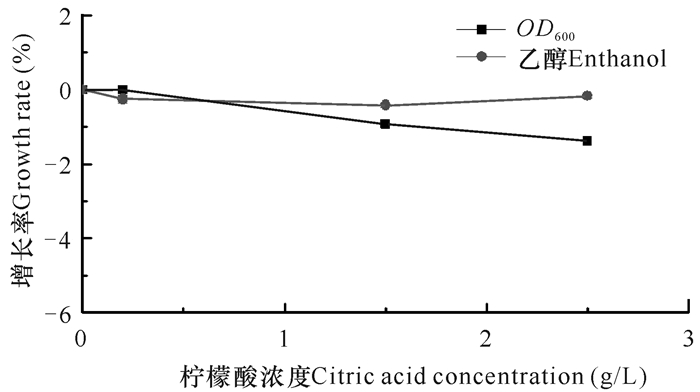
根据夏季和秋季的清液和二次凝水样品中检测到的柠檬酸浓度,设计柠檬酸在培养基中的初始浓度分别为0.0,0.2,1.5,2.5 g/L,考察柠檬酸浓度对酵母OD600值和乙醇产量的影响。结果如图 4所示:当柠檬酸初始浓度为0.0—2.5 g/L时,发酵结束后菌体OD600值和乙醇产量无显著变化。表明单一的柠檬酸对乙醇生产无显著影响。
|
| 图 4 柠檬酸对酿酒酵母S.cerevisiae NJ-2019生长及其发酵生产乙醇的影响 Fig. 4 Effects of citric acid on the growth and ethanol production of S.cerevisiae NJ-2019 |
2.3.5 琥珀酸对乙醇生产的影响
根据夏季和秋季的清液和二次凝水样品中检测到的琥珀酸浓度,设计琥珀酸在培养基中的初始浓度分别为0.0,0.2,0.5,1.0 g/L,考察琥珀酸浓度对酵母OD600值和乙醇产量的影响。结果如图 5所示:当琥珀酸初始浓度为0.0—1.0 g/L时,发酵结束后菌体OD600值和乙醇产量无显著变化。表明单一的琥珀酸未对乙醇生产产生显著影响。

|
| 图 5 琥珀酸对酿酒酵母S.cerevisiae NJ-2019生长及其发酵生产乙醇的影响 Fig. 5 Effects of succinic acid on the growth and ethanol production of S.cerevisiae NJ-2019 |
2.4 清液和二次凝水直接回用对乙醇生产的影响
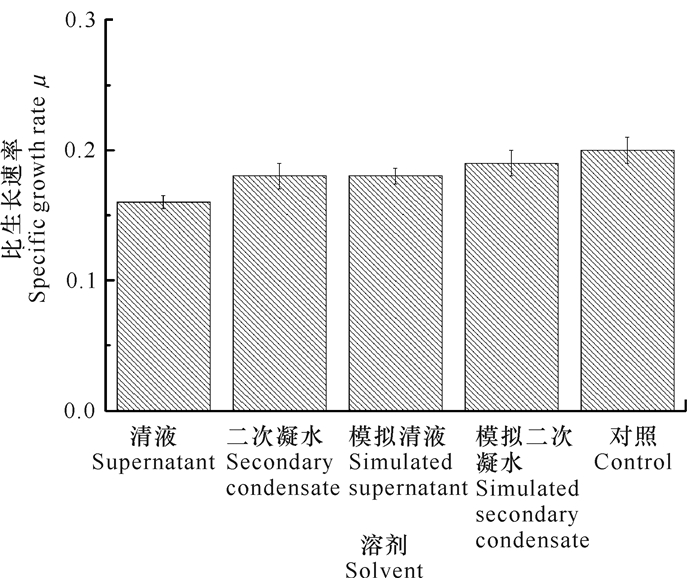
如图 6所示,对照组酵母菌Saccharomyce NJ-2019的比生长速率μ为0.21,模拟清液和模拟二次凝水的比生长速率分别为0.18和0.19,混合有机酸对酵母菌的生长表现出明显的抑制作用,这可能是由于有机酸之间的协同作用[21-22]。从图 6还可以看出,模拟清液和模拟二次凝水得到的比生长速率μ均大于对应的清液和二次凝水样品,表明在清液和二次凝水中还含有其他种类的抑制剂。在进行样品成分分析时,在清液、二次凝水中也检测出了糠醛、杂醇等物质,这些物质可以通过与有机酸的协同作用来增强有机酸的抑制能力。因此,考虑去除或者部分去除清液和二次凝水中的有机酸。
|
| 图 6 模拟液对酿酒酵母S.cerevisiae NJ-2019生长的影响 Fig. 6 Effects of simulated liquids on the growth of S.cerevisiae NJ-2019 |
经过离子交换处理后,清液中除了仍含有2.13 g/L的乳酸,其余有机酸均低于检测限,而二次凝水中均未检测出有机酸。表明样品中的乙酸、乳酸、丙酸、柠檬酸和琥珀酸已被大部分去除。
2.5 处理后清液和二次凝水回用对乙醇生产的影响如表 3所示,处理后的清液和二次凝水分别使酵母菌比生长速率提高14.22%和13.23%;其乙醇产量虽然仍低于纯水,但与清液和二次凝水直接回用相比,可使乙醇发酵产量分别提高10.11%和9.85%。
| 溶剂 Solvent |
比生长速率μ Specific growth rate μ |
乙醇产量 Ethanol production (%) |
| 纯水 Pure water |
0.21±0.02 | 13.66±0.12 |
| 清液 Supernatant |
0.16±0.03 | 10.50±0.34 |
| 处理后清液 Treated supernatant |
0.183±0.01 | 11.56±0.33 |
| 二次凝水 Secondary condensate |
0.18±0.02 | 11.68±0.21 |
| 处理后二次凝水 Treated secondary condensate |
0.204±0.01 | 12.83±0.13 |
3 结论
本研究以燃料乙醇实际工业生产过程排放的清液和二次凝水为研究对象,分析其有机酸组成及其对酿酒酵母S.cerevisiae NJ-2019乙醇发酵过程的影响,确定单一的乳酸和丙酸组分即可显著抑制乙醇生产,乳酸和丙酸对酿酒酵母S.cerevisiae NJ-2019生长和发酵的最低抑制浓度分别为7.0 g/L和1.0 g/L。去除或者部分去除清液和二次凝水中的有机酸能使乙醇发酵产量分别提高10.11%和9.85%。表明燃料乙醇发酵过程产生的清液和二次凝水具有回用的潜力,有利于实现乙醇生产过程节能减排。
| [1] |
KLEMES J J, VARBANOV P S, HUISINGH D. Recent cleaner production advances in process monitoring and optimization[J]. Journal of Cleaner Production, 2012, 34: 1-8. DOI:10.1016/j.jclepro.2012.04.026 |
| [2] |
韩秀丽, 赵浩浩, 鲁峰, 等. 有机酸对纤维素酶解和纤维乙醇发酵的影响[J]. 郑州大学学报:工学版, 2015, 36(6): 5-9. |
| [3] |
赵江, 赵华. 酒糟滤液全回用技术在酒精发酵上的应用[J]. 食品研究与开发, 2008, 29(6): 75-78. DOI:10.3969/j.issn.1005-6521.2008.06.021 |
| [4] |
李静, 刘景洋, 乔琦, 等. 反渗透膜处理含有机酸凝结水技术[J]. 化工进展, 2012, 31(12): 2648-2651. |
| [5] |
NARENDRANATH N V, THOMAS K C, INGLEDEW W M. Effects of acetic acid and lactic acid on the growth of Saccharomyces cerevisiae in a minimal medium[J]. Journal of Industrial Microbiology and Biotechnology, 2001, 26(3): 171-177. DOI:10.1038/sj.jim.7000090 |
| [6] |
OMAR F N, RAHMAN N A, HAFID H S, et al. Separation and recovery of organic acids from fermented kitchen waste by an integrated process[J]. African Journal of Biotechnology, 2009, 8(21): 5807-5813. DOI:10.5897/AJB09.992 |
| [7] |
SAGNE C, FARGUES C, LEWANDOWSKI R, et al. Screening of reverse osmosis membranes for the treatment and reuse of distillery condensates into alcoholic fermentation[J]. Desalination, 2008, 219: 335-347. DOI:10.1016/j.desal.2007.05.020 |
| [8] |
COUALLIER E M, RUIZ B S, LAMELOISE M L, et al. Usefulness of reverse osmosis in the treatment of condensates arising from the concentration of distillery vinasses[J]. Desalination, 2006, 196(1): 306-317. |
| [9] |
PUNITA V V, SHAH B G, TRIVEDI G S, et al. Separation of inorganic and organic acids from glyoxal by electrodialysis[J]. Desalination, 2001, 140(1): 47-54. DOI:10.1016/S0011-9164(01)00353-8 |
| [10] |
OLIVA J M, NEGRO M J, SÁEZ F, et al. Effects of acetic acid, furfural and catechol combinations on ethanol fermentation of Kluyveromyces marxianus[J]. Process Biochemistry, 2006, 41(5): 1223-1228. DOI:10.1016/j.procbio.2005.12.003 |
| [11] |
MAVROV V, BIHRES E. Reduction of water consu-mption and wastewater quantities in the food industry by water recycling using membrane processes[J]. Desalination, 2000, 131: 75-86. DOI:10.1016/S0011-9164(00)90008-0 |
| [12] |
LI X M, LI W F, WANG S J, et al. Treatment of stainless steel pickling wastewater by ion resin exchange and activated carbon adsorption[J]. Advanced Materials Research, 2012, 518-523: 2956-2960. DOI:10.4028/www.scientific.net/AMR.518-523.2956 |
| [13] |
ZENG Y G, LI L. Study on treatment of heavy metal ions of chemical wastewater by ion exchange resin[J]. Advanced Materials Research, 2014, 955-959: 2230-2233. DOI:10.4028/www.scientific.net/AMR.955-959.2230 |
| [14] |
LU J, QIN Y Y, WU Y L, et al. Recent advances in ion-imprinted membranes:Separation and detection via ion-selective recognition[J]. Environmental Science:Water Research and Technology, 2019, 5: 1626-1653. DOI:10.1039/C9EW00465C |
| [15] |
TAN HENRY K S. Ion exchange accompanied by neutralization reaction:Removal of dilute acids by anion exchange[J]. Separation Science and Technology, 2000, 35(1): 23-38. DOI:10.1081/SS-100100141 |
| [16] |
何珣, 蒋学剑, 花加伟, 等. 原位预处理甘蔗糖蜜对耐高温酿酒酵母突变株Saccharomyces cerevisiae AQ生产乙醇的影响[J]. 广西科学, 2016, 23(1): 1-6. |
| [17] |
任婷月, 周万里, 张利群, 等. 一种检测葡萄糖氧化酶活力的新方法[J]. 食品与发酵工业, 2015, 41(1): 212-215. |
| [18] |
王宝石, 李林波, 武忠伟, 等. 高浓度柠檬酸对酿酒酵母生长的抑制效应[J]. 中国酿造, 2018, 37(6): 56-60. |
| [19] |
孜力汗.废液全循环工艺中有机酸积累对自絮凝颗粒酵母酒精连续发酵影响的研究[D].大连: 大连理工大学, 2002. http://cdmd.cnki.com.cn/Article/CDMD-10141-2002112184.htm
|
| [20] |
赵伟, 赵兵涛, 次仁潘多, 等. 酿酒酵母代谢有机酸对乙醇发酵的影响[J]. 可再生能源, 2017, 35(7): 971-977. DOI:10.3969/j.issn.1671-5292.2017.07.004 |
| [21] |
任立伟.纤维质酒精发酵的菌种选育及发酵条件的研究[D].长春: 吉林农业大学, 2003. http://cdmd.cnki.com.cn/Article/CDMD-10193-2003097649.htm
|
| [22] |
秦艳, 申乃坤, 莫勇生, 等. 黄浆水与木薯粉混合发酵高浓度乙醇的发酵条件[J]. 广西科学, 2012, 19(3): 249-252. DOI:10.3969/j.issn.1005-9164.2012.03.014 |


