苯丙氨酯是一种具有镇静作用的中枢性骨骼肌松弛药,最早由Siegfried于1960年成功合成,在日本和德国首先上市。苯丙氨酯片主要用于治疗肌肉痉挛、肌强直等肌肉异常紧张、肌肉疼痛和神经痛,也可用于肩颈关节周围炎、风湿性关节炎、韧带损伤、肌腱炎[1]、儿童Lennox-Gastaut综合征的辅助治疗[2]等,其不良反应较少,应用较广,目前仅发现一例苯丙氨酯滥用与耐受病例[3]。苯丙氨酯原料及其片剂的现行国内标准为《中国药典》1995年版二部(ChP1995)[4]和《国家药品标准》化学药品地方标准上升国家标准第十四册[5]。国外药典中,仅在《日本药局方》外医药品规格1997年版[6]有收载。现行标准中苯丙氨酯原料及其片剂均缺少有关物质、溶出度等关键指标,无法较好控制苯丙氨酯及其片剂的质量。目前,有关于用紫外分光光度法[7]和高效液相色谱法[8]测定苯丙氨酯片含量的文献报道,此外,蒋洁等[9-10]对苯丙氨酯片的溶出度进行了研究,而对苯丙氨酯原料及其片剂中有关物质的测定方法研究未见报道。根据文献资料[11]和厂家提供的生产工艺及反应原理,推测在苯丙氨酯原料及其片剂的生产过程中,可能引入的中间体及杂质有苯丙醇和氨基甲酸苄酯。高效液相色谱法具有高速、高灵敏度、高选择性等特点,可应用于中药材中有效成分分析[12-13]和药品有关物质的测定[14-15]等。据此,本文建立苯丙氨酯原料及其片剂中有关物质测定的高效液相色谱测定法,有助于控制并发现产品的质量问题,保证其用药的有效性和安全性。
1 材料与方法 1.1 仪器Agilent1260型高效液相色谱系统(配DAD检测器),电子天平(Mettle-Toledo XS205DU)。
1.2 材料苯丙氨酯对照品(批号100145—199501,含量100%)购自中国食品药品检验研究院;氨基甲酸苄酯(批号20131009,含量98%)和苯丙醇(批号20160113,含量98%)均购自国药集团化学试剂有限公司;3批苯丙氨酯原料由A厂家提供,12批苯丙氨酯片来源于国家药品评价性抽验,共涉及6个厂家;甲醇为色谱纯,水为纯化水,其他试剂均为分析纯。
1.3 方法 1.3.1 样品处理和溶液的配制对照品溶液:分别精密称取苯丙氨酯、氨基甲酸苄酯、苯丙醇对照品适量,用流动相定量稀释成400 μg·mL-1,作为其对照品储备液,其中苯丙氨酯浓度为395.5 μg·mL-1,氨基甲酸苄酯浓度为434.4 μg·mL-1,苯丙醇浓度为392.4 μg·mL-1。精密移取各对照品储备液1 mL置于同一20 mL量瓶中,用流动相稀释至刻度,摇匀,即得混合对照品溶液,其中苯丙氨酯浓度为19.78 μg·mL-1,氨基甲酸苄酯浓度为21.72 μg·mL-1,苯丙醇浓度为19.62 μg·mL-1。分别精密量取对照品储备液适量,用流动相进一步稀释制备浓度约为4 μg·mL-1、8 μg·mL-1、12 μg·mL-1、16 μg·mL-1、20 μg·mL-1、24 μg·mL-1、30 μg·mL-1的系列浓度标准曲线溶液。
有关物质供试品溶液:精密称取苯丙氨酯原料及其片剂细粉适量(约相当于苯丙氨酯40 mg),置于20 mL容量瓶中,加入流动相适量,振摇使其溶解并稀释至刻度,摇匀;过滤,取续滤液,即得,浓度约为2 mg·mL-1。
有关物质对照溶液:精密量取上述有关物质供试品溶液1 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,滤过,即得,浓度约为20 μg·mL-1。
空白辅料溶液:依据收集到的厂家处方,精密称取空白辅料约45 mg(相当于含苯丙氨酯40 mg的辅料用量),置20 mL量瓶中,按有关物质供试品溶液制法制备,即得。
破坏性实验溶液:取苯丙氨酯原料,分别进行酸、碱、氧化、高温和光照破坏降解试验,酸、碱破坏样品需中和,然后按有关物质供试品溶液配制方法操作。
回收率实验溶液:精密称取不含苯丙氨酯、氨基甲酸苄酯和苯丙醇的空白辅料约45 mg(相当于含苯丙氨酯40 mg的辅料用量),共9份,分别置于20 mL量瓶中,分别精密加入各对照品储备液0.8 mL、1.0 mL和1.2 mL,加流动相溶解并定容至刻度,摇匀,滤过,即得低、中、高浓度的质控溶液,每个浓度点做3份,相当于杂质含量限度的80%、100%和120%。
1.3.2 色谱条件色谱柱SunFire 100-5 C18柱(4.6 mm×250 mm,5 μm);流动相为甲醇:水(50:50,V:V);流速1.0 mL·min-1;检测波长259 nm;柱温30℃;进样量20 μL。
2 结果与分析 2.1 专属性实验 2.1.1 辅料干扰及系统适用性实验取空白辅料溶液进样,结果各辅料峰能与苯丙氨酯、氨基甲酸苄酯、苯丙醇完全分离。取对照品溶液进样,苯丙氨酯与氨基甲酸苄酯、苯丙醇的分离度均大于1.5(图 1)。
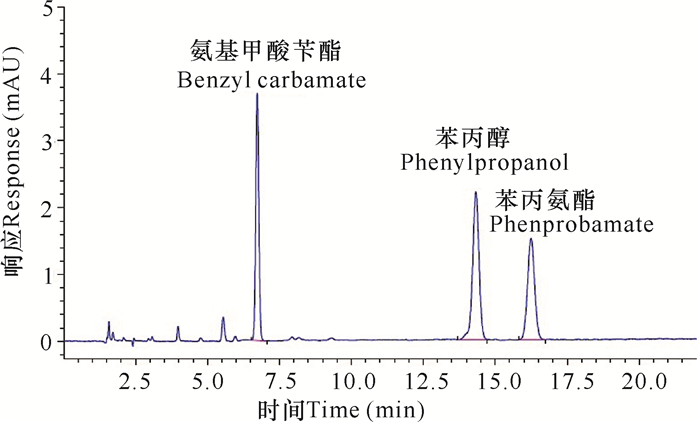
|
| 图 1 混合对照品的色谱图 Fig. 1 HPLC chromatogram of mixed reference substance |
2.1.2 破坏性实验
取1.3.1节制备的破坏性实验溶液,分别进样。结果碱破坏试验中,主要降解产物为苯丙醇,推测为苯丙氨酯水解产物;氧化破坏试验中,产生两个未知产物;酸、高温和光照破坏未发生明显降解;各分解产物与苯丙氨酯均分离完全。供试品溶液和破坏降解溶液色谱图见图 2。
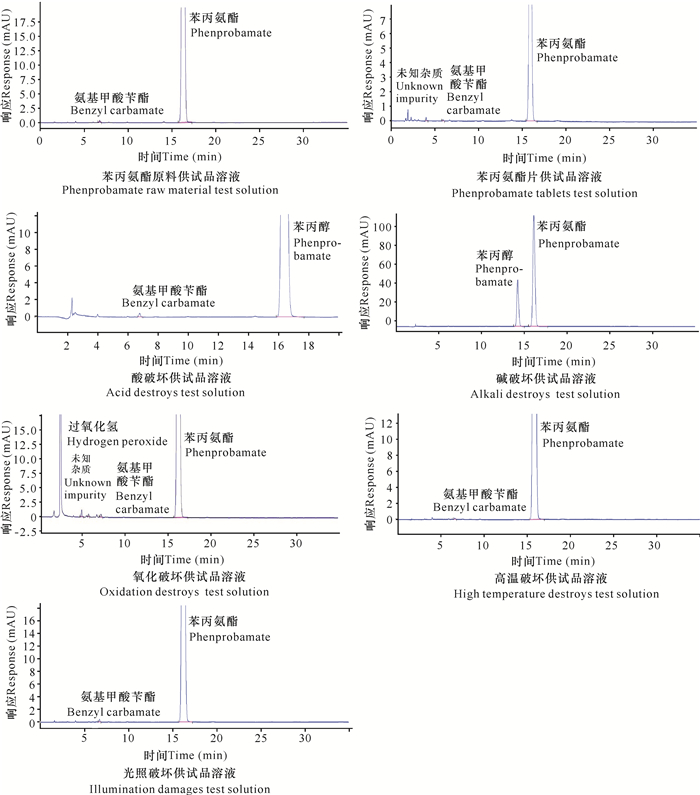
|
| 图 2 典型色谱图 Fig. 2 Typical HPLC chromatogram |
专属性实验结果表明,拟定的色谱条件可将苯丙氨酯与其杂质分离,可运用于其有关物质的测定。
2.2 检测波长的选择取1.3.1节配制的混合对照品溶液,在190~400 nm波长进行紫外扫描,结果显示苯丙氨酯、氨基甲酸苄酯和苯丙醇的最大吸收波长分别为260 nm、259 nm、257 nm,综合考虑,选择259 nm作为检测波长。
2.3 线性关系考察取1.3.1节制备的系列浓度标准曲线溶液,分别进样测定,记录色谱图。以峰面积Y为纵坐标,浓度X为横坐标,进行线性回归。结果各化合物曲线浓度、线性方程、相关系数详见表 1。
| 化合物 Compound | 各曲线点浓度Concentration at each curve point (μg·mL-1) | 线性方程 Linear equation | 相关系数 Correlation coefficient | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |||
| 苯丙氨酯 Phenprobamate | 4.344 | 8.688 | 13.03 | 17.38 | 21.72 | 26.06 | 32.58 | Y=1.2177X+0.2783 | 0.999 6 |
| 氨基甲酸苄酯 Benzyl carbamate | 3.955 | 7.911 | 11.87 | 15.82 | 19.78 | 23.73 | 29.66 | Y=1.3909X-0.0464 | 0.999 7 |
| 苯丙醇 Phenylpropanol | 3.924 | 7.848 | 11.77 | 15.70 | 19.62 | 23.54 | 29.43 | Y= 1.7563X+0.0207 | 0.999 5 |
2.4 回收率实验
取1.3.1节制备的回收率实验溶液,分别进样测定,按外标法以峰面积计算含量,结果氨基甲酸苄酯的平均回收率(n=9)为98.2%,RSD为1.6%;苯丙醇的平均回收率(n=9)为102.0%,RSD为1.6%;苯丙氨酯的平均回收率(n=9)为100.9%,RSD为1.6%。
2.5 检出限和定量限取最低浓度的标准曲线溶液,通过逐级稀释的方法,当S/N=10时得到苯丙氨酯、氨基甲酸苄酯、苯丙醇的定量限分别为1.30 μg·mL-1、0.53 μg·mL-1、0.75 μg·mL-1,当S/N=3时得到苯丙氨酯、氨基甲酸苄酯、苯丙醇的检出限分别为0.40 μg·mL-1、0.16 μg·mL-1、0.23 μg·mL-1。
2.6 进样精密度和稳定性取1.3.1节的标准曲线溶液连续进样测定6次,结果峰面积的RSD分别为苯丙氨酯0.6%;氨基甲酸苄酯0.2%;苯丙醇0.4%,表明进样精密度良好。
取1.3.1节的标准曲线溶液,于室温分别放置0 h、2 h、4 h、6 h、8 h、10 h、12 h、16 h、20 h和24 h后进样测定,记录峰面积。结果显示,苯丙氨酯、氨基甲酸苄酯、苯丙醇的峰面积的RSD分别为1.1%、0.8%和0.7%,且未生成新的杂质。表明混合对照品溶液在室温条件下放置24 h,溶液稳定性良好。
2.7 色谱记录时间取供试品溶液20 μL,注入液相色谱仪,按1.3.2节色谱条件,记录至主峰保留时间4倍,结果主峰保留时间2倍后不再有杂质峰出现。考虑仪器波动、分析时间等因素,将色谱记录时间定为主峰保留时间2倍。
2.8 有关物质方法学验证上述方法学验证结果表明,拟定的方法可用于苯丙氨酯原料及其片剂的测定。
2.9 样品测定取苯丙氨酯原料和5个厂家的片剂各1~3批,按1.3.1节方法配制供试品溶液,分别进样测定。结果见表 2。
| 样品 Sample | 批号 Batch number | 氨基甲酸苄酯 Benzyl carbamate (%) | 苯丙醇 Phenylpropanol (%) | 其他未知杂质总和 Total of other unknown impurities (%) | 总杂质 Sum of impurities (%) |
| 原料 | Y05-161010 | 0.02 | 未检出Not detected | 0.10 | 0.12 |
| Raw material | 151206 | 0.12 | 未检出Not detected | 0.05 | 0.17 |
| Y03-160010 | 0.09 | 0.05 | 0.02 | 0.16 | |
| A厂 | 2150714 | 0.03 | 未检出Not detected | 0.41 | 0.44 |
| Factory A | 2151007 | 0.11 | 0.10 | 0.35 | 0.56 |
| 2151011 | 0.12 | 0.07 | 0.29 | 0.48 | |
| B厂 | 160501 | 0.13 | 0.07 | 0.33 | 0.53 |
| Factory B | 150402 | 0.10 | 0.07 | 0.14 | 0.31 |
| 150901 | 0.10 | 0.09 | 0.21 | 0.40 | |
| C厂 | 150602 | 0.11 | 0.07 | 0.21 | 0.39 |
| Factory C | 150601 | 0.10 | 0.03 | 0.21 | 0.34 |
| 140202 | 0.15 | 0.04 | 0.21 | 0.40 | |
| D厂 | 1602231 | 0.13 | 未检出Not detected | 0.19 | 0.32 |
| Factory D | 1601301 | 0.11 | 未检出Not detected | 0.07 | 0.18 |
| E厂Factory E | 11411006 | 0.15 | 0.11 | 0.20 | 0.46 |
3 讨论 3.1 测定结果分析
15批苯丙氨酯原料及其片剂测定结果显示,所检测的样品中均检出氨基甲酸苄酯,有1批原料和9批片剂检出苯丙醇,表明氨基甲酸苄酯为苯丙氨酯原料及其片剂的主要杂质。原料的总杂质含量低于0.2%,12批片剂的含量均低于0.6%,表明苯丙氨酯原料及其片剂的有关物质情况良好,但根据ICH原则,对于表观含量在0.1%及其以上的杂质予以定性或确证其结构,下一步研究拟采用LC-MS或LC-MS-TOF等技术对杂质结构进行分析。
3.2 杂质来源分析由厂家提供的资料分析得到,氨基甲酸苄酯为苯丙氨酯合成过程的副产物,产生的原因是合成苯丙醇时有苯甲醇存在,苯甲醇会与氰酸钠发生反应生成氨基甲酸苄酯。而苯甲醇的来源可能有两方面:(1)生产苯丙醇所用的氯化苄不纯,含有苯甲醇;(2)合成苯丙醇时格氏反应有水存在,故产生副产物苯甲醇。
由厂家提供的苯丙氨酯合成路线图及破坏性试验结果推测,苯丙醇有可能为合成原料残留,也有可能是降解产物。
而由测定结果推测,其他杂质大部分是工艺杂质,且不同厂家检出的其他杂质有所不同,推测是不同工艺导致的。由表 2结果可知,A厂的其他杂质相对其他4个厂高,建议A厂进行自查。
3.3 流动相的选择余小平等[3]采用高效液相法测定苯丙氨酯片含量时使用的流动相和溶剂为甲醇:乙腈(70:30,V:V),为纯有机相,本文将流动相及溶剂改进为甲醇:水(50:50,V:V),减少了有机相种类,且降低了有机相的使用量,在一定程度上减少了对环境的污染。
4 结论原料及其片剂的有关物质是药品质量反映的关键指标,本文建立的高效液相色谱法测定苯丙氨酯原料及其片剂中有关物质含量方法,结果准确,操作简便,重复性好,对苯丙氨酯原料及其片剂的质量控制有应用意义,可为进一步制定苯丙氨酯原料及其片剂的质量标准提供科学的依据。
| [1] |
苏聪娟, 黄占周, 于林怡, 等. 苯丙氨酯药理毒理和临床研究综述[J]. 临床合理用药, 2012, 5(12A): 146. |
| [2] |
林跃. 苯丙氨酯在美国获准用于小儿癫痫性脑病[J]. 药学进展, 1994(1): 53. |
| [3] |
DEMIR B, DEMIR Y, AKSOY I, et al. Phenprobamated-ependence:A case report[J]. Addictive Behaviors, 2015, 45: 232-233. DOI:10.1016/j.addbeh.2015.01.037 |
| [4] |
中华人民共和国卫生部药典委员会. 中华人民共和国药典:一部[M]. 广州: 广东科技出版社, 1995.
|
| [5] |
国家药典委员会.国家药品标准化学药品地方标准上升国家标准第十四册[S].北京: 国家食品药品监督管理局, 2003.
|
| [6] |
日本药局方编辑委员会.日本药局方[S].日本: 日本厚生省, 1997.
|
| [7] |
田勇. 紫外分光光度法测定苯丙氨酯片含量的研究[J]. 天津药学, 1999, 11(3): 50-51. |
| [8] |
余小平, 张志根. 反相高效液相色谱法测定苯丙氨酯片的含量[J]. 医药导报, 2005, 24(8): 720-721. DOI:10.3870/j.issn.1004-0781.2005.08.033 |
| [9] |
蒋洁, 刘庄蔚, 朱健萍, 等. 光纤传感过程分析测定苯丙氨酯片在不同溶出介质中的溶出行为[J]. 华西药学杂志, 2018, 33(5): 477-480. |
| [10] |
蒋洁, 刘庄蔚, 朱健萍, 等. 光纤药物溶出度实时测定仪监测苯丙氨酯片的溶出度[J]. 药物评价研究, 2018, 41(9): 1653-1656. |
| [11] |
公佩欣, 党庆毅, 孙国新. L-苯丙氨酯的合成与表征[J]. 山东化工, 2013, 42(2): 3-5. DOI:10.3969/j.issn.1008-021X.2013.02.002 |
| [12] |
梁冰, 覃兰芳, 赖茂祥, 等. 高效液相色谱法测定广西壮药毛郁金中姜黄素的含量[J]. 广西科学, 2012, 19(2): 149-151. DOI:10.3969/j.issn.1005-9164.2012.02.015 |
| [13] |
陈明生, 黄艳, 林霄, 等. 高效液相色谱法测定互叶白千层中没食子酸的含量[J]. 广西科学, 2012, 19(1): 71-73. DOI:10.3969/j.issn.1002-7378.2012.01.025 |
| [14] |
袁秀菊, 姚亮元, 宿亮, 等. RP-HPLC法测定安塞曲匹的有关物质[J]. 药物分析杂志, 2019, 39(2): 304-309. |
| [15] |
郭志渊, 赵欣庆, 赵欣庆, 等. HPLC法测定福多司坦原料药及其制剂中有关物质的含量[J]. 中国药房, 2019, 30(13): 1764-1769. |



