2. 广西大学海洋学院, 广西南宁 530004;
3. 广西大学林学院, 广西南宁 530004
2. School of Marine Sciences, Guangxi University, Nanning, Guangxi, 530004, China;
3. College of Forestry, Guangxi University, Nanning, Guangxi, 530004, China
珊瑚礁生态系统是生物多样性、生态资源最为丰富的生态系统之一,而微生物是珊瑚生态系统中数量最大的生物,也是珊瑚礁生态系统中结构最为基础和活跃的组成成分[1-2]。珊瑚共生微生物在维护生态系统平衡和稳定的过程中扮演着重要的角色,在珊瑚礁生态系统的生物地球化学循环、物质转化以及健康维护上起到一定作用[3-6]:如碳和氮固定、磷和硫循环以维持珊瑚共生体的内稳态;通过分泌抗菌物质来保护珊瑚免遭破坏。珊瑚共生微生物与珊瑚宿主成互利共生关系,具有专一性、可塑性和协同进化的能力[7],其多样性很高,但是对珊瑚宿主本身以及外界环境的响应极为敏感,其群落结构显著受物种[8]、地理[9]、水温等外界环境因子影响。诸多研究表明,共生微生物的群落和结构与珊瑚健康状态息息相关,常常表现为海水升温致使珊瑚共生微生物群落结构和功能改变,引发珊瑚白化。
自1998年起,到2018年全球共发生了3次规模较大的珊瑚白化事件[10-14],最主要的原因是厄尔尼诺(El Niño)加剧和全球变暖导致的海水升温[15-17],表现为珊瑚白化,以致全球珊瑚礁出现了严重的退化。珊瑚白化前后其微生物群落结构与组成发生改变已经得到证实[18],然而对珊瑚白化的研究中,无论是野外调查还是室内模拟实验均发现块状珊瑚要比枝状珊瑚对高温环境具有更强的耐受性。1998年澳大利亚大堡礁发生大规模珊瑚白化事件中,Marshall等[19]对近岸岛屿的珊瑚礁区进行了大量珊瑚个体的调查,发现绝大部分枝状和叶片状的珊瑚对高温胁迫高度敏感(如鹿角珊瑚科Acroporidae等),而块状的珊瑚(如Faviidae)则对高温有较好的耐受性。在马尔代夫[20]和日本冲绳岛[21]的珊瑚礁区也发现类似的现象,马尔代夫一珊瑚礁区在1990年的高温胁迫中,约有98%的枝状珊瑚白化死亡,块状珊瑚则大量存活。室内模拟实验中有相同现象,李淑等[22]对海南三亚鹿回头岸礁的9种造礁石珊瑚进行升温模拟实验(26~32℃),发现枝状珊瑚对高温的耐受性最弱,最先白化、死亡,而块状珊瑚等对高温的耐受性较强。
在高温环境下,已知块状珊瑚具有比枝状珊瑚更强的耐受特性,但其原因仍不清楚。Liang等[7]对南海18种25个珊瑚共生细菌群落结构进行调查,发现块状珊瑚共生细菌的多样性显著比枝状珊瑚高,提出珊瑚共生微生物的多样性与珊瑚应对异常环境(高温)的能力之间具有关联性。李淑等[23]和Xu等[24]对南海北部多种珊瑚共生虫黄藻密度的研究,发现块状珊瑚的虫黄藻密度要显著高于枝状珊瑚,并认为这也是导致块状珊瑚耐受高温的原因之一。越来越多的研究表明,共生细菌在珊瑚对环境的响应方面发挥着重要作用[25-28]。因此,本研究选择块状珊瑚和枝状珊瑚,通过室内模拟实验探讨高温胁迫下珊瑚共生细菌的响应特征,希望为理解珊瑚响应高温的种间差异性提供新的认识,从微生物角度帮助预测珊瑚礁生态变化,以延缓珊瑚礁生态系统退化,保护和修护珊瑚礁生态系统。
1 材料与方法 1.1 珊瑚样品采集与实验方案在北部湾涠洲岛珊瑚礁区采集一种优势块状的海孔角蜂巢珊瑚(Favites halicora)和一种优势枝状的浪花鹿角珊瑚(Acropora cytherea),每种珊瑚的个体大小约为10 cm×10 cm。每种珊瑚适当凿剪成大小约为5 cm×5 cm的多个实验样品后,在广西大学珊瑚礁研究中心进行室内模拟实验,选用规格600 mm×600 mm×600 mm(长×宽×高)的养殖缸,维持水体环境:色温15 000 K,盐度30‰~35‰、pH值为7.3~8.3、Ca2+9.5~11.24 mmol/L、Mg2+50~55 mmol/L。
以26℃为对照温度驯化珊瑚20 d后开始实验,设置26℃、30℃和34℃为温度梯度,实验温度下胁迫24 h后采样,采样前对样品进行拍照记录如图 1。样品采集后马上用于基因组DNA的提取。升温胁迫实验结束时共采集样本3次,3个生物学重复。

|
| 图 1 升温胁迫下2种珊瑚的形态响应 Fig. 1 Morphological responses of two coral species under rising temperature |
1.2 DNA提取
采用海洋动物基因组DNA提取试剂盒(TIANGEN,DP324)提取珊瑚共生体宏基因组。使用灭菌手术剪在珊瑚非生长点处剪取包含珊瑚组织、骨骼和黏液的珊瑚样品约50 mg,按照试剂盒说明书的步骤操作,所提DNA经过质量检测后存放于-80℃冷冻保存备用。
1.3 PCR扩增与高通量测序以DNA样品为模板,使用特异性正向引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因的V3-V4可变区进行PCR扩增(ABI GeneAmp ® 9700)[29-30],反应体系参照Sun等[31]的方法。PCR扩增程序:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),72℃延伸10 min。用2%琼脂糖凝胶电泳、AxyPrep DNA凝胶提取试剂盒(AXYGEN)、Tris-HCl、2%琼脂糖电泳和QuantiFluorTM-ST荧光定量系统(Promega)对PCR产物进行回收、纯化、洗脱、检测和定量。合并重复样品,根据Illumina MiSeq平台的标准操作规程构建PE 2×300库,最后于Illumina Miseq PE300平台测序(Majorbio)。
1.4 数据分析以97%的相似水平对序列进行Operational taxonomic units (OTU)划分,参照Liang等[7]使用的Ribosomal database project (RDP),对PE reads进行拼接合并、质控和过滤。通过对OTU聚类分析和物种分类学分析,获得每个样本在不同分类层次(门和属)的细菌群落组成和数目信息。使用Mothur软件[32]对样本聚类结果进行阿尔法多样性指数分析得到单样本的多样性(Alpha多样性),通过Good's物种覆盖度(Coverage)、群落丰富度(Ace)和群落多样性(Shannon)指数反映微生物群落的覆盖率、丰度和多样性。使用软件Qiime[33]计算beta多样性距离矩阵,采用主坐标分析(Principal coordinates analysis, PCoA)作图,通过非约束性数据降维分析方法找出影响样本群落组成差异的潜在主成分,用于研究样本群落组成的相似性或差异。
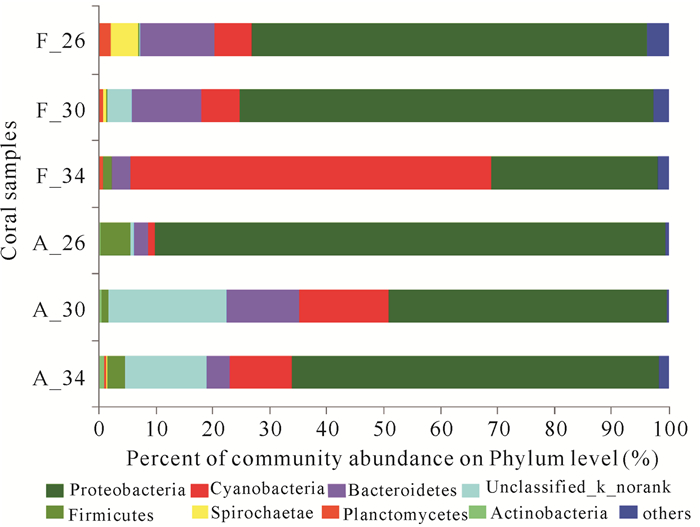
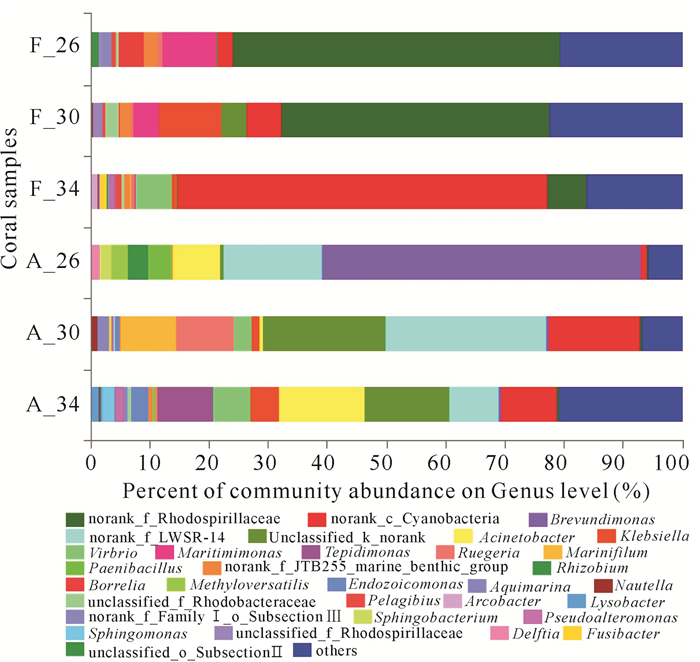
2 结果与分析F.halicora和A.cytherea的生长状态在同一温度胁迫下相比,F.halicora的生长状态优于A.cytherea。在34℃时对比较为显著,F.halicora颜色变浅并且分泌黏液,而A.cytherea发生白化。高通量测序获得6组样本数据库,共有301 848条序列数,序列长度为421~460 bp。每个样品的序列数均在3万条以上并且Coverage指数均大于99%(表 1),表明每个序列结果对样本的覆盖度足够还原珊瑚样本的菌群情况。物种注释分析共测得31个细菌门70个纲140个目247个科440个属678个种以及1 245个OTU聚类,其中A.cytherea共生细菌数在各个分类学水平上均比F.halicora的低(表 2)。在门水平和属水平对每个样本绘制详细的丰度百分比图(图 2~3)。
| Coral code | No.of Seq. | Ace | Shannon | Coverage |
| F_26 | 52 195 | 742.511 010 | 2.789 187 | 0.996 106 |
| F_30 | 42 845 | 724.894 378 | 3.189 847 | 0.996 455 |
| F_34 | 54 285 | 628.940 266 | 2.697 693 | 0.996 613 |
| A_26 | 69 491 | 205.153 744 | 2.199 332 | 0.998 924 |
| A_30 | 32 825 | 279.002 105 | 2.486 761 | 0.998 924 |
| A_34 | 50 207 | 725.450 153 | 4.047 487 | 0.998 006 |
| Coral code | Phylum | Class | Order | Family | Genus | Species | OTU |
| F_26 | 28 | 61 | 111 | 163 | 252 | 384 | 660 |
| F_30 | 23 | 52 | 105 | 157 | 249 | 382 | 653 |
| F_34 | 24 | 54 | 104 | 165 | 268 | 377 | 560 |
| A_26 | 18 | 29 | 55 | 95 | 139 | 168 | 185 |
| A_30 | 16 | 30 | 62 | 105 | 171 | 212 | 262 |
| A_34 | 26 | 52 | 107 | 183 | 305 | 445 | 702 |
|
| 图 2 细菌群落在门水平的丰度占比分析 Fig. 2 Analysis of the abundance ratio of bacterial communities on phylum level |
|
| 图 3 细菌群落在属水平的丰度占比分析 Fig. 3 Analysis of the abundance ratio of bacterial communities on genus level |
结果显示F.halicora共生细菌的总OTU数高于A.cytherea,但F.halicora在不同温度下的单个OTU数是随着升温缓慢下降的,而A.cytherea则上升。2种珊瑚的阿尔法多样性指数值中,F.halicora共生细菌的Ace指数和Shannon指数的波动幅度较小,Ace指数随着温度上升呈下降趋势,从742.51降为628.94,Shannon指数先上升后下降,在2.69~3.19波动。而A.cytherea共生细菌的丰富度(Ace指数:205.15~725.45)和多样性(Shannon指数:2.20~4.05)随着胁迫温度上升均增加,26℃时最低,34℃时最高。
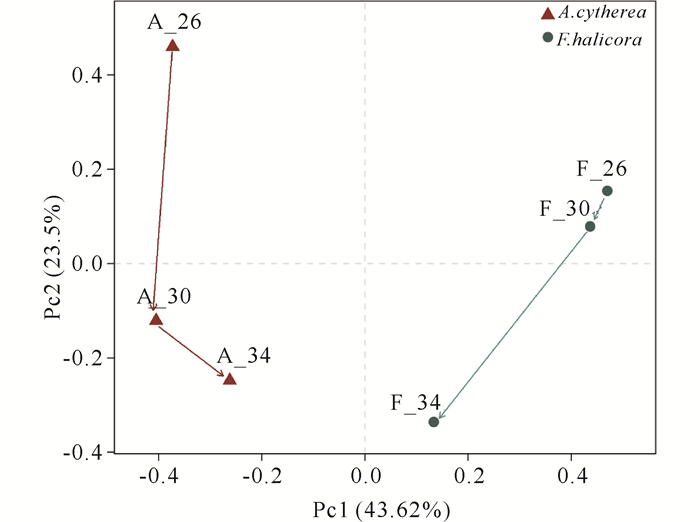
PCoA分析显示(图 4),珊瑚共生细菌群落在F.halicora和A.cytherea间具有显著差异性,其中F.halicora共生细菌的相似性在26℃和30℃高于34℃,从群落结构变化来看,在26℃与30℃时结构相似,30℃升温到34℃时结构改变;而A.cytherea共生细菌的相似性在30℃和34℃高于26℃,即群落结构在26℃到30℃的变化大,在30℃到34℃变化中结构相似,仅丰度改变。26℃时,F.halicora共生细菌以Proteobacteria为优势门,丰度为69.21%,其次为Bacteroidetes和Cyanobacteria,分别占12.98%和6.76%。随着温度上升,F.halicora中Cyanobacteria丰度增加,Proteobacteria和Bacteroidetes持续减少,在34℃时Cyanobacteria取代Proteobacteria的优势地位。unclassified_k_norank出现在30℃,比例为4.31%。而A.cytherea共生细菌中Proteobacteria占绝对优势,丰度在48.76%~89.74%波动,其次为Firmicutes、Bacteroidetes、Cyanobacteria和一个未分类的细菌门unclassified_k_norank。在温度上升过程中,Proteobacteria呈下降趋势,Cyanobacteria和unclassified_k_norank则大幅增加,Bacteroidetes有增加的趋势,Firmicutes呈下降趋势。
|
| 图 4 鹿角珊瑚和蜂巢珊瑚的PCoA分析 Fig. 4 Principal coordinates analysis of Acropora cytherea and Favites halicora |
在属水平、26℃的F.halicora共生细菌中,占55.33%的norank_f_Rhodospirllaceae丰度最大,其次是Maritimimonas(9.10%)和Borrelia(4.30%);而A.cytherea的优势细菌是占53.92%的Brevundimonas,其次为norank_f_LWSR-14(16.60%)和Acinetobacter(8.09%)。随着温度上升,F.halicora共生细菌在30℃时,norank_f_Rhodospirllaceae和Maritimimonas下降,而Borrelia丰度降到1%之下,同时norank_c_Cyanobacteria和klebsiella丰度增加到5.77%和10.63%;在温度34℃下,norank_c_Cyanobacteria丰度急剧增加为62.26%,取代了26℃和30℃时的占优势地位的norank_f_Rhodospirllaceae,此时F.halicora共生细菌群落中开始出现潜在致病菌Vibrio,丰度占比6.10%。而A.cytherea共生细菌在30℃温度胁迫下,主要共生细菌属为norank_f_LWSR-14、unclassified_k_norank和norank_c_Cyanobacteria,分别占27.34%、20.76%和15.50%,Ruegeria和Marinifilum分别占9.72%和9.50%,Vibrio和Aquimarina占比2.90%和1.98%;升温至34℃时,其共生菌属结构较为均匀,Acinetobacter、unclassified_k_norank、Tepidimonas、norank_c_Cyanobacteria、norank_f_LWSR-14、Vibrio、Klebsiella、Endozoicomonas、Sphingomnas、Pseudoalteromona和Lysobacter分别为14.40%、14.30%、9.40%、9.34%、8.36%、6.24%、4.95%、2.87%、2.12%、1.66%和1.31%。
3 讨论 3.1 珊瑚共生细菌群落多样性和稳定性与珊瑚耐热性有关虽然Proteobacteria、Firmicutes、Cyanobacteria、Bacteroidetes和Actinobacteria是健康珊瑚共生细菌的主导群落,但是其相对丰度则由珊瑚种类[34-35]和珊瑚所处的环境因子[36-38]决定。根据Liang等[7]对南海珊瑚的调查结果推测,珊瑚共生细菌多样性的高低可能影响着珊瑚对温度胁迫的耐受性,南海16个块状珊瑚共生细菌多样性(Shannon)在1.91~5.88波动,普遍高于9个枝状珊瑚(2.28~4.89)。模拟实验在26℃与30℃时,F.halicora共生细菌的多样性(Shannon指数:2.78与3.19)均高于A.cytherea(Shannon指数:2.20与2.49),唯独34℃时F.halicora共生细菌的多样性(Shannon指数:2.70)低于A.cytherea(Shannon指数:4.05),但此时的A.cytherea处于白化状态,珊瑚共生虫黄藻的完全丢失可能对珊瑚共生细菌结构造成一定干扰,导致各种细菌结构处于紊乱状态[39]。因此,健康珊瑚中共生细菌多样性的高低可能是决定F.halicora珊瑚耐受性高于A.cytherea的原因。另外,A.cytherea和F.halicora 2种珊瑚在26℃时的共生细菌在门水平上虽然主导群落相同,但非优势细菌和其丰度有显著差异。Firmicutes大量存在于A.cytherea中,而在F.halicora中相对丰度很低。Firmicutes是一种曾与Cyanobacteria和Bacteroidetes一同从病变组织中提取出来的细菌,因此这3种细菌被认为是一种混合微生物组合[40],这种组合的存在可能是造成A.cytherea对环境变化更敏感的原因,但其是否作为易感性的标志目前尚没有定论。
当珊瑚受到高温胁迫时,虽然F.halicora共生细菌属的组成发生了优势群落的替换,但其保持了明显的优势属。Reshef等[41]和Glasl等[42]认为,优势群落的替换是为了适应新的环境,因此F.halicora中优势菌的更替可能是为了更好地适应环境,这也可能是其对高温胁迫具有较强耐受性的原因。然而A.cytherea在高温胁迫下,其共生细菌群落由Brevundimonas占主导变成了Acinetobacter、unclassified_k_norank、Tepidimonas、norank_c_Cyanobacteria、norank_f_LWSR-14、Vibrio共同主导。黄建辉和韩兴国[43]认为,每增加一个种,群落不稳定的可能性将增加2n-1。而细菌群落处于不稳定的状态时,更容易受到条件致病菌如Vibrio的入侵[44]。因此,从共生微生物群落特征稳定性推测,A.cytherea比F.halicora更易受到外界环境因子的影响,因而对高温胁迫更敏感。
3.2 珊瑚共生细菌特殊类群或与珊瑚耐热性有关分析表明,F.halicora和A.cytherea共生细菌中丰度大于1%的属分别有15和21个,然而不同的细菌类群有各自的生物学功能。在珊瑚共生体中,有的细菌类群能够通过光合作用、固氮作用等提供营养和预防病原菌的感染等[45-46],然而有的细菌类群则会对珊瑚宿主造成致病威胁[5, 35, 45-48]。Lesser等[49]证实了珊瑚共生菌中的Cyanobacteria能够产生具有固氮作用的酶,温度的上升会刺激固氮酶活性,氮固定量的上升将有利于全生物体生产力的保持[50],但是过量的氮固定会增加珊瑚对温度的敏感性[51],因此Cyanobacteria的增加可能会导致珊瑚更容易发生白化,而在升温实验中,Cyanobacteria的丰度在F.halicora和A.cytherea中都是增加的。同时Ritchie[44]认为Proteobacteria sp.可以通过生成具有降解外周病原菌群体感应分子能力的酰化酶或内酯酶来抵御病原入侵。本研究发现,随着胁迫温度的上升,F.halicora和A.cytherea 的共生细菌中Proteobacteria的丰度显著降低,表示珊瑚增加了受病原菌群体入侵的几率,这与温度胁迫下珊瑚容易白化的现象一致。然而,从26℃升至34℃,Cyanobacteria在F.halicora中丰度的增加幅度(从6.76%增为63.38%)远远超过A.cytherea(从1.20%增为10.83%),Proteobacteria在F.halicora中减少的比例(从69.21%降至29.20%)也远远大于A.cytherea(从89.74%降至64.72%),在34℃时A.cytherea发生了白化,这可能是因为Cyanobacteria在F.halicora中过度增殖,以绝对优势(63.38%)占据有利生态位,从而能够抑制相对丰度病原菌群体对宿主的负面作用。
Vibrio有多个种已被确认对珊瑚具有致病性,其存在可以作为判断珊瑚致病的标志[42, 52]。当升温胁迫时,潜在致病菌Vibrio在2种珊瑚的共生细菌群落中均有出现,但是在A.cytherea中,当温度升至30℃时Vibrio已成功定植于珊瑚宿主内(2.90%),当34℃时其丰度达到6.24%。然而,在F.halicora中,当胁迫温度升至34℃时Vibrio才成功定植于珊瑚宿主内(6.10%)。Vibrio以较高丰度存在,标志着此时的珊瑚处于不健康状态,具有白化甚至致死的可能。当高温胁迫时,A.cytherea共生细菌中更早被Vibrio定植,这也可能是A.cytherea对温度耐受性低于F.halicora的原因。另外,Koren和Rosenberg[53]认为,在白化珊瑚中Acinetobacter应占主导地位,然而A.cytherea中的Acinetobacter在34℃时丰度最大,这同样也可能是A.cytherea对温度耐受性低于F.halicora的原因。
4 结论采用16S rDNA扩增子高通量测序法对3个温度梯度胁迫下的2种珊瑚共生细菌群落结构进行了分析,结果显示块状F.halicora和枝状A.cytherea的共生细菌多样性及其组成具有显著差异,且在高温胁迫下发生显著改变。其中,枝状珊瑚共生细菌的群落组成在高温胁迫下其波动比块状的大,并且更容易受到潜在致病菌的入侵。因此,本研究认为珊瑚共生细菌的差异性可能是导致块状珊瑚比枝状珊瑚更耐受高温的重要原因。
| [1] |
余克服. 珊瑚礁科学概论[M]. 北京: 中国科学出版社, 2018.
|
| [2] |
赵美霞, 余克服, 张乔民. 珊瑚礁区的生物多样性及其生态功能[J]. 生态学报, 2005, 26(1): 186-194. DOI:10.3321/j.issn:1001-9332.2005.01.038 |
| [3] |
LESSER M P, MAZEL C H, GORBUNOV M Y, et al. Discovery of symbiotic nitrogen-fixing cyanobacteria in corals[J]. Science, 2004, 305(5686): 997-1000. DOI:10.1126/science.1099128 |
| [4] |
FIORE C L, JARETT J K, OLSON N D, et al. Nitrogen fixation and nitrogen transformations in marine symbioses[J]. Trends in Microbiology, 2010, 18(10): 455-463. DOI:10.1016/j.tim.2010.07.001 |
| [5] |
MAO-JONES J, RITCHIE K B, JONES L E, et al. How microbial community composition regulates coral disease transmission[J]. PLOS Biology, 2010, 8(3): e1000345. DOI:10.1371/journal.pbio.1000345 |
| [6] |
MAHMOUD H M, KALENDAR A A. Coral-associated actinobacteria:Diversity, abundance, and biotechnological potentials[J]. Frontiers in Microbiology, 2016, 7: 204. |
| [7] |
LIANG J Y, YU K F, WANG Y H, et al. Distinct bacterial communities associated with massive and branching scleractinian corals and potential linkages to coral susceptibility to thermal or cold stress[J]. Frontiers in Microbiology, 2017, 8: 1-10. |
| [8] |
HONG M J, YU Y T, CHEN C A, et al. Influence of species specificity and other factors on bacteria associated with the coral Stylophora pistillata in Taiwan[J]. Applied and Environmental Microbiology, 2009, 75(24): 7797-7806. DOI:10.1128/AEM.01418-09 |
| [9] |
MCKEW B A, DUMBRELL A J, DAUD S D, et al. Characterization of geographically distinct bacterial communities associated with coral mucus produced by Acropora spp.and Porites spp.[J]. Applied and Environmental Microbiology, 2012, 78(15): 5229-5237. DOI:10.1128/AEM.07764-11 |
| [10] |
张乔民, 余克服, 施褀, 等. 全球珊瑚礁监测与管理保护评述[J]. 热带海洋学报, 2006, 25(2): 71-78. DOI:10.3969/j.issn.1009-5470.2006.02.013 |
| [11] |
HUGHES T P, HUANG H, YOUNG M A. The wicked problem of China's disappearing coral reefs[J]. Conservation Biology, 2013, 27(2): 261-269. DOI:10.1111/j.1523-1739.2012.01957.x |
| [12] |
HUGHES T P, KERRY J T, SIMPSON T. Large-scale bleaching of corals on the Great Barrier Reef[J]. Ecology, 2018, 99(2): 501. DOI:10.1002/ecy.2092 |
| [13] |
HUGHES T P, KERRY J T, ÁLVAREZ-NORIEGA M, et al. Global warming and recurrent mass bleaching of corals[J]. Nature, 2017, 543(7645): 373. DOI:10.1038/nature21707 |
| [14] |
HUGHES T P, KERRY J T, BAIRD A H, et al. Global warming transforms coral reef assemblages[J]. Nature, 2018, 556(7702): 492-496. DOI:10.1038/s41586-018-0041-2 |
| [15] |
李淑, 余克服. 珊瑚礁白化研究进展[J]. 生态学报, 2007, 27(5): 2059-2069. DOI:10.3321/j.issn:1000-0933.2007.05.047 |
| [16] |
张乔民, 赵美霞, 王丽荣, 等. 世界珊瑚礁现状和威胁研究进展[J]. 广西科学, 2017, 24(5): 435-440. |
| [17] |
HOEGH-GULDBERG O. Climate change, coral bleaching and the future of the world's coral reefs[J]. Marine and Freshwater Research, 1999, 50(8): 839-866. DOI:10.1071/MF99078 |
| [18] |
BOURNE D, ⅡDA Y, UTHICKE S, et al. Changes in coral-associated microbial communities during a bleaching event[J]. The ISME Journal, 2007, 2: 350-363. |
| [19] |
MARSHALL P A, BAIRD A H. Bleaching of corals on the Great Barrier Reef:Differential susceptibilities among taxa[J]. Coral Reefs, 2000, 19(2): 155-163. DOI:10.1007/s003380000086 |
| [20] |
EDWARDS A J, CLARK S, ZAHIR H, et al. Coral bleaching and mortality on artificial and natural reefs in Maldives in 1998, sea surface temperature anomalies and initial recovery[J]. Marine Pollution Bulletin, 2001, 42(1): 7-15. DOI:10.1016/S0025-326X(00)00200-9 |
| [21] |
LOYA Y, SAKAI K, YAMAZATO K, et al. Coral bleaching:The winners and the losers[J]. Ecology Letters, 2010, 4(2): 122-131. |
| [22] |
李淑, 余克服, 施褀, 等. 海南岛鹿回头石珊瑚对高温响应行为的实验研究[J]. 热带地理, 2008, 28(6): 534-539. DOI:10.3969/j.issn.1001-5221.2008.06.009 |
| [23] |
李淑, 余克服, 施褀. 南海北部珊瑚共生虫黄藻密度的种间与空间差异及其对珊瑚礁白化的影响[J]. 科学通报, 2007, 52(22): 2655. DOI:10.3321/j.issn:0023-074x.2007.22.012 |
| [24] |
XU L J, YU K F, LI S, et al. Interseasonal and interspecies diversities of Symbiodinium density and effective photochemical efficiency in five dominant reef coral species from Luhuitou fringing reef, northern South China Sea[J]. Coral Reefs, 2017, 36(2): 477-487. DOI:10.1007/s00338-016-1532-y |
| [25] |
ZIEGLER M, SENECA F O, YUM L K, et al. Bacterial community dynamics are linked to patterns of coral heat tolerance[J]. Nature Communications, 2017, 8: 14213. DOI:10.1038/ncomms14213 |
| [26] |
LI J, CHEN Q, LONG L J, et al. Bacterial dynamics within the mucus, tissue and skeleton of the coral Porites lutea during different seasons[J]. Scientific Reports, 2014, 4: 7320. |
| [27] |
MERON D, ATIAS E, KRUH L I, et al. The impact of reduced pH on the microbial community of the coral Acropora eurystoma[J]. The ISME Journal, 2011, 5(1): 51-56. DOI:10.1038/ismej.2010.102 |
| [28] |
CHEN C P, TSENG C H, CHEN C A, et al. The dynamics of microbial partnerships in the coral Isopora palifera[J]. The ISME Journal, 2011, 5(4): 728-740. DOI:10.1038/ismej.2010.151 |
| [29] |
MORI H, MARUYAMA F, KATO H, et al. Design and experimental application of a novel non-degenerate universal primer set that amplifies prokaryotic 16S rRNA genes with a low possibility to amplify eukaryotic rRNA genes[J]. DNA Research, 2014, 21(2): 217-227. DOI:10.1093/dnares/dst052 |
| [30] |
XU N, TAN G, WANG H, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8. DOI:10.1016/j.ejsobi.2016.02.004 |
| [31] |
SUN Z, LI G, WANG C, et al. Community dynamics of prokaryotic and eukaryotic microbes in an estuary reservoir[J]. Scientific Reports, 2014, 4: 6966. |
| [32] |
SCHLOSS P D, GEVERS D, WESTCOTT S L. Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA-based studies[J]. PLoS One, 2013, 6(12): e27310. |
| [33] |
KUCZYNSKI J, STOMBAUGH J, WALTERS W A, et al. Using QⅡME to analyze 16S rRNA gene sequences from microbial communities[J]. Current Protocols in Bioinformatics, 2011, 36(1): 10. |
| [34] |
BOURNE D G, MUNN C B. Diversity of bacteria associated with the coral Pocillopora damicornis from the Great Barrier Reef[J]. Environmental Microbiology, 2010, 7(8): 1162-1174. |
| [35] |
WEGLEY L, EDWARDS R, BELTRAN R B, et al. Metagenomic analysis of the microbial community associated with the coral Porites astreoides[J]. Environmental Microbiology, 2010, 9(11): 2707-2719. |
| [36] |
BAKER A C, STARGER C J, MCCLANAHAN T R, et al. Coral reefs:Corals' adaptive response to climate change[J]. Nature, 2004, 430(7001): 741. DOI:10.1038/430741a |
| [37] |
CEH J, RAINA J B, SOO R M, et al. Coral-bacterial communities before and after a coral mass spawning event on Ningaloo reef[J]. PLoS One, 2012, 7(5): e36920. DOI:10.1371/journal.pone.0036920 |
| [38] |
HUGHES T P, BAIRD A H, BELLWOOD D R, et al. , Climate change, human impacts, and the resilience of coral reefs[J]. Science, 2003, 301(5635): 929-933. DOI:10.1126/science.1085046 |
| [39] |
刘助红.西沙鹿角珊瑚共附生细菌多样性及其与珊瑚白化关系的研究[D].广州: 中国科学院南海海洋研究所, 2012.
|
| [40] |
JONES R J, BOWYER J, HOEGHGULDBERG O, et al. Dynamics of a temperature-related coral disease outbreak[J]. Marine Ecology Progress, 2004, 281(1): 63-77. |
| [41] |
RESHEF L, KOREN O, LOYA Y, et al. The coral probiotic hypothesis[J]. Environmental Microbiology, 2006, 8(12): 2068-2073. DOI:10.1111/j.1462-2920.2006.01148.x |
| [42] |
GLASL B, HERNDL G J, FRADE P R. The microbi-ome of coral surface mucus has a key role in mediating holobiont health and survival upon disturbance[J]. The ISME Journal, 2016, 10(9): 2280-2292. DOI:10.1038/ismej.2016.9 |
| [43] |
黄建辉, 韩兴国. 生物多样性和生态系统稳定性[J]. 生物多样性, 1995, 3(1): 31-37. DOI:10.3321/j.issn:1005-0094.1995.01.006 |
| [44] |
RITCHIE K B. Regulation of microbial populations by coral surface mucus and mucus-associated bacteria[J]. Marine Ecology Progress Series, 2006, 322(8): 1-14. |
| [45] |
ROSENBERG E, KOREN O, RESHEF L, et al. The role of microorganisms in coral health, disease and evolution[J]. Nature Reviews Microbiology, 2007, 5(5): 355-62. DOI:10.1038/nrmicro1635 |
| [46] |
周进, 晋慧, 蔡中华. 微生物在珊瑚礁生态系统中的作用与功能[J]. 应用生态学报, 2014, 25(3): 919-930. |
| [47] |
BENHAIM Y, ZICHERMANKEREN M, ROSENBER-G E. Temperature-regulated bleaching and lysis of the coral Pocillopora damicornis by the novel pathogen Vibrio coralliilyticus[J]. Applied and Environmental Microbiology, 2003, 69(7): 4236-42. DOI:10.1128/AEM.69.7.4236-4242.2003 |
| [48] |
黄玲英, 余克服. 珊瑚疾病的主要类型、生态危害及其与环境的关系[J]. 生态学报, 2010, 30(5): 1328-1340. |
| [49] |
LESSER M P, FALCÍN L I, RODRÍGUEZ-ROMÁN A, et al. Nitrogen fixation by symbiotic cyanobacteria provides a source of nitrogen for the scleractinian coral Montastraea cavernosa[J]. Marine Ecology Progress Series, 2007, 346: 143-152. DOI:10.3354/meps07008 |
| [50] |
CARDINI U, BEDNARZ V N, NAUMANN M S, et al. Functional significance of dinitrogen fixation in sustaining coral productivity under oligotrophic conditions[J]. Proceedings of the Royal Society B:Biological Sciences, 2015, 282(1818): 20152257. DOI:10.1098/rspb.2015.2257 |
| [51] |
WIEDENMANN J, D'ANGELO C, SMITH E G, et al. Nutrient enrichment can increase the susceptibility of reef corals to bleaching[J]. Nature Climate Change, 2013, 3(2): 160-164. DOI:10.1038/nclimate1661 |
| [52] |
FARMER Ⅲ J J, HICKMAN-BRENNER F W. The genera Vibrio and Photobacterium[M]. New York: Springer, 2006: 508-563.
|
| [53] |
KOREN O, ROSENBERG E. Bacteria associated with the bleached and cave coral Oculina patagonica[J]. Microbial Ecology, 2008, 55(3): 523-529. DOI:10.1007/s00248-007-9297-z |



