2. 广西壮族自治区海洋环境监测中心站, 广西北海 536000;
3. 广西水产研究院贝类科学实验站, 广西南宁 530004;
4. 厦门大学环境与生态学院, 福建厦门 361001
2. Marine Environmental Monitoring Center of Guangxi, Beihai, Guangxi, 536000, China;
3. Guangxi Academy of Fishery Science, Nanning, Guangxi, 530004, China;
4. College of the Environment and Ecological Science, Xiamen University, Xiamen, Fujian, 361001, China
【研究意义】近几十年来,贝类养殖作为海水养殖的重要组成部分在沿海地区得到大力发展,促进了当地经济增长,提高了居民的生活水平。但因贝类具备极强的滤水能力,大面积的贝类养殖不可避免地对养殖环境产生较大影响(如浮游植物群落结构、浮游生物密度以及浮游生物粒径谱、养殖水体营养盐水平等理化因子)。香港巨牡蛎(Crassostrea hongkongensis)原称近江牡蛎,属暖水性贝类,2003年香港学者Lam等[1]将珠江三角洲的近江牡蛎定为一个新种并将其命名为香港巨牡蛎,作为粤西、广西特有的优质食用贝类而在两广沿海地区大面积养殖。而学者在对广西钦州湾浮游生物的分布特征研究中发现,与非养殖区相比,高密度牡蛎养殖区浮游生物的生物量、群落结构等有着显著差异[2-5],高强度牡蛎摄食很可能是其重要原因之一。因此,研究不同浮游植物密度条件下香港巨牡蛎的清滤率、摄食率,不仅对贝类的科学养殖有着重要的意义,同时对确定合理的养殖容量以确保区域生态安全等有着重要的现实意义。【前人研究进展】双壳贝类能够滤食大部分浮游植物、浮游动物幼体以及有机碎屑,近年来利用贝类作为生物控制手段调控富营养化水体已经成为研究热点。付家想等[6]研究香港巨牡蛎的摄食控藻能力时发现,大规格牡蛎的单位个体滤水率达到8.94 L·ind-1·h-1,对亚心形扁藻的摄食百分比高达92%,能有效控制浮游植物密度。黄通谋等[7]发现沟纹巴非蛤和麒麟菜混养能有效地清除富营养化水体中的N、P和Chla。Prins等[8]在中型围隔试验中发现,贻贝能够显著控制浮游植物的爆发与赤潮的发生。但大面积的牡蛎养殖因其较高的清滤率和摄食率,可能会显著改变周围水体浮游植物群落结构,对海区生态系统的影响不可小觑。刘慧等[9]在对比桑沟湾和莱州湾贝类养殖前后微藻周年变动时发现,在扇贝养殖的影响下浮游植物群落优势种发生改变。李宵[10]在粤东深澳湾海水养殖对浮游植物群落结构影响的研究中发现,与对照区相比,贝类养殖区浮游植物密度和群落结构发生显著变化,由原来的主要优势种中肋骨条藻(2.9×105 cells·L-1)演变成中肋骨条藻和颤藻为共同优势种,但中肋骨条藻密度仅为对照区的1/5,为5.88×104 cells·L-1。【本研究切入点】国内对香港巨牡蛎的研究多集中在遗传、育种方面,少有从生态学角度对不同浮游植物密度条件下清滤率、摄食率以及下行控藻的研究[6]。【拟解决的关键问题】研究不同规格的香港巨牡蛎对不同浮游植物密度的摄食率、清滤率,以期为香港巨牡蛎滤食能力、控藻水平以及科学评估香港巨牡蛎养殖容量、生态影响的研究提供依据。
1 材料与方法 1.1 香港巨牡蛎香港巨牡蛎取自广西钦州湾龙门海域牡蛎筏式养殖区,分别在养殖1年龄、2年龄和3年龄的相同批次养殖筏中选取壳高6 cm、10 cm和15 cm左右(代表小、中、大3种不同规格)的健康牡蛎个体,并运回到国家贝类产业体系广西贝类综合实验站(北海)开展实验。去除贝壳上的附着物并清洗干净,放入装有80 L砂滤海水的塑料水箱中暂养一周。暂养期间持续充气,每两天换一次海水,保证牡蛎的活性;早晚定时投喂10 L浓度约3×105 cells·L-1的小球藻(Chlorella sp.)各一次。暂养期间观察牡蛎个体的活性,实验前一天停止投饵,随机挑选活性较好的个体进行实验。暂养香港巨牡蛎以及培养浮游植物的海水为北海市铁山港竹林海域砂滤海水,盐度22‰~24‰,海水温度26~28℃。
1.2 浮游植物及其初始密度实验用藻为北部湾近岸海域常见的牟氏角毛藻(Chaetoceros muelleri)和球等鞭金藻(Isochrysis galbana),分别代表硅藻和金藻,均取自国家贝类产业体系广西贝类综合实验站(北海)浮游植物二级扩种培养室。实验前两种藻经过400目筛绢去除杂质,并在40倍显微镜下测定其细胞密度,每种藻测定3次,每次同时随机测定10个细胞的大小参数。牟氏角毛藻和球等鞭金藻两种浮游植物的近似球体时直径大小约分别为4.0 μm和5.5 μm(直径为近似球体时的参数,牟氏角毛藻参数未包括角毛)。
不同密度实验中2种浮游植物各设定3种初始密度(分别代表低、中、高密度),其中牟氏角毛藻密度梯度设计为0.5×105 cells·L-1、3×105 cells·L-1和8×105 cells·L-1,球等鞭金藻密度梯度设计为0.5×104 cells·L-1、1×105 cells·L-1和1.2×106 cells·L-1。
1.3 摄食实验摄食实验采用静水系统,在容量为5 L的塑料桶、室温32℃下进行。等密度和等生物量的摄食实验分开进行,所用海水为与牡蛎暂养期同样的砂滤海水(盐度24‰,水温28℃)。
在清洗干净的塑料桶中分别加入4 L不同种类、密度的浮游植物藻液,每桶轻移放入准备好的1只牡蛎,观察记录牡蛎开口摄食时间,在开口后1 h取出牡蛎,同时采集10 mL水样并用鲁戈试剂固定。每种规格设置3个重复同步实验,另设一个无贝类空白作为对照以消除浮游植物繁殖和自然沉降的影响。实验中用气石充气使浮游植物混合均匀并保证有充足的溶氧,气量以不搅动桶底排泄物为准。
将实验固定好的浮游植物样品摇匀,然后用移液枪取100 μL放入浮游生物计数框并在显微镜下计数。测定香港巨牡蛎的壳高,随即开壳取出软体部,在60℃烘箱中烘干48 h,称其干重。
分别计算单位个体清滤率(CRind)、摄食率(FRind)以及单位质量清滤率(CRmass)、摄食率(FRmass),并按以下公式进行计算[6]:
清滤率:
| $ {\rm{C}}{{\rm{R}}_{{\rm{mass}}}} = ({Q_0}-{Q_1})/{Q_0} \times {V_S} \times {\left( {1/W} \right)^b}/T, $ | (1) |
| $ {\rm{C}}{{\rm{R}}_{{\rm{ind}}}} = V \times ({\rm{In}}{Q_0} - {\rm{In}}{Q_1})/\left( {N \times T} \right); $ | (2) |
摄食率:
| $ {\rm{F}}{{\rm{R}}_{{\rm{mass}}}} = ({Q_0} - {Q_1}) \times {V_S} \times {\left( {1/W} \right)^b}/T, $ | (3) |
| $ {\rm{F}}{{\rm{R}}_{{\rm{ind}}}} = ({Q_0} - {Q_1}) \times {V_S}/\left( {N \times T} \right), $ | (4) |
式中,Q0、Q1分别为香港巨牡蛎摄食前后海水中浮游植物细胞密(cells·L-1),Vs为实验用海水体积(L),W为香港巨牡蛎软体部干重(g),N为实验牡蛎个数,T为摄食时间(h),b取0.62[11](b值表示体重指数)。
1.4 数据处理实验数据为3个平行组的平均值,以平均值±标准差(mean±S.D.)表示,用Origin 9.0和Excel 2010作图,数据差异显著性检验用SPSS 19.0分析(以P<0.05为差异显著性标准)。
2 结果与分析 2.1 对不同密度牟氏角毛藻的摄食3种不同密度牟氏角毛藻条件下,香港巨牡蛎的单位个体、单位体重清滤率分别为1.29~5.49 L·ind-1·h-1和0.62~1.84 L·g-1·h-1(图 1)。香港巨牡蛎单位个体清滤率均表现出随着牡蛎大小的增加而增加,香港巨牡蛎单位体重清滤率在高密度浮游植物实验中随着体重增加而降低,但在牟氏角毛藻中低密度条件下变化规律不明显(图 1)。在3种不同牟氏角毛藻密度条件下,密度为3×105 cells·L-1时香港巨牡蛎单位个体与单位体重的清滤率均达到最大(5.49 L·ind-1·h-1和1.84 L·g-1·h-1)。浮游植物密度为8×105 cells·L-1时的香港巨牡蛎单位个体清滤率与密度为3×105 cells·L-1时的实验结果相近,但单位体重清滤率降低。低浮游植物密度(5×104 cells·L-1)时,小规格和中规格香港巨牡蛎的清滤率与大规格相比较低(图 1)。
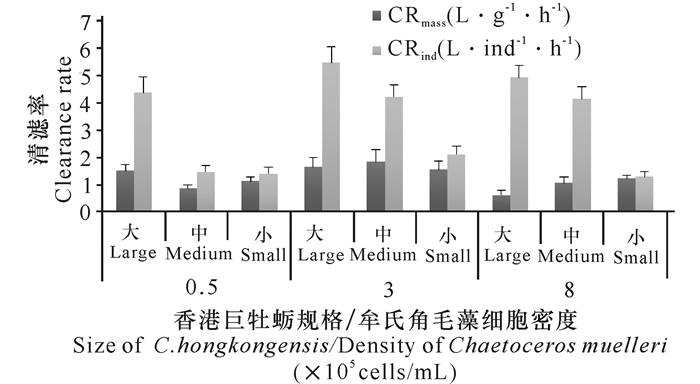
|
图 1 不同规格香港巨牡蛎对3种不同密度牟氏角毛藻的清滤率 Fig.1 Clearance rate of Chaetoceros muelleri with three different densities in different sizes of C.hongkongensis |
香港巨牡蛎单位个体摄食率在3种牟氏角毛藻密度梯度下,均表现出随着牡蛎个体增大而增高(图 2)。在低浮游植物密度下(0.5×105 cells·L-1)香港巨牡蛎单位个体摄食率很低,而牟氏角毛藻密度在3×105 cells·L-1、8×105 cells·L-1时,香港巨牡蛎单位个体摄食率无显著差异(P>0.05),但均显著高于低密度(0.5×105 cells·L-1)下单位个体摄食率(P<0.05)。香港巨牡蛎单位体重摄食率表现出随着浮游植物密度增大而升高(图 2),其中在牟氏角毛藻密度为8×105 cells·L-1时单位体重摄食率最大(7.82×108 cells·g-1·h-1)。香港巨牡蛎单位体重摄食率在高密度牟氏角毛藻实验中表现出随着牡蛎个体增大而降低,但中、低密度实验并没有表现出明显的规律。
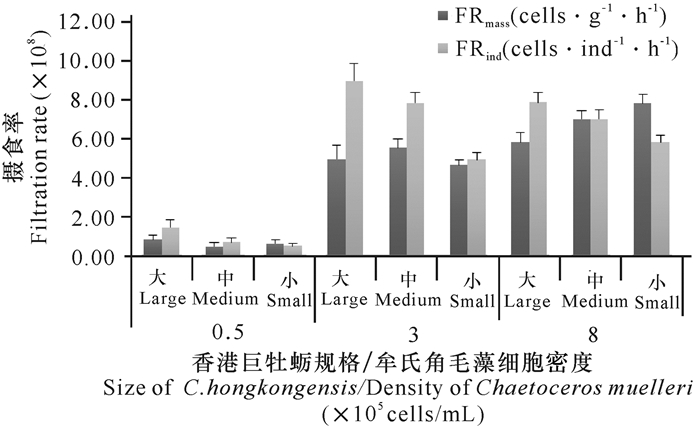
|
图 2 不同规格香港巨牡蛎对3种不同密度牟氏角毛藻的摄食率 Fig.2 Filtration rate of Chaetoceros muelleri with three different densities in different sizes of C.hongkongensis |
香港巨牡蛎对3种不同密度球等鞭金藻的摄食,结果表明其单位个体、单位体重清滤率分别为2.58~8.40 L·ind-1·h-1和1.18~3.17 L·g-1·h-1,均高于对牟氏角毛藻的清滤率。香港巨牡蛎对球等鞭金藻的单位个体摄食率在不同密度条件下均表现出随着香港巨牡蛎个体规格的增大而增加,而单位体重摄食率的表现正好相反(图 3)。在低、中、高3种密度条件下,香港巨牡蛎单位个体和单位体重清滤率表现为中等密度(1×105 cells·L-1)时最高,低密度(0.5×105 cells·L-1)与中等密度(1×105 cells·L-1)的结果相近,高密度(1.2×106 cells·L-1)时最小。而单位个体摄食率和球等鞭金藻密度呈显著的正相关关系(P<0.05):随着浮游植物密度增大而明显增大(图 4)。在不同球等鞭金藻密度中,不同规格香港巨牡蛎对球等鞭金藻的单位个体摄食率和单位体重摄食率的变化趋势与清滤率表现相似,即单位个体摄食率随着香港巨牡蛎个体规格的增大而增加,单位体重摄食率随着个体规格增大而降低,但不同规格之间的单位个体摄食率差异明显低于清滤率(图 3和4)。
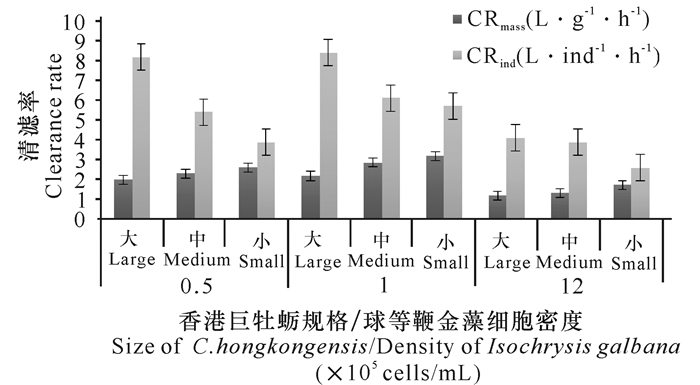
|
图 3 不同规格香港巨牡蛎对3种不同密度球等鞭金藻清滤率 Fig.3 Clearance rate of Isochrysis galbana with three different densites in different sizes of C.hongkongensis |
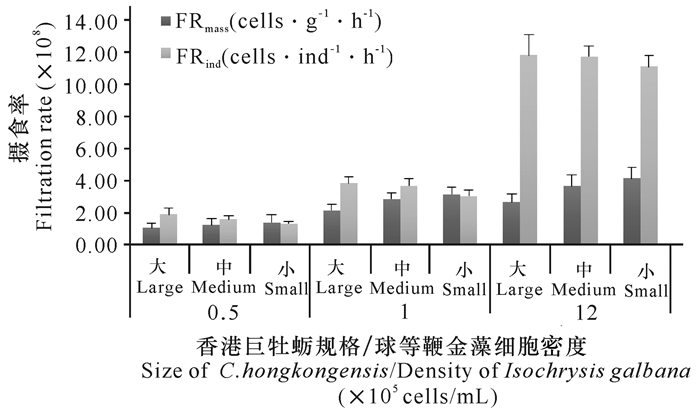
|
图 4 不同规格香港巨牡蛎对3种不同密度球等鞭金藻的摄食率 Fig.4 Filtration rate of Isochrysis galbana with three different densites in different sizes of C.hongkongensis |
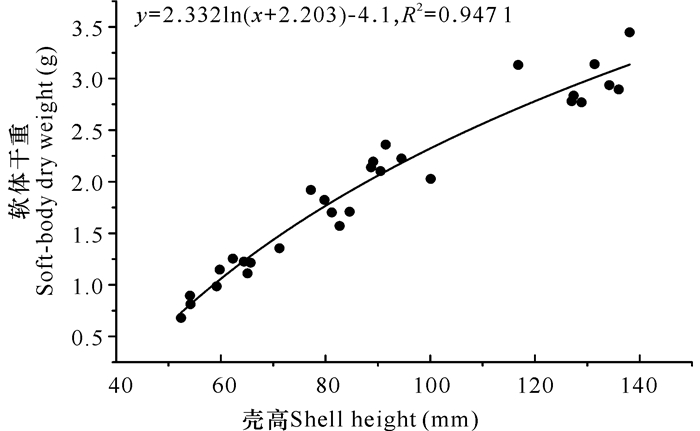
实验所用的小规格香港巨牡蛎平均壳高(最长部分)为62.5~71.1 mm,平均软体干重为0.94~1.18 g;中规格牡蛎平均壳高为93.7~98.9 mm,平均软体干重为1.51~1.76 g;大规格牡蛎平均壳高为135.9~140.5 mm,平均软体干重为2.35~2.64 g。如图 5所示,随着壳高的增加, 香港巨牡蛎的软体干重也相应增加,二者间存在显著的相关性,且表现为对数回归关系:y=2.332ln(x+2.203)-4.1(R2=0.947 1,P<0.01)。
|
图 5 香港巨牡蛎壳高与软体干重的关系 Fig.5 Relationship between soft-body dry weight and shell length of C.hongkongensis |
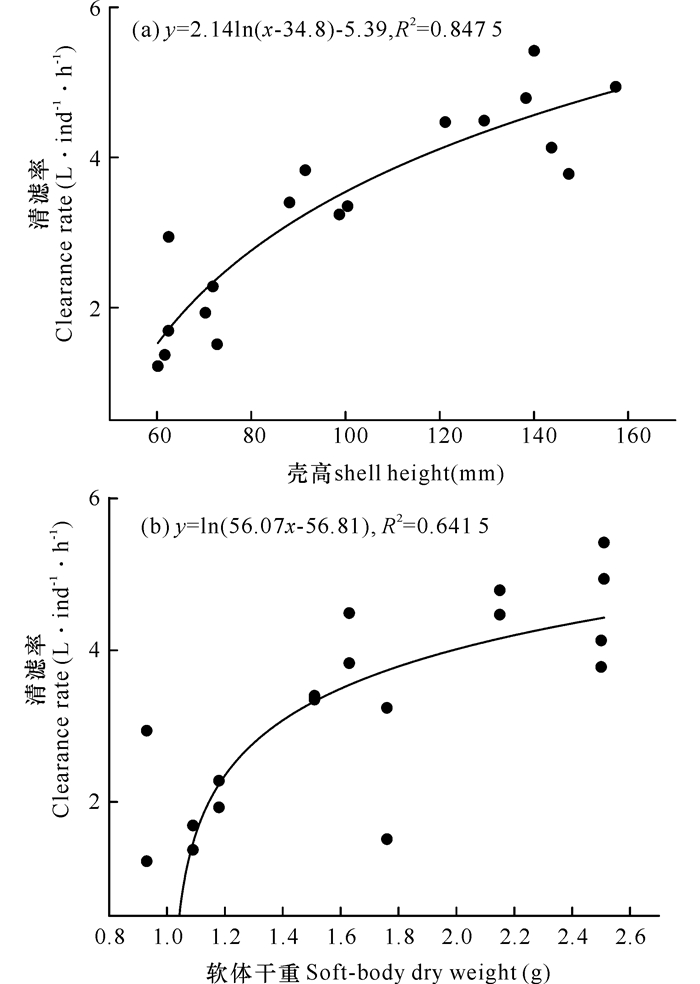
香港巨牡蛎的单位个体清滤率与壳高及软体干重(g)间表现出明显的正相关性。且单位个体清滤率与壳高间的相关性显著,P < 0.01。单位个体清滤率与软体部分干重之间的正相关性也显著,P < 0.05。其中单位个体清滤率与壳高间的相关性显著度略高于其与软体干重间的相关性(图 6)。
|
图 6 香港巨牡蛎单位个体清滤率与壳高(a)、软体干重(b)间的关系 Fig.6 Relationship between per individual clearance rate and shell length(left panel) and soft-body dry weight (right panel) of C.hongkongensis |
在低浮游植物密度范围内,香港巨牡蛎的清滤率随着藻细胞浓度升高而增大:牟氏角毛藻浓度由0.5×105 cells·L-1提高到3×105 cells·L-1时,球等鞭金藻浓度由0.5×105cells·L-1增加到1×105 cells·L-1时,3种规格香港巨牡蛎的清滤率均有所增加(图 1,图 3)。而当牟氏角毛藻密度由3×105cells·L-1上升到8×105cells·L-1时,香港巨牡蛎的单位个体与单位体重清滤率都随着藻密度的升高而下降;球等鞭金藻细胞密度由1×105cells·L-1继续上升到1.2×106cells·L-1时,香港巨牡蛎单位体重清滤率受到显著抑制作用,且下降的幅度明显高于牟氏角毛藻实验组(图 1,3)。这表明在较低密度饵料情况下,适当提高饵料密度会促进香港巨牡蛎的摄食,但在浮游植物(饵料)密度超过某一阈值时,其清滤率相应会受抑制,并且饵料密度越大抑制作用越明显。这与郭华阳等[12]关于长肋日月贝对不同浓度扁藻清滤率的研究结果相一致。浮游植物浓度对双壳贝类的清滤率存在较为显著的影响,对香港巨牡蛎而言,在浮游植物(饵料)密度持续增加的过程中,由于饵料刺激其产生的反馈机制使其在面对丰裕的食物时并不能无限制地摄食下去,导致其会有一个对应于最大清滤率和摄食率的中间饵料浓度[13](阈值)。在浮游植物密度到达这一阈值之前,继续添加饵料会刺激香港巨牡蛎的摄食,超过阈值则会表现为受抑制。赵俊梅[14]在研究长牡蛎、紫贻贝对不同密度塔玛亚历山大藻、裸甲藻摄食实验中发现,高密度的浮游植物会降低双壳贝类的清滤率。但本实验中香港巨牡蛎清滤率出现抑制时的浮游植物浓度(1×106 cells·L-1左右)明显低于林丽华等[15]的实验结果(8.8×106cells·L-1),这可能与实验条件有关。已有研究表明随着水温、盐度的增加,香港巨牡蛎清滤率均表现为先增加后降低的特征,其最大清滤率分别出现在水温22℃和盐度16‰时[6, 13, 15];本实验条件水温和盐度分别为28℃和24‰,这种差异很可能表明环境影响香港巨牡蛎的生理状态,另外也可能与所使用浮游植物种类有关,因此需要根据实际环境条件进一步深入研究。
不同浮游植物密度条件下香港巨牡蛎的摄食率变化较大,基本上随着浮游植物密度的增加而增加(图 2和4),其中从低浓度到中浓度时其摄食率基本上按浮游植物浓度成比例增加,但从中浓度到高浓度时其摄食率增加的幅度较小(图 2)。廖文崇[13]在饵料密度为3.5×106~15.5×106 cells·L-1的摄食实验中发现,香港巨牡蛎在12.9×106 cells·L-1饵料密度条件下摄食率最大。本实验中所用的浮游植物浓度均低于该值,因此随着浮游植物密度的增加香港巨牡蛎的摄食率明显增加;但在高饵料浓度时增加幅度较低,表明牡蛎在高密度条件下受生理条件限制开始出现抑制效应。这种现象从一定程度上表明,虽然牡蛎等被认为对赤潮有一定的控制作用[8],但在赤潮水域高密度赤潮藻可能会显著抑制其摄食,其对浮游植物的调控作用势必会受到影响。再者,本实验结果显示香港巨牡蛎壳高与干重成显著的正相关性(图 5),单位个体的摄食率、清滤率与壳高、干重也有着明显的正相关性(图 6),这为通过利用较为简便且易获取的壳高参数评估香港巨牡蛎对赤潮的控制作用以及养殖容量等工作提供便利。
3.2 不同浮游植物对香港巨牡蛎清滤率和摄食率的影响本实验结果显示,牟氏角毛藻和球等鞭金藻两个不同的浮游植物实验组所得出的香港巨牡蛎清滤率和摄食率有着较大的差异。牟氏角毛藻实验组所得出的香港巨牡蛎单位体重清滤率和摄食率明显低于球等鞭金藻实验组的结果,这与付家想等[6]研究香港巨牡蛎对3种浮游植物摄食结果一致,表明不同种类饵料对香港巨牡蛎的清滤率和摄食率有着显著的影响。浮游植物是双壳贝类的主要食物,又对不同浮游植物的滤食具有一定的选择性,不同的贝类对不同浮游植物的摄食也存在差异[16-17],这主要与浮游植物的大小以及饵料质量有关[6]。本实验中的牟氏角毛藻细胞个体较小(不含角毛),而且硅藻的细胞壁硅质化饵料质量较低[6],导致香港巨牡蛎清滤率和摄食率明显低于球等鞭金藻,因此不同浮游植物种类与香港巨牡蛎清滤率和摄食率密切相关。
除浮游植物种类不同导致香港巨牡蛎的清滤率、摄食率差异明显之外,本实验结果还发现不同浮游植物种类实验组中,不同规格的香港巨牡蛎单位体重清滤率和摄食率有着较大的不同。个体大小是影响贝类清滤率和摄食率的重要因素[13, 18],球等鞭金藻实验组的结果显示,香港巨牡蛎单位体重清滤率和摄食率随着个体规格的增大而降低(图 3和图 4)。这种现象与已有的香港巨牡蛎摄食部分研究结果一致[6, 13, 19],且符合清滤率和摄食率随个体规格增大而减小的规律,这与较小贝类个体具有较高的新陈代谢等生理活性有关。但在牟氏角毛藻实验组中这种规律不明显:在高密度条件下,香港巨牡蛎单位体重清滤率和摄食率随着个体大小增大而降低;但在低密度时规律不明显。目前关于不同个体规格对香港巨牡蛎的摄食率及清滤率影响的研究报道很少,而且结果仍有争议性。廖文崇[13]的实验结果显示,香港巨牡蛎的清滤率及摄食率随着个体增大而减少,但付家想等[6]研究表明这种规律性因所用的饵料种类而异,香港巨牡蛎摄食不同的浮游植物时其清滤率与个体大小之间的相互关系存在较大差异。在低密度牟氏角毛藻实验组中,小规格个体单位体重清滤率低于大规格个体,这与付家想等[6]对香港巨牡蛎以及王芳等[20]对海湾扇贝和太平洋牡蛎滤水率的研究相似。这种现象可能与牟氏角毛藻本身的细胞特征以及香港巨牡蛎的摄食选择性有关。本实验中的牟氏角毛藻细胞粒径虽然小于球等鞭金藻,但如果考虑其角毛(通常为藻体的5~6倍),其细胞粒径则显著大于球等鞭金藻,因此相对于小个体的香港巨牡蛎来说其更易被大规格个体捕获。另外牟氏角毛藻不仅营养价值低,且在摄食时其角毛上的倒刺可能会损害贝类腮丝和纤毛[6],也会使小规格的牡蛎产生避食现象。在香港巨牡蛎高强度的摄食压力下,钦州湾大规模高密度养殖区的硅藻仍是浮游植物群落结构的重要类群[2-4],这可能与香港巨牡蛎的摄食选择性有关,后续研究应该加强研究香港巨牡蛎对不同浮游植物种类的摄食选择性。
4 结论香港巨牡蛎对不同浮游植物种类的摄食率差异明显,香港巨牡蛎对牟氏角毛藻的清滤率及摄食率均低于对球等鞭金藻的结果。香港巨牡蛎单位个体清滤率和摄食率均随着贝类个体增大而增加,大个体牡蛎的控藻能力更强。
香港巨牡蛎对球等鞭金藻的单位体重清滤率和摄食率随着个体增大而降低,但香港巨牡蛎对牟氏角毛藻的单位体重清滤率和摄食率在中等密度条件下香港巨牡蛎具有较高的单位体重清滤率,存在饵料浓度阈值现象。
香港巨牡蛎的清滤率和摄食率除受牡蛎个体大小和浮游植物密度影响之外,还与浮游植物的种类、大小、营养质量等因子密切相关。
| [1] |
LAM K, MORTON B. Mitochondrial DNA and morphological identification of a new species of Crassostrea(Bivalvia:Ostreidae) cultured for centuries in the Pearl River Delta, Hong Kong, China[J]. Aquaculture, 2003, 228(1/2/3/4): 1-13. |
| [2] |
蓝文陆, 王晓辉, 黎明民. 应用光合色素研究广西钦州湾丰水期浮游植物群落结构[J]. 生态学报, 2011, 31(13): 3601-3608. LAN W L, WANG X H, LI M M. Phytoplankton community structure in Qinzhou Bay during flood season by analysis of HPLC photosynthetic pigment signatures[J]. Acta Ecologica Sinica, 2011, 31(13): 3601-3608. |
| [3] |
蓝文陆, 黎明民, 李天深. 基于光合色素的钦州湾平水期浮游植物群落结构研究[J]. 生态学报, 2013, 33(20): 6595-6603. LAN W L, LI M M, LI T S. Phytoplankton community structure based on pigment composition in Qinzhou Bay during average water period[J]. Acta Ecologica Sinica, 2013, 33(20): 6595-6603. |
| [4] |
蓝文陆, 李天深, 郑新庆, 等. 枯水期钦州湾浮游植物群落结构组成与分布特征[J]. 海洋学报, 2014, 36(8): 122-129. LAN W L, LI T S, ZHENG X Q, et al. The structure and distribution of phytoplankton community in the Qinzhou Bay during dry season[J]. Acta Oceanologica Sinica, 2014, 36(8): 122-129. |
| [5] |
蓝文陆, 李天深, 刘勐伶, 等. 钦州湾丰水期和枯水期浮游动物群落特征[J]. 海洋学报, 2015, 37(4): 124-133. LAN W L, LI T S, LIU M L, et al. Characteristics of zooplankton community in the Qinzhou Bay during flood and dry seasons[J]. Acta Oceanologica Sinica, 2015, 37(4): 124-133. |
| [6] |
付家想, 蓝文陆, 李天深, 等. 香港巨牡蛎对3种浮游植物摄食率和滤清率的研究[J]. 海洋学报, 2017, 39(8): 62-69. FU J X, LAN W L, LI T S, et al. Research of clearance rate and filtration rate of Crassostrea hongkongensis feeding on three different phytoplankton[J]. Acta Oceanologica Sinica, 2017, 39(8): 62-69. |
| [7] |
黄通谋, 李春强, 于晓玲, 等. 麒麟菜与贝类混养体系净化富营养化海水的研究[J]. 中国农学通报, 2010, 26(18): 419-424. HUANG T M, LI C Q, YU X L, et al. Purification of chlorophyll A, nitrogen and phosphate in eutrophic water by Paphia exarata philippi and Kappaphycus striatum Schmitz[J]. Chinese Agricultural Science Bulletin, 2010, 26(18): 419-424. |
| [8] |
PRINS T C, ESCARAVAGE V, SMAAL A C, et al. Nutrient cycling and phytoplankton dynamics in relation to mussel grazing in a mesocosm experiment[J]. Ophelia, 1995, 41(1): 289-315. DOI:10.1080/00785236.1995.10422049 |
| [9] |
刘慧, 方建光, 董双林, 等. 莱州湾和桑沟湾养殖海区浮游植物的研究Ⅱ[J]. 海洋水产研究, 2003, 24(3): 20-28. LIU H, FANG J G, DONG S L, et al. Study on phytoplankton in raft-culture areas of Laizhou Bay and Sanggou BayⅡ[J]. Marine Fisheries Research, 2003, 24(3): 20-28. |
| [10] |
李宵. 海水养殖对浮游植物群落结构和水质的影响[D]. 广州: 暨南大学, 2009. LI X. Effects of mariculture on the phytoplankton community and water quality[D]. Guangzhou: Jinan University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10559-2009108380.htm |
| [11] |
RIISGARD H U, RIISGÅRD H U. Filtration rate and growth in the blue mussel, Mytilus edulis LINNEAUS, 1785: Dependence on algal concentration[J]. J Shellfish Res, 1991, 10(1): 29-35. |
| [12] |
郭华阳, 王雨, 陈明强, 等. 盐度、饵料密度对长肋日月贝滤水率的影响[J]. 广东农业科学, 2012(15): 144-146, 152. GUO H Y, WANG Y, CHEN M Q, et al. Effects of microalgae densities and salinity on the filtration rate of Amusium pleuronectes[J]. Guangdong Agricultural Sciences, 2012(15): 144-146, 152. DOI:10.3969/j.issn.1004-874X.2012.15.046 |
| [13] |
廖文崇. 几种环境因子对香港巨牡蛎摄食和代谢的影响研究[D]. 上海: 上海海洋大学, 2010. LIAO W C. Effects of environmental factors on the feeding and metabolic physiology of Crassostrea hongkongensis[J]. Shanghai: Shanghai Ocean University, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1821728 |
| [14] |
赵俊梅. 三种海洋滤食性贝类对两种赤潮甲藻摄食生理的初步研究[D]. 青岛: 中国海洋大学, 2004. ZHAO J M. Primary studies on filter-feeding physiology of three important marine bivalves on two red tide dinoflagellates[D]. Qingdao: Ocean University of China, 2004. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y647212 |
| [15] |
林丽华, 廖文崇, 谢健文, 等. 盐度对香港巨牡蛎摄食和代谢的影响[J]. 广东农业科学, 2012, 11: 10-14. LIN L H, LIAO W C, XIE J W, et al. Effect of salinity on the feeding and metabolic physiology of Crassostrea hongkongensis[J]. Guangdong Agricultural Sciences, 2012, 11: 10-14. |
| [16] |
张爱菊, 朱俊杰, 刘金殿. 3种微藻对池蝶蚌幼蚌的选择滤食与生长的影响[J]. 浙江海洋学院学报:自然科学版, 2012, 31(1): 65-69. ZHANG A J, ZHU J J, LIU J D. Effects of three species of microalgae on ingestion rate and growth of juvenile Hyriopsis schlegeli[J]. Journal of Zhejiang Ocean University:Natural Science, 2012, 31(1): 65-69. |
| [17] |
WONG W H, CHEUNG S G. Feeding behaviour of the green mussel, Perna viridis(L.):Responses to variation in seston quantity and quality[J]. Journal of Experimental Marine Biology and Ecology, 1999, 236(2): 191-207. DOI:10.1016/S0022-0981(98)00207-X |
| [18] |
张继红. 滤食性贝类养殖活动对海域生态系统的影响及生态容量评估[D]. 北京: 中国科学院研究生院, 2008. ZHANG J H. Effect on filter feeding shellfish mariculture on the ecosystem and the evaluation of ecology carrying capacity[D]. Beijing: Graduate University of Chinese Academy of Science, 2008. http://cdmd.cnki.com.cn/article/cdmd-80068-2008117213.htm |
| [19] |
廖文崇, 朱长波, 张汉华. 体规格对香港巨牡蛎摄食和代谢的影响[J]. 中国渔业质量和标准, 2011, 1(3): 41-46. LIAO W C, ZHU C B, ZHANG H H. Effects of sizes on the feeding and metabolic physiology of Crassostrea hongkongensis[J]. Chinese Fishery Quality and Standards, 2011, 1(3): 41-46. |
| [20] |
王芳, 董双林, 张硕, 等. 海湾扇贝和太平洋牡蛎的食物选择性及滤除率的实验研究[J]. 海洋与湖沼, 2000, 31(2): 139-144. WANG F, DONG S L, ZHANG S, et al. Experimental studies on feeding selectivity and the filter-feeding rate of Argopecten irradians and Crassistrea gigas[J]. Oceanologia Et Limnologia Sinica, 2000, 31(2): 139-144. DOI:10.11693/hyhz200002005005 |
 2018, Vol. 25
2018, Vol. 25 


