2. 广西医科大学药学院,广西南宁 530021;
3. 广西中医药大学药学院,广西南宁 530200
2. College of Pharmacy, Guangxi Medical University, Nanning, Guangxi, 530021, China;
3. School of Pharmacy, Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China
钩藤(Uncaria rhynchophylla)是茜草科(Rubiaceae)的一种常绿藤本植物,含有多种萜类吲哚生物碱(Terpenoid Indole Alkaloids,TIA),包括异钩藤碱、钩藤碱和钩藤素,药用价值高,常用于治疗高血压、癫痫和阿尔茨海默病[1]。在传统中药体系中,相比于钩藤的其他器官组织,钩藤的茎钩被认为具有更好的药理作用[2]。钩藤茎钩仅着生于钩藤分枝的叶腋处,钩藤分枝一般在主茎茎节处呈对生生长,而本课题组前期在试验基地发现了钩藤植株部分主杆上的二级分枝呈三叉状(图 1),三分枝植株显著提高了钩藤单株的茎钩产量。

|
| 图 1 钩藤分枝现象 Fig.1 Branching phenomenon of Uncaria rhynchophylla |
植物的分枝数量受品种类型、生理结构、环境适应、激素调节等多种因素影响,植物激素是重要的因素之一,其中独脚金内酯(Strigolactone,SL)是调控植物分枝发育的重要植物激素。类胡萝卜素裂解双加氧酶(Carotenoid Cleavage Dixoygenase, CCD)作为影响植物激素分泌的重要酶,对深入研究钩藤分枝调控特性具有特殊意义。CCD基因家族是一类编码非血红素铁依赖性酶的基因家族,其成员含有保守的视网膜色素上皮细胞特异性蛋白(Retinal Pigment Epithelium Specific 65 kDa Protein,RPE65)结构域[3]。根据系统发育和功能,CCD基因家族可分为7个亚家族:CCD1、CCD4、CCD7、CCD8、NCED3、NCED6和NCED9[4-6],可参与植物生长发育、分枝形成及胁迫响应等多个生物学过程。在CCD基因家族中,CCD7和CCD8是研究较为深入的两个成员。研究表明,CCD7是类胡萝卜素代谢的关键分支点,催化β-胡萝卜素在9、10号位断裂,生成13C产物(如3-羟基-β-紫罗兰酮,独脚金内酯的前体)[7]。而14C化合物(如β-阿朴-14-胡萝卜醛)可能通过其他裂解酶(如CCD1)催化或氧化形成,与CCD7无直接关联[8]。目前,关于钩藤CCD基因家族的研究尚未见报道。因此,本研究基于课题组前期完成的钩藤基因组测序数据,结合拟南芥(Arabidopsis thaliana) CCD基因家族的蛋白序列信息,拟对钩藤CCD基因家族成员进行系统鉴定和分析,以期解析CCD基因家族对钩藤分枝调控的作用机制,为培育多分枝型钩藤品种并提升钩藤药材产量提供理论基础。
1 材料与方法 1.1 鉴定及命名参照已报道的9个拟南芥CCD蛋白序列[9],利用基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)对钩藤全基因组蛋白序列进行本地比对,利用隐马尔可夫模型生物序列分析工具Hmmer搜索(PFAM编号为PF03055),得到候选的钩藤CCD蛋白序列,并提交至在线软件SMART(http://smart.embl-heidelberg.de/)和在线工具CDD (https://www.ncbi.nlm.nih.gov/cdd)进行蛋白结构预测,删除不包含RPE65结构域的序列。依据拟南芥中同源基因命名方式进行命名,将没有同源基因的命名为UrCCD-like,同一个亚家族内的基因根据染色体上的位置按照小写字母依次排序。钩藤蛋白序列及其注释文件源于武汉贝纳科技有限公司测序所得的钩藤全基因组数据,拟南芥CCD基因序列和蛋白序列(表 1)从GenBank中下载。
| 编号 No. |
基因座位 Gene locus |
染色体位置 Chromosomal location |
基因长度/bp Gene length/bp |
蛋白长度/aa Protein length/aa |
外显子数量 Exon count |
基因标签 Gene tag |
| 1 | AT1G30100 | 10 571 340-10 573 365 | 2 025 | 591 | 1 | NCED5 |
| 2 | AT1G78390 | 29 490 895-29 492 875 | 1 980 | 659 | 1 | NCED1 |
| 3 | AT2G44990 | 18 558 938-18 561 621 | 2 683 | 631 | 7 | CCD7 |
| 4 | AT3G14440 | 4 831 288-4 833 599 | 2 311 | 601 | 1 | NCED3 |
| 5 | AT3G24220 | 8 761 434-8 763 172 | 1 738 | 579 | 1 | NCED6 |
| 6 | AT3G63520 | 23 452 911-23 456 078 | 3 167 | 540 | 14 | CCD1 |
| 7 | AT4G18350 | 10 142 650-10 144 445 | 1 795 | 585 | 1 | NCED2 |
| 8 | AT4G19170 | 10 481 786-10 483 857 | 2 071 | 597 | 1 | NCED4 |
| 9 | AT4G32810 | 15 828 228-15 831 485 | 3 257 | 572 | 6 | CCD8 |
1.2 系统发育树构建
使用MEGA 7.0软件中的Clustal W程序对钩藤、拟南芥、水稻(Oryza sativa)和小粒咖啡(Coffea arabica)的CCD蛋白序列进行比对。使用邻接方法(Neighbor-Joining Method,NJ)构建系统发育树,Bootstrap值设置为1 000。最后,使用在线工具Evolview Evolview (https://www.evolgenius.info/evolview/)对系统发育树进行美化和可视化处理。
1.3 蛋白理化性质分析利用ExPASy数据库的ProtParam(https://web.expasy.org/protparam)分析钩藤CCD蛋白的理化性质,包括氨基酸残基的个数、相对分子量、等电点和亲水性等。
1.4 基因结构及保守基序分析首先运用MEME Suite 5.5.8在线工具(http://meme-suite.org/)分析钩藤CCD蛋白的氨基酸序列的保守基序,基序个数设置为10个;然后用TBtools v1082软件将预测结果xml文件进行可视化处理;最后利用TBtools v1.082软件分析钩藤CCD基因结构,并利用CDD数据库分析CCD基因保守结构域。
1.5 染色体定位、共线性与顺式元件分析利用TBtools v1.082软件制作钩藤CCD基因家族的染色体定位图。利用MEGA 7.0软件构建钩藤和拟南芥CCD蛋白系统进化树,并使用在线工具Evolview(https://www.evolgenius.info/evolview/)对进化树进行美化和可视化处理。利用MCScanX v1.1软件检测钩藤CCD基因复制事件,并使用TBtools v1.082软件进行钩藤CCD基因家族成员的共线性分析。利用TBtools v1.082软件提取钩藤CCD基因家族上游2 000 bp的启动子序列,使用PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式元件分析。顺式作用元件的鉴定有助于解析基因的转录调控机制,并推测其可能参与的生物学过程及环境响应模式。
1.6 转录组测序分析实验所用钩藤来自广西壮族自治区三江侗族自治县归述村钩藤种植基地,为多年成熟植株。在钩藤旺盛生长期(2023年4月8日)分别采集二分枝、三分枝钩藤植株分叉处的茎节样品,以及在钩藤生殖生长期(2023年5月18日)分别采集钩藤植株的根、茎、叶和花等不同组织样品,各设置3个重复。所有样品置于-80 ℃保存待转录组测序。所有样品的RNA提取、cDNA文库构建及高通量测序工作委托武汉贝纳科技有限公司完成。具体流程如下:首先,采用1%琼脂糖凝胶电泳和NanoPhotometer分光光度计(德国Implen公司)检测RNA完整性及纯度。合格样品取1 μg总RNA,使用Illumina NEBNextⓇ UltraTM RNA文库制备试剂盒构建链特异性cDNA文库。文库质检包括:Qubit 2.0荧光计(美国Thermo Fisher公司)初步定量,Agilent 2100生物分析仪(美国Agilent公司)检测插入片段大小,qPCR(quantitative real-time Polymerase Chain Reaction)精确测定有效文库浓度。达标文库经Illumina HiSeq 2500平台进行双端测序。原始数据经FASTP v0.19.3软件质控获得clean reads后,通过HISAT2 v2.1.0软件比对至钩藤参考基因组,最终利用featureCounts v1.6.2软件计算基因表达量, 以FPKM(Fragments Per Kilobase of transcript per Million mapped reads)计,1≤FPKM<5表示基因有表达;5≤FPKM<20表示基因中等表达,FPKM≥20表示基因显著表达。
根据转录组数据中的FPKM值,分别利用TBtools v1.082软件绘制CCD基因家族成员在钩藤的根、茎、叶和花中的表达热图,利用Origin 2018软件绘制CCD基因家族成员在二分枝、三分枝钩藤植株分叉处茎节的表达柱形图。
2 结果与分析 2.1 CCD基因家族成员的鉴定及染色体定位从钩藤基因组中共筛选出20个钩藤CCD基因家族成员,均具备典型的RPE65结构域。经钩藤CCD基因家族染色体定位分析(图 2)发现,有18个钩藤CCD基因家族成员精准定位在钩藤22条染色体中的8条上,呈不均匀分布,仅分布在chr10、chr13、chr14、chr16、chr19、chr20、chr21和chr22,每条染色体有1-3个基因定位,其中chr13、chr14和chr20上分布的UrCCD基因数量各有3个。另外2个基因UrCCD4-b和UrNCED3-c没有被定位到钩藤的22条染色体上(表 2)。
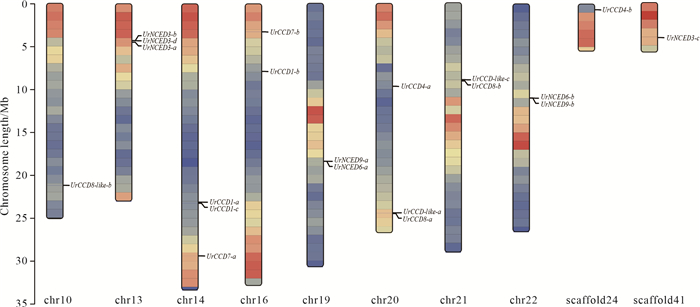
|
| Color represents gene density.The darker the color, the higher the gene density. 图 2 钩藤CCD基因家族成员在染色体上的分布 Fig.2 Distribution of CCD gene family members on the chromosomes of Uncaria rhynchophylla |
| 登录号 Accession number |
基因名称 Gene name |
染色体位置 Chromosomal location |
基因位置 Gene location |
RPE65域位置 RPE65 domain location |
| g43495.t1 | UrCCD1-c | chr14 | 23 247 215-23 259 804 | 60-457 |
| g43754.t1 | UrCCD1-b | chr16 | 7 876 748-7 888 038 | 61-558 |
| g21072.t1 | UrCCD4-a | chr20 | 9 661 195-9 665 149 | 122-589 |
| g31332.t1 | UrCCD4-b | scaffold24 | 663 511-665 439 | 135-604 |
| g20639.t1 | UrCCD7-a | chr14 | 29 381 916-29 386 112 | 68-608 |
| g4483.t1 | UrCCD7-b | chr16 | 3 261 988-3 274 749 | 69-565 |
| g427.t1 | UrCCD8-a | chr20 | 24 492 768-24 497 036 | 102-468 |
| g30064.t1 | UrCCD8-b | chr21 | 9 118 478-9 122 539 | 82-516 |
| g20336.t1 | UrCCD-like-b | chr10 | 21 212 751-21 229 048 | 59-479 |
| g43501.t1 | UrCCD1-a | chr14 | 23 118 618-23 119 112 | 102-152 |
| g432.t2 | UrCCD-like-a | chr20 | 24 410 604-24 417 706 | 89-621 |
| g30075.t1 | UrCCD-like-c | chr21 | 8 971 416-8 976 874 | 89-526 |
| g19751.t1 | UrNCED3-b | chr13 | 4 310 841-4 311 488 | 33-211 |
| g30946.t1 | UrNCED3-c | scaffold41 | 4 084 957-4 086 477 | 33-498 |
| g31259.t1 | UrNCED6-a | chr19 | 18 414 977-18 415 873 | 119-296 |
| g32452.t1 | UrNCED6-b | chr22 | 10 982 024-10 982 867 | 78-236 |
| g31260.t1 | UrNCED9-a | chr19 | 18 413 422-18 414 864 | 1-245 |
| g32451.t1 | UrNCED9-b | chr22 | 10 983 014-10 983 532 | 1-172 |
| g19752.t1 | UrNCED3-d | chr13 | 4 311 587-4 312 360 | 1-249 |
| g11687.t1 | UrNCED3-a | chr13 | 4 496 039-4 497 559 | 33-498 |
为解析钩藤CCD基因家族成员与其他物种间的进化关系,基于钩藤(20个)、拟南芥(9个)、水稻(10个)及小粒咖啡(20个)的CCD蛋白序列,采用最大似然法构建系统进化树,结合拓扑结构和分支支持率评估其亲缘关系(图 3)。根据序列相似性及进化树分支情况,将17个钩藤CCD基因家族成员分成CCD和NCED两个亚家族,其中CCD亚家族可分为CCD1 (3个)、CCD4 (2个)、CCD7 (2个)和CCD8 (2个)4个亚类,NCED亚家族又可分成NCED3 (4个)、NCED6 (2个)和NCED9 (2个)3个亚类,其他3个与拟南芥没有同源基因的家族成员则被归类到CCD-like类别,而同一类别中基因家族成员按其在染色体上位置则以小写字母排序。钩藤CCD基因家族成员中的CCD1亚类、CCD4亚类、CCD-like亚类、NCED3亚类和NCED9亚类在进化树中与同为茜草科植物小粒咖啡CCD基因的亲缘关系较近。
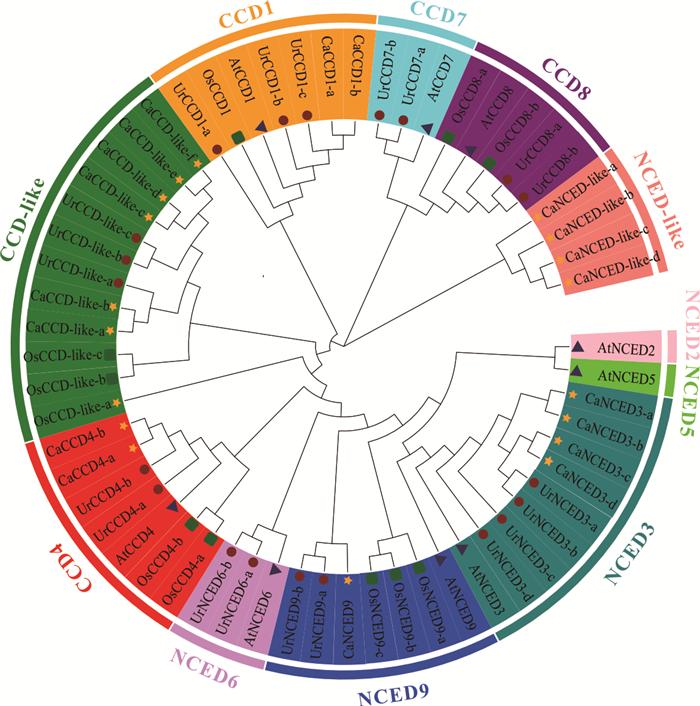
|
| 图 3 钩藤、拟南芥、水稻和小粒咖啡CCD基因家族系统进化树 Fig.3 Phylogenetic tree of CCD gene family from Uncaria rhynchophylla, Arabidopsis thaliana, Oryza sativa and Coffea arabica |
2.2 钩藤CCD基因家族成员的蛋白理化性质分析
通过ExPASy在线软件对钩藤CCD基因家族成员进行蛋白理化性质预测分析(表 3)。结果表明,钩藤CCD基因家族编码的蛋白由164-1 278个氨基酸组成,蛋白相对分子量为17 994.59-134 040.96 Da,均值为54 004.85 Da。与NCED蛋白亚家族成员(UrNCED3-c、UrNCED3-a除外)相比,CCD蛋白亚家族成员的氨基酸数目更小(UrCCD1-a除外);理论等电点的范围为4.7-9.1,只有蛋白UrCCD1-c、UrNCED3-b、UrNCED6-a、UrNCED6-b呈碱性,其他16个UrCCD呈酸性;不稳定指数为29.03-49.78,其中蛋白UrCCD7-a、UrCCD7-b、UrCCD-like-a、UrNCED6-a、UrNCED6-b不稳定指数>40,为不稳定蛋白;脂溶系数为68.40-97.44;亲水性平均值介于-0.373至0.214,除UrCCD1-a (0.214)外,其余蛋白亲水性平均值均<0,为亲水性蛋白;亚细胞定位分析显示钩藤CCD基因家族成员编码的蛋白位于细胞不同位置,大部分定位在细胞质、叶绿体,少部分定位在细胞核和细胞膜。
| 蛋白名称 Protein name |
氨基酸数量 Number of amino acids |
相对分子量 Relative molecular weight |
理论等电点 Theoretical isoelectric point |
不稳定指数 Instability index |
脂溶系数 Aliphatic index |
亲水性平均值 Grand average of hydropathicity |
亚细胞定位 Subcellular localization |
| UrCCD1-c | 467 | 53 267.68 | 7.6 | 29.03 | 82.83 | -0.285 | Cytoplasm |
| UrCCD1-b | 571 | 64 697.43 | 6.3 | 30.50 | 83.96 | -0.248 | Cytoplasm |
| UrCCD4-a | 597 | 65 725.89 | 6.9 | 37.96 | 86.85 | -0.182 | Chloroplast,cytoplasm |
| UrCCD4-b | 612 | 67 393.79 | 6.6 | 38.02 | 79.00 | -0.324 | Chloroplast,cytoplasm |
| UrCCD7-a | 618 | 69 263.85 | 6.4 | 41.45 | 80.63 | -0.258 | Cytoplasm |
| UrCCD7-b | 1 278 | 134 040.96 | 5.6 | 49.60 | 68.40 | -0.149 | Nucleus |
| UrCCD8-a | 469 | 52 057.46 | 5.5 | 31.44 | 82.73 | -0.280 | Chloroplast,cytoplasm |
| UrCCD8-b | 518 | 57 946.98 | 6.6 | 36.78 | 75.87 | -0.373 | Chloroplast |
| UrCCD-like-b | 808 | 91 216.32 | 5.1 | 37.70 | 81.27 | -0.311 | Chloroplast |
| UrCCD1-a | 164 | 17 994.59 | 4.7 | 39.88 | 87.99 | 0.214 | Cell membrane,cytoplasm |
| UrCCD-like-a | 653 | 72 913.76 | 5.2 | 44.44 | 82.85 | -0.194 | Cytoplasm |
| UrCCD-like-c | 529 | 59 297.71 | 6.0 | 37.44 | 81.25 | -0.221 | Chloroplast,cytoplasm |
| UrNCED3-b | 215 | 23 406.73 | 9.0 | 32.14 | 84.42 | -0.213 | Chloroplast,cytoplasm |
| UrNCED3-c | 506 | 56 542.43 | 5.6 | 38.04 | 80.53 | -0.292 | Cytoplasm |
| UrNCED6-a | 298 | 32 475.77 | 9.1 | 44.38 | 91.01 | -0.235 | Nucleus |
| UrNCED6-b | 246 | 26 680.93 | 9.0 | 49.78 | 90.41 | -0.061 | Chloroplast, cytoplasm |
| UrNCED9-a | 273 | 30 771.59 | 5.4 | 38.98 | 95.93 | -0.018 | Cytoplasm |
| UrNCED9-b | 172 | 19 018.79 | 5.7 | 36.95 | 97.44 | -0.095 | Chloroplast |
| UrNCED3-d | 257 | 28 996.04 | 5.0 | 34.95 | 80.74 | -0.319 | Cytoplasm |
| UrNCED3-a | 506 | 56 388.31 | 5.9 | 35.39 | 81.50 | -0.292 | Cytoplasm |
2.3 钩藤CCD基因家族的基因结构及保守基序分析
根据钩藤基因组注释结果可知(图 4),各成员外显子和内含子的数量和长度差异很大,外显子数目为1-17个,内含子数目为0-16个。UrNCED亚族的基因结构较简单,仅由1-2个外显子组成。UrCCD4亚族基因结构也较为简单,仅有2个外显子。UrCCD1、UrCCD7、UrCCD8和UrCCD-like亚族基因结构较为复杂,外显子数量最多的是UrCCD7-b,有17个;其次是UrCCD1亚族和UrCCD-like亚族,外显子数量有13-14个;而UrCCD7-a、UrCCD8包含的外显子数量为7个。
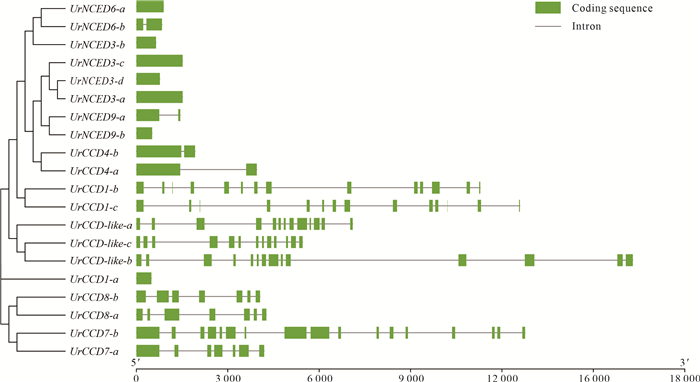
|
| 图 4 钩藤CCD基因家族成员基因结构分析 Fig.4 Analysis of the gene structure of the CCD gene family in Uncaria rhynchophylla |
通过MEME Suite 5.5.8在线工具分析了15个基序(motif),并将其可视化(图 5)发现,最为保守的motif2、motif3存在于16个基因家族成员结构中;其次是motif5、motif10,分别出现在15个、14个UrCCD蛋白的氨基酸序列中。同一亚家族内UrCCD的蛋白基序在结构上具有相似性,但各亚组组间所含的保守基序种类和数量差异较大,例如UrNCED3亚组和UrNCED6所含motif种类完全不同,UrNCED3亚组主要是motif2、motif11、motif13和motif8,而UrNCED6亚组主要是motif15、motif11、motif7、motif13和motif4;UrCCD1-a只含有1个motif10基序,而UrNCED3-c和UrNCED3-a则具有14个相同的motif。
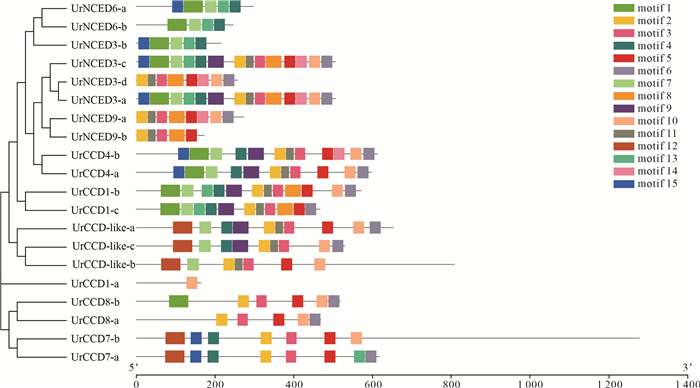
|
| 图 5 钩藤CCD基因家族保守基序分布 Fig.5 Conserved motif distribution of the CCD gene family members in Uncaria rhynchophylla |
2.4 钩藤CCD基因家族的共线性分析
为进一步探索钩藤CCD家族基因的进化关系,对钩藤CCD基因家族进行种内共线性分析发现,UrCCD1-c/UrCCD1-b、UrCCD7-a/UrCCD7-b、UrCCD8-a/UrCCD8-b、UrCCD-like-a/UrCCD-like-c、UrNCED6-a/UrNCED6-b和UrNCED9-a/UrNCED9-b等6对基因存在共线性关系(图 6)。这6对具有共线性关系的基因均为同源基因,且每对同源基因对分别分布于不同的染色体上,说明该家族在进化过程中,染色体片段复制事件可能是促使其家族成员数量增加、发生扩增的主要因素。
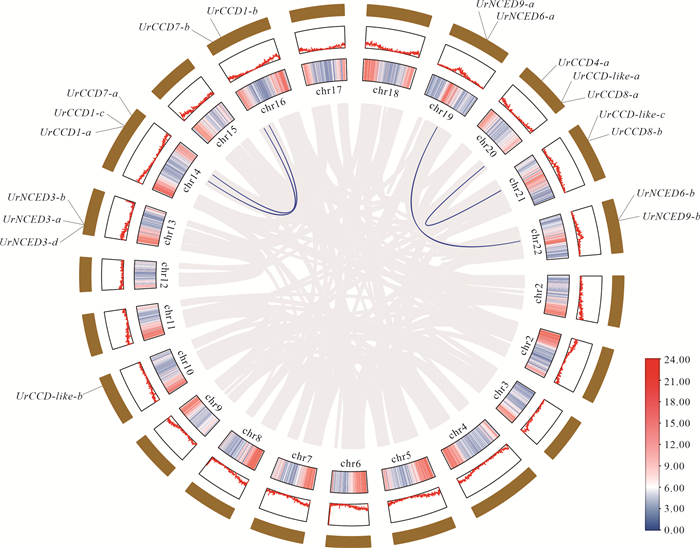
|
| Outer layer: chromosomes; Middle layer: the gene density is displayed as a line graph; Inner layer: the gene density is displayed in the form of a heat map.The gray line represents the collinear relationship of CCD gene family, while the blue line represents the duplicated gene pairs of CCD.The right side represents gene density, with darker colors indicating higher gene density. 图 6 钩藤CCD基因家族成员的共线性分析 Fig.6 Collinearity analysis of CCD gene family members in Uncaria rhynchophylla |
2.5 钩藤CCD基因家族的启动子顺式作用元件分析
为进一步探究钩藤CCD家族基因的潜在功能,对启动子区域的顺式作用元件进行了系统分析(图 7)。按功能分类,共预测到13个生长发育调控元件(A和B)、17个胁迫响应元件(C、D和E)、233个光响应元件(F、G、H、I、J、K、L和M)以及157个激素响应元件(N、O、P、Q、R、S、T、U和V)。结果表明,钩藤CCD家族基因的启动子序列中光响应元件和激素响应元件的占比显著高于其他类型,提示该家族基因可能主要参与光信号转导和激素调控途径,在植物生长发育和环境适应中发挥重要作用。这一发现为进一步研究钩藤CCD家族基因的功能及其调控网络提供了重要线索。

|
| (a) Distribution of predicted cis-acting elements; (b) Number of cis-acting elements.Different cis-acting elements are represented by rectangles of different colors.The darker the color, the more elements there are. 图 7 钩藤CCD基因家族启动子顺式作用元件分析 Fig.7 Analysis of cis-acting elements of the CCD gene family promoters of Uncaria rhynchophylla |
2.6 钩藤CCD基因家族在组织中的表达模式
CCD基因家族成员在二分枝钩藤植株根(UrR)、茎(UrS)、叶(UrL)、花(UrF)等4个组织中的表达见图 8。有3个CCD基因在根中表达水平高;7个CCD基因在茎中显著表达;UrCCD4-b、UrCCD1-c在叶中表达水平极高;在花中表达水平较高的CCD基因数目较多。有研究表明[10],桂花(Osmanthus fragrans)中的CCD1和CCD4可催化类胡萝卜素在特定位置发生裂解反应以参与植物激素的合成。由此可见,CCD基因家族兼具功能保守性和组织表达特异性,可能参与组织特异性代谢调控。
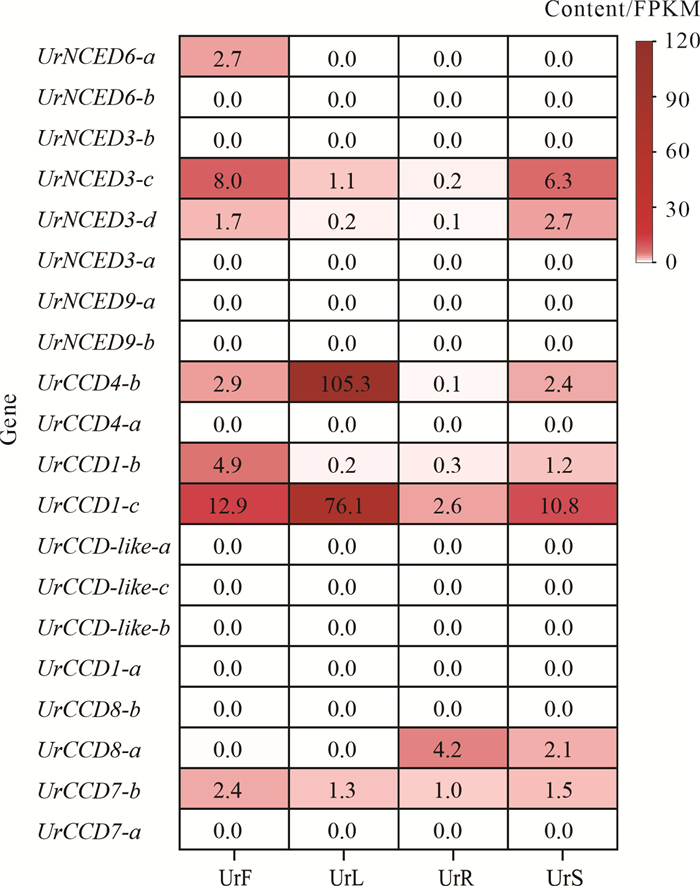
|
| The UrF represents flower; the UrL represents leaf; the UrR represents root; the UrS represents stem.The darker the color, the higher the expression level. 图 8 钩藤植株中不同组织的基因表达水平 Fig.8 Gene expression levels in different tissues of Uncaria rhynchophylla |
另外,根据钩藤植株茎节转录组数据,发现20个CCD基因家族成员中有10个基因家族成员在钩藤茎节中存在表达,且仅有3个基因家族成员表达差异较显著(P < 0.05), 分别为UrCCD1-b、UrCCD8-a、UrCCD8-b (图 9)。有研究表明CCD8/MAX4与激素独脚金内酯调控相关[10-11],植物的分枝发育受激素与基因调控的共同作用。因此,进一步进行qPCR验证,与二分枝钩藤植株相比,三分枝钩藤植株茎节中UrCCD8-a和UrCCD8-b的表达水平显著降低(图 10),印证了独脚金内酯对植物分枝存在负调控机制[12]。同时,表明UrCCD8-a、UrCCD8-b可能通过影响独脚金内酯的生物合成来调控钩藤的分枝表型。
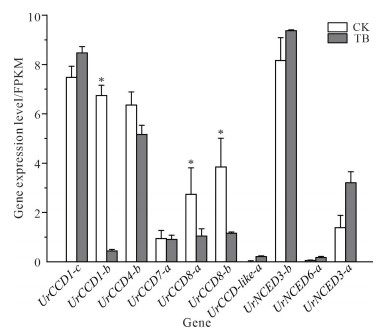
|
| The CK represents stem node of bifurcate plant of Uncaria rhynchophylla.The TB represents stem node of trifurcate plant of Uncaria rhynchophylla.*P < 0.05. 图 9 钩藤茎节中的基因表达水平 Fig.9 Gene expression levels in stem node of Uncaria rhynchophylla |
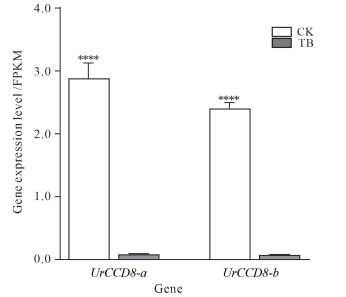
|
| The CK represents stem node of bifurcate plant of Uncaria rhynchophylla.The TB represents stem node of trifurcate plant of Uncaria rhynchophylla.****P < 0.000 1. 图 10 UrCCD8-a和UrCCD8-b在钩藤茎节中的基因表达水平 Fig.10 Gene expression levels of UrCCD8-a and UrCCD8-b in the stem node of Uncaria rhynchophylla |
3 讨论
本研究通过生物信息学分析,在钩藤基因组中鉴定出20个CCD基因家族成员,其编码蛋白长度(164-1 278个氨基酸)与已知植物CCD基因编码的特征相符。根据拟南芥分类标准,这些基因可分为CCD1、CCD4、CCD7、CCD8和NCED亚家族,其中UrNCED和UrCCD4亚家族基因结构相对简单,而其他亚家族成员结构较为复杂,但同亚家族内部结构高度保守(图 3)。这一发现不仅扩充了植物CCD基因家族的数据库,也为研究钩藤次生代谢的分子机制提供了新线索。系统进化分析显示,钩藤CCD基因与拟南芥、水稻、小粒咖啡的CCD基因具有较高的同源性(图 3),表明钩藤CCD基因在进化过程中功能相对保守。值得注意的是,UrCCD4-b和UrCCD1-c在叶片中呈现极高的表达水平,这与前人报道的CCD4参与类胡萝卜素代谢[13-14]和CCD1参与挥发性物质合成[15]的功能相符,提示这两个基因可能在钩藤叶片特殊代谢产物的合成中发挥重要作用。在分枝调控方面,本研究发现三分枝钩藤茎节中UrCCD8-a/b的表达量显著低于二分枝钩藤。这一结果与拟南芥[16]、藏红花(Crocus sativus)[17]等植物CCD7/CCD8通过独脚金内酯途径负调控分枝的机制相呼应。然而,与这些模式植物不同,钩藤表现出独特的CCD1-b表达下调现象,这可能是钩藤分枝调控网络的一个特异性调控节点。这一发现为理解植物分枝发育的多样性提供了新的视角,但具体机制还需通过基因功能验证实验进一步阐明。尽管本研究系统鉴定了钩藤CCD基因家族并分析了其表达模式,但仍存在一些局限性:(1)缺乏CCD基因功能的直接实验验证;(2)未测定独脚金内酯含量与分枝数的相关性;(3)环境因素对CCD基因表达的影响尚未评估。这些问题的解决将有助于更全面地理解CCD基因在钩藤生长发育中的作用。
4 结论CCD基因家族成员在调节植物生长发育和环境胁迫响应等方面发挥重要作用。本研究在钩藤全基因组水平上共鉴定出20个钩藤CCD基因,分布于8条染色体上。钩藤CCD基因编码的蛋白理论等电点为4.7-9.1,绝大多数以酸性为主,均为亲水性蛋白。钩藤与拟南芥、水稻、小粒咖啡的CCD基因具有较高的同源性,表明CCD基因在物种间比较保守。转录组数据分析发现有3个钩藤CCD基因家族成员在根中表达水平高,6个钩藤CCD基因家族成员在茎中显著表达,UrCCD4-b、UrCCD1-c在叶中表达水平极高等现象,表明钩藤CCD基因家族成员具有显著的组织表达特异性;而qPCR验证发现三分枝茎节中与独角金内酯的合成相关的UrCCD8表达量显著下调,与转录组数据一致,推测这些基因可能参与了钩藤分枝的调控过程。本研究为进一步探究钩藤CCD基因家族功能以及利用该基因家族培育多分枝型钩藤品种奠定了基础。
| [1] |
谭桂玉, 万凌云, 张坤, 等. 钩藤的药理作用及临床应用研究进展[J]. 广西科学, 2024, 31(1): 1-8. |
| [2] |
GENG C A, YANG T H, HUANG X Y, et al. Antidepressant potential of Uncaria rhynchophylla and its active flavanol, catechin, targeting melatonin receptors[J]. Journal of Ethnopharmacology, 2019, 232: 39-46. |
| [3] |
AULDRIDGE M E, BLOCK A, VOGEL J T, et al. Characterization of three members of the Arabidopsis carotenoid cleavage dioxygenase family demonstrates the divergent roles of this multifunctional enzyme family[J]. The Plant Journal, 2006, 45(6): 982-993. |
| [4] |
SUN Z K, HANS J, WALTER M H, et al. Cloning and characterization of a maize carotenoid cleavage dioxygenase (ZmCCD1) and its involvement in the biosynthesis of apocarotenoids with various roles in mutualistic and parasitic interactions[J]. Planta, 2008, 228(5): 789-801. |
| [5] |
张亚飞, 彭洁, 朱延松, 等. 柑橘CCD基因家族鉴定及CcCCD4-a对果肉颜色的影响[J]. 中国农业科学, 2020, 53(9): 1874-1889. |
| [6] |
梁细妹, 秦双双, 韦范, 等. 转录因子在植物干旱应激中的功能研究进展[J]. 生物资源, 2024, 46(3): 220-230. |
| [7] |
苏甜. 独脚金内酯调控黄瓜侧枝发育的机制研究[D]. 昆明: 云南农业大学, 2023.
|
| [8] |
艾芊, 云岚, 任晓敏, 等. 新麦草独脚金内酯合成相关基因CCD7的克隆及表达分析[J/OL]. 草地学报, 2024: 1-16[2024-12-26]. http://kns.cnki.net/kcms/detail/11.3362.S.20240909.
|
| [9] |
王瑞凯. 大豆独脚金内酯合成相关基因的克隆、功能与分子进化分析[D]. 南京: 南京农业大学, 2011.
|
| [10] |
王红运. 桂花ERF2转录因子在CCD1和CCD4基因表达调控中的作用研究[D]. 郑州: 河南大学, 2019.
|
| [11] |
DING A Q, BAO F, CHENG W H, et al. Phylogeny of PmCCD gene family and expression analysis of flower coloration and stress response in Prunus mume[J]. International Journal of Molecular Sciences, 2023, 24(18): 13950. |
| [12] |
赵建云. 独脚金内酯类似物(GR24)调控马尾松侧枝发育的机制研究[D]. 南宁: 广西大学, 2024.
|
| [13] |
KLOER D P, SCHULZ G E. Structural and biological aspects of carotenoid cleavage[J]. Cellular and Molecular Life Sciences, 2006, 63(19/20): 2291-2303. |
| [14] |
滕林佐. 桂花类胡萝卜素裂解关键基因CCD1的克隆及功能研究[D]. 长沙: 中南林业科技大学, 2019.
|
| [15] |
宋奕珩, 龚一富, 刘博悦, 等. 不同光周期对湛江等鞭金藻生长、岩藻黄素含量和光合作用及相关基因表达的影响[J]. 核农学报, 2024, 38(3): 532-539. |
| [16] |
BRUNO M, VERMATHEN M, ALDER A, et al. Insights into the formation of carlactone from in-depth analysis of the CCD8-catalyzed reactions[J]. FEBS Letters, 2017, 591(5): 792-800. |
| [17] |
ANGELA R, OUSSAMA A, M R P, et al. Apical dominance in saffron and the involvement of the branching enzymes CCD7 and CCD8 in the control of bud sprouting[J]. BMC Plant Biology, 2014, 14(1): 171. |



