火麻仁(Hemp seed)为桑科植物大麻(Cannabis sativa L.)的干燥成熟果实,亦称大麻仁、线麻子。火麻种植广泛,遍及亚洲、欧洲和北美等地,在中国主要有黑龙江绥化、河北保定、安徽六安、甘肃天水、云南大姚和广西巴马6个产区[1]。火麻仁化学成分主要包括脂肪酸类、蛋白质类、木脂素酰胺类、甾体及萜类、黄酮及苷类、大麻素类等,是国家卫生健康委员会公布的药食同源类中药材之一[2]。现代药理研究表明,火麻仁具有抗氧化[3-4],抗炎[5],神经保护[6],调节血脂、血糖和血压[7-8],调节肠道功能[9],抗肿瘤[10]等方面的作用。火麻仁相关制品已应用于临床,明显改善患有心血管疾病(Cardiovascular Disease,CVD)[11]、阿尔茨海默病(Alzheimer′s Disease,AD)[12]、糖尿病[8]和肿瘤[10]等患者的症状。
目前对火麻仁的研究虽然已取得一定进展,但是仍存在一些问题和不足。在化学成分方面,虽然已鉴定出火麻仁含有多种活性成分,但是对于其在人体内的相互作用以及具体治疗机制尚不明确。例如,火麻仁油中不饱和脂肪酸的稳定性较差,导致其在研究中成分损失或破坏,影响其在新药开发中的应用。在药理作用方面,有关火麻仁治疗机制的研究多基于动物实验,缺乏人体试验数据的支持,难以充分证明其临床疗效。关于火麻仁的研究多是单学科独立研究,如重点研究其成分或者独立药理作用,缺乏多学科间的协同合作研究,这限制了火麻仁在现代医学中的广泛应用,亟待进一步研究。本文从火麻仁的化学成分、药理作用和临床应用3个方面展开综述,通过梳理现有研究,分析存在的问题,旨在为火麻仁的深入研究和开发提供新的思路和方向,推动其在医学领域的发展,为其在多种疾病治疗中的广泛应用提供更多的可能性。
1 火麻仁主要化学成分及相关活性火麻仁化学成分丰富,目前已从火麻仁中分离鉴定出179个化合物,主要包括脂肪酸类、蛋白质类、木脂素酰胺类、甾体及萜类、黄酮及苷类、大麻素类等物质[3, 13]。在火麻仁中还鉴定出86种生物碱,包括酰化腐胺类、酚胺类生物碱等,与火麻仁的抗氧化活性直接相关[14]。此外,火麻仁还含有碳水化合物、纤维素、酚酸类化合物、微量元素、维生素A、维生素C、维生素E等多种化合物组分[15]。火麻仁主要化学成分的详细组成及其分子结构见表 1和图 1,分子式和化学结构图均来自公开化学资源数据库(https://pubchem.ncbi.nlm.nih.gov/)。
| 类型 Category |
化学成分 Chemical component |
分子式 Molecular formula |
| Fatty acids | Linoleic acid | C18H32O2 |
| α-Linolenic acid | C18H30O2 | |
| Oleic acid | C18H34O2 | |
| γ-Linolenic acid | C18H30O2 | |
| Arachidonic acid | C20H32O2 | |
| Docosahexaenoic acid (DHA) | C22H32O2 | |
| Nervonic acid | C24H46O2 | |
| Palmitoleic acid | C16H30O2 | |
| Stearic acid | C18H36O2 | |
| Arachidic acid | C20H40O2 | |
| Proteins | Albumin | C16H26O5 |
| Edestin | ||
| β-Conglycinin | ||
| Arginine | C6H14N4O2 | |
| Glutamic acid | C5H9NO4 | |
| Methionine | C5H11NO2S | |
| Cysteine | C3H7NO2S | |
| Angiotensin Converting Enzyme (ACE)-inhibitory peptides | ||
| Lignanamides | Cannabisin M | C34H32N2O8 |
| Cannabisin N | ||
| Cannabisin O | ||
| 3, 3′-Demethyl-heliotropamide | C36H36N2O8 | |
| Cannabisin E | C36H38N2O9 | |
| Grossamide | C36H36N2O8 | |
| N-trans-Feruloyl tyramine | C18H19NO4 | |
| (±)-Sativamide A | ||
| (±)-Sativamide B | ||
| Sterols | β-Sitosterol | C29H50O |
| Campesterol | C28H48O | |
| Stigmasterol | C29H48O | |
| Δ5-Avenasterol | C29H48O | |
| Cycloartenol | C30H50O | |
| Terpenes | α-Pinene | C10H16 |
| β-Pinene | C10H16 | |
| Myrcene | C10H16 | |
| D-Limonene | C10H16 | |
| Eucalyptol | C10H18O | |
| β-Caryophylene | C15H24 | |
| Sabinene | C10H16 | |
| γ-Terpinene | C10H16 | |
| Flavonoids and glycosides | Quercetin derivatives | C19H18O5 |
| Isorhamnetin derivatives | C16H12O7 | |
| Kaempferol-3-O-glucoside | C21H20O11 | |
| Cyanidin-3-O-glucoside | C21H21ClO11 | |
| Cyanidin-3-O-rutinoside | C27H31ClO15 | |
| Chrysoeriol | C16H12O6 | |
| Luteolin | C15H10O6 | |
| Naringin | C27H32O14 | |
| Genistein | C15H10O5 | |
| Naringenin | C15H12O5 | |
| Daidzein | C15H10O4 | |
| Quercetin-3-O-rutinoside | C27H30O16 | |
| Quercetin-3-O-glucoside | C21H20O12 | |
| Kaempferol-3-O-rutinoside | C27H30O15 | |
| Eriodictyol-7-O-glucoside | C21H22O11 | |
| Eriodictyol | C15H12O6 | |
| Cannabinoids | Δ9-Tetrahydrocannabinol | C21H30O2 |
| Cannabidiol | C21H30O2 | |
| Cannabigerol | C21H32O2 | |
| Cannabichromene | C21H30O2 |
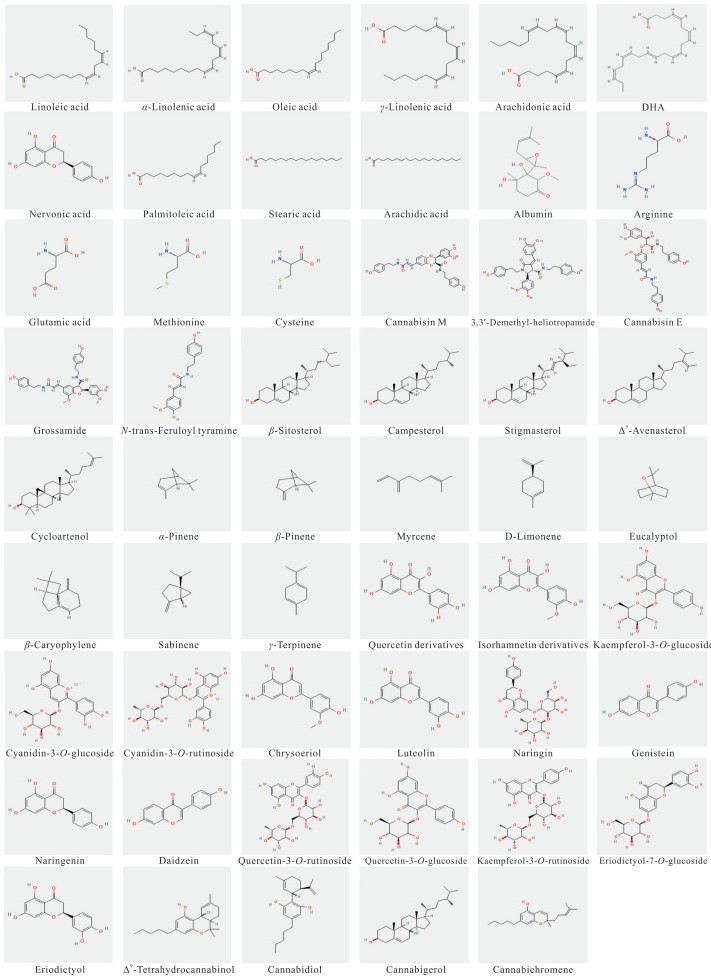
|
| 图 1 火麻仁主要化学成分的分子结构 Fig.1 Molecular structure of the main chemical components in hemp seed |
1.1 脂肪酸类
脂肪是火麻仁中含量最高的化学成分,约占总成分的30%,包括脂肪酸及脂肪酸酯类物质[13]。脂肪酸以不饱和脂肪酸为主,其中多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA)约占总脂肪酸的76%,主要包括亚油酸(Linoleic acid,ω-6)、α-亚麻酸(α-Linolenic acid,ω-3)和油酸(Oleic acid)[16-17]。饱和脂肪酸以棕榈酸(Palmitic acid)和硬脂酸(Stearic acid)为主,占总脂肪酸的10%左右[18]。火麻仁中ω-6∶ω-3稳定在2.36-3.23,这一范围比值有利于脂肪代谢,使火麻仁在维持血脂稳态和预防心血管疾病方面有较大的优势[17-18]。火麻仁脂肪酸的组成受到产地、加工方式及遗传因素的影响[19]。就产地和品种而言,产自广西巴马火麻仁的ω-3含量显著高于甘肃天水和云南大姚等地区的火麻仁,可能与当地海拔(234 m)和年平均气温(19.8 ℃)等生态条件相关[1];源自意大利中部的3个品种,Enectarol的油酸含量(14.97%)显著高于Carmaenecta(12.77%)和Enectaliana(11.45%),其中Carmaenecta的ω-6∶ω-3为3.14,更有利于心血管健康[13]。在加工方式方面,带壳火麻仁因外壳对脂质具有保护作用,其ω-6和ω-3含量较去壳火麻仁高[16]。
1.2 蛋白质类在火麻仁的化学成分中,蛋白质约占总成分的20%,主要由球蛋白和白蛋白构成。球蛋白以麻仁球蛋白(Edestin)为主,其氨基酸组成均衡,必需氨基酸比例符合人体需求,经蛋白质消化率校正的氨基酸评分验证该蛋白为优质植物蛋白[20]。火麻仁的白蛋白中精氨酸和谷氨酸含量丰富,前者在免疫调节和代谢调控中发挥关键作用,后者则与抗氧化功能密切相关[21]。通过化学或酶解处理,可从火麻仁蛋白中获得多种活性肽。Orio等[22]发现,从火麻仁中提取的Gly-Val-Leu-Tyr (GVLY)、Leu-Gly-Val (LGV)和Arg-Val-Arg (RVR)等短链肽,具有显著的血管紧张素转换酶(Angiotensin Converting Enzyme,ACE)抑制活性。
1.3 木脂素酰胺类木脂素酰胺类(Lignanamides)是火麻仁中一类结构多样的酰胺类成分。目前已从火麻仁中分离出20余种木脂素酰胺,包括大麻酰胺(Cannabisin)A-G、M-O、Q等[23]。Zhu等[24]从火麻仁中分离出两个木脂素酰胺外消旋体Sativamides A和Sativamides B,发现这两个成分能够有效缓解衣霉素诱导的神经细胞内质网应激,减轻由此导致的细胞生长抑制和死亡,具有良好的神经保护作用。Aloo等[25]发现在低等生物层面,作为火麻仁重要成分之一的木脂素酰胺对高糖饲养的秀丽隐杆线虫(Caenorhabditis elegans)具有良好的抗氧化、抗肥胖和抗神经衰老作用。
1.4 甾体及萜类火麻仁中甾醇类化合物以β-谷甾醇(β-Sitosterol)含量最高(占总成分的60%-65%),其次为菜油甾醇(Campesterol)和豆甾醇(Stigmasterol)等,这些甾醇类化合物具有调节胆固醇代谢的潜力,与多不饱和脂肪酸协同发挥降胆固醇的作用[26]。Montserrat-De La Paz等[17]发现甾体骨架中普遍存在羟基及酮基取代基团,如环阿屯醇(Cycloartenol)及其氧化衍生物,这类四环三萜的特殊结构赋予了火麻仁甾体类成分区别于其他药用植物的特征。萜类化合物则主要为挥发油组分,单萜和倍半萜占挥发油总量的38.6%,其中α-蒎烯(α-Pinene)、β-石竹烯(β-Caryophyllene)和D-柠檬烯(D-Limonene)为主要活性成分。不同产地火麻仁的萜类组成差异明显,中国南方产区火麻仁的β-石竹烯相对含量(12.4%)较北方产区(8.7%)高出42.5%,这与纬度梯度引起的光照时长和积温变化有关[26]。
1.5 黄酮及苷类在火麻仁中已鉴定出至少8种黄酮类化合物,主要包括黄酮醇类(Flavonols)的山柰酚-3-O-葡萄糖苷(Kaempferol-3-O-glucoside)和槲皮素-3-O-芸香糖苷(Quercetin-3-O-rutinoside),黄烷酮类(Flavanones)的柚皮素(Naringenin)及其糖苷衍生物柚皮苷(Naringin),异黄酮类(Isoflavones)的黄豆苷元(Daidzein)和染料木素(Genistein),以及黄烷醇类(Flavanols)的表儿茶素(Epicatechin)和儿茶素(Catechin)等[14, 27-28]。柚皮苷是火麻籽油中含量最高的黄酮类化合物,占总酚含量的30%-50%,其清除自由基的能力显著高于其他组分[27]。王世连等[1]发现,产自广西巴马的火麻仁,其黄酮类物质以槲皮素衍生物为主,且其自由基清除能力为六大产地中最强,可能与当地高湿热气候促进黄酮类物质生物合成有关;此外,广西巴马火麻仁的山奈酚-3-O-葡萄糖苷含量较高,与油脂中γ-亚麻酸协同增强抗氧化活性。黄酮类化合物通过多途径(如自由基清除、金属离子螯合)发挥抗氧化作用,使其成为火麻仁在药物和功能食品开发中的核心活性成分。
1.6 大麻素类火麻仁中的大麻素类物质含量显著低于植株其他部位(如花、苞片和叶),且种类相对有限[29]。Salehi等[30]的研究表明,在火麻仁及其冷压油中检测到的大麻素类物质主要来源于种子表面腺毛或加工过程中与植株其他组织的接触污染,通过脱壳、冷压等工艺可进一步降低火麻仁制品(如油、粉)中的大麻素残留。已明确鉴定出火麻仁中含有的大麻素包括酸性大麻素大麻二酚酸(Cannabidiolic acid,CBDA)和四氢大麻酚酸(Tetrahydrocannabinolic acid,THCA),中性大麻素大麻二酚(Cannabidiol,CBD)和Δ9-四氢大麻酚(Δ9-Tetrahydrocannabinol,Δ9-THC)等,其中酸性大麻素CBDA和THCA的含量占总大麻素含量的90%以上,而中性大麻素CBD和Δ9-THC含量很低[31]。CBD是一种脂溶性非精神活性大麻素,治疗副作用较少,是应用最广的大麻素类化合物。Δ9-THC对神经系统的作用最为显著,作为大麻素受体1(Cannabinoid receptor 1,CB1R)完全激动剂可引发剂量依赖性致幻反应,长期使用会导致受体脱敏和成瘾风险,因此国际法规严格限定火麻仁制品中Δ9-THC含量不得超过0.3%(干重)[30]。火麻仁本身缺乏THC合成酶和CBD合成酶,但其酸性大麻素可能通过非酶促脱羧反应转化为中性大麻素CBD和Δ9-THC,尤其在热处理或长期储存条件下更明显[32]。
2 火麻仁的核心药理作用及机制目前许多研究显示,火麻仁提取物及其相关制品具有广泛的药理作用,其在抗氧化[3-4],抗炎[5],神经保护[6],调节血脂、血糖和血压[7-8],调节肠道功能[9],抗肿瘤[10],抗菌[33]等方面的作用取得了重要研究进展(图 2)。
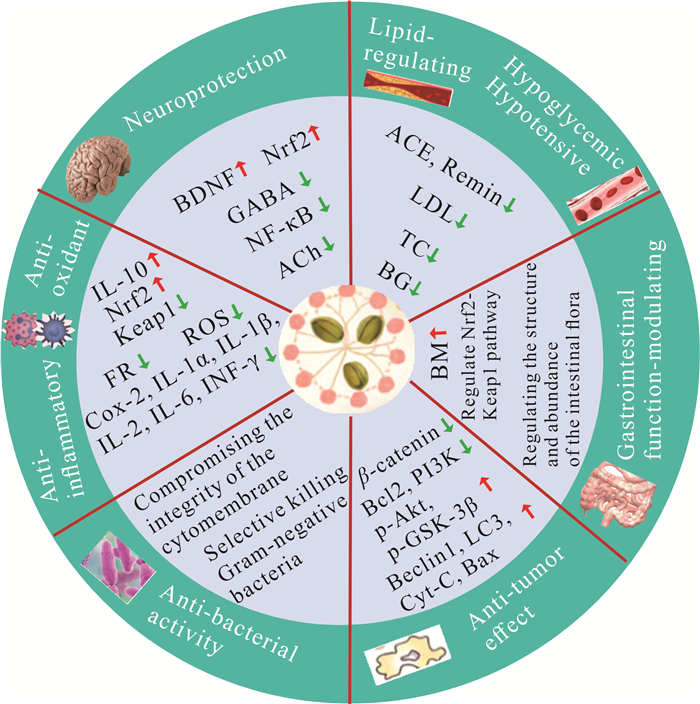
|
| IL-10 indicates interleukin 10;Nrf2 indicates nuclear factor erythroid 2-related factor 2;Keap1 indicates Kelch-like ECH-associated protein 1;FR indicates free radical; ROS indicates reactive oxygen species; Cox-2 indicates cyclooxygenase 2;IL-1α indicates interleukin 1α; IL-1β indicates interleukin 1β; IL-2 indicates interleukin 2;IL-6 indicates interleukin 6;INF-γ indicates interferon-γ; BDNF indicates brain derived neurotrophic factor; GABA indicates gamma-aminobutyric acid; NF-κB indicates nuclear factor kappa-B; ACh indicates Acetyl choline; ACE indicates angiotensin converting enzyme; LDL indicates low-density lipoprotein; TC indicates total cholesterol; BG indicates blood glucose; BM indicates beneficial microorganism; Bcl2 indicates B-cell lymphoma 2;PI3K indicates phosphatidylinositol 3-kinase; p-Akt indicates phosphorylated protein kinase B; p-GSK-3β indicates phosphorylated glycogen synthase kinase 3β; LC3 indicates microtubule-associated protein light chain 3;Cyt-C indicates cytochrome C; Bax indicates Bcl2-associated X protein. 图 2 火麻仁的药理作用机制 Fig.2 Pharmacological mechanism of hemp seed |
2.1 抗氧化、抗炎作用
火麻仁中的多种成分具有不同程度的抗氧化作用。Vitorović等[34]的研究表明,火麻仁油对非应激条件和H2O2诱导下的果蝇氧化应激损伤有改善作用。火麻仁中被水解的蛋白质亦具有显著的抗氧化效果,例如,不同酶水解得到的火麻仁蛋白水解物(Hemp seed Protein Hydrolysates,HPHs)具有不同程度的自由基清除能力;经火麻仁酚类化合物处理的火麻仁球蛋白清除自由基的能力增强[35]。除了上述的脂肪酸和蛋白质,从火麻仁中分离得到的木脂素酰胺也具有较好的抗氧化活性[23]。火麻仁中的大麻素特别是CBD具有强的抗氧化作用。CBD通过影响抗氧化剂的含量和活性,或减少活性氧(Reactive Oxygen Species,ROS)的产生而表现出直接的抗氧化作用[4]。此外,CBD可通过影响过氧化物酶体增殖物激活受体γ(Peroxisome Proliferator Activated Receptor γ,PPAR-γ)、G蛋白偶联受体55(G protein-coupled receptor 55,GPR55)和瞬时受体电位(Transient Receptor Potential,TRP)通道和5-羟色胺1A(5-Serotonin 1A,5-HT1A)受体间接调节氧化还原平衡[36]。火麻仁类黄酮酚羟基上的氢原子可与超氧阴离子结合形成类黄酮自由基,然后与其他自由基反应而终止自由基链反应,从而发挥抗氧化作用[3]。火麻仁中的多糖成分HSP0.2可以上调细胞内转录因子核因子红细胞2相关因子2(Nuclear factor erythroid 2-related factor 2,Nrf2) 的表达而抑制Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)的表达水平,从而使小肠上皮细胞免受H2O2诱导的氧化应激损伤[37]。完整火麻仁提取物比去皮火麻仁提取物具有更好的抗氧化活性[15]。
火麻仁还具有抗炎作用。火麻仁中的大麻素CBD和Δ9-THC可与CB1R和大麻素受体2(Cannabinoid receptor 2,CB2R)结合,发挥抗慢性炎症和慢性疼痛的作用;CBD还可以通过非受体介导的通路激活PPAR-γ来减少炎症的产生,如肺炎和口腔炎症;此外,CBD可抑制白细胞介素-1α(Interleukin-1α,IL-1α)、IL-1β、IL-2、IL-6、干扰素(Interferon-γ,INF-γ)等炎症因子的产生而发挥抗炎作用[38-40]。体外实验显示,火麻仁水解物HPH20A和HPH60A可降低BV-2小胶质细胞的肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、IL-1β和IL-6的mRNA表达水平,同时上调促炎因子IL-10基因的表达而发挥抗神经炎症作用[41]。Kaushal等[5]对高脂饮食致脂肪肝大鼠进行实验,发现火麻仁脂质成分可保护肝脏免受氧化应激和炎症介质环氧合酶-2(Cyclooxygenase 2,Cox-2)、IL-4、TNF-α等的影响。Wang等[42]的研究显示,大麻酰胺F在脂多糖(Lipopolysaccharide,LPS)诱导的BV-2小胶质细胞炎症反应中以浓度依赖性的方式抑制促炎介质如IL-6和TNF-α的产生,这表明木脂素酰胺也具有抗炎作用。
2.2 神经保护作用火麻仁中的大麻素在中枢神经系统中发挥重要作用。其中不具有成瘾作用的CBD可与CB1R结合发挥抗焦虑、抗癫痫、抗精神病和神经保护作用,并通过抑制γ-氨基丁酸(Gamma-Aminobutyric Acid,GABA)再摄取增强抗焦虑效应[3]。CBD还可以通过调节5-HT1A受体和脑源性神经营养因子(Brain Derived Neurotrophic Factor,BDNF)信号通路改善神经可塑性而发挥神经保护作用[43-44]。火麻仁中的Δ9-THC也被证实具有神经保护作用,其可通过CB1R依赖机制恢复线粒体膜电位和抗凋亡对谷氨酸盐损伤的小鼠原代细胞发挥神经保护作用[6]。
乙酰胆碱(Acetylcholine,ACh)系统功能障碍与神经退行性疾病密切相关。Yan等[23]的研究表明HPHs和木脂素酰胺是ACh的强抑制剂,提示其可能具有缓解记忆力减退的作用。LRRK2基因突变是迟发性常染色体显性帕金森病(Parkinson′s Disease,PD)的关键原因,Torrecillas-lopez等[45]利用LRRK2基因突变制备PD小鼠模型来测试HPHs的抗氧化和抗炎作用,研究结果表明,HPHs能够通过降低促炎因子的表达来减轻神经炎症,提示HPHs对PD有很好的预防或治疗作用。火麻仁中的苯丙酰胺类化合物香豆酰氨基丁醇葡萄糖苷(Coumaroylaminobutanol Glucopyranoside,CLG)通过调节NF-κB和Nrf2通路抑制LPS诱导的BV-2小胶质细胞的神经炎症[46]。
2.3 调节血脂、血糖和血压作用火麻仁可以调节血脂异常。Majewski等[47]的研究表明,在膳食中添加磨碎的火麻仁可降低肥胖Zucker大鼠血浆中总胆固醇(Total Cholesterol,TC)水平。火麻仁还可通过调节炎症通路中氧化还原的敏感性来介导高胆固醇血症Wistar大鼠的抗高胆固醇能力[48]。从火麻仁中获得的短链肽混合物可通过调节低密度脂蛋白(Low-Density Lipoprotein,LDL)受体而改善胆固醇的代谢[49];火麻仁短中链肽还具有类似于他汀药物的降胆固醇作用[50]。上述结果均提示火麻仁中的短链肽具有良好的血脂调节作用。
火麻仁具有一定的降血糖作用。Zhang等[8]基于肽组学和计算机模拟分析,从火麻仁蛋白酶水解物中鉴定出了新的α-葡萄糖苷酶抑制肽,其中NPVSLPGR、LSAERGFLY和PDDVLANAF抑制肽表现出强大的α-葡萄糖苷酶抑制活性,提示火麻仁蛋白水解物可能具有一定的降血糖作用。动物实验表明,火麻仁蛋白肽能够调节高血糖大鼠的血糖水平[51]。另一研究的动物体外实验发现,火麻仁酚类成分具有强大的α-淀粉酶抑制活性;同时该酚类成分在动物体内实验中也显示出对糖尿病大鼠显著的降血糖效果[52]。
火麻仁具有很好的降血压作用。有研究显示,火麻仁中的PUFA特别是ω-3和HPHs能够抑制ACE和肾素,从而使火麻仁起到降血压作用[7, 53]。Girgih等[54]使用脱脂火麻仁蛋白水解产物(Hemp seed Meal protein Hydrolysate,HMH)分别喂养幼龄大鼠和成年大鼠,发现与对照组相比,用HMH喂养的幼龄大鼠的收缩压升高幅度减小;用相同的饮食喂养成年大鼠4周后,与对照组的血压相比,其收缩压显著降低,提示HMH具有较强的降压作用。大麻酚是α2肾上腺素受体的激动剂,当该受体激活时会抑制突触前释放去甲肾上腺素,从而使血压降低。Vernail等[55]的研究表明,服用大麻酚后小鼠的血压明显降低。一项临床双盲随机试验显示,与对照组相比,服用火麻仁蛋白或HPHs的高血压患者,其收缩压和舒张压明显改善,这可能与火麻仁蛋白或HPHs降低血浆中ACE、肾素的活性并提高一氧化氮的浓度有关[56]。
2.4 调节肠道功能作用火麻仁、火麻仁油、火麻仁多糖和大麻素可有效调节机体的胃肠功能,其润肠通便的效果已催生出多种中成药应用于临床。Ben Necib等[9]的研究显示,在饮食诱导的肥胖小鼠模型中,用火麻仁喂养的小鼠其肠道中梭菌科(Clostridiaceae)和理研菌科(Rikenellaceae)的丰度均高于用亚麻籽和对照饲料喂养的小鼠,显示出火麻仁具有保护肠道黏膜功能和抗炎作用。Huang等[57]对肠道微生物组进行研究,结果表明火麻仁及其乙醇提取物能改变便秘小鼠肠道菌群的结构和丰度,特别是拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)和普氏菌属(Prevotella)的丰度,刺激肠道有益微生物的增殖,促进肠道蠕动,从而改善肠道健康。火麻仁中的多糖具有重要的肠道保护作用,可通过Nrf2-Keap1信号通路减轻环磷酰胺诱导的小鼠肠道氧化损伤[58],大麻素可影响肠道黏膜的通透性和肠道微生物群的丰度从而调节肠道[59]。
2.5 调节免疫系统、诱导癌细胞凋亡或自噬火麻仁可通过发挥其抗炎作用来调节机体的免疫系统,激活巨噬细胞/自然杀伤细胞直接杀死肿瘤细胞。火麻仁含有的多种成分可诱导癌细胞凋亡或自噬,其中效果最为突出的是CBD。基于细胞模型和动物模型的研究显示,CBD通过激活CB1R和CB2R、瞬时受体电位香草素通道1(Transient Receptor Potential Vanilloid 1,TRPV1),诱导癌细胞凋亡,抑制其在机体内的侵袭和迁移,并增强化疗药物效果,从而发挥抗肺癌、乳腺癌、前列腺癌和结直肠癌等癌症的作用[10]。一项关于荷瘤小鼠的实验显示,火麻仁油可显著增加Beclin1、微管相关蛋白1轻链3(Microtubule-associated protein 1 light chain 3,LC3)、细胞色素C和Bax的表达水平同时显著降低B淋巴细胞瘤2因子(B-cell lymphoma 2,Bcl2)和磷脂酰肌醇3激酶(Phosphatidylinositol 3-kinase,PI3K)的表达水平[60],提示火麻仁油可能通过诱导细胞自噬和凋亡两种途径来发挥抗肿瘤作用。Wei等[61]用火麻仁肽处理人肝癌细胞Hep3B和正常肝细胞系L02,结果显示,Hep3B的活力降低、迁移减少、凋亡增加,但L02的功能不受影响;进一步观察发现,这些变化与火麻仁肽诱导的蛋白激酶B、糖原合成酶激酶3β磷酸化增加以及β-连环蛋白下调有关。
3 火麻仁的主要临床应用基于火麻仁多方面的药理作用,火麻仁及相关产物在日常生活和临床上也得到一定的应用。一些普通家庭根据其药食同源特性,把火麻仁当作功能性食品进行食用,旨在达到保健和养生的目的;部分医生则把火麻仁及其衍生产品作为辅助性药物,用于心血管疾病、神经精神疾病、糖尿病和肿瘤等疾病的预防和治疗;但因缺乏火麻仁直接的在体实验证据和临床依据,所以对于其具体的临床应用引用了一些基础实验研究结果作为依据或基于现有相关理论进行预测和推导,为进一步深入和拓展临床应用研究提供参考(图 3)。
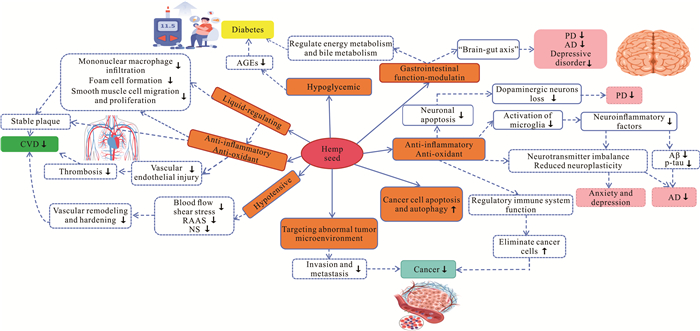
|
| CVD indicates cardiovascular disease; AGEs indicates advanced glycation end-products; RAAS indicates renin-angiolensin-aldosterone system; NS indicates sympathetic nervous system; PD indicates Parkinson′s disease; AD indicates Alzheimer′s disease; Aβ indicates β-amyloid protein; p-tau indicates phosphorylated tau. 图 3 火麻仁的主要临床应用及其机理 Fig.3 Main clinical applications and mechanisms of hemp seed |
3.1 心血管疾病
氧化应激、炎症、血脂异常、高血糖和高血压在CVD的发生和发展中扮演关键角色,而火麻仁及其各组分可能通过稳定斑块、减少血管内皮损伤、抑制血管重塑或硬化等独立或协同机制,发挥潜在的干预或保护作用。火麻仁油不仅提高体外培养内皮细胞的抗氧化能力、改善内皮细胞血脂谱、减少脂质过氧化和炎症反应并维持内皮细胞完整性,还减轻ApoE-/-大鼠的血管炎症,从而发挥抗动脉粥样硬化的作用[11]。在肥胖大鼠的膳食中添加磨碎的火麻仁不但可以降低其血浆甘油三酯水平,减轻血浆和心脏中的脂质过氧化,还能改善去甲肾上腺素的缩血管效应,并上调三磷酸腺苷(Adenosine Triphosphate,ATP)依赖性和Ca2+依赖性钾通道的敏感性,从而调节肥胖大鼠血管功能[47]。在高胆固醇血症Wistar大鼠的饮食中加入火麻仁,可显著改善大鼠的血脂谱,并减轻主动脉组织损伤[48]。
3.2 神经精神疾病在神经系统中,火麻仁具有的抗炎、抗氧化作用可减少神经元凋亡、抑制神经胶质细胞活化和改善神经传导,从而有助于预防或治疗神经精神疾病。Manzoni等[62]的研究显示,火麻仁中的CBD可通过作用于CB1R、CB2R、GPR55、PPAR-γ、5-HT1A等受体和TRPV1、电压门控钾、T型钙等离子通道,发挥抗焦虑,抗抑郁,抗癫痫,抗精神病,缓解AD和PD等神经退行性疾病的作用。此外,火麻仁中的多种生物活性成分,如氨基酸和脂肪酸,能通过改善神经传导和保护神经细胞,进一步增强其对神经精神疾病的疗效[63]。此外,火麻仁对肠道功能的调节作用可能通过“脑-肠轴”影响PD、AD和抑郁症等神经精神疾病。综上,火麻仁中的活性成分通过“受体-离子通道-脑肠轴”的三位一体机制展现出广谱神经保护潜力,但需进一步开展靶向递送系统和精准用药的研究。
3.3 糖尿病火麻仁在糖尿病管理中的应用也引起了广泛关注,其富含的膳食纤维和蛋白质有助于调节糖尿病患者的血糖水平,降低胰岛素抵抗[8]。Thongtak等[64]的研究表明,火麻仁中的生物活性肽能够抑制二肽基肽酶(Dipeptidyl Peptidase,DPP)-Ⅳ的活性,从而提高胰岛素的分泌,降低血糖水平。动物实验结果表明,火麻仁蛋白肽可以降低高血糖大鼠的血糖水平,表明火麻仁蛋白可能是有望预防和治疗高血糖的天然物质[51]。火麻仁可能通过减少糖基化终产物的形成而减少胰岛素抵抗并降低血糖,从而达到治疗糖尿病的作用。火麻仁对肠道功能的调节功能也可能影响机体的能量代谢和胆汁酸代谢而调控糖尿病。火麻仁通过其膳食纤维、蛋白质及生物活性成分的综合作用,对血糖调控和糖尿病管理展现出潜在价值,可为糖尿病防治提供辅助支持。作为天然补充物,其应用应整合于规范化治疗框架内,并加强靶向性临床转化研究。
3.4 肿瘤火麻仁的抗肿瘤特性得到了越来越多的研究支持。火麻仁中的大麻素和大麻素类似物通过靶向异常肿瘤微环境(Tumor Microenvironments,TMEs)、降低肿瘤发生、防止转移和(或)提高化疗、放疗的有效性,影响健康细胞生长和逆转癌症相关异常[65]。CBD在治疗乳腺癌、肺癌、结肠癌、前列腺癌、神经母细胞瘤中展现出多种抗癌效应[10, 66]。Le等[67]的研究表明,大麻素溶液(THC∶CBD=1∶6)可以抑制人胰腺导管腺癌(Pancreatic Ductal Adenocarcinoma,PDAC)异种移植模型的增殖并诱导凋亡;进一步分析发现,大麻素显著降低有丝分裂细胞的有丝分裂率和凋亡率,同时显著增加凋亡细胞;大麻素显著下调Ki-67、PCNA和Bcl2的表达水平并上调Bax/Bcl2比值及Bax、Caspase-3的表达水平,而不能改变Caspase-8表达水平。大麻二酚双哌啶基衍生物增强了火麻仁对黑色素瘤细胞的抗增殖作用[68]。Shan等[69]通过综合代谢组学和相关性分析发现,火麻发酵产物中的活性酸与其增强的抗炎和免疫调节作用密切相关,表明火麻发酵产物能显著降低促炎因子水平,增强免疫系统对癌细胞的清除能力。
4 展望本文综述了火麻仁的主要化学成分、药理作用和主要临床应用,为火麻仁的进一步研究和应用提供了依据。目前,有关火麻仁的研究仍存在以下问题。首先,火麻仁化学成分复杂多样,未来的研究方向应聚焦于火麻仁中尚未被充分研究的化学成分鉴定与功能探索上,或者通过比较不同产地不同品种火麻仁的化学成分,可能会发现具有特定药理作用的新化合物,从而为开发新的药物奠定基础。其次,火麻仁的药理作用机制仍需进一步深入探讨。已有研究主要集中在火麻仁油、火麻仁蛋白,以及大麻素的抗炎、抗氧化、神经保护作用上,但火麻仁复杂的化学成分可能通过多种机制共同发挥作用,未来研究应着重于探讨火麻仁中各类化合物的相互作用及其对生物靶点的影响。再次,火麻仁在临床中的应用也应逐渐扩展,除了传统的缓解便秘、改善消化和治疗疼痛等应用,未来的研究可以集中在治疗心血管疾病、代谢综合征、神经退行性疾病和肿瘤等方面。此外,在临床应用中应建立更多的动物模型和临床试验来验证火麻仁对疾病预防和治疗的有效性,将有助于推动火麻仁在医药领域的应用。最后,关于火麻仁的研究多是单学科独立研究,如重点研究其成分或独立药理作用,缺乏多学科间的协同合作研究。未来应该通过多学科合作,推动火麻仁研究的临床应用,为其在多种疾病治疗中的广泛应用提供更多的可能性。



