2. 桂林医科大学附属桂林市人民医院肾内科, 广西桂林 541000
2. Department of Nephrology, Guilin People's Hospital Affiliated to Guilin Medical University, Guilin, Guangxi, 541000, China
人口老龄化背景下,老年人认知障碍的发生率不断上升,已成为影响老年人生活质量和公共健康的重要问题。认知障碍受多种因素影响,可概括为遗传和环境因素共同作用的结果。其中,较为明确的遗传因素是APOEε4,为认知障碍风险较高的等位基因[1],其他相关基因也陆续被报道,包括CLEC5A、BDH1、ST6GAL1、RAB20、PDS5B、ADARB2和SPSB1等[2-3]。环境因素,也称非遗传因素,包括教育程度、营养状况、生活方式等,其对认知功能的影响已成为研究的热点[4-5]。味觉/嗅觉障碍常被视为认知障碍的早期标志。嗅觉功能下降作为认知损害的预测因子已有大量报道,如Mclaren等[6]的研究显示85%-90%的阿尔茨海默病患者存在嗅觉功能障碍,且嗅觉识别能力下降常早于认知症状出现,可作为认知损害及疾病进展的重要预测指标;Jacobson等[7]指出,嗅觉功能障碍可预测神经退行性疾病患者的进一步认知衰退;Marin等[8]强调,嗅觉功能障碍在多种神经退行性疾病中普遍存在,并可作为疾病早期阶段的临床标志。另外,味觉功能与认知的关系也逐渐受到关注。Mantovani等[9]研究发现,约1/3的老年认知障碍患者存在客观的味觉功能减退。一项采用诱发电位客观评估味觉功能的研究发现,对比健康人,轻度和重度认知障碍患者在受到味觉刺激后皮层反应潜伏期显著延长,且该延迟与简易精神状态检查(Mini-mental State Examination,MMSE)量表认知评分呈负相关,这提示味觉功能下降可能是认知损害的一项早期客观指标[10]。另外,有学者认为味觉受体基因的多态性可能影响个体对味觉刺激的敏感度和饮食偏好,从而间接影响认知[11-12]。Yu等[13]研究表明,苦味受体基因TAS2R113、TAS2R125不仅可在小鼠外周组织中表达,而且也可在下丘脑室管膜细胞中表达,并通过特化的室管膜细胞介导葡萄糖和激素信号传导,提示其可能在能量稳态和脑-全身通讯中发挥中枢作用,这也表明味觉受体基因的遗传变异可能通过中枢化学感知信号途径影响代谢过程,进而对认知功能产生影响。广西红水河流域居民以长寿现象著称于世,且长寿老人的认知功能保持较好。该流域居民长期以来因交通不便,形成相对单一的遗传学背景及独特的饮食习惯[14],其中食用火麻仁食品是该流域居民的饮食特色之一。朱丽娜[15]对D-gal致衰老大鼠的研究表明,火麻仁提取物可能对神经系统具有保护作用,进而改善认知功能。此外,饮食习惯可调节味觉功能,火麻仁食品富含的ω-3脂肪酸与ω-6脂肪酸是内源性大麻素合成的前体物质,而内源性大麻素可增强人体对甜味的感知[16-17]。红水河流域居民长期食用火麻仁油,与该地区长寿老年人群认知功能普遍较好的现象一致,提示该区域人群可能富集了一些能协同发挥味觉功能与认知保护作用的有利单核苷酸多态性(SNP)。该地区老年人群因其独特的遗传背景与生活方式,是研究环境因素和遗传因素对认知功能影响的理想样本,探究其遗传背景,以及味觉功能与认知损害之间的关系,对揭示认知损害的潜在机制具有重要意义。因此,本研究通过检测红水河流域老年人群味觉相关的SNP位点,分析这些SNP位点之间的交互作用,以及SNP位点在不同性别中与味觉功能的交互作用,以探索遗传和环境因素对该流域老年人群认知损害的共同影响,旨在初步揭示老年人群认知功能维持或衰退的遗传学机制,为我国老年人群认知健康的风险评估和干预提供科学依据。
1 材料与方法 1.1 研究对象与分组研究对象为广西红水河流域的老年人群,平均(76.6±12.4)岁。纳入标准包括:年龄≥60岁,长期居住在红水河流域。根据认知功能评估结果将受试者分为认知正常(Cognitive Normal,CN)组和认知损害(Cognitive Impairment,CI)组。通过日常生活活动能力(Activity of Daily Living,ADL)量表评估该流域老年人群的日常生活自理能力。认知状态的判定采用MMSE量表,MMSE量表共30分,涵盖时间定向、地点定向、注意力和计算能力、记忆力、语言与表达6个认知维度,当受试者认知测验得分高于教育调整后MMSE阈值则判定为认知功能正常,即文盲>17分、小学>20分、中学以上>24分[18],低于这些分值者则判定为认知损害者。排除标准:既往患有急性脑血管事件、帕金森病等严重神经系统疾病者,合并影响认知评估的重度抑郁或其他精神障碍者,存在严重感官障碍以致无法配合味觉或嗅觉测试者,患有严重口腔疾病、口干症、近期接受放化疗或使用影响味觉功能药物者,患有严重肝肾功能障碍、严重感染、恶性肿瘤等重大系统性疾病者。最终共有895例老年人纳入分析,其中CN组670例、CI组225例。本研究获得广西医科大学伦理委员会批准(伦理批号:20200036),所有受试者均在签署了书面知情同意书后参与研究。
1.2 临床生化指标检测及味觉功能测定每位受试者均接受经统一培训过的调查员面对面的访谈和体格检查,收集人口学资料和生活方式信息,测量受试者的收缩压(Systolic Blood Pressure,SBP)、舒张压(Diastolic Blood Pressure,DBP)、脉压(Pulse Pressure,PP)、身高(Height)、体重(Weight)、腰围(Waist circumference)和臀围(Hip circumference),并计算平均动脉压(Mean Artery Pressure,MAP)、腰臀比(Waist-to-hip Ratio,WHR)、体质指数(Body Mass Index,BMI)。另外,采集空腹静脉血8 mL,其中6 mL非抗凝血,用于分离血清并检测生化指标;2 mL抗凝血用于提取DNA,并进行味觉相关SNP位点的基因分型。生化指标包括空腹血糖(Fasting Blood Glucose,FBG)、尿酸(Uric Acid,UA)、血尿素氮(Blood Urea Nitrogen,BUN)、同型半胱氨酸(Hcy)、肌酐(Creatinine,Cr)、估算的肾小球滤过率(estimated Glomerular Filtration Rate,eGFR)、总胆固醇(Total Cholesterol,TC)、甘油三酯(Triglyceride,TG)、高密度脂蛋白胆固醇(High-Density Lipoprotein Cholesterol,HDL-C)、低密度脂蛋白胆固醇(Low-Density Lipoprotein Cholesterol,LDL-C)、载脂蛋白A1(Apolipoprotein A1,Apo A1)、载脂蛋白B (Apolipoprotein B,Apo B)、C反应蛋白(C-Reactive Protein,CRP)和免疫球蛋白G (Immunoglobulin G,IgG)。味觉功能评估方面,采用全口味觉检查法对受试者的味觉功能进行评估,测试内容包括甜味、咸味、酸味和苦味4种基本味觉。试剂选用蔗糖(甜)、氯化钠(咸)、柠檬酸(酸)和奎宁(苦),分别按梯度配制5种不同浓度的味觉刺激溶液。测试按照从低浓度到高浓度的顺序进行,能够正确辨别出味道类型的最低浓度为味觉识别阈。评分标准采用五分制,在最低浓度即可识别时则味觉功能记为5分,识别所需浓度越高得分越低,在最高浓度仍无法识别时则计为0分。4种味觉评分相加得到总味觉评分,总分为20分。溶液配制及味觉测试评分方法详见陈玉琴等[19]的研究报道。味觉测试均采用标准溶液和程序,并由专人指导受试者完成,确保结果可靠。
1.3 基因型检测采用标准酚氯仿法从抗凝血中提取基因组DNA。本研究检测以下多态性位点:TAS2R38 rs10246939、CLEC5A rs1285933、CLEC5A rs1285935、CLEC5A rs12539499、CLEC5A rs1285950、AGK rs12703386、AGK rs4725559、AGK rs12539011、DENND11 rs76303304、DENND11 rs2269984、DENND11 rs4726463、DENND11 rs35963232。上述多态性位点所涉及的基因为近期全基因组关联研究(Genome-Wide Association Studies,GWAS)报道的与味觉相关的基因,并在千人基因组计划中国南方汉族人群中。针对这些基因,基于Haploview 4.2软件确定了代表性标签SNPs(表 1),挑选的SNPs的最小等位基因频率(Minor Allele Frequency,MAF)为1%。基因分型采用改进的多重高温连接酶检测反应技术(iMLDR)法[20] (基因型表示中,野生型等位基因在“/”前,突变型等位基因在“/”后),对于在对照组或总人群中显著偏离哈迪-温伯格平衡[Hardy-Weinberg Equilibrium(HWE),P<0.05]的位点予以剔除,HWE检验采用卡方拟合优度检验(Chi-square goodness-of-fit test)。
| 单核苷酸多态性位点 SNPs |
位置 Position |
等位基因 Allele |
| AGK rs12703386 | 7:141552753 | T>C |
| AGK rs4725559 | 7:141587852 | G>A |
| AGK rs12539011 | 7:141595258 | T>C |
| CLEC5A rs1285935 | 7:141928139 | T>C |
| CLEC5A rs12539499 | 7:141930467 | T>C |
| CLEC5A rs1285950 | 7:141936763 | C>A |
| CLEC5A rs1285933 | 7:141927349 | G>A |
| TAS2R38 rs10246939 | 7:141972804 | T>C |
| DENND11 rs2269984 | 7:141662893 | A>T |
| DENND11 rs4726463 | 7:141666839 | A>G |
| DENND11 rs35963232 | 7:141673242 | A>T |
| DENND11 rs76303304 | 7:141656178 | G>A |
| Note: data sourced from the NCBI dbSNP database; in the allele notation, the nucleotide before and after “>” represents the original allele and derived allele, respectively.All SNP positions are reported according to the GRCh38 human reference genome assembly.GRCh38 refers to the 38th version of the human reference genome assembly released by the Genome Reference Consortium. | ||
1.4 统计分析
数据分析采用R软件。正态分布的连续变量以平均数±标准差表示,组间比较采用独立样本t检验。偏态分布或等级资料采用非参数检验。分类变量以频数或比例表示,组间比较采用卡方拟合优度检验。为全面评估各SNP位点在不同遗传模式下与认知状态、味觉功能的关联性,分别采用等位基因遗传模型、显性遗传模型、隐性遗传模型、共显性遗传模型和超显性遗传模型对每个SNP位点进行单因素分析。具体而言,等位基因遗传模型比较突变等位基因与野生型等位基因,显性遗传模型比较杂合突变型/纯合突变型与纯合野生型,隐性遗传模型比较杂合突变型/纯合野生型与纯合突变型,共显性遗传模型对纯合野生型、杂合突变型和纯合突变型3种基因型两两比较并校准P值,超显性遗传模型则比较杂合突变型与纯合野生型/纯合突变型。在多因素分析中,采用多元逻辑回归模型,以认知状态(0=正常,1=损害)为因变量,将各SNP位点基因型转为哑变量并纳入相应遗传模型,调整性别、年龄、空腹血糖、BMI、ADL评分、血脂、肾功能等混杂因素,分析结果以优势比(OR)及其95%置信区间表示。
1.5 交互作用分析为深入探讨遗传因素与环境因素对味觉功能的影响,以及作为人口学变量的性别与其他因素在老年人群认知功能中的交互作用,采用广义多因子降维法(GMDR)分析SNP-SNP及SNP-环境的交互作用,以揭示这些因素如何共同影响认知功能。基于GMDR 0.9软件构建不同维度的最佳交互模型,在不同维度的预测模型中筛选出预测准确率和交叉验证一致性均较高且具有统计学意义的模型作为最优模型。为评估最优模型的交互作用,构建交互作用效应矩阵,每个3×3的方格代表两个SNP位点之间所有可能的基因型组合,深色方格表示具有显著高风险的组合,浅色方格表示具有显著保护性的组合;方格中黑色柱体的高度反映交互作用对认知功能的影响程度,方格中正值表示增加认知损害的风险,负值表示降低认知损害的风险。此外,使用基于MDR 0.7软件分析层次聚类树状图来展示交互作用的强度和模式,交互作用强的变量在树状图中聚类距离较小,表现为连接线的长度较短;红色和橙色线条分别表示强和弱的协同效应,蓝色和绿色线条分别表示强和弱的冗余效应。
2 结果与分析 2.1 一般临床资料研究对CN组(n=670)和CI组(n=225)的临床资料进行了比较分析,结果显示两组在多个变量上存在显著差异。具体而言,CN组的嗅觉(Olfactory)功能评分、甜味觉(Sugar)功能评分、咸味觉(Salt)功能评分、酸味觉(Sour)功能评分、苦味觉(Bitter)功能评分和总味觉(Taste)功能评分均高于CI组(P<0.05),提示味觉功能作为环境因素与认知功能存在关联。人口统计学指标方面,CI组年龄(Age)显著高于CN组(P<0.05),且男性(Male)比例更高(P<0.05),显示出年龄、性别(Gender)差异与认知功能的相关性。生活方式相关指标中,饮酒量(Alcohol drinking)在两组间无显著差异。临床指标方面,CI组的ADL评分、身高、体重、BMI、腰围、臀围、eGFR、TC、Apo A1显著低于CN组(P<0.05),而BUN、Cr、Hcy、IgG则显著高于CN组(P<0.05),其他指标如SBP、DBP、PP、WHR、FBG、MAP、UA、TG、LDL-C、Apo B、Apo A1/Apo B、CRP等在两组间无显著差异,表明部分临床指标与老年人群认知功能密切相关。这些结果共同说明在老年人群认知损害中环境因素发挥着重要作用(表 2)。
| 指标 Indicator |
CN组样本量 Sample size of CN group |
CN组 CN group |
CI组样本量 Sample size of CI group |
CI组 CI group |
| Olfactory | 670 | 10.557±2.145 | 225 | 7.613±2.024* |
| Sugar | 670 | 3.281±0.670 | 225 | 2.516±0.701* |
| Salt | 670 | 3.057±0.709 | 225 | 2.310±0.689* |
| Sour | 670 | 3.754±0.734 | 225 | 2.991±0.641* |
| Bitter | 670 | 2.839±0.732 | 225 | 2.044±0.653* |
| Taste | 670 | 12.931±2.483 | 225 | 9.862±2.331* |
| Age/year | 670 | 73.779±11.030 | 225 | 84.867±12.434* |
| Male (Gender) | 299 | 44.63% | 120 | 53.33%* |
| Female (Gender) | 371 | 55.37% | 105 | 46.67% |
| Alcohol drinking/(500 g/d) | 306 | 0.573±0.697 | 83 | 0.477±0.588 |
| ADL | 661 | 98.389±7.639 | 222 | 90.969±20.260* |
| SBP/mmHg | 670 | 144.581±19.005 | 225 | 145.343±18.929 |
| DBP/mmHg | 670 | 80.359±13.131 | 225 | 81.069±14.477 |
| PP/mmHg | 670 | 64.223±15.088 | 225 | 64.274±15.609 |
| MAP/mmHg | 670 | 99.251±15.797 | 225 | 101.544±15.218 |
| FBG/(mmol/L) | 668 | 5.540±1.307 | 225 | 5.374±1.471 |
| Height/cm | 662 | 152.302±9.810 | 223 | 147.502±10.381* |
| Weight/kg | 667 | 49.447±10.067 | 224 | 42.536±10.252* |
| BMI | 662 | 21.221±3.132 | 223 | 19.382±3.361* |
| Waist circumference/cm | 666 | 72.710±8.413 | 222 | 69.824±8.747* |
| Hip circumference/cm | 665 | 84.472±6.204 | 222 | 80.752±6.994* |
| WHR | 665 | 0.860±0.068 | 222 | 0.865±0.082 |
| BUN/(mmol/L) | 663 | 6.012±1.985 | 220 | 6.536±2.419* |
| Cr/(μmol/L) | 663 | 79.113±28.684 | 220 | 84.959±29.699* |
| eGFR/(mL/min) | 663 | 79.342±20.952 | 220 | 71.389±24.745* |
| UA/(μmol/L) | 663 | 339.490±97.969 | 220 | 346.014±97.941 |
| TG/(mmol/L) | 663 | 1.283±1.056 | 220 | 1.212±0.689 |
| TC/(mmol/L) | 663 | 4.974±0.946 | 220 | 4.769±0.922* |
| HDL-C/(mmol/L) | 663 | 1.481±0.391 | 220 | 1.423±0.400 |
| LDL-C/(mmol/L) | 649 | 2.987±0.860 | 212 | 2.872±0.782 |
| Apo A1/(g/L) | 662 | 1.433±0.193 | 220 | 1.381±0.198* |
| Apo B/(g/L) | 662 | 0.991±0.226 | 220 | 0.976±0.220 |
| Apo A1/Apo B | 662 | 1.516±0.411 | 220 | 1.484±0.430 |
| Hcy/(μmol/L) | 300 | 17.863±5.510 | 124 | 21.478±7.670* |
| IgG/(g/L) | 661 | 14.297±3.771 | 220 | 15.080±4.127* |
| CRP/(mg/L) | 661 | 6.617±7.808 | 219 | 9.022±18.475 |
2.2 HWE分析结果
HWE分析结果显示,除DENND11 rs35963232外,其余SNP位点总体符合HWE(P>0.05)。由于DENND11 rs35963232位点在本研究群体中不符合HWE,因此在后续分析中予以剔除,但剔除DENND11 rs35963232仅涉及该SNP位点本身,不涉及样本个体的删除,因此样本总量未发生变化(表 3)。
| 单核苷酸多态性位点 SNP |
组别(样本量) Group (n) |
纯合野生型(比例/%) Homozygous wild-type (Proportion/%) |
杂合型(比例/%) Heterozygous (Proportion/%) |
纯合突变型(比例/%) Homozygous mutant (Proportion/%) |
P |
| AGK rs12703386 | Total(895) | T/T(17.5) | T/C(50.1) | C/C(32.4) | 0.478 |
| CN(670) | T/T(18.1) | T/C(48.3) | C/C(33.6) | 0.817 | |
| CI(225) | T/T(16.0) | T/C(55.1) | C/C(28.9) | 0.070 | |
| AGK rs4725559 | Total(895) | G/G(18.2) | G/A(48.6) | A/A(33.2) | 0.866 |
| CN(670) | G/G(18.1) | G/A(47.8) | A/A(34.2) | 0.617 | |
| CI(225) | G/G(18.7) | G/A(51.1) | A/A(30.2) | 0.589 | |
| AGK rs12539011 | Total(895) | T/T(32.5) | T/C(50.3) | C/C(17.2) | 0.374 |
| CN(670) | T/T(33.7) | T/C(48.8) | C/C(17.5) | 0.945 | |
| CI(225) | T/T(28.9) | T/C(54.7) | C/C(16.4) | 0.097 | |
| DENND11 rs76303304 | Total(895) | G/G(75.3) | G/A(22.8) | A/A(1.9) | 0.733 |
| CN(670) | G/G(75.8) | G/A(22.2) | A/A(1.9) | 0.593 | |
| CI(225) | G/G(73.8) | G/A(24.4) | A/A(1.8) | 0.820 | |
| DENND11 rs2269984 | Total(895) | A/A(26.1) | A/T(48.2) | T/T(25.7) | 0.270 |
| CN(670) | A/A(25.5) | A/T(47.8) | T/T(26.7) | 0.248 | |
| CI(225) | A/A(28.0) | A/T(49.3) | T/T(22.7) | 0.875 | |
| DENND11 rs4726463 | Total(895) | A/A(21.2) | A/G(49.6) | G/G(29.2) | 0.963 |
| CN(670) | A/A(20.9) | A/G(48.8) | G/G(30.3) | 0.695 | |
| CI(225) | A/A(22.2) | A/G(52.0) | G/G(25.8) | 0.535 | |
| DENND11 rs35963232 | Total(895) | A/A(34.8) | A/T(36.3) | T/T(28.9) | <0.001 |
| CN(670) | A/A(35.5) | A/T(36.0) | T/T(28.5) | <0.001 | |
| CI(225) | A/A(32.4) | A/T(37.3) | T/T(30.2) | <0.001 | |
| CLEC5A rs1285933 | Total(895) | G/G(59.3) | G/A(34.1) | A/A(6.6) | 0.095 |
| CN(670) | G/G(60.0) | G/A(33.3) | A/A(6.7) | 0.068 | |
| CI(225) | G/G(57.3) | G/A(36.4) | A/A(6.2) | 0.841 | |
| CLEC5A rs1285935 | Total(895) | T/T(7.6) | T/C(35.6) | C/C(56.8) | 0.073 |
| CN(670) | T/T(7.6) | T/C(34.9) | C/C(57.5) | 0.068 | |
| CI(225) | T/T(7.6) | T/C(37.8) | C/C(54.7) | 0.664 | |
| CLEC5A rs12539499 | Total(895) | T/T(28.2) | T/C(49.1) | C/C(22.8) | 0.629 |
| CN(670) | T/T(28.8) | T/C(47.6) | C/C(23.6) | 0.242 | |
| CI(225) | T/T(26.2) | T/C(53.3) | C/C(20.4) | 0.292 | |
| CLEC5A rs1285950 | Total(895) | C/C(26.7) | C/A(48.6) | A/A(24.7) | 0.410 |
| CN(670) | C/C(28.4) | C/A(46.7) | A/A(24.9) | 0.095 | |
| CI(225) | C/C(21.8) | C/A(54.2) | A/A(24.0) | 0.202 | |
| TAS2R38 rs10246939 | Total(891) | T/T(9.4) | T/C(38.5) | C/C(52.1) | 0.079 |
| CN(666) | T/T(9.8) | T/C(38.0) | C/C(52.3) | 0.060 | |
| CI(225) | T/T(8.4) | T/C(40.0) | C/C(51.6) | 0.794 |
2.3 味觉相关SNP位点与味觉功能的相关性
相关性分析显示,多个SNP位点在不同遗传模型下与味觉功能之间存在显著关联。AGK rs12703386位点主要与苦味感知功能相关,等位基因遗传模型中携带突变等位基因C、隐性遗传模型中纯合突变基因型C/C和超显性遗传模型中杂合突变型T/C的个体苦味评分均显著降低(P<0.05),提示该位点在参与味觉功能调控中可能存在杂合子优势,且是苦味感知功能下降的风险性因素。在AGK rs4725559位点中,等位基因遗传模型中携带突变等位基因A、隐性遗传模型中纯合突变型A/A、共显性遗传模型中纯合突变型A/A以及超显性遗传模型中基因型G/A的个体苦味评分均显著降低(P<0.05),表明AGK rs4725559位点可能是味觉功能下降的影响因素, 且在苦味感知功能调控中存在一定的杂合子优势。对于AGK rs12539011位点,显性遗传模型中携带突变等位基因C和超显性遗传模型中T/C基因型个体的苦味评分均显著降低(P<0.05),共显性遗传模型中杂合突变型T/C个体相较于纯合野生型T/T个体苦味感知评分也显著降低(P<0.05),提示该位点可能存在杂合子优势效应并且是苦味感知功能下降的风险因素。在DENND11 rs2269984位点中,隐性遗传模型中纯合突变型T/T、超显性遗传模型中杂合突变型A/T个体的苦味评分均显著降低(P<0.05),提示该位点的突变可能是苦味感知功能下降的风险性因素。此外,CLEC5A rs1285950位点与多种味觉感知表型相关:在隐性遗传模型中,A/A基因型个体的酸味感知评分显著降低(P<0.05);共显性遗传模型中,相较于纯合野生型C/C个体,C/A基因型个体在咸味感知中评分显著下降(P<0.05);超显性遗传模型中,C/A基因型个体在咸味(P=0.028)、酸味(P=0.028)、苦味(P=0.041)及整体味觉(P=0.023)中的评分均显著降低,这些结果表明CLEC5A rs1285950位点的突变是整体味觉功能下降的风险性因素,尤其是杂合突变型C/A可能以杂合子优势效应广泛参与老年人的味觉感知调控(表 4)。
| 单核苷酸多态性位点 SNP |
味觉类型 Taste modality |
遗传模型 Genetic model |
n1 | 遗传模型组1 Genetic model group 1 |
组1味觉评分 Taste score of group 1 |
n2 | 遗传模型组2 Genetic modelgroup 2 |
组2味觉评分 Taste score of group 2 |
P | Cohen′s d |
| AGK rs12703386 | Bitter | Allelic | 762 | T | 2.598±0.768 | 1 028 | C | 0.768±2.669 | 0.044 | 0.878 |
| AGK rs12703386 | Bitter | Recessive | 605 | T/T+T/C | 2.582±0.769 | 290 | C/C | 0.769±2.759 | 0.002 | 1.071 |
| AGK rs12703386 | Bitter | Overdominant | 448 | T/T+C/C | 2.554±0.770 | 447 | T/C | 0.77±2.725 | 0.002 | 0.891 |
| AGK rs4725559 | Bitter | Allelic | 761 | G | 2.590±0.775 | 1 029 | A | 0.775±2.675 | 0.015 | 0.868 |
| AGK rs4725559 | Bitter | Codominant | 163 | G/G | 2.607±0.781 | 297 | A/A | 0.781±2.747 | 0.046 | 0.809 |
| AGK rs4725559 | Bitter | Recessive | 598 | G/G+G/A | 2.585±0.773 | 297 | A/A | 0.773±2.747 | 0.004 | 1.064 |
| AGK rs4725559 | Bitter | Overdominant | 435 | G/G+A/A | 2.577±0.771 | 460 | G/A | 0.771±2.698 | 0.040 | 0.900 |
| AGK rs12539011 | Bitter | Dominant | 604 | T/T | 2.593±0.764 | 291 | T/C+C/C | 0.764±2.735 | 0.012 | 1.089 |
| AGK rs12539011 | Bitter | Codominant | 450 | T/T | 2.578±0.758 | 291 | T/C | 0.758±2.735 | 0.011 | 1.004 |
| AGK rs12539011 | Bitter | Overdominant | 450 | T/T+C/C | 2.578±0.758 | 445 | T/C | 0.758±2.701 | 0.034 | 0.920 |
| DENND11 rs2269984 | Bitter | Recessive | 665 | A/A+A/T | 2.603±0.785 | 230 | T/T | 0.785±2.743 | 0.021 | 1.177 |
| DENND11 rs2269984 | Bitter | Overdominant | 431 | A/A+T/T | 2.578±0.773 | 464 | A/T | 0.773±2.696 | 0.045 | 0.896 |
| CLEC5A rs1285950 | Salt | Codominant | 435 | C/C | 2.811±0.760 | 239 | C/A | 0.760±2.933 | 0.045 | 1.109 |
| CLEC5A rs1285950 | Sour | Recessive | 674 | C/C+C/A | 3.531±0.777 | 221 | A/A | 0.777±3.656 | 0.044 | 1.423 |
| CLEC5A rs1285950 | Salt | Overdominant | 435 | C/C+A/A | 2.811±0.760 | 460 | C/A | 0.760±2.924 | 0.028 | 0.949 |
| CLEC5A rs1285950 | Sour | Overdominant | 435 | C/C+A/A | 3.503±0.787 | 460 | C/A | 0.787±3.617 | 0.028 | 1.025 |
| CLEC5A rs1285950 | Bitter | Overdominant | 435 | C/C+A/A | 2.575±0.783 | 460 | C/A | 0.783±2.700 | 0.041 | 0.891 |
| CLEC5A rs1285950 | Total taste | Overdominant | 435 | C/C+A/A | 11.947±2.781 | 460 | C/A | 2.781±12.361 | 0.023 | 1.010 |
| Note: n1 and n2 denote the sample sizes of genetic model group 1 and genetic model group 2, respectively.To enhance the interpretability of statistical results, effect sizes (Cohen′s d) have been provided for comparisons with P values close to 0.05. | ||||||||||
2.4 味觉相关SNP位点在认知分组的分布
由前述分析可知,多个味觉相关SNP位点与味觉功能显著相关,尤其是部分位点在超显性遗传模型下表现出潜在的杂合子优势效应。然而,进一步分析这些SNP位点在不同认知分组的分布时发现,大多数SNP位点组间分布差异并不显著,提示其可能更多地参与味觉功能调控,而非直接关联认知状态。特别的是,CLEC5A rs1285950位点的基因型在组间显示出显著的分布差异,具体而言,在共显性遗传模型中,杂合突变型C/A在CN组中的比例显著低于CI组(P<0.05),提示该基因型可能是认知损害的危险因素(图 1)。

|
| The y-axis indicates relative genotypic or allelic frequency of each group.A red asterisk (*) indicates a statistically significant difference (P < 0.05) in distribution between the CN and CI groups under the corresponding genetic model. 图 1 CLEC5A rs1285950在认知分组中的分布情况 Fig.1 Distribution of CLEC5A rs1285950 in cognitive groups |
2.5 味觉相关SNP位点对认知功能的影响
在多元逻辑回归模型中,纳入性别、年龄、ADL评分、BMI、血脂、Hcy、IgG等混杂因素作为协变量进行调整,只有TAS2R38 rs10246939在显性遗传模型中,携带突变等位基因C的T/C或C/C基因型个体的认知损害风险显著高于T/T型(OR>1,P<0.05),提示该位点的突变等位基因C可能是认知功能下降的风险因素。相较之下,TAS2R38 rs10246939在等位基因遗传模型、隐性遗传模型、超显性遗传模型及共显性遗传模型中OR置信区间均跨越1,未观察到统计学显著差异,这一结果提示TAS2R38 rs10246939可能主要通过显性遗传模式造成认知损害(图 2)。
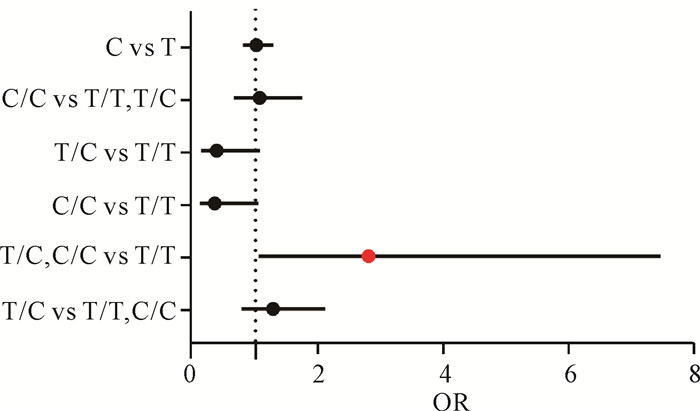
|
| For each genetic model, the reference group was set as the posterior genotype.The vertical dashed line at OR=1 indicates the null value.Each dot corresponds to the OR estimate of a genotype, with its horizontal position indicating the OR value and the horizontal line indicating the 95% confidence interval (CI group).Red dots denote statistically significant associations (P < 0.05). 图 2 TAS2R38 rs10246939在不同遗传模型下与认知功能损害的关联 Fig.2 Association between TAS2R38 rs10246939 and cognitive function impairment under different genetic models |
2.6 SNP-SNP及SNP-环境交互作用对认知功能的影响
在交互作用分析中,调整在一般临床资料单因素分析中具有统计学显著差异的混杂因素(不包括味觉功能和性别),以控制潜在混杂效应。最优的SNP-SNP交互模型为四维交互模型,即rs12539011-rs2269984-rs1285935-rs12539499四基因座模型。该模型在测试集中的预测准确率为0.606 3,表明其对老年人群认知功能具有较强的预测能力。交叉验证一致性为9/10,显示模型具有良好的稳健性。此外,模型的统计学显著性检验结果为P<0.001,进一步支持了其有效性。在SNP-环境交互分析中,最优模型为四维交互模型rs1270336-rs10246939-Taste-Gen-der。该模型在测试集中的预测准确率为0.686 7,交叉验证一致性达到10/10,且统计学显著性检验结果为P<0.001,表明该模型在预测认知功能方面具有高度的可靠性和显著性(表 5)。从最优SNP-SNP交互模型的高风险和低风险基因型组合分布图可知,不同的SNP位点基因型组合对认知功能的作用存在显著差异,提示可能存在基因间的调节作用[图 3(a)]。MDR聚类分析结果显示,4个SNP位点之间对认知功能的影响存在强协同效应,特别是AGK rs12539011与CLEC5A rs12539499之间的交互作用更为显著[图 3(b)]。在最优SNP-环境交互模型中,由高风险和低风险基因型组合的分布图可知,以味觉评分10分为分界,当味觉评分不低于10分时,rs12703386和rs10246939的基因型组合(除男性中rs12703386 T/C-rs10246939 T/C基因型组合和rs12703386 T/C-rs10246939 C/C基因型组合外)对认知功能具有保护作用;然而,当味觉评分小于10分时,所有基因型组合全部转变为风险因素。此外,味觉评分不低于10分时,部分组合(rs12703386 T/C-rs10246939 T/C基因型组合和rs12703386 T/C-rs10246939 C/C基因型组合)在男性和女性中表现出相反的作用,图中方格由男性中的深灰色转变为女性中的浅灰色,提示这些基因型组合对味觉功能的影响由风险性变为保护性。上述结果共同说明味觉和性别在此过程中呈现出上位调控的作用[图 3(a)]。MDR聚类结果还显示,味觉与性别之间存在强烈的冗余效应[图 3(b)]。
| 交互模型 Interaction model |
组合 Combination |
训练集准确率 Training sets accuracy |
测试集准确率 Testing sets accuracy |
交叉验证一致性 CV consistency |
P |
| SNP-SNP | rs1285950 | 0.537 2 | 0.524 1 | 10/10 | 0.170 |
| rs12539011-rs12539499 | 0.571 7 | 0.531 4 | 5/10 | 0.170 | |
| rs12539011-rs1285935-rs12539499 | 0.598 1 | 0.586 6 | 9/10 | <0.001 | |
| rs12539011-rs2269984-rs1285935-rs12539499 | 0.620 5 | 0.606 3 | 9/10 | <0.001 | |
| SNP-Environment | Taste | 0.657 8 | 0.657 4 | 10/10 | <0.001 |
| rs12703386-Taste | 0.657 8 | 0.657 4 | 5/10 | <0.001 | |
| rs12703386-Taste-Gender | 0.681 8 | 0.681 6 | 10/10 | <0.001 | |
| rs1270336-rs10246939-Taste-Gender | 0.687 3 | 0.686 7 | 10/10 | <0.001 |
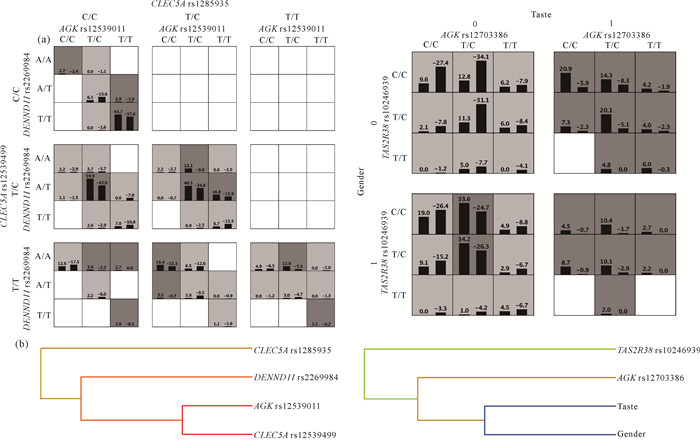
|
| (a)Interaction effect matrices for SNP-SNP (left) and SNP-environment (right) combinations.(b)Hierarchical dendrograms illustrating SNP-SNP (left) and SNP-environment (right) interactions.In the gender variable, male is coded as 1 and female is coded as 0 respectively.In the taste variable which uses 10 points as the cutoff, 1 represents a score of less than 10 and 0 represents a score of 10 or more. 图 3 SNP-SNP与SNP-环境交互作用对认知功能的影响 Fig.3 Impact of SNP-SNP and SNP-environment interactions on cognitive function |
3 讨论
本研究基于广西红水河流域老年人群,系统评估了味觉相关SNP位点与认知功能的关系,揭示了遗传变异、味觉感知与认知损害之间的潜在关联机制。结果显示,CI组在甜、咸、酸、苦味及总体味觉评分上均显著低于CN组,表明味觉功能下降可能是认知衰退的一个早期表型,与既往感觉退化先于认知退化的研究结论一致[21]。TAS2R38 rs10246939为苦味受体基因,与苦味感知功能显著相关[22-23],多元逻辑回归显示,在调整性别、年龄、空腹血糖、BMI、血脂及肾功能等混杂因素后,TAS2R38 rs10246939突变等位基因C在显性遗传模型下为老年人的认知损害风险因素。从TAS2R38基因单倍型角度来看,TAS2R38 rs10246939位点等位基因T构成丙氨酸-缬氨酸-异亮氨酸(Alanine-Valine-Isoleucine,AVI)单倍型,该单倍型对应着较低的苦味敏感性,而与脯氨酸-丙氨酸-缬氨酸(Proline-Alanine-Valine,PAV)单倍型相关的等位基因C携带个体则对苦味更为敏感[24],携带AVI单倍型的个体可能由于苦味敏感性降低而更容易接受富含苦味的健康食物,如火麻仁食品,这可能有助于改善其长期的营养状况和代谢状态,进而通过这种饮食方式对认知功能起保护作用。在AVI单倍型频率相对较高的东亚人群中[25],TAS2R38 rs10246939位点多态性与认知保护之间的关联可能更为紧密,具有重要的现实意义。值得注意的是,TAS2R38不仅可以在舌头上表达,而且其编码的受体蛋白也存在于肠道和呼吸道等组织,引发炎症及参与代谢过程,其基因多态性可能通过多靶点机制影响机体稳态与脑健康[26-27]。
此外,CLEC5A rs1285950位点突变与酸味(隐性遗传模型)、咸味(共显性遗传模型)以及咸味、酸味、苦味及整体味觉评分(超显性遗传模型)降低显著关联,其中杂合突变型C/A在多个味觉维度中表现出稳定的调控效应,提示该位点可能通过杂合子优势广泛参与味觉感知调控。同时,该位点杂合突变型的分布在CN组中的比例显著低于CI组,提示其可能是认知功能下降的遗传风险因素。CLEC5A编码的C型凝集素样受体在中枢免疫细胞中表达,参与炎症信号通路调控[28],因此推测CLEC5A rs1285950杂合突变型可能增强CLEC5A受体功能,激发过度免疫反应,从而加剧神经炎症,损害认知功能。CLEC5A不仅调控感觉感知,而且其与免疫反应的关联提示其可能通过味觉-免疫相关路径间接影响认知功能。
SNP-SNP及SNP-环境交互分析进一步加深了我们对认知功能影响机制的理解。基于GMDR分析筛选出的最优四基因座模型,在测试集中的预测准确率达0.606 3,显著优于单一SNP位点模型,显示SNP间可能存在非线性叠加效应。某些基因型组合如rs1285935 C/C-rs12539011 T/C-rs12539499 T/C-rs2269984 A/T是老年人群认知损害的风险因素,而另一些组合如rs1285935 C/C-rs12539011 T/T-rs12539499 T/C-rs2269984 T/T则可能对认知功能具有保护作用,体现出复杂遗传背景下的协同与拮抗关系。此外,最优SNP-环境交互模型提升了对认知状态的预测准确率,认为特定基因型组合在味觉功能正常者中可能发挥保护作用,而在味觉减退者中则转变为高风险因素。同样地,基因型组合在不同性别中亦表现出不同的效应,提示性激素水平可能影响基因的表达与表型转化[29]。上述结果表明,遗传因素对认知功能的影响并非固定不变,而是受到个体味觉功能与性别背景的动态调节。
值得注意的是,尽管教育年限被广泛认为是认知功能的重要影响因素之一,但本研究在多元逻辑回归模型中并未将其纳入。主要原因在于:一是本研究收集的教育信息为分类变量(文盲/小学/中学),缺乏精确的连续性年限数据,难以满足将其作为定量变量进行调整的建模需求;二是教育水平作为认知障碍判断的重要依据,已在MMSE量表的解释中设定了基于教育程度的不同判定截点,因此其影响在认知状态的初步定义中已被考虑,若在回归分析中再次引入该变量,可能造成混杂解释或模型共线性,从而掩盖其他潜在影响因素的真实作用。因此,为避免模型解释偏倚,本研究在建模过程中未将教育年限作为自变量纳入,但充分认可其在认知研究中的价值,并在研究设计与判定标准中加以体现。
综上,本研究为阐明老年人群认知损害的遗传机制提供了新思路,也为将味觉功能评估纳入老年人群认知损害风险预测模型提供了依据。未来的研究可进一步探讨改善味觉功能是否有助于降低高危基因携带者的认知衰退风险,助力精准预防策略的实施。
4 结论本研究系统分析了广西红水河流域老年人群的味觉基因多态性与认知功能的关系,发现免疫相关基因CLEC5A rs1285950的C/A基因型、苦味受体基因TAS2R38 rs10246939的突变等位基因C是认知损害的风险因素,遗传因素对认知功能的影响是多位点协同作用的结果,并受到味觉功能和性别等环境因素的调节。本研究揭示了老年人群味觉功能基因与认知损害的关联及其潜在机制,提示应将遗传背景、味觉功能纳入老年人群认知损害风险评估体系。研究结果对早期筛查认知损害高危个体具有潜在应用价值,今后可据此开展更大规模的前瞻性研究以验证本研究结果,并探索干预措施来降低认知损害的发生风险。
| [1] |
LIU C C, ZHAO J, FU Y, et al. Peripheral apoE4 enhances Alzheimer's pathology and impairs cognition by compromising cerebrovascular function[J]. Nature Neuroscience, 2022, 25(8): 1020-1033. DOI:10.1038/s41593-022-01127-0 |
| [2] |
LIN Y Y, CHANG W H, HSIEH S L, et al. The deficient CLEC5A ameliorates the behavioral and pathological deficits via the microglial Aβ clearance in Alzheimer's disease mouse model[J]. Journal of Neuroinflammation, 2024, 21(1): 273. DOI:10.1186/s12974-024-03253-x |
| [3] |
LEE E, GIOVANELLO K S, SAYKIN A J, et al. Single-nucleotide polymorphisms are associated with cognitive decline at Alzheimer's disease conversion within mild cognitive impairment patients[J]. Alzheimer's & Dementia: Diagnosis, Assessment & Disease Monitoring, 2017, 8: 86-95. |
| [4] |
DOMINGUEZ L J, VERONESE N, VERNUCCIO L, et al. Nutrition, physical activity, and other lifestyle factors in the prevention of cognitive decline and dementia[J]. Nutrients, 2021, 13(11): 4080. DOI:10.3390/nu13114080 |
| [5] |
DALILE B, KIM C, CHALLINOR A, et al. The EAT-Lancet reference diet and cognitive function across the life course[J]. The Lancet Planetary Health, 2022, 6(9): e749-e759. DOI:10.1016/S2542-5196(22)00123-1 |
| [6] |
MCLAREN A M R, KAWAJA M D. Olfactory dysfunction and Alzheimer's disease: a review[J]. Journal of Alzheimer's Disease, 2024, 99(3): 811-827. DOI:10.3233/JAD-231377 |
| [7] |
JACOBSON P T, VILARELLO B J, TERVO J P, et al. Associations between olfactory dysfunction and cognition: a scoping review[J]. Journal of Neurology, 2024, 271(3): 1170-1203. DOI:10.1007/s00415-023-12057-7 |
| [8] |
MARIN C, VILAS D, LANGDON C, et al. Olfactory dysfunction in neurodegenerative diseases[J]. Current Allergy and Asthma Reports, 2018, 18(8): 42. DOI:10.1007/s11882-018-0796-4 |
| [9] |
MANTOVANI E, ZANINI A, CECCHINI M P, et al. The association between neurocognitive disorders and gustatory dysfunction: a systematic review and meta-analysis[J]. Neuropsychology Review, 2024, 34(1): 192-213. DOI:10.1007/s11065-023-09578-3 |
| [10] |
EL KADIRI W, PERRIGNON-SOMMET M, DEL-PONT B, et al. Changes in taste perception in patients with minor and major cognitive impairment linked to Alzheimer's disease recorded by gustatory evoked potentials[J]. Journal of Alzheimer's Disease, 2023, 96(4): 1593-1607. DOI:10.3233/JAD-230270 |
| [11] |
MATTOS J L, HASAN S, SCHLOSSER R J, et al. The association of gustatory dysfunction, olfactory dysfunction, and cognition in older adults[J]. International Forum of Allergy & Rhinology, 2023, 13(9): 1577-1583. |
| [12] |
GENICK U K, KUTALIK Z, LEDDA M, et al. Sensitivity of genome-wide-association signals to phenotyping strategy: the PROP-TAS2R38 taste association as a benchmark[J]. PLoS One, 2011, 6(11): e27745. DOI:10.1371/journal.pone.0027745 |
| [13] |
YU Q, GAMAYUN I, WARTENBERG P, et al. Bitter taste cells in the ventricular walls of the murine brain regulate glucose homeostasis[J]. Nature Communications, 2023, 14(1): 1588. DOI:10.1038/s41467-023-37099-3 |
| [14] |
黎海燕. 广西巴马地区壮族长寿群体认知状况调查及认知相关基因多态性的相关性研究[D]. 南宁: 广西医科大学, 2016.
|
| [15] |
朱丽娜. 火麻仁提取液对D-gal致衰老大鼠嗅觉辨识记忆障碍的影响[D]. 南宁: 广西医科大学, 2019.
|
| [16] |
TARRAGON E, MORENO J J. Role of endocannabinoids on sweet taste perception, food preference, and obesity-related disorders[J]. Chemical Senses, 2017, 43(1): 3-16. |
| [17] |
ALIANI M, UDENIGWE C C, GIRGIH A T, et al. Zinc deficiency and taste perception in the elderly[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(3): 245-250. DOI:10.1080/10408398.2010.527023 |
| [18] |
陈海根. 老年高血压患者睡眠质量与认知功能的相关性及其认知功能的影响因素分析[D]. 沈阳: 沈阳医学院, 2023.
|
| [19] |
陈玉琴, 石磊, 钱海馨. 中国年轻人味觉敏感性的初步研究[J]. 口腔医学, 2012, 32(3): 137-139. |
| [20] |
HUANG L, PENG J H, LIANG Q H, et al. Insulin-like factor-2 receptor rs9456497 G genotype overrepresents in males of average population and its correlation with cardiovascular risks[J]. Archives of Gerontology and Geriatrics, 2018, 76: 202-209. DOI:10.1016/j.archger.2018.03.004 |
| [21] |
SANNA F, CASTELLI M P, MOSTALLINO R, et al. Correlations between gustatory, olfactory, cognitive function, and age in healthy women[J]. Nutrients, 2024, 16(11): 1731. DOI:10.3390/nu16111731 |
| [22] |
GRAHAM C A, PILIC L, MCGRIGOR E, et al. The associations between bitter and fat taste sensitivity, and dietary fat intake: are they impacted by genetic predisposition?[J]. Chemical Senses, 2021, 46: bjab029. DOI:10.1093/chemse/bjab029 |
| [23] |
COLARES-BENTO F C J, SOUZA V C, TOLEDO J O, et al. Implication of the G145C polymorphism (rs713598) of the TAS2r38 gene on food consumption by Brazilian older women[J]. Archives of Gerontology and Geriatrics, 2012, 54(2): e13-18. DOI:10.1016/j.archger.2011.05.019 |
| [24] |
BOXER E E, GARNEAU N L. Rare haplotypes of the gene TAS2R38 confer bitter taste sensitivity in humans[J]. SpringerPlus, 2015, 4: 505. DOI:10.1186/s40064-015-1277-z |
| [25] |
WANG X J, WANG L, XIA M W, et al. Variations in the TAS2R38 gene among college students in Hubei[J]. Hereditas, 2022, 159(1): 46. DOI:10.1186/s41065-022-00260-x |
| [26] |
MUTH A K, PARK S Q. The impact of dietary macronutrient intake on cognitive function and the brain[J]. Clinical Nutrition, 2021, 40(6): 3999-4010. DOI:10.1016/j.clnu.2021.04.043 |
| [27] |
COSTA M M, DA SILVA A P, SANTOS C, et al. Influence of the TAS2R38 gene single nucleotide polymorphisms in metabolism and anthropometry in thyroid dysfunction[J]. Nutrients, 2023, 15(9): 2214. DOI:10.3390/nu15092214 |
| [28] |
SPROKHOLT J, HELGERS L C, GEIJTENBEEK T B. Innate immune receptors drive dengue virus immune activation and disease[J]. Future Virology, 2018, 13(4): 287-305. DOI:10.2217/fvl-2017-0146 |
| [29] |
PAN Q, HU T, MOORE J H. Epistasis, complexity, and multifactor dimensionality reduction[J]. Methods in Molecular Biology, 2013, 1019: 465-477. |



