2. 广西科学院,广西海洋科学院(广西红树林研究中心),广西近海海洋与环境科学重点实验室,广西南宁 530006;
3. 北部湾海洋产业研究院,广西防城港 538000
2. Guangxi Key Laboratory of Marine and Coastal Environmental Sciences, Guangxi Academy of Marine Sciences (Guangxi Mangrove Research Center), Guangxi Academy of Sciences, Nanning, Guangxi 530006, China;
3. Beibu Gulf Marine Research Institute, Fangchenggang, Guangxi, 538000, China
链状裸甲藻(Gymnodinium catenatum)是可以产生麻痹性贝类毒素(PSP)的裸甲藻(Gymnodinium)之一,是近些年来全球发生频繁的有害赤潮种类之一[1]。PSP能在软体动物中富集,不仅会给水产养殖业带来巨大经济损失,而且还会对人类健康和海洋生态造成极大危害。当链状裸甲藻细胞被贝类(如牡蛎、贻贝、扇贝)食用后,PSP会在贝类体内积累,人类误食易引起中毒,严重时会导致肌肉麻痹、呼吸困难甚至死亡。曾在墨西哥3次暴发的链状裸甲藻赤潮共造成460人中毒,32人死亡[2];新西兰也曾发生因PSP而导致的中毒事件[2];在中国,链状裸甲藻营养细胞及孢囊分布广泛且多次引发赤潮,已成为危害我国近海生态安全的常见赤潮藻[1]。
目前赤潮防治方法主要有物理法、化学法和生物法等。其中,生物法防治具有安全可靠、经济实用等优势[3]。生物法防治主要利用自然界中共生植物之间的资源竞争来进行赤潮防治,其中干扰竞争是资源竞争的重要方式之一[3]。对于植物来说,干扰竞争的主要机制是化感作用[3]。植物通过化感作用将细胞中的代谢产物释放到环境之中,以此增加自身在资源竞争中的优势。海洋微藻间的化感作用既可以通过释放化感物质来实现,也可通过细胞间的直接接触来实现[4],化感作用的方式不同,其抑藻机理也不同。在2011年的加利福尼亚赤潮研究中,Fernández-herrera等[2]发现链状裸甲藻与隶属于针胞藻纲(Raphidophyceae)的海洋卡盾藻(Chattonella marina)能够共存于巴哈拉斯水域中,二者都能向环境中释放毒素。同时,针胞藻对链状裸甲藻往往具有支配作用[2],也一定程度说明海洋卡盾藻与链状裸甲藻之间存在着明显的化感作用。但海洋卡盾藻与链状裸甲藻间的化感作用机理尚不明确,确定海洋卡盾藻对链状裸甲藻化感作用的机制和化感物质的种类,对分析海洋卡盾藻对链状裸甲藻的抑藻机理具有十分重要的意义。
藻类的化感物质主要是次级代谢产物中的脂类、氨基酸、多糖以及蛋白。Dorantes-aranda等[5]通过分离海洋卡盾藻的次级代谢产物得到4种主要成分,分别为十四烷酸、棕榈酸、棕榈油酸和十八碳四烯酸。李嘉雯[6]研究表明,棕榈油酸具有良好的抑藻活性, 甚至可以杀死藻细胞,且其具有经济实惠、获取简单等特点。故本研究探究以棕榈油酸为主的海洋卡盾化感物质对链状裸甲藻的化感作用机制,拟为海洋卡盾藻对链状裸甲藻的抑藻机制研究提供新解释,以期为进一步开发棕榈油酸抑藻剂提供理论支持。
1 材料与方法 1.1 材料本实验所用链状裸甲藻和海洋卡盾藻均由广西海洋科学院提供,并保存于广西海洋科学院微藻种质资源库中,采用盐度为30的F/2培养基20 ℃培养,并取处于对数生长期的链状裸甲藻藻液进行实验。
1.2 仪器设备全波长多功能酶标仪(Thermo Scientific Multiskan GO,美国赛默飞世尔科技公司),倒置荧光显微镜[Nikon TS-100,尼康仪器(上海)有限公司],紫外分光光度计(T6,北京普析通用仪器有限公司),高速冷冻离心机(Sigma 3-18K,德国Sigma公司),超声波细胞破碎仪(Scientz-Ⅱ D,宁波新芝生物科技股份有限公司)。
1.3 方法 1.3.1 海洋卡盾藻中不同组分对链状裸甲藻生长的影响取处于对数生长期末期(第20天)且生长良好的链状裸甲藻和海洋卡盾藻各1瓶并计算细胞密度(链状裸甲藻细胞密度为60 cells/mL,海洋卡盾藻细胞密度为240 cells/mL)。每实验组先各取50 mL 60 cells/mL的链状裸甲藻藻液于250 mL的灭菌三角瓶中。第1组:另加入50 mL的F/2培养基,作空白对照组;第2组:另加入50 mL 240 cells/mL的海洋卡盾藻完整细胞培养液;第3组:另加入50 mL的无细胞滤液,滤液为用0.22 μm滤膜过滤海洋卡盾藻培养液并去除细胞所得;第4组:另加入50 mL的海洋卡盾藻破碎细胞液(破碎条件:在冰浴环境中,破碎功率250 W、工作3 s间歇2 s,持续破碎30 min)。每实验组均设置3个平行,培养温度为(20±1) ℃,光照强度约2 500 lx,光暗比为12 h∶12 h,每隔1天取样并进行细胞计数(取1.0 mL摇匀后的藻液培养液于1.5 mL的离心管中,加入20 μL鲁哥氏碘液进行固定,用移液枪轻轻吹打混匀,取一定量样品铺满100 μL浮游植物计数框并进行藻细胞计数)。实验开始当天记为第0天。
1.3.2 海洋卡盾藻次级代谢产物对链状裸甲藻生长的影响棕榈油酸组:先各取50 mL 400 cells/mL的链状裸甲藻藻液于100 mL容量瓶中。第1组:不添加棕榈油酸,作空白对照组;第2组:另加入2 mg的棕榈油酸;第3组:另加入4 mg的棕榈油酸;第4组:另加入8 mg的棕榈油酸;第5组:另加入16 mg的棕榈油酸。依次添加有适量F/2培养基的灭菌海水并定容至100 mL(即5个实验组中的棕榈油酸浓度依次为0、20、40、80、160 μg/mL),再转移到250 mL的灭菌三角瓶中培养。每实验组均设置3个平行,培养温度为(20±1) ℃,光照强度约2 500 lx,光暗比为12 h∶12 h,每隔1天取样并进行细胞计数,实验开始当天记为第0天。棕榈酸组、十四烷酸组和十八碳四烯酸组的测定方法皆同上述方法。
1.3.3 超氧阴离子自由基(O2-·)产生速率等指标的测定筛选1.3.2节中生长抑制作用最强的化感物质作为主要研究对象,加入处于对数生长期(第20天)的链状裸甲藻藻液中,分别设置化感物质浓度为0、20、40、80、160 μg/mL的实验组培养,取10 mL处理48 h后的藻液离心(4 ℃、4 000 r/min、10 min)收集藻细胞。用0.1 mol/L、pH值为7.4的磷酸盐(PBS)缓冲液洗涤并重悬细胞,超声波破碎后(破碎条件:在冰浴环境中,破碎功率250 W、工作3 s间歇2 s,持续破碎30 min)用离心管收集上清液。
取少许上清液,分别利用超氧阴离子自由基(O2-·)试剂盒(比色法,南京建成生物工程研究所有限公司)进行O2-·产出速率测定;利用超氧化物歧化酶(SOD)试剂盒(WST-1法,南京建成生物工程研究所有限公司)进行酶含量测定;利用过氧化氢酶(CAT)试剂盒(可见光法,南京建成生物工程研究所有限公司)进行酶含量测定;利用丙二醛(MDA)试剂盒(微板法,南京建成生物工程研究所有限公司)进行MDA含量测定;利用Caspase-3试剂盒(比色法,北京索莱宝科技有限公司)进行Caspase-3含量测定。具体测定方法参照相关试剂盒使用说明书进行操作。
1.4 数据处理采用Origin 8软件绘制数据图。显著性分析使用SPSS 13.0软件完成,对实验数据进行单因素方差分析(One-way ANOVA)和最小显著差异(LSD)检验分析,显著水平设置为0.05,极显著水平设置为0.01。
2 结果与分析 2.1 海洋卡盾藻中不同组分对链状裸甲藻生长的影响海洋卡盾藻中不同组分对链状裸甲藻的生长影响存在差异(图 1)。相较于F/2培养基培养的链状裸甲藻(空白对照组),其他组的链状裸甲藻前期(前6天)生长均受到较为明显抑制(P < 0.05),整体上抑制强度为完整细胞培养液>无细胞滤液>破碎细胞液。在生长后期,添加有海洋卡盾藻无细胞滤液、破碎细胞液组的链状裸甲藻生长受抑制程度明显减弱,仅添加有海洋卡盾藻完整细胞培养液组的链状裸甲藻仍受显著抑制。可知,海洋卡盾藻对链状裸甲藻的化感抑制作用来自海洋卡盾藻完整细胞的次级代谢产物。
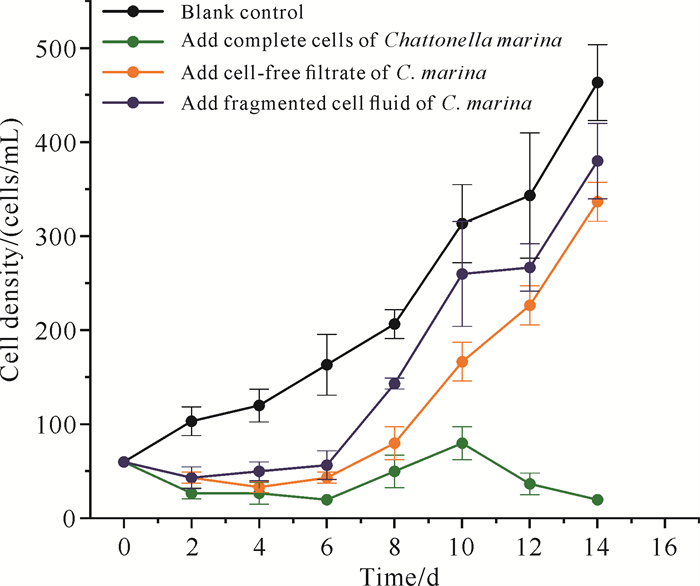
|
| 图 1 海洋卡盾藻中不同组分对链状裸甲藻生长的影响 Fig.1 Effect of different components in Chattonella marina on growth of Gymnodinium catenatum |
2.2 海洋卡盾藻次级代谢产物对链状裸甲藻生长的影响
为进一步确定海洋卡盾藻影响链状裸甲藻生长的主要组分,将其次级代谢产物中的主要成分(棕榈油酸、棕榈酸、十四烷酸、十八碳四烯酸)与链状裸甲藻共培养,以探究不同浓度下海洋卡盾藻次级代谢产物对链状裸甲藻生长的影响。如图 2(a)所示,当添加的棕榈油酸浓度为20 μg/mL时,链状裸甲藻细胞的生长受到一定的促进作用(P<0.05);浓度上升至40 μg/mL时,链状裸甲藻细胞生长虽然受到抑制(P<0.05),但是仍能正常生长; 而当浓度达到80 μg/mL以上时,链状裸甲藻细胞密度开始下降,表明链状裸甲藻细胞的生长受到了明显的抑制(P<0.05)。棕榈油酸组研究结果说明棕榈油酸对链状裸甲藻有明显的“低促高抑”现象。
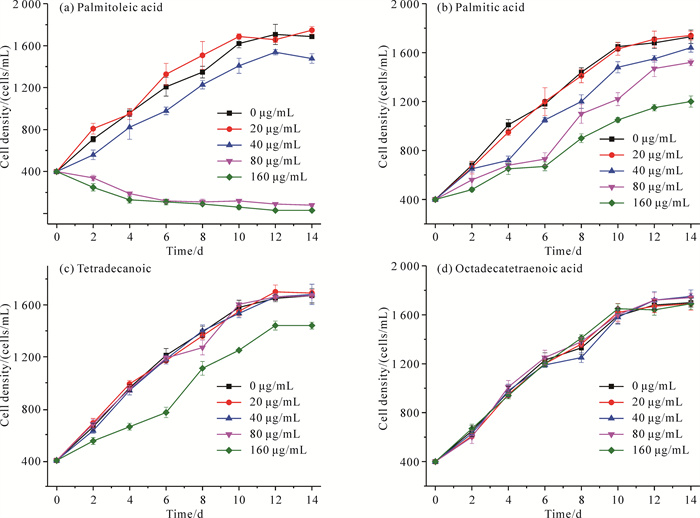
|
| 图 2 海洋卡盾藻中不同次级代谢产物对链状裸甲藻生长的影响 Fig.2 Effect of different secondary metabolites in Chattonella marina on growth of Gymnodinium catenatum |
在棕榈酸组中[图 2(b)],当添加的棕榈酸浓度为20 μg/mL时,链状裸甲藻细胞的生长无明显变化(P>0.05)。而浓度继续增大时,链状裸甲藻细胞的生长速率随着棕榈酸浓度的上升而下降,生长受到明显抑制(P<0.05),但仍能保持缓慢生长。在十四烷酸[图 2(c)]或十八碳四烯酸[图 2(d)]作用下,除高浓度(160 μg/mL)十四烷酸表现出一定抑制作用(P<0.05)外,其余实验组的链状裸甲藻细胞生长趋势与空白对照组无明显差异(P>0.05),说明一般情况下十四烷酸或十八碳四烯酸对链状裸甲藻细胞的生长并无明显影响。
综上,棕榈油酸对链状裸甲藻所产生的抑制作用最强,且随着棕榈油酸浓度的升高,抑制效果显著增强并存在明显剂量效应。可见,棕榈油酸是海洋卡盾藻次级代谢产物中主要的化感物质组分。
2.2.1 棕榈油酸对链状裸甲藻O2-·产生速率的影响棕榈油酸能对微藻的抗氧化系统造成影响[6],因此,为进一步解析棕榈油酸对链状裸甲藻化感作用机制,对不同棕榈油酸浓度下链状裸甲藻的O2-·产生速率进行测定。经棕榈油酸处理后的链状裸甲藻O2-·产生速率变化如图 3所示,处理后的链状裸甲藻O2-·产生速率相较于空白对照组呈现上升趋势。其中,在棕榈油酸浓度为80 μg/mL时,链状裸甲藻O2-·产生速率达到最大值(P < 0.01);而当棕榈油酸浓度达到160 μg/mL时,O2-·产生速率明显下降,这说明链状裸甲藻的细胞活性受到了影响,细胞很可能大量死亡。
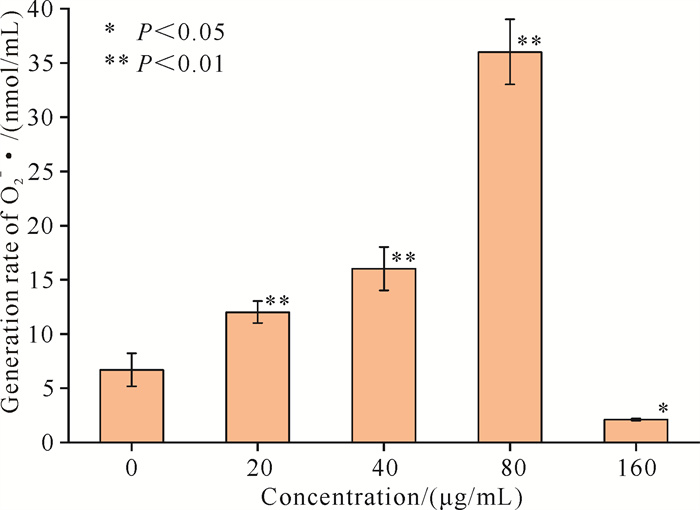
|
| 图 3 不同浓度棕榈油酸对链状裸甲藻O2-·产生速率的影响 Fig.3 Effect of different concentrations of palmitoleic acid on the generation rate of O2-· in Gymnodinium catenatum |
2.2.2 棕榈油酸对链状裸甲藻SOD和CAT含量的影响
经过0-80 μg/mL浓度的棕榈油酸处理后,链状裸甲藻SOD[图 4(a)]和CAT[图 4(b)]的含量均呈现随浓度上升而上升的趋势,显著高于空白对照组(P < 0.01)。经80 μg/mL棕榈油酸处理后的链状裸甲藻SOD和CAT含量均相对最高。这说明棕榈油酸能够引起链状裸甲藻细胞的氧化应激反应,从而导致链状裸甲藻细胞SOD和CAT含量升高。而当棕榈油酸的浓度达到160 μg/mL时,链状裸甲藻的SOD和CAT含量明显下降,棕榈油酸对链状裸甲藻SOD和CAT的产生表现出明显的“低促高抑”现象。
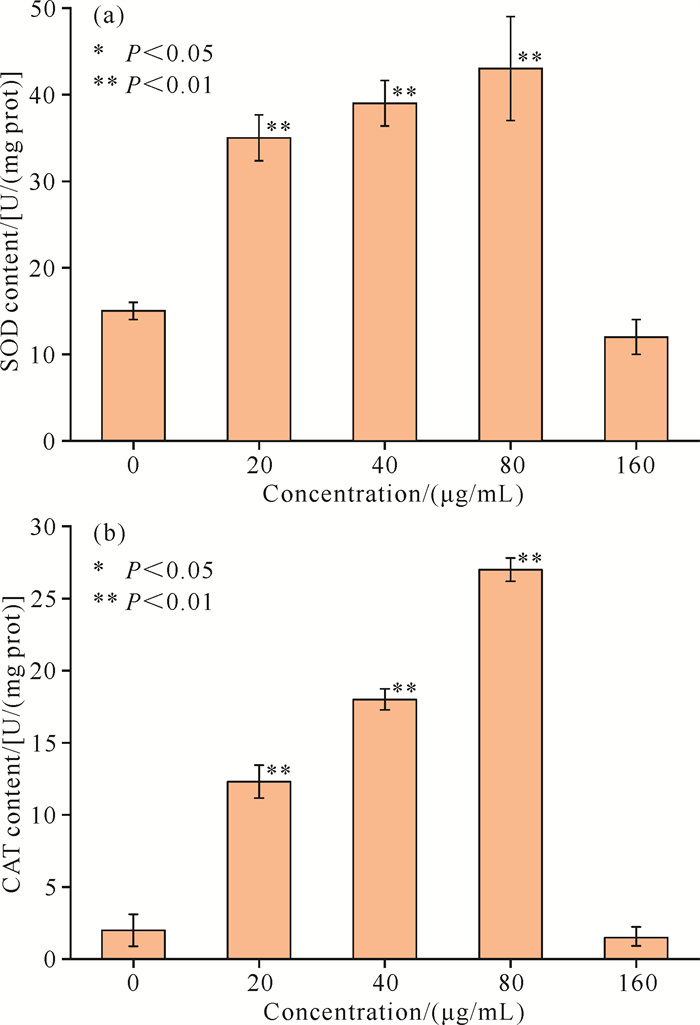
|
| 图 4 不同浓度棕榈油酸对链状裸甲藻SOD含量(a)和CAT含量(b)的影响 Fig.4 Effect of different concentrations of palmitoleic acid on SOD content (a) and CAT content (b) of Gymnodinium catenatum |
2.2.3 棕榈油酸对链状裸甲藻MDA含量的影响
经棕榈油酸处理后的链状裸甲藻MDA含量的变化如图 5所示,随着棕榈油酸浓度的升高,链状裸甲藻的MDA含量出现显著上升的趋势,且随着棕榈油酸浓度的增加而增加。

|
| 图 5 不同浓度棕榈油酸对链状裸甲藻MDA含量的影响 Fig.5 Effect of different concentrations of palmitoleic acid on MDA content of Gymnodinium catenatum |
2.2.4 棕榈油酸对链状裸甲藻Caspase-3含量的影响
在棕榈油酸的作用下,链状裸甲藻出现氧化应激反应,SOD和CAT的含量显著升高,过量积累的活性氧簇(ROS)不能完全被清除,从而造成了氧化损伤,会以此为信号激活程序性细胞死亡(PCD),导致Caspase-3含量上升从而诱导细胞的凋亡。棕榈油酸处理后的链状裸甲藻Caspae-3的含量变化如图 6所示,棕榈油酸处理后的链状裸甲藻Caspase-3含量显著高于空白对照组,且Caspase-3含量整体上随着棕榈油酸浓度的增加而增加。
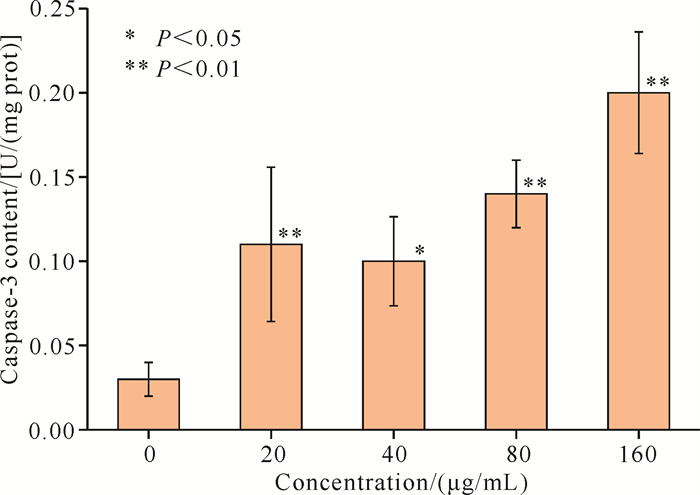
|
| 图 6 不同浓度棕榈油酸对链状裸甲藻Caspase-3含量的影响 Fig.6 Effect of different concentrations of palmitoleic acid on Caspase-3 content of Gymnodinium catenatum |
3 讨论
随着环境变化和海洋资源压力的增加,海洋生态系统的稳定性受到前所未有的挑战[7]。海洋微藻中存在的化感现象及其对生物群落结构和功能的影响已成为海洋生态学研究的热点[8, 9]。为研究探索海洋卡盾藻对链状裸甲藻化感作用的机制,本研究分析了海洋卡盾藻的完整细胞培养液、无细胞滤液和破碎细胞液等不同组分对链状裸甲藻生长的影响。除空白对照组外,各实验组的链状裸甲藻生长均受到抑制,这说明海洋卡盾藻对链状裸甲藻的化感作用可通过释放化感物质到细胞外来发挥作用,也可通过细胞直接接触来实现。而实验组3种不同组分的抑制强度为完整细胞培养液>无细胞滤液>破碎细胞液,这可能是因为海洋卡盾藻对链状裸甲藻的化感作用具有时效性,且释放化感物质到细胞外的作用效果比细胞直接接触的效果更强的缘故。
进一步对海洋卡盾藻的主要次级代谢产物进行抑藻活性测试,在海洋卡盾藻的4种次级代谢产物中,棕榈油酸、棕榈酸和十四烷酸均能对链状裸甲藻的生长产生抑制作用,但十四烷酸和棕榈酸均需要高浓度才能明显抑制链状裸甲藻细胞的生长,且不能杀死链状裸甲藻细胞。棕榈油酸在较高浓度时能直接抑制链状裸甲藻细胞生长,具有较高的抑藻活性,具有进一步开发成抑藻剂的价值。在添加的棕榈油酸浓度为20 μg/mL时,链状裸甲藻细胞生长受到促进作用,而当浓度达到80 μg/mL以上时,链状裸甲藻细胞密度开始下降,这种“低促高抑”现象可能是由于毒物的兴奋效应所引起的[10]。
在加入棕榈油酸(0-80 μg/mL)后,链状裸甲藻O2-·的产生速率明显上升,链状裸甲藻SOD和CAT的含量变化趋势也与O2-·的产生速率变化趋势相同,链状裸甲藻MDA含量与Caspase-3含量整体上随着棕榈油酸浓度的增加而增加。结合以上指标变化,可以推测:在棕榈油酸的作用下,链状裸甲藻细胞氧化胁迫反应加剧,细胞中的活性氧自由基大量积累。为了使藻细胞内活性氧自由基维持在正常水平,SOD和CAT开始清除细胞中的活性氧自由基(SOD和CAT含量增加)。MDA含量的上升表明链状裸甲藻细胞经历着激烈的氧化胁迫和细胞膜脂过氧化损伤过程。细胞的膜脂过氧化损伤会进一步影响Caspase-3的活性进而激活机体细胞中的PCD途径,诱导细胞凋亡[11],Caspase-3含量的升高说明链状裸甲藻细胞在棕榈油酸的作用下发生凋亡。
当棕榈油酸浓度达到160 μg/mL时,外界的刺激超过藻细胞本身的内部平衡时,抗氧化系统的清除能力下降甚至失去作用,链状裸甲藻细胞内的活性氧无法清除,抗氧化系统的崩溃是链状裸甲藻细胞的SOD和CAT含量在棕榈油酸浓度达到160 μg/mL时大幅度下降的主要原因。而MDA含量的继续升高也表明了棕榈油酸引起的氧化胁迫对链状裸甲藻细胞造成了更广泛、更彻底的膜脂过氧化损伤。
4 结论通过剖析海洋卡盾藻不同组分对链状裸甲藻生长的影响,发现棕榈油酸是海洋卡盾藻次级代谢产物中主要的化感物质,且棕榈油酸主要通过氧化胁迫的方式对链状裸甲藻的抗氧化系统造成影响,导致链状裸甲藻细胞内O2-·过度积累引起膜脂过氧化,从而诱导链状裸甲藻细胞凋亡。本研究为海洋卡盾藻对链状裸甲藻的化感作用机制提供了新解释,为分析我国近岸海域中的典型赤潮藻类的相互影响关系以及浮游植物群落间生态系统的稳定性提供了参考依据。
| [1] |
史竞园. 我国福建沿海链状裸甲藻(Gymnodinium catenatum)毒素组成与环境响应特征研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所), 2023.
|
| [2] |
FERNÁNDEZ-HERRERA L J, BAND-SCHMIDT C J, LÓPEZ-CORTÉS D J, et al. Allelopathic effect of Chattonella marina var.marina (Raphidophyceae) on Gymnodinium catenatum (Dinophycea)[J]. Harmful Algae, 2016, 51: 1-9. DOI:10.1016/j.hal.2015.10.009 |
| [3] |
詹慧玲, 饶小珍. 赤潮的危害、成因和防治研究进展[J]. 生物学教学, 2021, 46(7): 66-68. |
| [4] |
RICE E L. Allelopathy[M]. 2nd ed. Orlando: Academic Press, 1984: 1-2.
|
| [5] |
DORANTES-ARANDA J J, NICHOLS P D, DAVID WAITE T, et al. Strain variability in fatty acid composition of Chattonella marina (Raphidophyceae) and its relation to differing ichthyotoxicity toward rainbow trout gill cells[J]. Journal of Phycology, 2013, 49(2): 427-438. DOI:10.1111/jpy.12053 |
| [6] |
李嘉雯. 海洋卡盾藻(香港株)批培养技术及其溶血毒素分离纯化[D]. 广州: 暨南大学, 2014.
|
| [7] |
ENCINAS-YÁNEZ M F, BAND-SCHMIDT C J, ZENTENO-SAVÍN T, et al. Deleterious effects of free fatty acids and hydrogen peroxide towards the dinoflagellate Gymnodinium catenatum[J]. Frontiers in Protistology, 2024, 2: 1302560. DOI:10.3389/frpro.2024.1302560 |
| [8] |
ABOUALAALAA H, RIJAL LEBLAD B, HORMAT- ALLAH A, et al. New insights into the dynamics of causative dinoflagellates and the related contamination of molluscs by paralytic toxins in the southwestern Mediterranean coastal waters of Morocco[J]. Marine Pollution Bulletin, 2022, 185: 114349. DOI:10.1016/j.marpolbul.2022.114349 |
| [9] |
WANG R, XUE Q, WANG J, et al. Competitive interactions between two allelopathic algal species: Heterosigma akashiwo and Phaeodactylum tricornutum[J]. Marine Biology Research, 2020, 16(1): 32-43. DOI:10.1080/17451000.2019.1702213 |
| [10] |
张毓书. 重金属Cd对佐夫色球藻的毒物兴奋效应及其机制[D]. 保定: 河北大学, 2024.
|
| [11] |
张晓宇. 二十碳五烯酸对赤潮微藻氧化胁迫的影响及细胞凋亡机制的研究[D]. 曲阜: 曲阜师范大学, 2015.
|



