2. 北部湾海洋产业研究院,中国-东盟现代渔业产业技术转移示范中心,广西南宁 530007;
3. 广西大学资源环境与材料学院,广西南宁 530004;
4. 南宁学院食品与质量工程学院,广西南宁 530200
2. China-ASEAN Modern Fishery Industry Technology Transfer Demonstration Center, Beibu Gulf Marine Industrial Research Institute, Nanning, Guangxi, 530007, China;
3. School of Resources, Environment and Materials, Guangxi University, Nanning, Guangxi, 530004, China;
4. College of Food and Quality Engineering, Nanning University, Nanning, Guangxi, 530200, China
石斑鱼是我国东南沿海重要的经济养殖品种之一,肉质细腻,营养丰富,是温中补气养生食品。近年来,由于种质资源退化、水环境污染加剧、病原微生物滋生导致石斑鱼病害频发。其中由虹彩病毒引起的病毒性疾病严重威胁着石斑鱼养殖的健康和可持续发展[1]。新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus,SGIV)是一种高致病性虹彩病毒,从新加坡患病石斑鱼中分离,在国际病毒分类手册中被认定为蛙虹彩病毒的新种[2]。SGIV是一种正二十面体双链DNA病毒,直径为154-176 nm,双层膜围绕着电子密度为93 nm的核,其核衣壳亚单位约为5 nm[3]。对SGIV进行蛋白质组学研究分析,可鉴定出29个编码该病毒蛋白的基因,其中20个与致病、抗原等有关[4]。主要衣壳蛋白(Major Capsid Protein,MCP)是虹彩病毒的核心蛋白,编码该蛋白的基因在虹彩病毒科同属间高度保守,不同属间差异显著,是研究虹彩病毒分类及系统演变的重要靶基因[5];而VP19是病毒的外囊膜蛋白,在SGIV入侵阶段发挥着重要作用[4]。SGIV是石斑鱼中传染性极强的病毒性病原之一,可引起石斑鱼全身性疾病,致死率达90%以上[6]。然而目前缺乏获得许可的抗病毒治疗方法以应对SGIV引起的病毒性疾病,因此迫切需要研发针对此病毒的特效药。
仙鹤草(Agrimonia pilosa Ledeb.),又称为龙芽草,广泛分布和种植于中国、韩国。在我国,仙鹤草作为一种药用植物,其地上部分在东方医学中被用于止血、截疟、防痢疾、解毒、补虚、治咳血和脱水劳损等[7, 8]。仙鹤草含有大量黄酮类化合物、挥发油、单宁、酚类、间苯三烯醇、五环三萜、异香豆素、木脂素、有机酸等化学成分,如木犀草素、槲皮素、金丝桃苷、山柰酚、芹菜素、熊果酸等,这些化合物成分被证明具有抗炎、抗癌、抗肿瘤、抗氧化、镇痛等作用[8]。近年来,由于低毒性及高安全性,仙鹤草已被广泛用于临床研究并证实其对多种病毒具有抑制作用。例如,仙鹤草和五倍子的混合物可通过干扰严重急性呼吸系统综合征冠状病毒2型(SARS-CoV-2)侵染宿主的多个感染过程,强烈抑制SARS-CoV-2的感染,其中属于仙鹤草源的化合物熊果酸和槲皮素表现出较强的抗病毒活性[7];仙鹤草和五倍子的混合物还能显著降低甲型流感病毒(Influenza A Virus,IAV) 诱导的细胞病变效应、病毒基因的转录/蛋白表达水平以及病毒颗粒的产生,混合物中的金丝桃苷、木犀草素、黄芪苷、阿夫泽林和芹菜素具有极好的抗丙型肝炎病毒(Hepatitis C Virus,HCV)作用[9]。仙鹤草还能阻碍乙型肝炎病毒(Hepatitis B Virus,HBV)及HCV蛋白的合成,从而抑制两种病毒的感染[10]。综上可知,仙鹤草具有高效的抗病毒活性。尽管仙鹤草对多种病毒具有抑制作用,但是其在SGIV感染中的作用及作用机制目前仍未见报道。因此,本研究拟评估仙鹤草水提物(A.pilosa Ledeb.Water Extract,AWE)对SGIV感染细胞的影响,同时探究仙鹤草对SGIV感染的作用机制,拟为研发抗SGIV的高效渔用药物提供理论基础。
1 材料与方法 1.1 材料供试药材仙鹤草购自广西南宁一心大药房。石斑鱼脾脏(Grouper Spleen,GS)细胞为岭南现代农业科学与技术广东省实验室秦启伟教授惠赠,由广西渔业重大疫病防控与高效健康养殖产业技术工程研究中心保存,细胞在含有10%的胎牛血清(Gibco)的L15培养基中培养。SGIV由本实验室的实验人员从广西人工养殖的珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×E.lanceolatus♂)中分离出,在GS细胞中增殖,保存于-80 ℃超低温冰箱。
1.2 AWE的制备将仙鹤草粉碎成粉末,称取25 g装入药包并将药包浸泡于500 mL超纯水中,4 ℃浸泡过夜,次日将仙鹤草浸泡液及药包置于锅中煎煮至约100 mL,定容得到250 mg/mL的AWE母液。经12 000 r/min离心10 min,使用0.22 μm滤膜过滤即得到AWE,-20 ℃保存备用。
1.3 AWE细胞安全工作浓度的确定将GS细胞按照1×105个/孔接种至96孔板并于28 ℃培养箱中培养18 h,然后将AWE用L15培养基稀释成不同浓度(1 250.0、625.0、312.5、156.3、78.2 μg/mL)后加入96孔板中,并与GS细胞在28 ℃条件下共孵育培养48 h。利用光学显微镜观察GS细胞在不同浓度AWE处理下的形态变化。光镜观察结束后,弃掉各组细胞的上清液,通过CCK-8试验检测细胞活力,即用磷酸盐缓冲液(PBS)将细胞清洗2次后往各孔加入20 μL的水溶性四唑盐(WST-8)溶液,再继续在28 ℃培养箱中避光培养4 h,利用酶标仪检测450 nm处的吸光度,计算细胞存活率。对照组为未用AWE处理的GS细胞。细胞存活率的计算公式如下:细胞存活率(%)=(实验组OD450/对照组OD450)×100%。
1.4 AWE的细胞毒性分析为确认1.3节所得到的AWE细胞安全工作浓度对GS细胞没有伤害,进一步检测该浓度AWE对细胞骨架蛋白的影响。首先,将GS细胞(1×105 个/孔)接种至35 mm玻璃底细胞培养皿(型号为D35C4-20-1-N,美国Cellvis生产)中并于28 ℃培养箱过夜培养,到时间后在细胞中加入安全工作浓度的AWE并于28 ℃下再培养48 h。然后,用4%多聚甲醛固定1 h后,使用PBS洗涤细胞3次。GS细胞经无水乙醇透化后用角蛋白抗体(Abcam)室温孵育1.5 h,使用PBS洗涤细胞3次后再用带有异硫氰酸荧光素(FITC)标记的二抗(Abcam)孵育细胞1 h。最后,使用细胞核染料Hoechst-33342对细胞核进行避光染色5 min,通过激光共聚焦扫描显微镜(Laser Scanning Confocal Microscope,LSCM,日本尼康株式会社生产)观察细胞的结构(DAPI通道)。以未经AWE处理的GS细胞作为对照。
1.5 AWE在SGIV感染中的作用使用AWE预处理的SGIV感染GS细胞,以评估AWE在SGIV感染中的作用。由于在无血清培养基培养超过48 h可能会造成细胞因营养的缺乏而状态不佳,因此选择病毒感染48 h作为药物抗病毒活性的评估时间点。将GS细胞(8×105个/孔)接种至12孔板中并于28 ℃培养箱中过夜培养,备用。首先,用L15培养基将AWE稀释至156.3、78.2和39.1 μg/mL;然后分别往各浓度AWE中加入0.5 μL半数组织细胞感染剂量(病毒滴度TCID50,为1×107 /mL)的SGIV,将药物和病毒在4 ℃条件下共孵育2 h后加入备用的GS细胞。当SGIV感染GS细胞48 h后,利用光学显微镜观察GS细胞的病变效应(Cytopathic Effects,CPEs),同时提取细胞总RNA,通过RT-qPCR方法检测SGIV MCP和VP19基因的表达,其中检测基因的引物序列如下。qMCP-F:5′-GCACGCTTCTCTCACCTTCA-3′,qMCP-R:5′-AACGGCAACGGGAGCACTA-3′;qVP19-F:5′-TCCAAGGGAGAAACTGTAAG-3′,qVP19-R:5′-GGGGTAAGCGTGAAGACT-3′;β-actin-F:5′-TACGAGCTGCCTGACGGACA-3′,β-actin-R:5′-GGCTGTGATCTCCTTCTGCA-3′。以未用AWE处理的SGIV感染组为对照组。
另外,同时使用荧光分子探针通过流式细胞仪来分析AWE抗SGIV的活性。核酸适体LYGV1能够特异性识别SGIV感染的GS细胞,用6-羧基荧光素(FAM)标记LYGV1可得到FAM-LYGV1。将细胞以8×105个/孔接入12孔板,在28 ℃培养18 h后,实验组使用L15培养基将AWE稀释至工作浓度(156.3、78.2和39.1 μg/mL)并分别与0.5 μL的SGIV (TCID50=1×107/mL)在4 ℃孵育2 h后共同处理GS细胞(总体系为800 μL)。阴性对照组(Control)仅使用L15培养基,阳性对照组(SGIV)使用0.5 μL SGIV (TCID50=1×107/mL)和L15培养基,其余操作同实验组(总体系为800 μL),在28 ℃培养48 h。使用细胞刮刀收集每组细胞,FAM-LYGV1在92 ℃变性5 min,4 ℃复性5 min,随后每组细胞与10 μL FAM-LYGV1在4℃孵育30 min,期间每隔5 min轻弹1次,细胞经300 μL PBS溶液清洗两次后重悬于200 μL的PBS中,然后使用流式细胞仪选择FITC通道进行分析,结果以3个独立样本的平均值±标准差表示。
1.6 AWE在SGIV感染中的作用机制 1.6.1 AWE对SGIV病毒粒子结构的影响将GS细胞(8×105个/孔)接种至12孔板中并于28 ℃培养箱中过夜培养,备用。将安全工作浓度的AWE与1.25 μL SGIV(TCID50=1×107/mL)在4 ℃条件下共孵育2 h,然后将药物与病毒的混合液在4 ℃下以25 000 g离心30 min,弃掉上清液。利用TN缓冲液重悬病毒颗粒并将其加入GS细胞中进行细胞感染。病毒感染48 h后,收集细胞上清液用于TCID50的测定,并提取各组细胞的总RNA用于RT-qPCR以检测SGIV MCP和VP19基因的表达。以未用AWE处理的SGIV感染的GS细胞作为对照。
1.6.2 AWE对SGIV感染宿主细胞吸附阶段的影响将GS细胞(8×105个/孔)接种至12孔板中并于28 ℃培养箱中过夜培养,然后将AWE与SGIV混匀后加入细胞中并在4 ℃条件下处理30 min。移除上清液,用L15培养基将细胞清洗2次后加入新的L15培养基,并在28 ℃条件下继续培养12 h。收集细胞以提取总RNA,并通过RT-qPCR方法检测SGIV MCP和VP19基因的表达。以未用AWE处理的SGIV感染的细胞作为对照。
为验证AWE是否对SGIV的吸附阶段产生影响,进一步使用流式细胞仪[型号Raisecyte 2L6C, 瑞思凯尔(中国)生产]进行分析。首先,使用Cy5标记SGIV(Cy5-SGIV),然后在4 ℃下使用安全工作浓度的AWE+Cy5-SGIV处理GS细胞,对照组为仅用Cy5-SGIV处理的GS细胞。各组在4 ℃下静置2 h后收集细胞,用PBS洗涤细胞2次。最后通过流式细胞仪对结果进行分析。
1.6.3 AWE对SGIV侵入宿主细胞阶段的影响将GS细胞(8×105 个/孔)在28 ℃下接种到12孔板中过夜培养,然后往细胞中加入SGIV并在4 ℃下感染30 min,用L15培养基洗涤细胞2次,加入安全工作浓度的AWE并于28 ℃下再培养2 h。弃上清液后用L15培养基洗涤细胞2次,继续在28 ℃条件下培养10 h。提取各组细胞的总RNA,使用RT-qPCR方法检测SGIV MCP和VP19基因的表达。以未经AWE处理的SGIV感染的细胞作为对照。
另外,进一步通过流式细胞仪分析AWE对SGIV侵入宿主细胞的影响。在4 ℃下用Cy5-SGIV处感染GS细胞2 h后弃掉上清液,并用L15培养基洗涤细胞2次,加入安全工作浓度的AWE或L15培养基于28 ℃条件下培养细胞2 h。移除上清液后用PBS洗涤细胞2次,每孔加入300 μL蛋白酶K处理2 min以去除细胞表面的病毒颗粒,然后收集细胞孔里的细胞并于1 000 g条件下离心2 min,去掉上清液,细胞再经PBS洗涤3次后用于流式细胞仪分析。
1.6.4 AWE对SGIV在宿主细胞中复制阶段的影响将GS细胞(8×105个/孔)在28 ℃下接种至12孔板中过夜培养,然后在4 ℃条件下用SGIV感染GS细胞30 min再将细胞转移至28 ℃条件下继续培养2 h,弃上清液后用PBS洗涤细胞2次,最后加入安全工作浓度的AWE在28 ℃条件下处理细胞10 h。提取各组细胞的总RNA,通过RT-qPCR方法检测SGIV MCP和VP19基因的表达。以未用AWE处理的SGIV感染的细胞为对照。
1.6.5 AWE对SGIV基因表达的抑制率分析根据SGIV MCP或VP19基因在1.6.1-1.6.4节过程(Test 1、Test 2、Test 3和Test 4)中的相对表达量,分析AWE在SGIV感染细胞的不同情况下对SGIV基因表达的抑制率。抑制率的计算方法如下:抑制率(%)=(1-M)×100%,其中M代表药物组病毒MCP基因(VP19基因)相对于对照组病毒MCP基因(VP19基因)的表达量。
1.7 数据统计分析实验数据以3个独立实验的平均值±标准差表示。在SPSS 16.0软件中,采用单因素方差分析比较组间差异,并以GraphPad Prism 7软件制图。
2 结果与分析 2.1 AWE对GS细胞的安全工作浓度光学显微镜观察结果发现,与未用AWE处理的GS细胞相比,当AWE浓度≤156.3 μg/mL时,GS细胞生长正常,形态没有发生变化;而当AWE浓度>156.3 μg/mL时,GS细胞形态呈现出脱落、皱缩和变圆的变化,该形变随着AWE浓度的增加而加重[图 1(a)]。此外,CCK-8法检测结果显示,当AWE浓度≤312.5 μg/mL时, GS的细胞活力与对照组相比没有显著差异; 而当AWE浓度>312.5 μg/mL时,GS的细胞活力与对照组相比有显著差异[图 1(b)]。综上所述,本实验选择对细胞形态及细胞活力都没有影响的156.3 μg/mL为仙鹤草在GS细胞中的安全工作浓度。
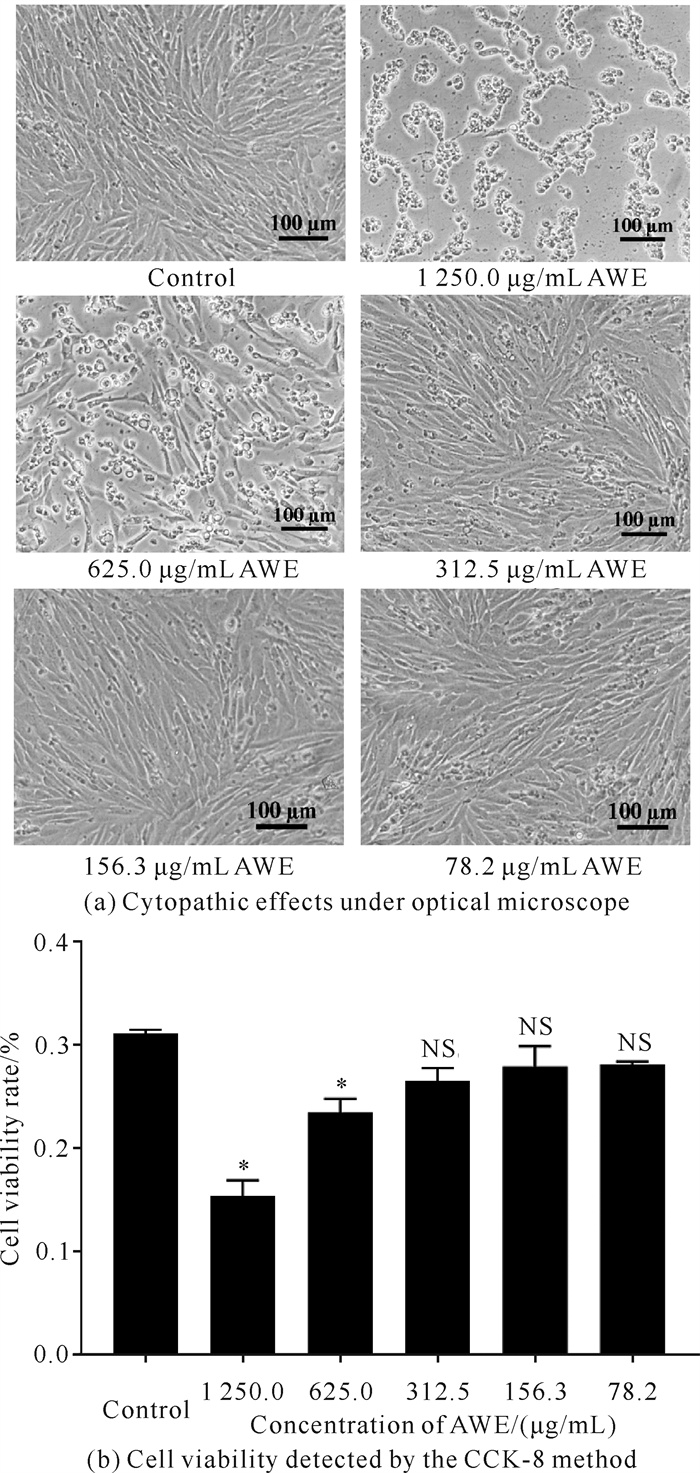
|
| *represents significant difference between the experimental group and the control group (P < 0.05), NS represents no significant difference between the experimental group and the control group. 图 1 仙鹤草水提物细胞安全工作浓度的确定 Fig.1 Determination of safe working concentration of Agrimonia pilosa Ledeb.water extract in cells |
2.2 安全工作浓度AWE对GS细胞的毒性
利用细胞骨架蛋白抗体进行免疫荧光实验,即对照组与AWE组细胞在正常情况下(Light)经细胞骨架蛋白抗体标记(FITC)后再用Hoechst-33342进行核染(DAPI),结果如图 2所示,经AWE处理的GS细胞骨架角蛋白的形态结构与未用AWE处理的没有差异(Merge)。由此表明,AWE对GS细胞没有毒性。
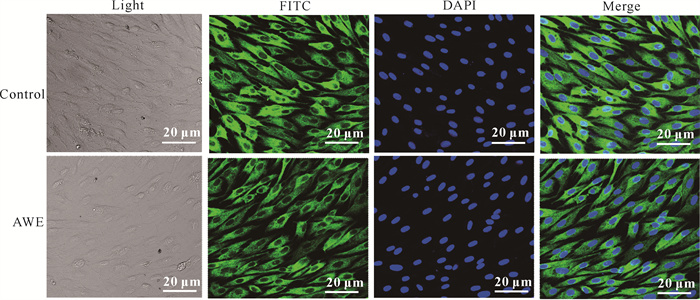
|
| 图 2 激光共聚焦扫描显微镜下的细胞骨架角蛋白 Fig.2 Cytoskeleton keratin under LSCM |
2.3 AWE抗SGIV活性
光学显微镜观察显示,与未用AWE处理的SGIV感染组细胞相比,AWE处理的SGIV感染细胞出现CPEs显著降低,且随着AWE浓度的增加而逐渐减弱[图 3(a)]。同时,AWE处理的SGIV感染的GS细胞中SGIV MCP和VP19基因的表达量显著低于对照组[图 3:(b)、(c)],且随着AWE浓度的增加SGIV MCP和VP19基因的表达量逐渐降低。此外,流式细胞仪分析结果显示,不同浓度AWE处理的SGIV感染组的荧光强度显著低于未经AWE处理的SGIV感染组,且荧光强度随着AWE浓度的增加而减弱[图 3(d)]。综上所述,AWE具有抗SGIV活性,该活性是浓度依赖性的。
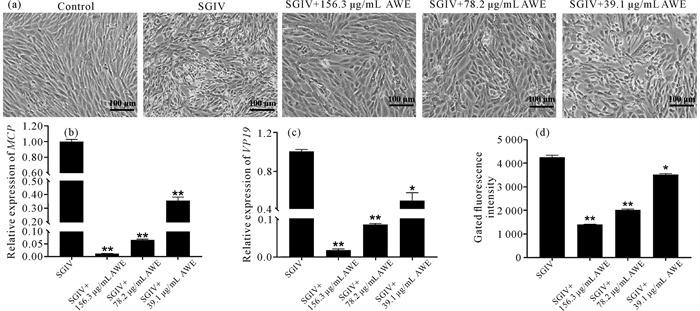
|
| * represents significant difference compared with the control group (P < 0.05), ** represents extremely significant difference compared with control group (P < 0.01). 图 3 仙鹤草水提物在SGIV感染中的作用 Fig.3 Role of Agrimonia pilosa Ledeb.water extract in SGIV infection |
2.4 AWE对SGIV病毒粒子的破坏作用
Wen等[8]发现,中草药可破坏病毒粒子结构从而发挥抗病毒功能,因此为明确AWE潜在的抗病毒机制,首先探究AWE是否对SGIV病毒粒子结构产生影响。结果发现,与未用AWE处理的SGIV感染组细胞相比,经AWE处理的SGIV感染组细胞中SGIV MCP和VP19基因的表达量显著降低[图 4: (a)、(b)]。此外,通过收集各组细胞上清液进行TCID50测定发现,AWE处理组的SGIV的TCID50显著低于未用AWE处理的SGIV感染组[图 4(c)]。因此,推测AWE可能具有破坏SGIV病毒粒子的作用。

|
| * represents significant difference compared with the control group (P < 0.05), ** represents extremely significant difference compared with control group (P < 0.01). 图 4 仙鹤草水提物对SGIV病毒粒子结构的影响 Fig.4 Impact of Agrimonia pilosa Ledeb.water extract on the structure of SGIV particle |
2.5 AWE对SGIV感染细胞吸附阶段的干扰
为探究AWE抗SGIV的潜在机制,进一步分析AWE对SGIV感染细胞吸附阶段的影响。结果显示,仅用SGIV感染的GS细胞中SGIV MCP和VP19基因的表达量显著高于经AWE处理的SGIV感染组细胞[图 5: (a)、(b)],表明AWE对SGIV与宿主细胞的结合具有抑制作用。通过流式细胞仪分析发现,Cy5的荧光信号在经AWE处理的SGIV感染组细胞中显著低于仅用SGIV感染的细胞[图 5(c)],进一步证实AWE可干扰SGIV吸附宿主细胞的过程。
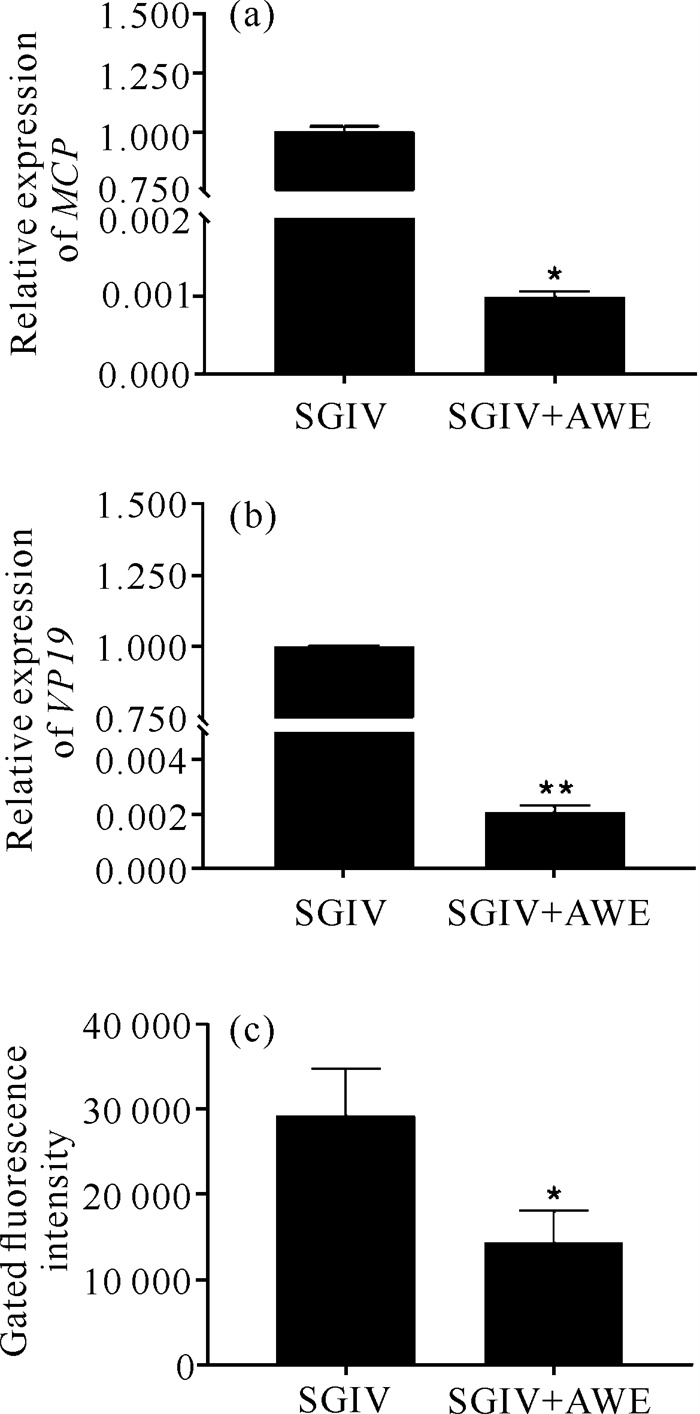
|
| * represents significant difference compared with the control group (P < 0.05), ** represents extremely significant difference compared with control group (P < 0.01). 图 5 仙鹤草水提物对SGIV与宿主细胞结合的影响 Fig.5 Effect of Agrimonia pilosa Ledeb.water extract on the binding of SGIV to host cells |
2.6 AWE对SGIV感染细胞侵入阶段的影响
RT-qPCR检测结果显示,与对照组相比,经AWE处理的SGIV感染的GS细胞中SGIV MCP和VP19基因的表达水平显著低于未用AWE处理的细胞[图 6: (a)、(b)],且流式细胞仪分析结果显示,AWE处理组中Cy5的荧光信号显著低于未用AWE处理组[图 6(c)]。由此表明,AWE可以干扰SGIV侵入宿主细胞的过程。
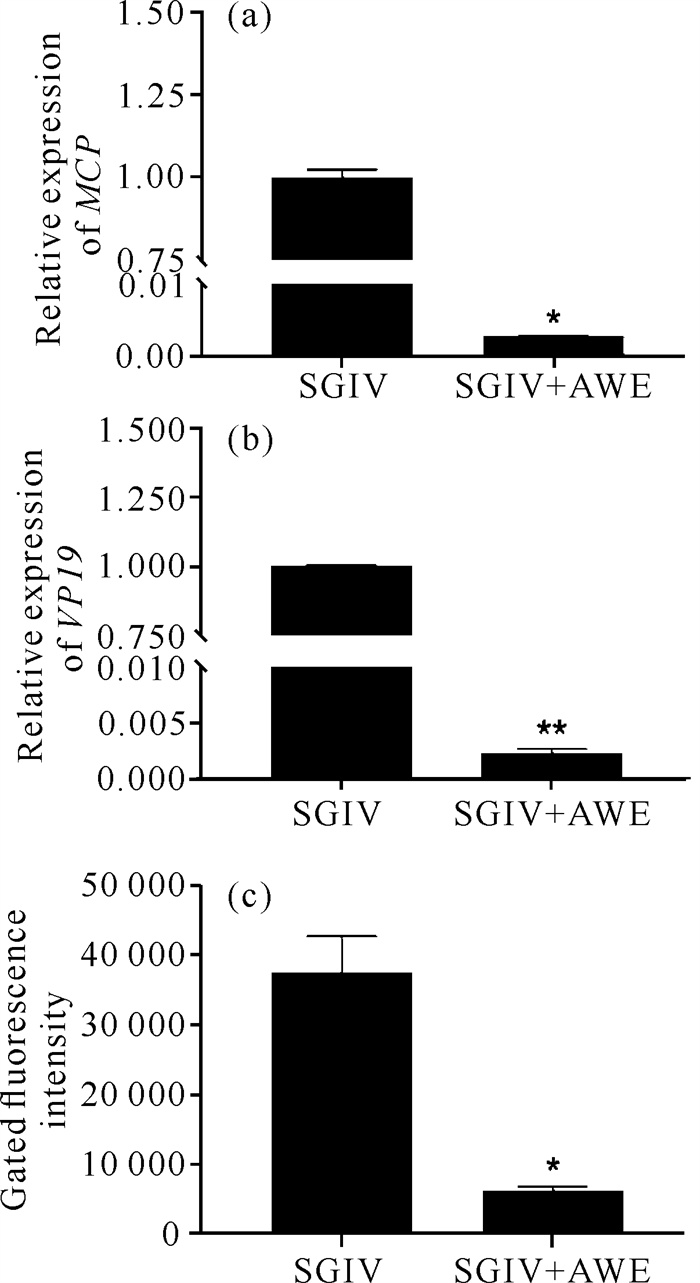
|
| * represents significant difference compared with the control group (P < 0.05), ** represents extremely significant difference compared with control group (P < 0.01). 图 6 仙鹤草水提物对SGIV侵入宿主细胞的影响 Fig.6 Effect of Agrimonia pilosa Ledeb.water extract on the invasion of SGIV into host cells |
2.7 AWE对SGIV感染细胞复制阶段的影响
在SGIV侵染宿主细胞的复制阶段用AWE处理感染的细胞,以明确AWE是否能影响SGIV在宿主细胞中的复制。结果发现,AWE处理的SGIV感染的GS细胞中SGIV MCP和VP19基因的表达量显著低于未用AWE处理的细胞[图 7: (a)、(b)],这意味着AWE具有干扰SGIV在宿主细胞中复制的能力。
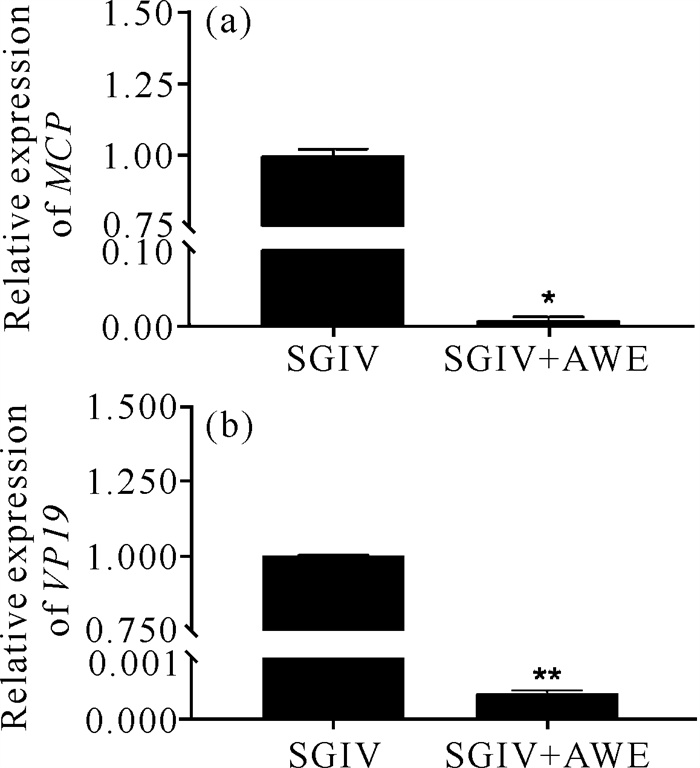
|
| * represents significant difference compared with the control group (P < 0.05), ** represents extremely significant difference compared with control group (P < 0.01). 图 7 仙鹤草水提物对宿主细胞中SGIV复制的影响 Fig.7 Impact of Agrimonia pilosa Ledeb.water extract on SGIV replication in host cells |
2.8 AWE对SGIVMCP或VP19基因表达的抑制率
根据SGIV MCP基因在AWE处理的SGIV感染组及仅SGIV感染组细胞中的相对表达量可知,AWE对SGIV病毒粒子结构的影响(Test 1)以及SGIV感染宿主细胞的吸附(Test 2)、侵入(Test 3)、复制(Test 4)过程中SGIV MCP基因表达的抑制率分别为80.88%、99.91%、99.74%和99.26%[图 8(a)]。另外,根据SGIV VP19基因在上述4个过程中的表达,可知AWE在SGIV感染细胞的不同阶段对VP19基因表达的抑制率与MCP基因类似[图 8(b)]。由此可知,AWE具有很好的抗SGIV效果,其在SGIV感染宿主细胞的吸附阶段显示出最好的抗病毒效果。
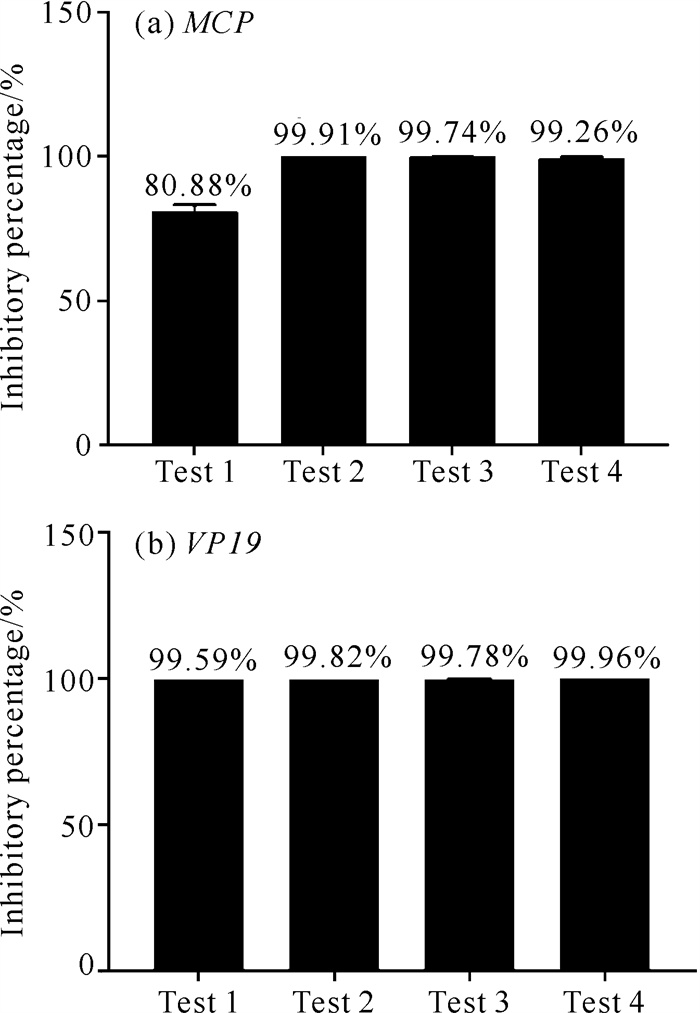
|
| 图 8 AWE对SGIV MCP或VP19基因表达的抑制率 Fig.8 Inhibition rates of Agrimonia pilosa Ledeb.water extract on SGIV MCP or VP19 gene |
3 讨论
水产养殖中防治水生动物疾病常见的手段是使用抗生素。抗生素对细菌性疾病疗效显著,但是抗生素的滥用易引发水环境污染、耐药性病原的产生及食品安全问题[9]。虹彩病毒是一种高致病性病毒性病原,可引发石斑鱼严重的病毒性疾病,造成重大经济损失。尽管抗生素可治疗细菌性疾病,但是其对虹彩病毒并没有防治作用。疫苗也被认为是水生动物疾病防治的重要手段之一,只是疫苗虽然具有很好的预防效果,但是其严格的灭活和储存条件以及剂量的不确定性在一定程度上影响了疫苗在水产养殖中的应用[10, 11]。因此,急需研发环境友好且经济实惠的绿色药物用于防治虹彩病毒的感染。
鉴于药用植物具有抗菌、抗病毒、增强机体免疫等功能,越来越多的有关抗水生动物病毒药物的研究聚焦于被称为“绿色药物”的药用植物。例如,Huang等[12]发现栀子(Gardenia jasminoides Ellis)提取物可以抑制白斑综合征病毒(White Spot Syndrome Virus,WSSV)在克氏原螯虾(Procambarus clarkii)中的复制;Wang等[13]证实绿茶[Camellia sinensis (L.) Kuntze]提取物以剂量依赖的方式抑制草鱼呼肠孤病毒(Grass Carp Reovirus,GCRV);Micol等[14]指出橄榄(Canarium album)叶提取物对病毒性出血性败血症病毒(Viral Haemorrhagic Septicaemia Virus,VHSV)具有抗病毒活性;钩藤(Uncaria tomentosa)[15]、木樨榄(Olea europaea)[16]、羊栖菜(Hizikia fusiforme)[17]等药用植物提取物对WSSV均表现出很好的抗病毒效果。另外,八角茴香(Illicium verum Hook.f.)水提物[18]、紫花地丁(Viola philippica)水提物[19]、忍冬(Lonicera japonica Thunb.)水提物[20]、败酱草(Thlaspi arvense Linn)水提物[1]等可以剂量依赖的方式抑制SGIV在细胞中的感染。本研究中,仙鹤草水提物也表现出显著抗SGIV的效果,并且其抗病毒活性也是剂量依赖性的,与上述抗水生动物病毒的中草药提取物的研究结果相似。Sharma等[21]研究证实,药用植物的抗病毒潜力归因于各种生物活性成分的存在,包括黄酮类、木脂素、萜类、皂苷、呋喃类等。仙鹤草中含有大量黄酮类和木脂素等化合物,在明确仙鹤草提取物具有抗SGIV效果的情况下挖掘防治石斑鱼虹彩病毒的仙鹤草源活性成分,是未来需要深入探究的课题之一,也是筛选和研发石斑鱼抗病毒新型药物的重要途径,最终可为水产养殖中因抗生素的泛滥使用而引发的水环境污染、耐药性病原的产生及食品安全问题的解决提供策略。
病毒感染宿主细胞的过程包括吸附、侵入、复制、组装与释放。病毒的生命周期始于病毒附着在细胞膜上,随后是侵入宿主细胞,在细胞内复制并组装成病毒颗粒后从宿主细胞中释放[22]。深入探究抗病毒药物在病毒感染宿主细胞的起作用阶段对开发新型抗病毒药物至关重要。Liao等[23]调查发现,药用植物可以通过干扰病毒侵染宿主的吸附、侵入和复制中的一个或多个阶段直接地发挥抗病毒作用,也可以通过调控宿主免疫应答间接地发挥抗病毒作用。例如,绿茶提取物及绿茶活性成分表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)与GCRV竞争结合富集在细胞表面的LamR从而抑制GCRV吸附于宿主细胞上[13];紫花地丁提取物及八角茴香活性成分槲皮素能够干扰SGIV侵染宿主细胞的吸附、侵入与复制阶段从而发挥抗病毒功能[19, 24];甘草(Glycyrrhiza uralensis)提取物不仅可以通过阻碍SGIV的吸附与复制来发挥抗病毒效果[25],而且还可以通过直接抑制病毒颗粒在细胞表面的附着和内化来实现其对VHSV的抑制作用[26]。此外,药用植物活性成分槲皮素和硫辛酸等能调控一些抗病毒基因,如调控干扰素(Interferon, IFN)系统相关基因IFN、STAT1、PKR、ISG15、MXI、IRF7、Viperin的表达使宿主建立抗病毒状态而间接地发挥抗病毒功能[1, 26, 27];活性成分厚朴酚可调节IRF7、IFN1、IL-1β的表达从而发挥抗GCRV的作用,而和厚朴酚不仅能显著促进IL-1β的表达,而且还能显著促进TNFα和NF-κB的表达,通过激活NF-κB信号通路发挥抗GCRV的功效[28]。此外,厚朴酚还能促进抑凋亡因子bcl-2,抑制促凋亡基因bax及凋亡相关基因caspase 3、caspase 8和caspase 9的表达从而抑制GCRV诱导的细胞凋亡而发挥抗病毒功能[29]。月桂酸甘油酯则通过促进NF-κB和C型凝集素的表达,并增强血细胞总数、酚氧化酶活性和超氧化物歧化酶活性以降低WSSV感染克氏原螯虾的死亡率[23];木犀草素能降低有利于WSSV复制的免疫相关基因如BAF、Hsp70和STAT的表达,同时调控抗氧化因子(SOD、CAT和GST)的活性以增强机体的抗氧化防御,并调节促炎因子(COX-1和COX-2) 和凋亡相关基因(BAX和BI-1) 的表达,以减轻病毒感染引起的炎症反应和诱导细胞凋亡而使机体更好地应对WSSV感染[30]。麦冬(Ophiopogon japonicus)水提物也被证明能够上调抗氧化酶SOD、CAT和GSH的活性以减弱WSSV感染引起的氧化应激[31]。此外,还有一些药用植物或药用植物的活性成分可以通过调节机体的炎症反应、自噬反应等间接地发挥抗病毒功效[23]。Lee等[7]研究发现,仙鹤草能够作用于SARS-CoV-2感染过程中的侵入与复制阶段而呈现出显著的抗SARS-CoV-2效果。本研究发现,仙鹤草水提物在SGIV吸附、侵入与复制过程均具有干扰作用,且对SGIV吸附阶段的作用效果最强,该结果与仙鹤草对SARS-CoV-2的作用[7]相似。然而仙鹤草中哪些成分具有抗SGIV活性,以及仙鹤草的活性成分是否能够通过调节宿主的免疫反应而间接地发挥抗SGIV作用仍需进一步探究。
完整的病毒结构是病毒感染的必需条件[32]。研究发现,药用植物及其活性成分可直接与病毒粒子相互作用,通过破坏病毒粒子结构而发挥抗病毒作用[27, 28]。例如,橄榄叶提取物及其活性成分橄榄苦苷能够抑制VHSV在感染细胞中诱导的细胞间膜融合,橄榄叶提取物及橄榄苦苷预处理VHSV后可使VHSV的感染力分别降低10%和30%,说明橄榄叶提取物及橄榄苦苷可与VHSV的包膜相互作用[13];来自于叶下珠(Phyllanthus urinaria Linnea)的外花青素可使单纯疱疹病毒2型(Herpes Simplex Virus type 2,HSV-2)的病毒粒子失活,推测叶下珠的外花青素与HSV-2的结构蛋白发生了相互作用从而降低该病毒的感染性[33];冬青(Ilex chinensis)提取物中的3,4-二咖啡酰基奎宁酸能够靶向肠道病毒A7 (Enterovirus A71,EV-A71) 结构蛋白VP1内5重轴中98位(E98)的谷氨酸残基和246位(P246)的脯氨酸残基,并特异性地抑制EV-A71与宿主受体硫酸乙酰肝素(HS)的连接,从而破坏EV-A71与宿主细胞的附着,影响EV-A71感染的初始阶段[34];八角茴香的活性成分槲皮素和紫花地丁水提物被证实具有破坏SGIV病毒粒子结构的能力,从而降低SGIV的细胞感染力[18, 21]。此外,作为绿茶活性成分的EGCG也被报道具有损害大口黑鲈病毒(LargeMouth Bass Virus,LMBV)结构的功能从而抑制LMBV的感染[35]。本研究中,SGIV经仙鹤草水提物预处理后其感染力有所减弱,推测仙鹤草水提物可能与SGIV的病毒粒子发生相互作用从而削弱了SGIV感染细胞的能力。然而,仙鹤草是直接破坏SGIV的病毒粒子结构,还是与SGIV结构蛋白发生相互作用,或是与SGIV竞争结合细胞受体而减弱SGIV的感染力仍需要深入探究。
近年来,药物靶标的探究已成为药理学领域的研究热点。Singh等[36]研究发现穿心莲(Andrographis paniculata)、美丽乌头(Aconitum pulchellum)、闭鞘姜(Hellenia speciosa)和藏木香(Inula racemosa)与宿主蛋白具有较高的亲和力,并能靶向SARS-CoV-2病毒的S糖蛋白;Bandyopadhyay等[37]从靶向新型冠状病毒非结构蛋白Nsp9的药物中发现忍冬及甘草具有多药生态学特性,可同时作用于多种途径,抑制病毒进入、复制阶段及病毒感染引起的疾病进程。因此,仙鹤草靶标蛋白的研究也是未来值得深入探索的方向,可助力SGIV靶向药物的研发。
4 结论仙鹤草水提物能够抑制SGIV在细胞中的感染,可能通过与病毒粒子相互作用而破坏SGIV病毒粒子结构,或干扰SGIV感染宿主细胞过程中的吸附、侵入与复制阶段来发挥抗SGIV作用,因此仙鹤草具有研发成为作用机制明确的渔用抗SGIV病毒制剂的潜力。
| [1] |
HUANG L, LI M, WEI H, et al. Research on the indirect antiviral function of medicinal plant ingredient quercetin against grouper iridovirus infection[J]. Fish & Shellfish Immunology, 2022, 124: 372-379. |
| [2] |
CHINCHAR V G, WALTZEK T B, SUBRAMANIAM K. Ranaviruses and other members of the family Iridoviridae: their place in the virosphere[J]. Virology, 2017, 511: 259-271. DOI:10.1016/j.virol.2017.06.007 |
| [3] |
ZHANG Y, GAO X L, YANG X M, et al. Singapore grouper iridovirus VP131 drives degradation of STING-TBK1 pathway proteins and negatively regulates antiviral innate immunity[J]. Journal of Virology, 2022, 96(20): e0068222. DOI:10.1128/jvi.00682-22 |
| [4] |
秦启伟, 黄晓红. 石斑鱼虹彩病毒SGIV感染致病的细胞分子基础及免疫防控对策[J]. 华南农业大学学报, 2019, 40(5): 78-90. |
| [5] |
肖贺贺, 徐凤巧, 刘明珠, 等. 石斑鱼虹彩病毒主要衣壳蛋白的表达及其生物学功能分析[J]. 南方农业学报, 2021, 52(3): 806-814. DOI:10.3969/j.issn.2095-1191.2021.03.029 |
| [6] |
李梦梦, 韦红玲, 刘明珠, 等. 八角茴香水提物调控宿主免疫反应抗石斑鱼虹彩病毒的机制研究[J]. 南方农业学报, 2022, 53(10): 2756-2765. DOI:10.3969/j.issn.2095-1191.2022.10.006 |
| [7] |
LEE Y G, KANG K W, HONG W, et al. Potent antiviral activity of Agrimonia pilosa, Galla rhois, and their components against SARS-CoV-2[J]. Bioorganic & Medicinal Chemistry, 2021, 45: 116329. |
| [8] |
WEN S, ZHANG X, WU Y, et al. Agrimonia pilosa Ledeb. : a review of its traditional uses, botany, phytochemistry, pharmacology, and toxicology[J]. Heliyon, 2022, 8(8): e09972.
|
| [9] |
JOO Y H, LEE Y G, LIM Y, et al. Anti-influenza A virus activity by Agrimonia pilosa and Galla rhois extract mixture[J]. Biomedicine & Pharmacotherapy, 2022, 155: 113773. |
| [10] |
KWON J E, LEE Y G, KANG J H, et al. Anti-viral ac- tivity of compounds from Agrimonia pilosa and Galla rhois extract mixture[J]. Bioorganic Chemistry, 2019, 93: 103320. DOI:10.1016/j.bioorg.2019.103320 |
| [11] |
WANG S, HUANG X, HUANG Y, et al. Entry of a novel marine DNA virus, Singapore grouper iridovirus, into host cells occurs via clathrin-mediated endocytosis and macropinocytosis in a pH-dependent manner[J]. Journal of Virology, 2014, 88(22): 13047-13063. DOI:10.1128/JVI.01744-14 |
| [12] |
HUANG A G, TU X, QI X Z, et al. Gardenia jasminoides Ellis inhibit white spot syndrome virus replication in red swamp crayfish Procambarus clarkii[J]. Aquaculture, 2019, 504: 239-247. DOI:10.1016/j.aquaculture.2019.02.008 |
| [13] |
WANG H, LIU W, YU F, et al. Identification of (-)-epigallocatechin-3-gallate as a potential agent for blocking infection by grass carp reovirus[J]. Archives of Virology, 2016, 161(4): 1053-1059. DOI:10.1007/s00705-016-2751-9 |
| [14] |
MICOL V, CATURLA N, PÉREZ-FONS L, et al. The olive leaf extract exhibits antiviral activity against viral haemorrhagic septicaemia rhabdovirus (VHSV)[J]. Antiviral Research, 2005, 66(2/3): 129-136. |
| [15] |
JÚNIOR O T, KUHN F, PADILHA P J M, et al. Survival of white spot syndrome virus-infected Litopenaeus vannamei fed with ethanol extract of Uncaria tomentosa[J]. Journal of the World Aquaculture Society, 2018, 49(1): 165-174. DOI:10.1111/jwas.12483 |
| [16] |
GHOLAMHOSSEINI A, KHEIRANDISH M R, SHIRY N, et al. Use of a methanolic olive leaf extract (Olea europaea) against white spot virus syndrome in Penaeus vannamei: comparing the biochemical, hematological and immunological changes[J]. Aquaculture, 2020, 528: 735556. DOI:10.1016/j.aquaculture.2020.735556 |
| [17] |
JIANG X, JIN W, ZHU F. Dietary Hizikia fusiforme enhance survival of white spot syndrome virus infected crayfish Procambarus clarkii[J]. Fish & Shellfish Immunology, 2020, 103: 88-94. |
| [18] |
LIU M, YU Q, XIAO H, et al. Antiviral activity of Illicium verum Hook.f.extracts against grouper iridovirus infection[J]. Journal of Fish Diseases, 2020, 43(5): 531-540. DOI:10.1111/jfd.13146 |
| [19] |
YU Q, LIU M, XIAO H, et al. The inhibitory activities and antiviral mechanism of Viola philippica aqueous extracts against grouper iridovirus infection in vitro and in vivo[J]. Journal of Fish Diseases, 2019, 42(6): 859-868. DOI:10.1111/jfd.12987 |
| [20] |
LIU M, YU Q, YI Y, et al. Antiviral activities of Lonicera japonica Thunb.components against grouper iridovirus in vitro and in vivo[J]. Aquaculture, 2020, 519: 734882. DOI:10.1016/j.aquaculture.2019.734882 |
| [21] |
SHARMA R, BHATTU M, TRIPATHI A, et al. Po- tential medicinal plants to combat viral infections: a way forward to environmental biotechnology[J]. Environmental Research, 2023, 227: 115725. DOI:10.1016/j.envres.2023.115725 |
| [22] |
YU Q, LIU M, WU S, et al. Specific aptamer-based probe for analyzing biomarker MCP entry into Singapore grouper iridovirus-infected host cells via clathrin-mediated endocytosis[J]. Frontiers in Microbiology, 2020, 11: 1206. DOI:10.3389/fmicb.2020.01206 |
| [23] |
LIAO W, HUANG L, HAN S, et al. Review of medicinal plants and active pharmaceutical ingredients against aquatic pathogenic viruses[J]. Viruses, 2022, 14(6): 1281. DOI:10.3390/v14061281 |
| [24] |
LIU M, YU Q, XIAO H, et al. The inhibitory activities and antiviral mechanism of medicinal plant ingredient quercetin against grouper iridovirus infection[J]. Frontiers in Microbiology, 2020, 11: 586331. DOI:10.3389/fmicb.2020.586331 |
| [25] |
LI M, LIU M, WEI H, et al. Antiviral activities of Glycyrrhiza uralensis components against Singapore grouper iridovirus[J]. Journal of the World Aquaculture Society, 2022, 53(4): 894-909. DOI:10.1111/jwas.12878 |
| [26] |
LIM J W, SEO J K, JUNG S J, et al. Efficacy of an optimized extract from licorice roots (Glycyrrhiza uralensis Fischer) against viral hemorrhagic septicemia virus in olive flounder (Paralichthys olivaceus)[J]. Aquaculture Research, 2021, 52(6): 2609-2621. DOI:10.1111/are.15108 |
| [27] |
ZHANG W, CHEN X, YU F, et al. α-lipoic acid exerts its antiviral effect against viral hemorrhagic septicemia virus (VHSV) by promoting upregulation of antiviral genes and suppressing VHSV-induced oxidative stress[J]. Virologica Sinica, 2021, 36(6): 1520-1531. DOI:10.1007/s12250-021-00440-5 |
| [28] |
CHEN X, HU Y, SHAN L, et al. Magnolol and honokiol from Magnolia officinalis enhanced antiviral immune responses against grass carp reovirus in Ctenopharyngodon idella kidney cells[J]. Fish & Shellfish Immunology, 2017, 63: 245-254. |
| [29] |
CHEN X, HAO K, YU X, et al. Magnolol protects Ctenopharyngodon idella kidney cells from apoptosis induced by grass carp reovirus[J]. Fish & Shellfish Immunology, 2018, 74: 426-435. |
| [30] |
JIANG H F, CHEN C, JIANG X Y, et al. Luteolin in Lonicera japonica inhibits the proliferation of white spot syndrome virus in the crayfish Procambarus clarkii[J]. Aquaculture, 2022, 550: 737852. DOI:10.1016/j.aquaculture.2021.737852 |
| [31] |
CHEN C, SHEN J L, WANG T, et al. Ophiopogon japonicus inhibits white spot syndrome virus proliferation in vivo and enhances immune response in Chinese mitten crab Eriocheir sinensis[J]. Fish & Shellfish Immunology, 2021, 119: 432-441. |
| [32] |
BOSON B, LEGROS V, ZHOU B, et al. The SARS-CoV-2 envelope and membrane proteins modulate maturation and retention of the spike protein, allowing assembly of virus-like particles[J]. The Journal of Biological Chemistry, 2021, 296: 100111. DOI:10.1074/jbc.RA120.016175 |
| [33] |
CHENG H Y, YANG C M, LIN T C, et al. Excoecarianin, isolated from Phyllanthus urinaria Linnea, inhibits herpes simplex virus type 2 infection through inactivation of viral particles[J]. Evidence-Based Complementary and Alternative Medicine, 2011, 2011: 259103. DOI:10.1093/ecam/nep157 |
| [34] |
HSIEH C F, CHEN Y L, LIN G H, et al. 3, 4-Dicaffeoylquinic acid from the medicinal plant ilex kaushue disrupts the interaction between the five-fold axis of enterovirus A-71 and the heparan sulfate receptor[J]. Journal of Virology, 2022, 96(7): e0054221. DOI:10.1128/jvi.00542-21 |
| [35] |
CHENG Y, LIU M, YU Q, et al. Effect of EGCG extracted from green tea against largemouth bass virus infection[J]. Viruses, 2023, 15(1): 151. DOI:10.3390/v15010151 |
| [36] |
SINGH P, CHAUHAN S S, PANDIT S, et al. The dual role of phytochemicals on SARS-CoV-2 inhibition by targeting host and viral proteins[J]. Journal of Traditional and Complementary Medicine, 2022, 12(1): 90-99. DOI:10.1016/j.jtcme.2021.09.001 |
| [37] |
BANDYOPADHYAY S, ABIODUN O A, OGBOO B C, et al. Polypharmacology of some medicinal plant metabolites against SARS-CoV-2 and host targets: molecular dynamics evaluation of NSP9 RNA binding protein[J]. Journal of Biomolecular Structure & Dynamics, 2022, 40(22): 11467-11483. |



