2. 自然资源部北部湾滨海湿地生态系统野外科学观测研究站, 广西北海 536015;
3. 广西壮族自治区海洋环境监测中心站, 广西北海 536000;
4. 广西建工建设投资集团有限公司, 广西南宁 530201
2. Observation and Research Station of Coastal Wetland Ecosystemin Beibu Gulf, Ministry of Natural Resources, Beihai, Guangxi, 536015, China;
3. Marine Environmental Monitoring Center of Guangxi, Beihai, Guangxi, 536000, China;
4. Guangxi Construction and Investment Group Co., Ltd., Nanning, Guangxi, 530201, China
珊瑚礁是地球上生物多样性极高的生态系统之一[1-3],全球海洋生物种类的25%-35%生活在其间[4, 5]。珊瑚礁及其礁栖生物共同构成的生态网络相当复杂,即使是独立的珊瑚礁,其生物多样性也可能变化较大,而珊瑚礁结构的复杂性正是造成变化的关键因素之一[6-8]。珊瑚礁结构多具洞穴和缝隙,占珊瑚礁总面积的75%,栖息其间的生物种类繁多,主要为无脊椎动物[9],它们体型较小,又被称为隐居动物(Cryptofauna),是珊瑚礁生物的重要组成部分[10],对生物多样性的贡献率甚至高达70%[11]。隐居动物拥有着不同的生活方式和营养功能,并在多种生物内部关系中相互影响,对珊瑚礁生态功能的发挥至关重要[12, 13]。珊瑚礁生物多样性的研究多聚焦于珊瑚礁结构表面的生物,如造礁石珊瑚、大型藻类、海绵、鱼类和其他一些肉眼可见的底栖生物,往往忽略了藏身于珊瑚礁石缝隙、裂隙之间以及珊瑚礁底质中的砾石、碎屑甚至其他底栖生物间隙中的隐居动物,造成相关研究较为缺乏,导致珊瑚礁生物多样性被严重低估[14]。在全球气候变化和人为干扰的情况下,珊瑚礁的面积逐渐减少,可能直接影响礁栖生物的种类变化,甚至增加某些种类灭绝的风险。在以往珊瑚礁生物多样性的研究中发现,软体动物是其中数量最多的门类[15-17],它们占据各种生态位,被视为指标群落[18, 19]。此外,软体动物的种类数量和生活习性还在一定程度上反映珊瑚礁的基质可利用情况,而基质类型是决定珊瑚分布和生长的重要因素之一[19]。因此,了解珊瑚礁中软体动物的组成和空间分布不仅有助于监测海洋中的人为干扰,还能用于快速评估珊瑚礁多样性和预测珊瑚礁退化。
珊瑚礁隐居动物通常个体较小且生活隐匿,采用常规调查方法很难将其充分采集。目前,隐居动物的采样方式主要是通过电化学取样和人工挖掘礁石等,很大程度上会对珊瑚礁造成破坏。因此,出于对珊瑚礁的保护和量化研究的开展,美国国家海洋和大气管理局(NOAA)珊瑚礁生态系统处(CRED)、海洋生物普查计划(CoML)和珊瑚礁生态系统普查及计划(CReefs)共同开发了自主珊瑚礁监测装置(Autonomous Reef Monitoring Structures, ARMS),用于评估和探明全球尺度下隐居生物的多样性、分布、丰度和群落结构。目前,已在比斯开湾、地中海、亚得里亚海、黑海、红海、加勒比海、印度尼西亚、美国大西洋海岸以及法属波利尼西亚等不同海域利用ARMS开展珊瑚礁生物多样性的评估工作[11, 20-22],为揭示珊瑚礁中被忽视但关键的组成成分提供了有效的帮助[11, 23]。与其他采样方法类似,利用ARMS也会产生物种多样性偏差和物种遗漏,但是ARMS能够系统地提供定量数据以便对不同的珊瑚礁区和采样站位之间进行比较[24]。
涠洲岛是广西海域最大的岛屿[25, 26],分布有珊瑚礁。20世纪80年代始,涠洲岛珊瑚礁的覆盖率逐渐降低,从高达80%下降至现在的10%左右[27, 28]。研究表明,珊瑚覆盖率的降低往往会影响其环境中软体动物群落的变化[19, 29]。在持续退化的珊瑚礁环境中,活珊瑚-死珊瑚-珊瑚碎屑这一变化过程会愈加频繁,从而促进隐居生物多样性的增加,因此对珊瑚礁的隐居生物进行研究和持续监测变得十分必要。目前,涠洲岛的珊瑚礁生物多样性研究多聚焦于造礁石珊瑚[28, 30-32]和鱼类[33],对隐居软体动物鲜有涉及[34]。因此,本研究首次采用ARMS研究和分析涠洲岛海域珊瑚礁隐居软体动物的种类及其多样性,以期增加了解和更准确地评估涠洲岛珊瑚礁区生物多样性。
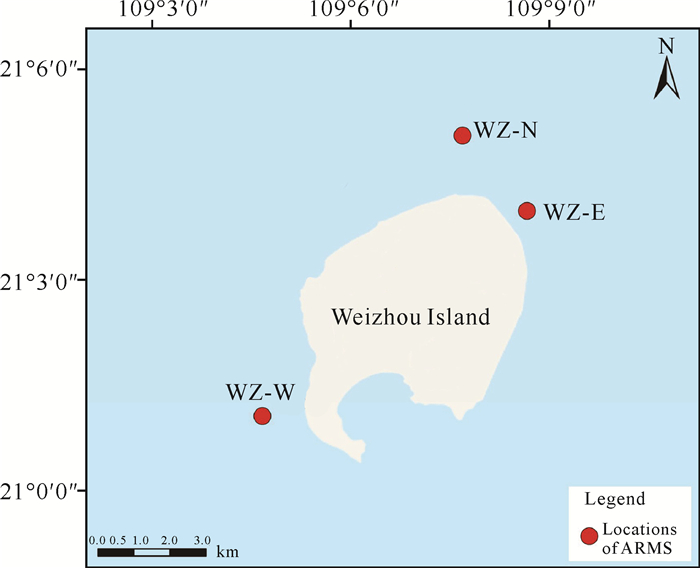
1 材料与方法 1.1 研究区域涠洲岛位于南海北部的北部湾内,是我国珊瑚礁分布的最北缘[35-37],也是华南大陆沿岸除雷州半岛徐闻珊瑚礁区外唯一能成礁的珊瑚分布区[38]。其所处的气候环境为亚热带季风性气候,在夏、秋两季经常遭受西南季风的影响,春、冬季则受北风的影响。因此,涠洲岛西南部和北部是受风浪影响较大的区域。另外,在涠洲岛东北部有一片覆盖度为20%-80%的牡丹珊瑚群落,十分具有研究价值。2017年5月至2020年5月,本研究分别在涠洲岛西南部、北部和东北部布设3个ARMS,编号分别为WZ-W、WZ-N和WZ-E。站位分布见图 1,站位经纬度、环境理化参数及附近珊瑚覆盖率见表 1。
|
| 图 1 涠洲岛珊瑚礁区ARMS布设站位 Fig.1 ARMS locations at coral reefs in Weizhou Island |
| 站位 Station |
经度 Longitude |
纬度 Latitude |
水深/m Depth/m |
温度/℃ Temperature/℃ |
盐度 Salinity |
pH值 pH value |
珊瑚覆盖率/% Coral coverage/% |
| WZ-W | 109°4′41.120 0″E | 21°1′02.200 0″N | 6.00 | 26.73 | 31.70 | 7.33 | 11.30 |
| WZ-N | 109°7′41.768 4″E | 21°4′58.958 4″N | 3.50 | 27.67 | 31.32 | 7.90 | 14.70 |
| WZ-E | 109°8′39.700 0″E | 21°3′55.370 0″N | 4.50 | 27.63 | 31.65 | 7.96 | 13.10 |
1.2 ARMS规格、回收和处理
本研究使用的ARMS由9块22.5 cm×22.5 cm的灰色PVC板叠放组合而成,空间高度为1.27 cm[22],底层由35.0 cm×45.0 cm的面板(带有两个开槽)固定。在水下放置时,使用斜拉筋将整个装置固定于礁石旁。ARMS堆叠交替的三维结构能很好地模仿珊瑚礁的复杂结构[39-41],可吸引珊瑚礁基质中的生物(包括移动的或固着的微型、小型和大型生物)[12, 23, 42]。
ARMS取回时,使用网目为106 μm的筛网包裹ARMS,防止ARMS上的非固着生物流失。取回的ARMS在实验室进行拆卸和样品收集。ARMS拆解后,将运动型生物轻刷入盛有过滤海水(0.2 μm滤膜过滤)的容器中,然后将附有固着生物的PVC板置于已做标记的托盘中,进行正反面拍照记录,接着用刮刀将固着生物刮取到容器中,最后将所有生物样品置于网目为106 μm的筛网中,用去离子水和95%乙醇溶液进行清洗后保存于含有95%乙醇溶液的样品瓶中[22, 43, 44],部分处理过程见图 2。生物样品中的空壳种类只做定性描述,不用于数据分析。

|
| 图 2 ARMS回收(a)、拆卸(b)和处理(c) Fig.2 ARMS retrieval (a), disassembly (b) and processing (c) |
参考《中国近海底栖动物分类体系》[45]对收集的隐居软体动物进行形态分类鉴定,除个别个体较小或者形态不完整的难以鉴定到属级外,其他的均鉴定到种或属一级。对于没能及时更新中文名的物种,保留其曾用名。样品的处理、鉴定、统计等参照《海洋调查规范第6部分:海洋生物调查》(GB 12763.6-2007)进行。所有鉴定的隐居生物种类均保留形态学特征照片,种类名录均通过World Register of Marine Species(WoRMS)网站(https://marinespecies.org/)进行核对。
1.3 数据分析利用多元统计分析软件PRIMER v6对涠洲岛珊瑚礁隐居软体动物进行多样性分析,采用的多样性指数包括香农-威纳(Shannon-Wiener)多样性指数(H′)、马格列夫(Margalef)丰富度指数(d)和皮洛(Pielou)均匀度指数(J′)。
Shannon-Wiener多样性指数:
| $H^{\prime}=-\sum\limits_{i=1}^S P_i \log _2 P_i。$ | (1) |
Margalef丰富度指数:
| $ d=(S-1) / \log _2 N。$ | (2) |
Pielou均匀度指数:
| $ J^{\prime}=H^{\prime} / \log _2 S。$ | (3) |
式中,S为样品中的种类总数,N为样品中种类的总个体数,Pi为第i种生物的个体数与样品中总个体数的比值。
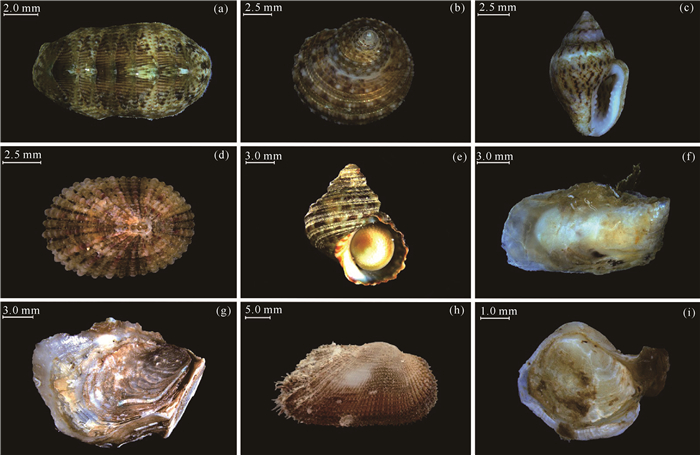
2 结果与分析 2.1 种类组成及其生态指数样品中共鉴定出软体动物53种,其中,定量样品35种,分别为多板纲(Polyplacophora)2科2属2种,腹足纲(Gastropoda)16科17属18种,双壳纲(Bivalvia)11科14属15种。本研究根据个体数量优势划分不同类群的优势种,部分优势种见图 3。多板纲的优势种为双刻鳞带石鳖(疑似种,Lepidozona cf.bisculpta),丰度为3.34 ind./m2,湿重生物量为0.186 g/m2;腹足纲的优势种为粗糙真蹄螺(Euchelus scaber)、瓦尼沟螺科(疑似种,Vanikoridae cf.und.)、杂色牙螺(Euplica scripta)、鼠眼孔(Diodora mus)和节蝾螺(Turbo bruneus),丰度分别为9.27、2.59、1.11、1.11和1.11 ind./m2,湿重生物量分别为0.870、0.009、0.210、0.152和1.530 g/m2;双壳纲的优势种为豆荚钳蛤(Isognomon legumen)、头巾牡蛎(Booneostrea subucula)、布纹蚶(Barbatia decussata)、膜石蛏属未定种(Leiosolenus sp.)和日本闭壳蛤(Petricola japonica),丰度分别为31.88、5.93、4.45、1.48和1.48 ind./m2,湿重生物量分别为3.616、3.015、11.024、0.017和0.057 g/m2。定性样品18种,分别为腹足纲9科11属15种和双壳纲2科2属3种。优势种为蕾丝蟹守螺(Cerithium dialeucum),其次为褶条马蹄螺(Trochus sacellum),个体数量分别为17个和5个。另外,本研究鉴定的所有种类中,共有29种软体动物的个体数量仅为1个,且个体大小普遍较小。本研究软体动物种类名录详见表 2。
|
| (a) Lepidozona cf. bisculpta (Suspected species); (b) Euchelus scaber; (c) Euplica scripta; (d) Diodora mus; (e) Turbo bruneus; (f) Isognomon legumen; (g) Booneostrea subucula; (h) Barbatia decussata; (i) Petricola japonica 图 3 涠洲岛珊瑚礁区ARMS中的优势种 Fig.3 Dominant species of ARMS in coral reef area of the Weizhou Island |
| 纲 Class |
目 Order |
科 Family |
属 Genus |
种 Species |
| Polyplacophora | Chitonida | Chitonidae | Chitonidae und. | |
| Ischnochitonidae | Lepidozona | Lepidozona cf. bisculpta(Carpenter in Pilsbry, 1892) | ||
| Gastropoda | Gastropoda und.* | |||
| Caenogastropoda | Cerithiidae | Cerithium | Cerithium dialeucum* (Philippi, 1849) | |
| Cerithiopsidae cf. | Cerithiopsidae cf.und.* | |||
| Epitoniidae | Epitonium | Epitonium cf.clementinum (Grateloup, 1940) |
||
| Triphoridae | Mastonia | Mastonia cf.clavate* (Pease, 1861) | ||
| Coriophora | Coriophora sp.* | |||
| Inella cf. | Inella cf.sp. | |||
| Littorinimorpha | Rissoinidae | Rissoina | Rissoina sp.1* | |
| Rissoina sp.2* | ||||
| Zebinidae | Zebina | Zebina cf.tridentata* (Michaud, 1830) | ||
| Stosicia | Stosicia annulate* (Dunker, 1860) | |||
| Vanikoridae cf. | Vanikoridae cf.und. | |||
| Eulimidae | Sticteulima | Sticteulima cf. Lentiginose(A.Adams, 1861) | ||
| Cypraeidae | Purpuradusta | Purpuradusta gracilis (Gaskoin, 1849) | ||
| Neogastropoda | Columbellidae | Euplica | Euplica scripta (Lamarck, 1822) | |
| Mitrella | Mitrella sp. | |||
| Nassariidae | Reticunassa | Reticunassa paupera(Gould, 1850) | ||
| Muricidae | Drupella | Drupella rugosa* (Born, 1778) | ||
| Ergalatax | Ergalatax contracta (Reeve, 1846) | |||
| Pisaniidae | Engina | Engina armillata (Reeve, 1846) | ||
| Lepetellida | Fissurellidae | Diodora | Diodora mus (Reeve, 1850) | |
| Trochida | Calliostomatidae | Calliostoma | Calliostoma spesa (J.-L.Zhang, P.Wei & S.-P.Zhang, 2018) | |
| Trochidae | Trochus | Trochus sacellum* (Philippi, 1851) | ||
| Clanculus | Clanculus sp.* | |||
| Clanculus bronni(Dunker, 1860) | ||||
| Clanculus margaritarius* (Philippi, 1846) | ||||
| Stomatolina | Stomatolina rubra(Lamarck, 1822) | |||
| Turbinidae | Turbo | Turbo bruneus (Röding, 1798) | ||
| Colloniidae | Collonista | Collonista granulosa(Pease, 1868) | ||
| Seguenziida | Chilodontaidae | Euchelus | Euchelus sp.* | |
| Euchelus scaber(Linnaeus, 1758) | ||||
| Unallocated order | Pyramidellidae | Babella | Babella sp. | |
| Boonea | Boonea sp.* | |||
| Bivalvia | Arcida | Arcidae | Arcidae und.* | |
| Lamarcka | Lamarcka avellana (Lamarck, 1819) | |||
| Barbatia | Barbatia decussata (G.B.Sowerby I, 1833) | |||
| Barbatia cruciate* (Philippi, 1849) | ||||
| Mytilida | Mytilidae | Leiosolenus | Leiosolenus sp. | |
| Ostreida | Ostreidae | Booneostrea | Booneostrea subucula(Jousseaume in Lamy, 1925) | |
| Isognomonidae | Isognomon | Isognomon legumen (Gmelin, 1791) | ||
| Pectinida | Plicatulidae | Plicatula | Plicatula cf.australis (Lamarck, 1819) | |
| Limida | Limidae | Lima | Lima vulgaris (Link, 1807) | |
| Limaria | Limaria fragilis (Gmelin, 1791) | |||
| Venerida | Chamidae | Chama | Chama dunkeri (Lischke, 1870) | |
| Veneridae | Gafrarium | Gafrarium dispar* (Holten, 1802) | ||
| Irus | Irus mitis (Deshayes, 1854) | |||
| Petricola | Petricola japonica(Dunker, 1882) | |||
| Galeommatida | Galeommatidae | Galeommatidae und. | ||
| Ephippodontina | Ephippodontina sp. | |||
| Lasaeidae | Kellia | Kellia cf. subrotunda(Dunker, 1882) | ||
| Adapedonta | Hiatellidae | Hiatella arctica(Linnaeus, 1767) | ||
| Notes: *means that there are no living samples of this species; lack of some taxonomic category because they are not updated synchronizely with WoRMS; the bolds are the firstly recorded species in Weizhou Island. | ||||
2.2 物种多样性
涠洲岛珊瑚礁隐居软体动物的Shannon-Wiener多样性指数为3.51,Margalef丰富度指数为9.59,Pielou均匀度指数为0.99。Shannon-Wiener多样性指数能够很好地描述底栖生物群落结构的变化,被认为可以较好地评价环境污染程度[46],本研究中,Shannon-Wiener多样性指数大于3,可认为调查海域整体环境清洁,无污染。
3 讨论 3.1 涠洲岛珊瑚礁软体动物研究现状及其影响因素本研究利用ARMS共收集到涠洲岛珊瑚礁区隐居软体动物53种,优势种为豆荚钳蛤、粗糙真蹄螺、头巾牡蛎和布纹蚶,大多数种类个体较小,为1.5-5.0 mm。研究显示,采用潜水调查的方法于2015年秋季在涠洲岛珊瑚礁区收集到软体动物55种,优势种为斑顶拟舌骨牡蛎(Hyotissa numisma)、粗衣蛤(Beguina semiorbiculata)、刺荔枝螺(Mancinella echinata)、马蹄螺(Trochus maculatus)、杂色牙螺、青蚶(Barbatia obliquata)、旗江珧(Atrina verxillum)、甲虫螺(Cantharus cecillei)[34];2018年春季收集到89种,优势种为杂色牙螺、蕾丝蟹守螺、珠母爱尔螺(Drupa margariticola)、刺荔枝螺、斑顶拟舌骨牡蛎、粗衣蛤[34];2021年秋季发现软体动物26种,优势种为阿文绶贝(Mauritia arabica asiatica)、马蹄螺和旗江珧(未发表数据);2022年秋季发现27种,优势种为粗衣蛤、阿文绶贝和旗江珧(未发表数据)。4次潜水调查的结果如表 3所示,可以明显看出,采样区域的大小是直接影响调查结果的重要因素,它与种类数量成正比关系。采样区域面积的增加会促进样品数量的增加,从而可能增加物种数量。另外,季节和人为因素也会对采样结果造成影响。根据海洋生物活动规律,秋季的水温和盐度更适合软体动物繁殖和幼体附着发育,生物丰度会更高,但是2015年秋季和2018年春季相同站位的调查结果则相反,春季的软体动物丰度和生物量明显高于秋季。主要因为2018年以前,涠洲岛旅游业和捕捞业发展迅猛,频繁的海上活动和过度捕捞对生态环境造成破坏;2018年出台相关保护政策后,涠洲岛的海洋生态环境得到了保护,生境逐步好转,生物得以迅速繁衍生息[34]。
| 年份 Year |
站位数量 Stations quantity |
样线长度/m Transect length/m |
采样面积/m2 Sampling area/m2 |
定性采样 Qualitative sampling |
种类数量 Species quantity |
| 2015 | 4 | 100 | 800 | Yes | 55 |
| 2018 | 6 | 100 | 1 200 | Yes | 89 |
| 2021 | 3 | 50 | 300 | No | 26 |
| 2022 | 3 | 50 | 300 | No | 27 |
| Note: Sampling area=Transect length×Width of both sides of the transect (2 m)×Stations quantity. | |||||
潜水调查均是采集珊瑚礁表面肉眼可见的软体动物,对于藏匿于礁石缝隙的隐居软体动物则无法获取。与之相反,本研究使用的ARMS旨在不破坏珊瑚礁的条件下收集礁石缝隙中的隐居生物。ARMS类似于人工礁体,能模仿天然礁石的功能,其内部既封闭又开放的结构能够很好地模拟珊瑚礁结构中复杂的环境,为海洋底栖生物提供新的栖息空间、避敌场所以及食物来源[47]。ARMS放入海中后,其表面会被海洋环境中的细菌黏附,形成细菌黏膜,细菌新陈代谢后进而形成细菌生物膜,生物膜能为附着生物的幼虫提供饵料来源,促进附着生物的附着[48]。初始附着的生物群落会吸引其上级食物链上的生物因捕食需求而在其周边栖息,促进群落演替,最终形成相对稳定的群落结构[47]。作为构筑物置于海底,ARMS会局部影响其周围的水流,这一改变可能会促进滤食性物种的定居。ARMS虽然可以作为新的栖息环境,但是其内部大小固定的结构可能会限制某些物种的附着[11]。因为软体动物自身多拥有坚硬的外壳,所以随着它们的生长发育,ARMS能够提供的生态位有限[12]。这也可能是本研究收集到的隐居软体动物种类多为小个体的原因之一。通过比较,本研究结果中有38种软体动物未曾在涠洲岛珊瑚礁区4次潜水调查结果中出现。首次记录的种类中,由于其体型较小,多数无法鉴定到具体种类,可能还处于生长发育的初期,分类特征不明显。这也很好地证明了ARMS在珊瑚礁调查中的可行性:ARMS能够吸引新生种类的栖息和附着,可有效补充珊瑚礁区软体动物的记录空白。
3.2 国内外利用ARMS对软体动物的研究现状及影响因素目前,ARMS方法在国内仅被应用在大亚湾珊瑚分布区海域底栖生物群落的研究中。该研究结果表明,使用ARMS连续4个季度共收集到软体动物64种[49](站位平均珊瑚覆盖率10.07%[50]),种类数量明显多于本研究结果,这可能与使用的ARMS的结构差异有关。本研究使用的ARMS是由9块22.5 cm×22.5 cm的PVC板间隔1.27 cm叠放组合而成,而大亚湾研究使用的ARMS则是由5块29.6 cm×29.6 cm的PVC板组合而成,面板和内部空间高度更大,充足的空间方便更多的生物聚集。另外,海洋环境和ARMS的浸没时间也可能会造成调查种类数量的差异。虽然两个海域布设站位的珊瑚平均覆盖度相近,但是大亚湾珊瑚分布区的底质环境主要为沙、沉积物和碎石,适合珊瑚生长的岩石覆盖率非常低[51],该环境的隐居生物种类往往更为丰富[52]。此外,大亚湾的ARMS布设时间为3个月,此时内部的生物群落处于演替早期,生物在不停地“定居”、适应和变换,加上生物自身的栖息和附着会随季节而改变,如冬季的低温可能会限制生物的生长和繁殖,不同季节的营养盐含量变化会影响生物的捕食,进而影响种类分布。而本研究中,涠洲岛珊瑚礁区底质环境以岩石为主,生物栖息空间结构简单,底栖生物丰富度可能会低于大亚湾,加上ARMS浸没时间较长(3年),内部生物群落结构相较于大亚湾稳定,种类更替变化不大。
在国际上,本研究结果的种类数量要多于比斯开湾和地中海等中纬度海域[20, 53]以及夏威夷岛海域[54],但较墨西哥湾[9]、红海[20, 43, 55]、加勒比海[42]和新加坡海域[56]等低纬度海域的种类数量要少,这很可能是受珊瑚礁的分布影响所致。研究表明,热带和亚热带地区的软体动物生物多样性明显高于高纬度地区,但其生物多样性的峰值出现在北半球的亚热带地区而不是赤道附近[57]。在热带浅海,如无珊瑚礁分布或者生物多样性较低,软体动物的种类和数量就大幅减少[58]。此外,局部环境因素也会影响软体动物的生物多样性,如港口附近放置的ARMS收集到的软体动物种类数比港口外多[43, 53],这可能是港口内ARMS周围的环境受到进出港船只和人类活动的频繁扰动,以及码头、防波堤、桩柱等人工设施上附着的软体动物为其提供幼虫来源[59]引起的。
3.3 利用ARMS对珊瑚礁隐居软体动物研究的必要性珊瑚礁隐居生物被广泛认为是珊瑚礁中生物多样性最丰富的类群,基本涵盖了所有后生动物门类,其体积小,种群生产力高,对环境变化反应迅速,因此,珊瑚礁隐居生物多样性的提高被认为是生态系统衰退的前兆[60, 61]。珊瑚礁框架(活珊瑚-死珊瑚-珊瑚碎屑)的演替侵蚀对隐居生物群落的丰度和多样性有很大的决定作用。这一情况可以用中度干扰假说来解释:在低干扰环境中,高覆盖率的造礁石珊瑚限制了隐居生物在其底部框架的缝隙中定居和栖息,而在珊瑚退化程度较高的地区,如珊瑚碎屑区,障碍的减少使得隐居生物群落的多样性得到提高[52, 60, 62]。这是因为在完整的珊瑚礁结构中,活珊瑚的刺细胞和其分泌的黏液能够对某些类群的生物造成伤害,但行动便捷且具有几丁质外壳的节肢动物则可抵御这种伤害,成为该环境下的主要栖息生物;而在坍塌的结构中,珊瑚防御机制的消失为某些类群提供了定居机会,加上环境不稳定性也有效限制了空间霸道竞争者行为[62]。另外,死亡珊瑚和碎石结构表面的高藻类生产力和碎屑沉积物也能为软体动物提供食物来源,使其多样性得到提高[62]。
珊瑚礁生物调查多数采用潜水调查方法,这种方法主要是针对珊瑚礁区中暴露的区域以及个体较大且活动较慢的底栖生物,虽然可以频繁进行,但是随着时间的累积,会对珊瑚礁造成慢性破坏[49]。而采用ARMS的研究则不同,虽然ARMS需要放置于海底一段时间,但是其不仅可以比较同时期不同海域的珊瑚礁生物数据,还能在不破坏成熟珊瑚礁的情况下收集在此处隐匿生活的生物。因此,采用ARMS对珊瑚礁区隐居动物进行研究,了解其群落结构变化过程,不仅能丰富礁栖生物种类数据,还能在一定程度上反映珊瑚礁生态系统的健康状况和退化程度,便于及时了解珊瑚礁的状况并采取相应的措施对珊瑚礁生态系统进行保护。
4 结论本研究使用ARMS对涠洲岛珊瑚礁隐居软体动物进行调查,共收集到53种软体动物,其中38种为首次记录。本研究表明ARMS适宜用于涠洲岛珊瑚礁隐居生物多样性的调查,丰富了珊瑚礁隐居软体动物调查数据。在后续工作中,可将ARMS与潜水调查方法相结合,对涠洲岛珊瑚礁区或其他海域的软体动物(或其他类群生物)进行持续的研究或监测,以便全面地掌握珊瑚礁区生物多样性。
| [1] |
许红, 史国宁, 廖宝林, 等. 中国海洋的珊瑚-珊瑚礁: 南海中央区珊瑚-珊瑚礁生物多样性特征[J]. 古地理学报, 2021, 23(4): 771-788. |
| [2] |
马丽丽, 殷建平, 吴跃伟, 等. 国际珊瑚礁领域研究现状及知识图谱分析[J]. 海洋科学, 2018, 42(11): 118-125. |
| [3] |
徐奎栋. 印太交汇区海洋生物多样性中心形成演化机制研究进展与展望[J]. 海洋与湖沼, 2021, 52(2): 262-273. |
| [4] |
REAKA-KUDLA M L. Biodiversity of Caribbean coral reefs[M]//MILOSLAVICH P, KLEIN E. Caribbean Marine Biodiversity. Lancaster, PA: Des Tech Publications, 2005.
|
| [5] |
吴瑞, 王道儒. 海南珊瑚礁生物多样性的保护现状与研究展望[J]. 海洋开发与管理, 2014, 31(1): 84-87. |
| [6] |
GRAHAM N A J. Habitat complexity: coral structural loss leads to fisheries declines[J]. Current Biology, 2014, 24(9): R359-R361. DOI:10.1016/j.cub.2014.03.069 |
| [7] |
WILSON S K, GRAHAM N A J, POLUNIN N V C. Appraisal of visual assessments of habitat complexity and benthic composition on coral reefs[J]. Marine Biology, 2007, 151(3): 1069-1076. DOI:10.1007/s00227-006-0538-3 |
| [8] |
GRAHAM N A J, NASH K L. The importance of structural complexity in coral reef ecosystems[J]. Coral Reefs, 2013, 32(2): 315-326. DOI:10.1007/s00338-012-0984-y |
| [9] |
PALOMINO-ALVAREZ L A, VITAL X G, CASTILLO-CUPUL R E, et al. Evaluation of the use of autonomous reef monitoring structures (ARMS) for describing the species diversity of two coral reefs in the Yucatan Peninsula, Mexico[J]. Diversity, 2021, 13(11): 579. DOI:10.3390/d13110579 |
| [10] |
DENNIS C, ALDHOUS P. Biodiversity: a tragedy with many players[J]. Nature, 2004, 430(6998): 396-398. DOI:10.1038/430396a |
| [11] |
PEARMAN J K, CHUST G, AYLAGAS E, et al. Pan-regional marine benthic cryptobiome biodiversity patterns revealed by metabarcoding Autonomous Reef Monitoring Structures[J]. Molecular Ecology, 2020, 29(24): 4882-4897. DOI:10.1111/mec.15692 |
| [12] |
CARVALHO S, AYLAGAS E, VILLALOBOS R, et al. Beyond the visual: using metabarcoding to characterize the hidden reef cryptobiome[J]. Proceedings of the Royal Society B: Biological Sciences, 2019, 286(1896): 20182697. DOI:10.1098/rspb.2018.2697 |
| [13] |
LERAY M, KNOWLTON N. Censusing marine eukar-yotic diversity in the twenty-first century[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2016, 371(1702): 20150331. DOI:10.1098/rstb.2015.0331 |
| [14] |
DUBINSKY Z, STAMBLER N. Coral reefs: an ecosystem in transition[M]. Dordrecht, The Netherlands: Springer, 2011.
|
| [15] |
BOUCHET P. The magnitude of marine biodiversity [M]//DUARTE C M. The exploration of marine biodiversity: scientific and technological challenges. Paris: Fundación BBVA, 2006.
|
| [16] |
STELLA J S, PRATCHETT M S, HUTCHINGS P A, et al. Coral-associated invertebrates: diversity, ecological importance and vulnerability to disturbance[J]. Oceanography and Marine Biology: An Annual Review, 2011, 49: 43-104. |
| [17] |
张均龙, 张树乾, 焦英毅. 印太交汇区海洋软体动物生物多样性研究进展[J]. 海洋与湖沼, 2021, 52(2): 487-497. |
| [18] |
WELLS F E. Marine molluscs of Milne Bay Province, Papua New Guinea[M]// WERNER T B, ALLEN G R. A rapid biodiversity assessment of the coral reefs of Milne Bay Province, Papua New Guinea. Washington, DC: Conservation International, 1998: 35-38.
|
| [19] |
ZUSCHIN M, HOHENEGGER J, STEININGER F. Molluscan assemblages on coral reefs and associated hard substrata in the northern Red Sea[J]. Coral Reefs, 2001, 20(2): 107-116. DOI:10.1007/s003380100140 |
| [20] |
DAVID R, UYARRA M C, CARVALHO S, et al. Lessons from photo analyses of Autonomous Reef Monitoring Structures as tools to detect (bio-) geographical, spatial, and environmental effects[J]. Marine Pollution Bulletin, 2019, 141: 420-429. DOI:10.1016/j.marpolbul.2019.02.066 |
| [21] |
RANSOME E, GELLER J B, TIMMERS M, et al. The importance of standardization for biodiversity comparisons: a case study using autonomous reef monitoring structures (ARMS) and metabarcoding to measure cryptic diversity on Mo'orea coral reefs, French Polynesia[J]. PLoS One, 2017, 12(4): e0175066. DOI:10.1371/journal.pone.0175066 |
| [22] |
LERAY M, KNOWLTON N. DNA barcoding and metabarcoding of standardized samples reveal patterns of marine benthic diversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(7): 2076-2081. |
| [23] |
PEARMAN J K, AYLAGAS E, VOOLSTRA C R, et al. Disentangling the complex microbial community of coral reefs using standardized Autonomous Reef Monitoring Structures (ARMS)[J]. Molecular Ecology, 2019, 28(15): 3496-3507. DOI:10.1111/mec.15167 |
| [24] |
PLAISANCE L, BRAINARD R, CALEY M J, et al. Using DNA barcoding and standardized sampling to compare geographic and habitat differentiation of crustaceans: a Hawaiian Islands example[J]. Diversity, 2011, 3(4): 581-591. DOI:10.3390/d3040581 |
| [25] |
张惠雅, 黄荣永, 余克服. 涠洲岛活珊瑚覆盖率变化的仿真分析[J]. 热带地理, 2019, 39(3): 329-336. |
| [26] |
梁文, 黎广钊, 张春华, 等. 20年来涠洲岛珊瑚礁物种多样性演变特征研究[J]. 海洋科学, 2010, 34(12): 78-87. |
| [27] |
YU W, WANG W, YU K, et al. Rapid decline of a relatively high latitude coral assemblage at Weizhou Island, northern South China Sea[J]. Biodiversity and Conservation, 2019, 28(14): 3925-3949. DOI:10.1007/s10531-019-01858-w |
| [28] |
杨振雄, 张敬怀, 吕向立, 等. 涠洲岛造礁石珊瑚群落变化特征及其环境影响因子[J]. 生态学报, 2021, 41(18): 7168-7179. |
| [29] |
MARTINEZ A S, MENDES L, LEITE T. Spatial distribution of epibenthic molluscs on a sandstone reef in the Northeast of Brazil[J]. Brazilian Journal of Biology, 2012, 72(2): 287-298. DOI:10.1590/S1519-69842012000200009 |
| [30] |
何精科, 黄振鹏. 广西涠洲岛珊瑚分布状况研究[J]. 海洋开发与管理, 2019, 36(1): 57-62. |
| [31] |
黄晖, 马斌儒, 练健生, 等. 广西涠洲岛海域珊瑚礁现状及其保护策略研究[J]. 热带地理, 2009, 29(4): 307-312, 318. |
| [32] |
梁文, 黎广钊. 涠洲岛珊瑚礁分布特征与环境保护的初步研究[J]. 环境科学研究, 2002, 15(6): 5-7, 16. |
| [33] |
邹琦, 吴志强, 黄亮亮, 等. 广西涠洲岛珊瑚礁海域鱼类物种组成的调查分析[J]. 南方农业学报, 2020, 51(1): 1-10. |
| [34] |
黄雯, 温铮, 胡利莎, 等. 北部湾涠洲岛珊瑚礁底栖贝类的群落特征[J]. 海洋学报, 2020, 42(6): 62-69. |
| [35] |
周浩郎, 王欣, 梁文. 涠洲岛珊瑚礁特点、演变及保护与修复对策的思考[J]. 广西科学院学报, 2020, 36(3): 228-236. |
| [36] |
周浩郎, 黎广钊. 涠洲岛珊瑚礁健康评估[J]. 广西科学院学报, 2014, 30(4): 238-247. |
| [37] |
周浩郎, 黎广钊, 梁文, 等. 涠洲岛珊瑚健康及其影响因子分析[J]. 广西科学, 2013, 20(3): 199-204. |
| [38] |
张乔民. 我国热带生物海岸的现状及生态系统的修复与重建[J]. 海洋与湖沼, 2001, 32(4): 454-464. |
| [39] |
DANOVARO R, CARUGATI L, BERZANO M, et al. Implementing and innovating marine monitoring approaches for assessing marine environmental status[J]. Frontiers in Marine Science, 2016, 3: 213. |
| [40] |
BRAINARD R E, ASHER J, BLYTH-SKYRME V, et al. Coral reef ecosystem monitoring report of the Mariana Archipelago: 2003-2007[R]. Honolulu: PIFSC Special Publication, 2012.
|
| [41] |
PLAISANCE L, CALEY M J, BRAINARD R E, et al. The diversity of coral reefs: what are we missing?[J]. PLoS One, 2011, 6(10): e25026. DOI:10.1371/journal.pone.0025026 |
| [42] |
ZIMMERMAN T L, MARTIN J W. Artificial reef matrix structures (ARMS): an inexpensive and effective method for collecting coral reef-associated invertebrates[J]. Gulf and Caribbean Research, 2004, 16(1): 59-64. |
| [43] |
PEARMAN J K, ANLAUF H, IRIGOIEN X, et al. Please mind the gap: visual census and cryptic biodiversity assessment at central Red Sea coral reefs[J]. Marine Environmental Research, 2016, 118: 20-30. DOI:10.1016/j.marenvres.2016.04.011 |
| [44] |
AL-RSHAIDAT M M D, SNIDER A, ROSEBRAUGH S, et al. Deep COI sequencing of standardized benthic samples unveils overlooked diversity of Jordanian coral reefs in the northern Red Sea[J]. Genome, 2016, 59(9): 724-737. |
| [45] |
李新正, 甘志彬. 中国近海底栖动物分类体系[M]. 北京: 科学出版社, 2022.
|
| [46] |
蔡立哲, 马丽, 高阳, 等. 海洋底栖动物多样性指数污染程度评价标准的分析[J]. 厦门大学学报(自然科学版), 2002, 41(5): 641-646. |
| [47] |
TOLEDO M-I, TORRES P, DÍAZ C, et al. Ecological succession of benthic organisms on niche-type artificial reefs[J]. Ecological Processes, 2020, 9(1): 38. |
| [48] |
王震. 青岛石雀滩海域不同材质人工鱼礁附着生物群落结构特征研究[D]. 上海: 上海海洋大学, 2019.
|
| [49] |
朱文涛. 大亚湾珊瑚礁生态系统结构与功能初步研究[D]. 上海: 上海海洋大学, 2020.
|
| [50] |
郭峰, 肖家光, 田鹏, 等. 大亚湾及大鹏半岛沿岸造礁石珊瑚现状与生态脆弱性评价[J]. 应用海洋学学报, 2022, 41(4): 568-582. |
| [51] |
刘建峰. 近40年来大亚湾珊瑚群落退化因素的研究[D]. 南宁: 广西大学, 2022.
|
| [52] |
ENOCHS I C, MANZELLO D P. Responses of cryptofaunal species richness and trophic potential to coral reef habitat degradation[J]. Diversity, 2012, 4(1): 94-104. |
| [53] |
GRAC NER A. Assessing fouling communities in the northern Adriatic through photo-analysis of Autonomous Reef Monitoring Structures (ARMS)[D]. Faro: Universidade do Algarve, 2022.
|
| [54] |
TIMMERS M A, JURY C P, VICENTE J, et al. Biodiversity of coral reef cryptobiota shuffles but does not decline under the combined stressors of ocean warming and acidification[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(39): e2103275118. |
| [55] |
PEARMAN J K, LERAY M, VILLALOBOS R, et al. Cross-shelf investigation of coral reef cryptic benthic organisms reveals diversity patterns of the hidden majority[J]. Scientific Reports, 2018, 8(1): 8090. |
| [56] |
CHANG J J M, IP Y C A, BAUMAN A G, et al. MinION-in-ARMS: nanopore sequencing to expedite barcoding of specimen-rich macrofaunal samples from Autonomous Reef Monitoring Structures[J]. Frontiers in Marine Science, 2020, 7: 448. |
| [57] |
CHAUDHARY C, SAEEDI H, COSTELLO M J. Bimodality of latitudinal gradients in marine species richness[J]. Trends in Ecology & Evolution, 2016, 31(9): 670-676. |
| [58] |
REX M A, CRAME J A, STUART C T, et al. Large-scale biogeographic patterns in marine mollusks: a confluence of history and productivity?[J]. Ecology, 2005, 86(9): 2288-2297. |
| [59] |
MARZINELLI E M. Artificial structures influence fouling on habitat-forming kelps[J]. Biofouling, 2012, 28(3): 339-349. |
| [60] |
WOLFE K, KENYON T M, DESBIENS A, et al. Hierarchical drivers of cryptic biodiversity on coral reefs[J]. Ecological Monographs, 2023, 93(3): e1586. |
| [61] |
廖馨, 周浩郎. 珊瑚礁隐居生物的研究现状和展望[J]. 广西科学, 2023, 30(5): 891-898. |
| [62] |
ENOCHS I C, MANZELLO D P. Species richness of motile cryptofauna across a gradient of reef framework erosion[J]. Coral Reefs, 2012, 31(3): 653-661. |



