2. 广西科学院, 广西海洋科学院(广西红树林研究中心), 广西红树林保护与利用重点实验室, 广西北海 536000;
3. 自然资源部北部湾滨海湿地生态系统野外科学观测研究站, 广西北海 536015
2. Guangxi Key Laboratory of Mangrove Conservationand Utilization, Guangxi Academy of Marine Sciences (Guangxi Mangrove Research Center), Guangxi Academy of Sciences, Beihai, Guangxi, 536000, China;
3. Observation and Research Stationof Coastal Wetland Ecosystemin Beibu Gulf, Ministryof Natural Resources, Beihai, Guangxi, 536015, China
海草属大型沉水被子植物,能在海水中完成整个生活史过程[1]。全球海草有70余种,隶属6科13属[2]。以海草植物构成的海草床为海洋生物提供了重要的食物来源和栖息场所,且在生物多样性维持、水质净化和气候调节等方面有着重要的生态功能[3]。海草床生态系统是最具生产力的生态系统之一,据估计其平均初级生产量可达1 012 g/m2[4],同时它也是滨海生态系统的重要组成部分,对海陆交错带的物质循环起重要作用[5]。但由于人类活动和全球气候变化,目前全球海草床正在快速退化[6, 7]。据资料显示,全球范围内有10个海草物种的灭绝风险持续上升,贝克喜盐草(Halophila beccarii)就是其中一种[7]。据世界自然保护联盟(International Union for Conservation of Nature,IUCN)评估,贝克喜盐草在全球分布的面积不超过200 000 hm2,且处于加速衰退的状态,被IUCN列为全球范围内的易危(Vulnerable,VU)种[7]。贝克喜盐草隶属水鳖科(Hydrocharitaceae)喜盐草属(Halophila),是形态最小的海草之一,喜好泥质或泥沙质的潮间带生境[8]。由于贝克喜盐草生长快、种群更新速率快、形态矮小且容易被滩涂上的沉积物覆盖,贝克喜盐草及其重要生态功能常被人们忽视[8, 9]。
叶片是植物光合固碳的重要场所,也是植物与外界接触面积最大、对环境变化最敏感的器官[10]。叶片是连接植物与外界环境的纽带,其形态变化既能客观地反映植物自身的生理过程及其对外界环境适应策略的差异,又能有效地将植物个体与环境、生态系统功能和过程紧密联系起来11, 12]。植物叶片形态在一定程度上可反映叶片捕获光的能力,同时也体现了植物在不同环境下的资源获取能力和对不同环境的适应特征[10]。Munns等[13]研究发现,在适宜盐度条件下植物叶片可以更好地吸收水体中的养分,促进叶片的延伸和拓展,而盐度过高时植物叶片会将光合作用产物用于合成保卫组织或增加叶肉细胞密度,导致叶片粗而短,从而抵御或适应高盐环境。Fakhrulddi等[14]研究表明,在盐度20-25的条件下,贝克喜盐草的叶长、叶宽、叶柄长达到最大,而盐度45条件下的叶片则比盐度5-30时的更短、更窄。此外,Fernández-torquemada等[15]研究发现,随着盐度的增加,大洋波喜荡草(Posidonia oceanica)的叶片数和最大叶长显著下降。Collier等[16]对卵叶喜盐草(H.ovalis)和单脉二药草(Halodule uninervis)的研究发现,在亚致死盐度时,直立茎密度的增幅最大。植物在面临环境变化时,可通过改变原有的资源分配策略,将更多的资源分配至能有效获取资源的地上或地下器官中,从而使植物往降低环境不利影响的方向上生长[17]。因此,研究贝克喜盐草对盐度的适应策略,对深入理解贝克喜盐草在不同环境条件下的资源获取或分配策略具有重要意义。
贝克喜盐草主要分布在潮间带,海域河口的数量和流量、降雨等环境因素的不同造成不同海域的海水盐度存在较大差异[18]。贝克喜盐草具有比较广泛的耐盐性(盐度0-45),一般生长在盐度0-37的自然环境中[19-21]。邱广龙等[9]将广西珍珠湾、海南东寨港的贝克喜盐草与其他国外文献研究的贝克喜盐草进行对比,发现贝克喜盐草为了适应不同水体盐度,不同环境下的种群覆盖度、密度、面积、土壤种子库等均有所差异。另外,Jiang等[18]对广东沿海贝克喜盐草海草床的研究发现,不同海域海水盐度存在较大差异,海草的直立茎密度、叶长、叶宽以及生物量等也均存在较大差异。目前,由于全球尺度上关于贝克喜盐草与盐度关系的相关研究资料较为稀缺,严重阻碍了人们对贝克喜盐草种群盐度适应机制的了解[22, 23]。因此,为探究贝克喜盐草叶和茎的形态对不同盐度的适应特征,本研究以贝克喜盐草为对象,根据野外贝克喜盐草自然生境的盐度范围,选取了4组盐度(盐度0、10、20和30),于可控的室内生态水槽内开展不同盐度处理对贝克喜盐草生长的影响实验,探讨不同盐度下贝克喜盐草叶长、叶宽、叶柄长、直立茎密度和生长端密度的差异,以及不同盐度下贝克喜盐草叶长、叶宽、叶柄长分别与直立茎密度、生长端密度的关系,从而揭示贝克喜盐草对盐度的适应策略,为贝克喜盐草的保护、管理以及海草床修复提供科学依据。
1 材料与方法 1.1 材料与设备实验材料采集于广西壮族自治区钦州市钦南区沙井岛西侧(109°69′17.29″E,21°70′13.59″N),该海草床位于茅尾海红树林外缘,因有钦江淡水资源不断注入,使得该海草床内海水盐度常年维持在10±2范围内。本研究于2022年10月27日在海草床内采集长势均一的海草连同深度10 cm左右的沉积物一起移入海草培养托(培养托长40 cm、宽17 cm、高15 cm)内,随后运回实验室进行培养。
本实验在广西北海市广西科学院广西海洋科学院(广西红树林研究中心)海草实验室的海水循环培养系统内进行。该培养系统有光照控制系统、温度控制系统及海水循环装置,在实验过程中可保持温度、pH值、光照、水流速度等培养条件基本一致。该培养系统可设置4组不同条件的处理,每组处理有3个重复(1个重复为1个种植水槽),每一组用20 W的水泵分别与1个储水池连接起来,储水池和种植水槽内的海水为人工配置的海水。将野外运回来的草块连同海草培养托一起放入种植水槽内,每个种植水槽放入4个海草培养托,每组共计12个培养托。
1.2 方法将海草培养托放入种植水槽进行5个月(2022年10月27日至2023年3月27日)的适应性培养,此时系统内的海水盐度设置为10(软体珊瑚盐∶自来水=4.55 kg∶450 L),使其尽可能接近采集地的海水盐度(盐度10±2)。用长76 cm、功率为25 W的LED植物生长灯于每日6:00-18:00(昼夜比为12 h∶12 h)时为海草生长提供光照,整个实验期间温度保持在贝克喜盐草的最适生长温度(25±0.5) ℃[24]。
适应性培养结束后进行不同盐度处理,处理的盐度设置为0(S1)、10(CK)、20(S2)和30(S3)4个水平,每个水平3个重复,各盐度误差控制在±2以内。其中,CK不做其他处理;S1则将储水桶、种植水槽内的海水排净后不断注入自来水并排出,直至储水桶、种植水槽内的海水与自来水盐度保持一致;S2和S3则是在原先盐度的基础上等比例加入适量的海盐(软体珊瑚盐)使两者分别保持为盐度20和30。培养期间,每3天检查种植水槽内海水盐度和水位的变化并及时补充淡水以维持盐度的稳定。待系统内海水盐度基本稳定后,于2023年3月30日进行正式的盐度处理实验,盐度处理实验时长3个月,总实验时长约8个月。
1.3 样品采集与测定2023年3月27日于适应性培养结束后进行一次本底值的测定。在每个处理组内随机挑选一个海草培养托,用直径为7 cm的圆柱形采样器进行采样,每个海草培养托采集6个带沉积物(深度10 cm左右)的样品,每个样品用50目筛网进行筛洗,将沉积物和海草分开,随后将海草样品放入已标记好的且带有唯一编号的密封袋内。由于贝克喜盐草属于小型海草,具有生长速度快、种群周转速率快、种群时空差异大等特点,特别是一年生的贝克喜盐草种群(可在8个月内完成整个生活史周期),一年中不同月份的植物种群外貌有很大的变化[23]。因此,自2023年3月30日系统内的海水盐度稳定后,每月(4月30日、5月30日和6月30日)在不同盐度下重复上述样品的采集、清洗和分装工作。
选取能够反映茎变化的直立茎密度和生长端密度进行测定。生长端是指海草根状茎具有生长点、且在适宜环境下生长点能够一直向前生长的一端,而生长端密度是指单位面积内生长端的数量[25]。将洗净后的海草样品的地上部分和地下部分分开,并对每个样品的直立茎和生长端数量进行计数,用于统计单位面积内贝克喜盐草的直立茎密度和生长端密度。另外,再测定与植物的生长发育密切相关的叶片形态特征如叶长、叶宽和叶柄长等。从每个样品中随机挑选30片成熟的、连同叶柄的叶片平铺于方格纸上(精度为1 mm),用数码相机(型号:IM015,日本奥林巴斯公司)垂直于方格纸进行俯拍,然后用AutoCAD 2020测量叶片的叶长、叶宽和叶柄长。直立茎密度和生长端密度计算公式如下:
| $ 直立茎密度 (\mathrm{SD})= 直立茎个数 / 采样面积 \left(\mathrm{m}^2\right), $ | (1) |
| $ 生长端密度 (\mathrm{MD})= 生长端个数/采样面积 \\ \left(\mathrm{m}^2\right) 。$ | (2) |
在数据处理前,首先对各指标数据进行Shapiro-Wilk函数正态分布检验,对不满足正态分布的数据进行对数转化。统计分析与绘图均在R 4.3.1软件(The R Development Core Team, 2023)的ggplot2程序包中完成。
1.4.1 不同盐度下贝克喜盐草叶、茎指标的比较采用单因素方差分析(One-way ANOVA)不同盐度下贝克喜盐草生长指标(叶长、叶宽、叶柄长、直立茎密度和生长端密度)的差异性,当贝克喜盐草生长指标在不同盐度上呈现显著性差异时,即P < 0.05,再运用Tukey-Kramer HSD test进行多重比较。
1.4.2 不同盐度下贝克喜盐草叶、茎的线性回归模型采用线性回归模型探索贝克喜盐草叶片形态特征(叶长、叶宽和叶柄长)与生长特征(直立茎密度和生长端密度)的相关性,即分别以贝克喜盐草叶长、叶宽和叶柄长为自变量,以直立茎密度和生长端密度为因变量进行回归分析。根据R和P值判断贝克喜盐草叶片形态特征与生长特征的回归关系。其中,R是反映回归模型中两个变量间相关程度的系数,其取值范围为[-1, 1]。当R>0时,表明两变量之间呈正相关;当R<0时,表明两变量之间呈负相关,且R的绝对值越接近1说明两变量之间的相关性越强。P值即概率,用来判定假设检验结果,P < 0.05时表示两者间的差异达到显著水平,P值越小表明两者间的差异越显著。
1.4.3 不同盐度下贝克喜盐草叶、茎的主成分分析采用主成分分析(PCA)探讨不同盐度对贝克喜盐草生长状况的影响,进一步探讨不同盐度下贝克喜盐草对叶片和生长特征的投资策略。
2 结果与分析 2.1 不同盐度下贝克喜盐草叶、茎的比较不同盐度处理下贝克喜盐草的叶长、叶宽和叶柄长均在S2处理组具有最大平均值,分别为10.69、2.24和13.61 mm [图 1:(a)、(b)和(c)]。其中,叶长和叶宽表现出相同的变化规律,即S2>S1>CK>S3,而叶柄长则表现为S2>CK>S3>S1。不同盐度处理下贝克喜盐草的生长端密度表现为CK>S2>S1>S3,直立茎密度表现为CK>S1>S2>S3 [图 1:(d)和(e)]。总体来说,盐度为S2时贝克喜盐草具有最大的叶长、叶宽和叶柄长,而在CK处理组具有最大的生长端密度和直立茎密度,且随着盐度的升高或降低,贝克喜盐草的生长端密度和直立茎密度均呈下降趋势。
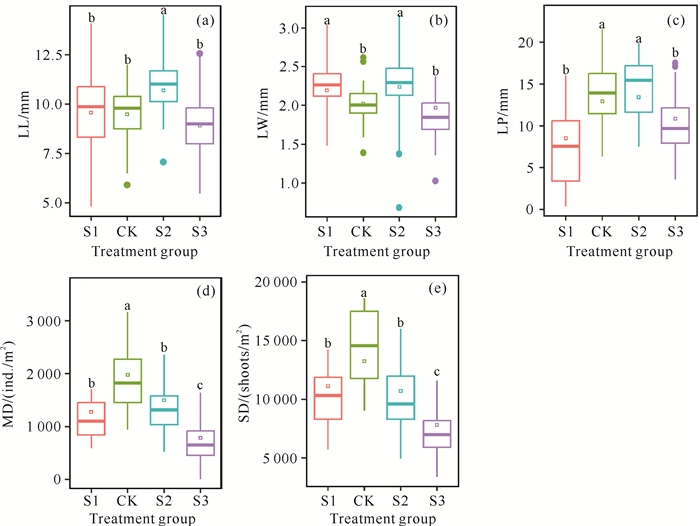
|
| LL, leaf length; LW, leaf width; LP, leaf petiole length; MD, meristems density; SD, shoot density.Different letters indicate significant differences among different salinity groups (P < 0.05). 图 1 不同盐度对贝克喜盐草生长指标的影响 Fig.1 Effect of different salinities on the growth indices of Halophila beccarii |
2.2 不同盐度下贝克喜盐草叶与茎的关系
不同盐度处理下贝克喜盐草叶片形态特征与生长端、直立茎密度的关系有较大差异(图 2)。其中,S1处理组贝克喜盐草的叶长、叶柄长分别与直立茎密度、生长端密度呈显著负相关[P < 0.05,图 2:(a)、(c)、(d)和(f)]。CK处理组贝克喜盐草的叶宽、叶柄长分别与生长端密度呈显著正相关[P < 0.05,图 2:(e)和(f)]。在S2处理组贝克喜盐草的叶长与直立茎密度呈显著正相关[P < 0.05,图 2(a)]。在S3处理组贝克喜盐草的叶长与生长端密度呈显著负相关[P < 0.05,图 2(d)],叶柄长分别与直立茎密度、生长端密度呈显著负相关[P < 0.05,图 2:(c)和(f)]。
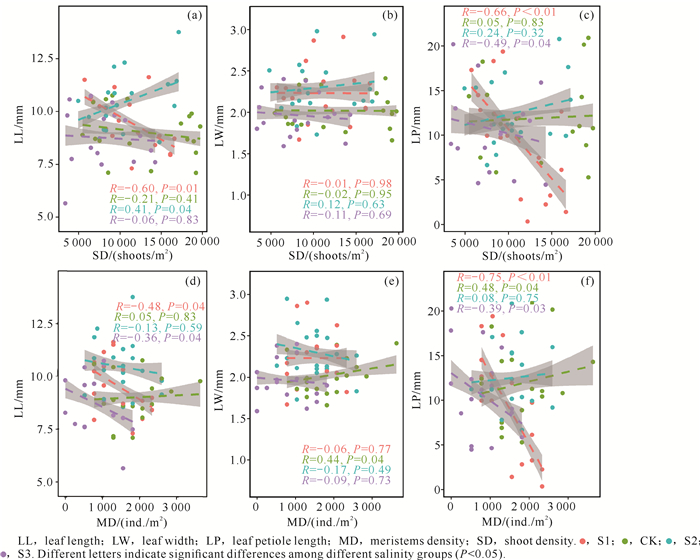
|
| 图 2 不同盐度下贝克喜盐草叶片和生长指标的关系 Fig.2 Relationship between leaf and growth indices of H.beccarii under different salinities |
2.3 不同盐度下贝克喜盐草叶、茎的主成分分析
主成分分析结果表明,CK处理组贝克喜盐草主要侧重于对生长端密度和直立茎密度的投资;而S2处理组贝克喜盐草主要侧重于对叶片的投资,在该盐度条件下更有利于贝克喜盐草叶片、叶柄的生长和延伸[图 3(a)]。前2个PCA轴的累计解释方差的比例为69.1%[第1、2轴的累计解释方差的比例分别为36.7%和32.4%,图 3(b)]。其中,CK处理组贝克喜盐草的生长端密度和直立茎密度对前两个主成分贡献最高,而S2处理组贝克喜盐草的叶长、叶宽和叶柄长对前两个主成分贡献最高。
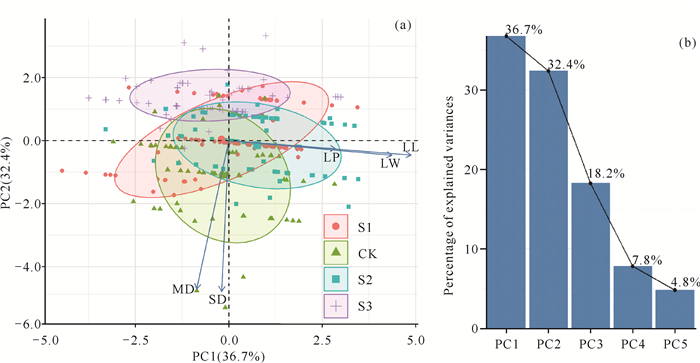
|
| 图 3 贝克喜盐草叶性状的主成分分析 Fig.3 Principal component analysis of leaf traits of H.beccarii |
3 讨论 3.1 不同盐度对贝克喜盐草叶、茎指标的影响
盐度是影响植物存活、生长和分布的关键生态因子之一,盐度的改变会影响植物重要的生理过程,进而影响植物的新陈代谢、生长、发育和繁殖。由于不同的植物具有不同的耐盐机制,当植物受到盐胁迫的时候,其耐盐因子以不同的变化规律进行响应。另外,植物耐盐有一定的阈值,在这个范围内植物可以正常生长发育,当盐度超过阈值时,植物的生长发育就会受到影响,甚至对植物产生伤害[26],并会引起植物有机体在功能水平上产生变化,即发生胁迫[27],而植物在盐度胁迫时最明显的变化就是生长会受到抑制[28]。一般来说,盐度较高时植物吸收土壤中的水分受阻,会降低植物体内的含水量,导致植物生长减缓[29]。植物通过气孔进行蒸腾作用和气体交换,在盐生环境中,叶片的气孔密度减少,蒸腾作用减弱,而小叶具有较大的主脉密度和较高的水力导度,因此叶面积减小是植物降低叶片蒸腾作用从而减少水分流失的常用手段,是植物的一种自我保护机制[30]。贝克喜盐草可以生存的盐度范围较广,在盐度为0-45的环境中均可存活,但是当盐度偏低或偏高时,其植物形态更小[8]。本研究发现,盐度为0-20时,贝克喜盐草的叶长、叶宽和叶柄长随盐度的增加整体上呈明显的上升趋势,并在盐度20时达到最大值;盐度为20-30时,贝克喜盐草的叶长、叶宽和叶柄长随盐度的增加呈下降趋势,这与Azad等[31]对孟加拉国孙德尔本斯地区海莲(Bruguiera sexangula)的盐度胁迫研究结果一致。
叶片大小可以在很多方面影响植物的生理过程。基于同一地区或种群中多个物种的研究指出,大叶具有较高的光获取效率[32-34]。叶面积增大,出叶强度(Leafing intensity)降低[35],叶片在空间上排列分散,即单位枝条上叶数较少[32, 36],因此叶片间遮蔽程度(Self-shading)较低,光获取面积较大[37]。同时大叶通常具有较长的叶柄,与小叶相比,大叶为保证水分供应和养分运输,其脉管和厚壁细胞会增多,也需要更长的叶柄以减少叶片间的自荫作用,因此大叶需要分配更多的干物质用于支撑结构[38-40]。
Collier等[16]研究表明,在低盐度下,具有耐盐性的海草会表现出类似于胁迫诱导形态反应(SIMR)的反应,最适盐度和SIMR盐度之间的“次优过渡区”是一个直立茎密度变化较小的区域,而在高于最适盐度和低于SIMR盐度条件下,都出现了直立茎增殖;受SIMR影响时,有性繁殖非常少,这与开花减少相对应,表明资源从有性生殖转移到支持侧枝生长。本实验结果表明,直立茎密度随着盐度的增加呈先增加后降低的趋势,盐度为20时,贝克喜盐草主要侧重于对叶片的投资;盐度为0和10时的直立茎密度均高于盐度20处理组,与之前的研究相符[16]。另外,在高盐条件下较高的呼吸需求可能引发盐度与温度的协同效应。随着盐度的增加,海草的呼吸作用加强,光合效率减弱,但当温度提高时,海草的最大生长量也得到了提高[41]。
3.2 不同盐度下贝克喜盐草叶与茎的关系本研究发现,在盐度10和20的条件下,叶片形态参数与生长端密度或直立茎密度总体呈正相关关系;而在淡水(盐度0)或相对较高盐度下(盐度30),叶片形态参数与生长端密度或直立茎密度总体呈负相关关系。该结果可能为以下原因导致:(1)盐度10和20的条件下更有利于贝克喜盐草根、茎、叶的生长。尽管国内贝克喜盐草分布区域的盐度范围较大(一般为3-31)[19, 42, 43],但是本研究所用钦州市钦南区沙井的贝克喜盐草种群长期生长于10左右的海水盐度中,贝克喜盐草的形态、生理以及结构特征已经适应了该海域的盐度条件,在与海草采集地盐度接近的室内环境,贝克喜盐草更容易适应,能够更有效地吸收水分来提高利用率。另外,本研究结果显示,在盐度20条件下贝克喜盐草的叶长、叶宽、叶柄长最大,这表明在室内环境下适合贝克喜盐草生长的盐度在20左右。(2)叶芽的发育与叶片的形成都需要营养物质,生长端密度越大,枝条分枝的数量越多,叶片的数量也越多,能够分配给每片叶子的水分和营养物质就越少,而受水分和养分限制,叶片的长度变短、宽度变小[44]。韩秋影等[45]研究表明盐度的变化会影响光合作用和呼吸作用,盐度增加会影响非结构性碳水化合物的合成,使海草体内叶绿素含量下降和酶活性降低。另外,Murphy等[46]研究也表明在高盐度下川蔓草(Ruppia maritima)的蔗糖合成减少,蔗糖磷酸合成酶活性显著降低,从而导致供给叶片的营养物质减少,这与叶长、叶宽、叶柄长、生长端密度呈负相关的结果相符。
4 结论本研究对贝克喜盐草生长状况与盐度的关系进行研究,分析不同盐度下贝克喜盐草叶片形态、生长端密度和直立茎密度的差异,以及叶片形态与生长端密度、直立茎密度的关系。结果表明,贝克喜盐草具有较广的耐盐性,但盐度为20时贝克喜盐草具有最大的叶长、叶宽、叶柄长,而盐度为10时有利于贝克喜盐草生长端和直立茎的生长。在中等盐度(盐度10和20)下,叶片形态参数与生长端密度或直立茎密度总体呈正相关关系;而在淡水(盐度0)或相对较高的盐度(盐度30)下,叶片形态参数与生长端密度或直立茎密度总体呈负相关关系。本研究成果深化了对贝克喜盐草在不同盐度下的形态响应特征的认识,为科学地解析濒危海草贝克喜盐草的生态适应性特征提供了重要的理论依据。
| [1] |
ALI ABOUD S, KANNAH J F. Abundance, distribution and diversity of seagrass species in lagoonal reefs on the Kenyan coast[J]. American Scientific Research Journal for Engineering, Technology, and Sciences (ASRJETS), 2017, 37(1): 52-67. |
| [2] |
SHORT F, CARRUTHERS T, DENNISON W, et al. Global seagrass distribution and diversity: a bioregional model[J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1/2): 3-20. |
| [3] |
UNSWORTH R K F, NORDLUND L M, CULLENU-NSWORTH L C. Seagrass meadows support global fisheries production[J]. Conservation Letters, 2019, 12(1): e12566. DOI:10.1111/conl.12566 |
| [4] |
DUARTE C M, CHISCANO C L. Seagrass biomass and production: a reassessment[J]. Aquatic Botany, 1999, 65(1/2/3/4): 159-174. |
| [5] |
SHORT F T, COLES R, WAYCOTT M, et al. The IUCN red list of threatened species: Halophila beccarii. [Z/OL]. [2024-07-30]. https://www.iucnredlist.org/species/173342/6995080.
|
| [6] |
WAYCOTT M, DUARTE C M, CARRUTHERS T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381. |
| [7] |
SHORT F T, POLIDORO B, LIVINGSTONE S R, et al. Extinction risk assessment of the world's seagrass species[J]. Biological Conservation, 2011, 144(7): 1961-1971. DOI:10.1016/j.biocon.2011.04.010 |
| [8] |
邱广龙, 苏治南, 范航清, 等. 贝克喜盐草的生物学和生态学特征及其保护对策[J]. 海洋环境科学, 2020, 39(1): 121-126. |
| [9] |
邱广龙, 苏治南, 钟才荣, 等. 濒危海草贝克喜盐草在海南东寨港的分布及其群落基本特征[J]. 广西植物, 2016, 36(7): 882-889. |
| [10] |
WRIGHT I J, REICH P B, WESTOBY M, et al. The worldwide leaf economics spectrum[J]. Nature, 2004, 428(6985): 821-827. DOI:10.1038/nature02403 |
| [11] |
ACKERLY D D, KNIGHT C A, WEISS S B, et al. Leaf size, specific leaf area and microhabitat distribution of chaparral woody plants: contrasting patterns in species level and community level analyses[J]. Oecologia, 2002, 130(3): 449-457. DOI:10.1007/s004420100805 |
| [12] |
唐青青, 黄永涛, 丁易, 等. 亚热带常绿落叶阔叶混交林植物功能性状的种间和种内变异[J]. 生物多样性, 2016, 24(3): 262-270. |
| [13] |
MUNNS R, TESTER M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008, 59: 651-681. DOI:10.1146/annurev.arplant.59.032607.092911 |
| [14] |
FAKHRULDDI I M, SIDIK B J, HARAH Z M. Halophila beccarii Aschers (Hydrocharitaceae) responses to different salinity gradient[J]. Journal of Fisheries and Aquatic Science, 2013, 8(3): 462-471. DOI:10.3923/jfas.2013.462.471 |
| [15] |
FERNÁNDEZ-TORQUEMADA Y, SÁNCHEZ-LIZ- ASO J L. Effects of salinity on seed germination and early seedling growth of the Mediterranean seagrass Posidonia oceanica (L.) Delile[J]. Estuarine, Coastal and Shelf Science, 2013, 119: 64-70. DOI:10.1016/j.ecss.2012.12.013 |
| [16] |
COLLIER C J, VILLACORTA-RATH C, VAN DIJK K J, et al. Seagrass proliferation precedes mortality during hypo-salinity events: a stress-induced morphometric response[J]. PLoS One, 2014, 9(4): e94014. DOI:10.1371/journal.pone.0094014 |
| [17] |
POORTER H, NIKLAS K J, REICH P B, et al. Biomass allocation to leaves, stems and roots: meta-analyses of interspecific variation and environmental control[J]. The New Phytologist, 2012, 193(1): 30-50. DOI:10.1111/j.1469-8137.2011.03952.x |
| [18] |
JIANG K, XU N N, TSANG P K E, et al. Genetic variation in populations of the threatened seagrass Halophila beccarii (Hydrocharitaceae)[J]. Biochemical Systematics and Ecology, 2014, 53: 29-35. DOI:10.1016/j.bse.2013.12.004 |
| [19] |
郭晋宇, 耿晓晓, 尹雷, 等. 海南儋州湾贝克喜盐草资源分布特征及影响因素分析[J]. 海洋湖沼通报, 2023, 45(2): 123-132. |
| [20] |
吴钟解, 陈石泉, 蔡泽富, 等. 海南岛海草床分布变化及恢复建议[J]. 海洋环境科学, 2021, 40(4): 542-549. |
| [21] |
盘远方, 苏治南, 邱思婷, 等. 华南沿海贝克喜盐草种子库与有性繁殖的时空格局及其关系[J/OL]. 广西植物, 2024: 1-11[2024-07-31]. https://kns.cnki.net/kcms2/article/abstract?v=WnCf0VAm38rQVDGOvJM vq3F7mAL8dCi222_XDs6Zh00XuF5PF4kh_5pXwuKr2 zgjevOIUlBR-HLHzroeAWnIu3tGg-chcU_819H1YRH BoQPjvu8mhWXIAxqE6TuWJRCqkTqMphMNIYBbia Vc4AODKP9oxsBw6yo5LA_WqJq36pK7j639NQnSG Yi3B9cXZfnB&uniplatform=NZKPT&language= CHS.
|
| [22] |
PARTHASARATHY N, RAVIKUMAR K, RAMAM- URTHY K. Floral biology and ecology of Halophila beccarii Aschers.(Hydrocharitaceae)[J]. Aquatic Botany, 1988, 31(1/2): 141-151. |
| [23] |
ZAKARIA M H, BUJANG J S, ARSHAD A B. Flowering, fruiting and seedling of annual Halophila beccarii Aschers in Peninsular Malaysia[J]. Bulletin of Marine Science, 2002, 71(3): 1199-1205. |
| [24] |
江志坚, PREMARATHNE C I, 方扬, 等. 铵态氮加富对贝克喜盐草光合作用、谷氨酰胺合成酶和氨基酸成分的影响[J]. 热带海洋学报, 2023, 42(3): 116-125. |
| [25] |
SHORT F T, DUARTE C M. Methods for the measurement of seagrass growth and production[M]//SHORT F T, COLES R G. Global Seagrass Research Methods. Amsterdam: Elsevier, 2001: 155-182.
|
| [26] |
王殿, 袁芳, 王宝山, 等. 能源植物杂交狼尾草对NaCl胁迫的响应及其耐盐阈值[J]. 植物生态学报, 2012, 36(6): 572-577. |
| [27] |
王宝山. 逆境植物生物学[M]. 北京: 高等教育出版社, 2010.
|
| [28] |
王宝山, 邹琦, 赵可夫. 高粱不同器官生长对NaCl胁迫的响应及其耐盐阈值[J]. 西北植物学报, 1997, 17(3): 279-285. |
| [29] |
MUNNS R. Genes and salt tolerance: bringing them together[J]. The New Phytologist, 2005, 167(3): 645-663. DOI:10.1111/j.1469-8137.2005.01487.x |
| [30] |
李景生, 黄韵珠. 浅述植物的耐盐生理[J]. 植物学通报, 1995, 12(3): 15-19. |
| [31] |
AZAD M S, MOLLICK A S, RANON R J K, et al. Plasticity of leaf morphology of Bruguiera sexangula to salinity zones in Bangladesh's Sundarbans[J]. Journal of Forestry Research, 2022, 33(6): 1857-1866. DOI:10.1007/s11676-022-01470-9 |
| [32] |
SMITH D D, SPERRY J S, ADLER F R. Convergence in leaf size versus twig leaf area scaling: do plants optimize leaf area partitioning?[J]. Annals of Botany, 2017, 119(3): 447-456. DOI:10.1093/aob/mcw231 |
| [33] |
NIKLAS K J, COBB E D, NⅡNEMETS V, et al. "Diminishing returns" in the scaling of functional leaf traits across and within species groups[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(21): 8891-8896. |
| [34] |
NⅡNEMETS V, SPARROW A, CESCATTI A. Light capture efficiency decreases with increasing tree age and size in the southern hemisphere gymnosperm Agathis australis[J]. Trees-Structure and Function, 2005, 19(2): 177-190. DOI:10.1007/s00468-004-0379-y |
| [35] |
WANG C G, HE J M, ZHAO T H, et al. The smaller the leaf is, the faster the leaf water loses in a temperate forest[J]. Frontiers in Plant Science, 2019, 10: 58. DOI:10.3389/fpls.2019.00058 |
| [36] |
DUURSMA R A, FALSTER D S, VALLADARES F, et al. Light interception efficiency explained by two simple variables: a test using a diversity of small- to medium-sized woody plants[J]. The New Phytologist, 2012, 193(2): 397-408. DOI:10.1111/j.1469-8137.2011.03943.x |
| [37] |
FALSTER D S, WESTOBY M. Leaf size and angle vary widely across species: what consequences for light interception?[J]. The New Phytologist, 2003, 158(3): 509-525. DOI:10.1046/j.1469-8137.2003.00765.x |
| [38] |
NⅡNEMETS U, PORTSMUTH A, TENA D, et al. Do we underestimate the importance of leaf size in plant economics? Disproportional scaling of support costs within the spectrum of leaf physiognomy[J]. Annals of Botany, 2007, 100(2): 283-303. DOI:10.1093/aob/mcm107 |
| [39] |
MILLA R, REICH P B. The scaling of leaf area and mass: the cost of light interception increases with leaf size[J]. Proceedings of The Royal Society B, 2007, 274(1622): 2109-2114. DOI:10.1098/rspb.2007.0417 |
| [40] |
YANG D, NIKLAS K J, XIANG S, et al. Size-dependent leaf area ratio in plant twigs: implication for leaf size optimization[J]. Annals of Botany, 2010, 105(1): 71-77. DOI:10.1093/aob/mcp262 |
| [41] |
ONTORIA Y, WEBSTER C, SAID N, et al. Positive effects of high salinity can buffer the negative effects of experimental warming on functional traits of the seagrass Halophila ovalis[J]. Marine Pollution Bulletin, 2020, 158(9): 111404. |
| [42] |
陈石泉, 吴钟解, 王道儒, 等. 海南岛海草床群落种间关系研究[J]. 海洋通报, 2013, 32(1): 78-84. |
| [43] |
JIANG Z J, CUI L J, LIU S L, et al. Historical changes in seagrass beds in a rapidly urbanizing area of Guangdong Province: implications for conservation and management[J]. Global Ecology and Conservation, 2020, 22: e01035. DOI:10.1016/j.gecco.2020.e01035 |
| [44] |
赵杏花, 段娜, 张淑媛, 等. 盐胁迫对唐古特白刺枝叶性状的影响[J]. 西北农林科技大学学报(自然科学版), 2023, 51(8): 49-58. |
| [45] |
韩秋影, 曾文轩, 叶嘉晖, 等. 海南新村湾泰来草形态和生理指标特征及环境影响因素[J]. 渔业科学进展, 2023, 44(6): 225-238. |
| [46] |
MURPHY L R, KINSEY S T, DURAKO M J. Physiological effects of short-term salinity changes on Ruppia maritima[J]. Aquatic Botany, 2003, 75(4): 293-309. DOI:10.1016/S0304-3770(02)00206-1 |



