2. 自然资源部北部湾滨海湿地生态系统野外科学观测研究站,广西北海 536015
2. Observation and Research Station of Coastal Wetland Ecosystem in Beibu Gulf, Ministry of Natural Resources, Beihai, Guangxi, 536015, China
潮间带海草床是河口、浅海和海湾生态系统中极其重要的组成部分[1],与红树林、盐沼一起被称为“三大海岸带蓝碳生态系统”[2, 3],具有增加碳储量、保护海岸线、减缓气候变化等生态功能[2-4],尤其在维护生物多样性方面发挥着重要的作用[5-7]。海草床不仅可以为儒艮、海龟等濒危物种提供栖息地[8, 9],还可以支持大型底栖动物(多毛类动物、软体动物、甲壳类动物等)的生长[10, 11],因此常被称为“海洋动物取食地”和“育幼场”[1, 8, 12]。尽管海草床在营养循环方面的服务价值每年高达1.9万亿美元,但是由于不合理的沿海开发[13, 14]、污染导致的水质恶化[15, 16]、生物入侵[17]和全球气候变化[18, 19]等问题,全球海草床以每年7%的速率损失[20]。海草床损失最显著的特征是海草植物消失,其生态功能也随之发生改变[21, 22]。大型底栖动物是海草床最重要的组成部分之一,也是最常见的动物类型[6],其对人为干扰或自然变化可做出快速响应,常被用作监测海洋生态系统的生物指标[23-25]。
海草植物的存在对大型底栖动物群落结构的影响已在全球范围内开展诸多研究,一般可分为时间尺度和空间尺度。时间尺度研究主要是对比海草消失或重新出现(自然恢复或人为恢复)前后大型底栖动物群落的变化。Githaiga等[26]研究发现清除海草后,动物群落结构快速发生变化;Ambo-Rappe等[27]研究发现,开展海草修复以后,动物种群密度显著增加;Lundquist等[28]研究表明,大型动物物种多样性随海草定植而增加。空间尺度研究主要是对比海草床(海草植被覆盖区)和裸滩中大型底栖动物群落的差异。多数的研究结果表明,海草床全年平均或各季度的大型底栖动物丰度和生物量均大于裸滩[5, 7]。但也有不同的研究结果:Armenteros等[29]研究发现裸滩的大型底栖动物丰度高于海草床;Wong[30]则发现不是任何时候海草床的大型底栖动物次级生产力都大于裸滩。
大型底栖动物的定居是指其长期生活在某个区域,甚至完成整个生活史。海草植物资源的变化(增加或减少)是改变海草床动物多样性的驱动因素[31]。相比于裸滩,海草不仅为大型底栖动物提供更多的食物来源,其附生藻类也是重要的食物来源之一[32]。海草床物理结构也是影响大型底栖动物的重要因素,海草的密度、叶宽和冠层等均是影响大型底栖动物丰度的重要指标[33, 34]。因海草的密度、生物量等呈现出季节性变化,海草床大型底栖动物群落结构也可能呈现季节性变化[35],然而并非所有的海草床都一致,Sordo等[36]研究发现,尽管海草生物量和密度随季节变化,但是大型底栖动物丰度和物种丰富度保持稳定。Barnes[21]研究表明,海草消失后,大型底栖动物的种类明显减少。此外,Boutoumit等[37]研究发现,在海草的作用下,沉积物特征也会发生变化,从而影响大型底栖动物的群落结构。
日本鳗草(Zostera japonica)是我国分布最广的海草,在辽宁省、河北省、山东省、福建省、广东省、广西壮族自治区和海南省均有分布[38]。北仑河口国家级自然保护区位于广西壮族自治区防城港市防城区和东兴市境内,保护区内的珍珠湾属于典型的海湾地貌,是我国日本鳗草主要分布区之一。以往的调查发现,因自然因素和人为因素干扰,珍珠湾日本鳗草海草床面积波动较大,现有资料更多关注植物资源的变化[39],对该类海草床的其他组成部分(如动物资源)关注较少。本研究以广西珍珠湾大型底栖动物为研究对象,通过对比海草床和裸滩4季的大型底栖动物群落结构、保有量(丰度、生物量、次级生产力)和多样性指数等,分析日本鳗草的生长对潮间带大型底栖动物的影响。
1 材料与方法 1.1 研究区概况与站位设置研究区位于广西壮族自治区防城港市珍珠湾。珍珠湾地处广西壮族自治区北部湾西岸,总面积94.2 km2,海岸线约46 km,滩涂面积约5 333.3 ha。该湾多年平均气温为22.5 ℃,冬季较冷,夏季、秋季较热;年平均降水量为2 220.5 mm,8月份的平均降水量为503 mm,多年平均湿度为81%;主要灾害性天气有台风、暴雨、强风暴等。珍珠湾的潮汐类型以正规全日潮为主,平均潮高和最大潮差分别为2.24 m及5.05 m,海水盐度的平均值为29。湾内海草床的优势种主要为日本鳗草和贝克喜盐草(Halophila beccarii),其中日本鳗草常分布于红树林向海一侧的滩涂,而贝克喜盐草分布在红树林边缘滩涂和红树林区的空斑[5]。研究区的地理坐标为21°34′-21°36′N,108°10′-108°12′E,在研究区内有日本鳗草分布的海草床(标记为SG)和无海草分布的裸滩(标记为UnV)各设置4个站位(表 1),可较好地反映有日本鳗草分布区域与无日本鳗草分布区域的大型底栖动物群落特征差异。
| 生境类型 Habitat type |
站位 Position |
纬度 Latitude |
经度 Longitude |
| Seagrass bed | SG1 | 21°34′57.97″N | 108°11′39.10″E |
| SG2 | 21°34′44.98″N | 108°11′20.47″E | |
| SG3 | 21°35′03.64″N | 108°11′49.25″E | |
| SG4 | 21°35′22.08″N | 108°12′16.72″E | |
| Unvegetated habitat | UnV1 | 21°34′29.13″N | 108°10′57.62″E |
| UnV2 | 21°35′37.13″N | 108°12′28.27″E | |
| UnV3 | 21°36′04.25″N | 108°12′51.47″E | |
| UnV4 | 21°36′14.87″N | 108°12′59.99″E |
1.2 样品采集与鉴定
在2015年11月至2016年7月[11月(秋季),1月(冬季),4月(春季),7月(夏季)]开展调查。每季度在每个站位随机采集4个大小为25 cm×25 cm、采样深度为30 cm的样方作为1个定量样品,并采集定性样品。样品的采集、处理、分析和资料整理均按《海洋监测规范第7部分:近海污染生态调查和生物监测》(GB 17378.7-2007)和《海洋调查规范第6部分:海洋生物调查》(GB/T 12763.6-2007)要求进行。本研究主要参考《中国海洋生物图集》[40]和《广西北部湾红树林湿地海洋动物图谱》[41]等对样品进行鉴定。
1.3 统计与分析 1.3.1 优势度计算使用Pinkas相对重要性指数(IRI)来研究大型底栖动物物种的优势度,其公式[42]:
| $ \mathrm{IRI}=(W+N) \times F, $ | (1) |
其中,W为该物种的密度占大型底栖动物总密度的百分率,N为该物种的生物量占大型底栖动物总生物量的百分率,F为该物种出现的次数占调查总次数的百分率。
IRI包含了生物的个体数、生物量及出现频率3个重要信息,常被用来研究群落中各种类的生态优势度。本研究中,将IRI>1 000的物种定为优势种,IRI在101-1 000为重要种,IRI在10-100为常见种,IRI < 10为少见种。
1.3.2 丰度、生物量和次级生产力计算丰度的计算公式:
生物量的计算公式:
其中,A为每个样品的大型底栖动物的栖息丰度(ind.·m-2),B为每个样品的大型底栖动物生物量(g·m-2),NT为每个样品的大型底栖动物总数量,WT为每个样品的大型底栖动物总湿重,S为采样面积(m2)。
将每个样品的大型底栖动物湿生物量(g·m-2)的1/5作为干生物量,干生物量的9/10作为去灰干质量(Ash Free Dry Mass,AFDM)[43, 44],同时结合大型底栖动物栖息丰度(ind.·m-2),按照下式计算每个样品的次级生产力[44]:
| $ P=\frac{A^x \times B_{\mathrm{AFDM}}{ }^y}{10^x}, $ |
其中,P为每个样品的大型底栖动物次级生产力[g(AFDM)·m-2·a-1],BAFDM为每个样品的大型底栖动物去灰干质量[g(AFDM)·m-2],x、y、z为不同类群的系数(表 2)。
| 类群 Groups |
系数 Coefficient |
||
| x | y | z | |
| Polychaeta | 0.116 | 0.906 | 0.018 |
| Mollusca | 0.283 | 0.747 | 0.591 |
| Crustacea | 0.361 | 0.661 | 0.614 |
| Echinodermata and others | 0.274 | 0.733 | 0.473 |
1.3.3 多样性指数计算
利用PRIMER 6软件,计算大型底栖动物群落的Margalef丰富度指数(d)、Pielou均匀度指数(J′)和Shannon-Wiener多样性指数(H′),分析其多样性特征。
1.3.4 数据分析利用PRIMER 6软件将数据基于物种丰度矩阵进行4次方根转换后,计算物种丰度Bray-Curtis相似性系数,以组平均法进行等级聚类(Cluster)分析,生成非度量多维尺度排序(NMDS)图,研究4季中2种生境的大型底栖动物群落之间的差异。
利用SPSS 23.0软件,采用单因素方差分析(One-way ANOVA)比较同一生境不同季节或同一季节不同生境的大型底栖动物群落差异,P < 0.05为差异显著水平,P < 0.01为差异极显著水平。
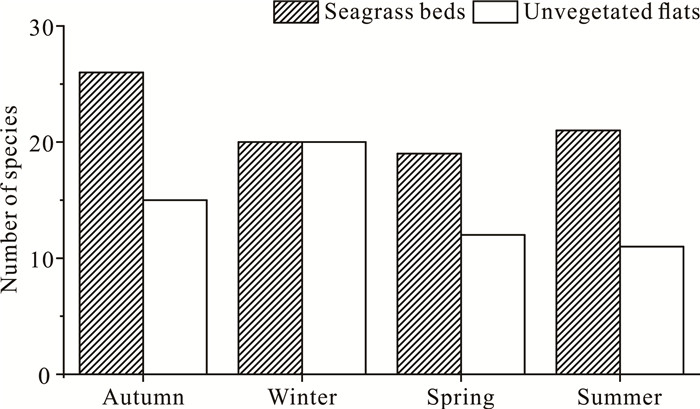
2 结果与分析 2.1 海草床和裸滩的种类组成结合定量和定性调查,在4季的海草床(在“2结果与分析”中的“海草床”均指有日本鳗草分布的海草床)和裸滩中共发现大型底栖动物69种(表 3),隶属7门10纲20目41科,其中软体动物38种,占总种数的55.07%。海草床定量记录大型底栖动物45种,裸滩定量记录大型底栖动物29种。4季海草床的大型底栖动物种数都大于或等于裸滩,秋季海草床的大型底栖动物种数最多,冬季裸滩的大型底栖动物种数最多(图 1)。
| 门 Phylum |
纲 Class |
目 Order |
科 Family |
属 Genus |
种 Species |
| Nemertea | Anopla | Heteronemertea | Lineidae | Lineidae sp. | |
| Annelida | Polychaeta | Sabellida | Oweniidae | Owenia | Owenia fusiformis |
| Nereidida | Nephtyidae | Nephtys | Nephtys oligobranchia | ||
| Namalycastis | Namalycastis abiuma | ||||
| Sipuncula | Phascolosomatidea | Phascolosomatiformes | Phascolosomatidae | Phascolosoma | Phascolosoma arcuatum |
| Sipunculiformes | Sipunculidae | Sipunculus | Sipunculus nudus | ||
| Mollusca | Gastropoda | Archaeogastropoda | Lottiidae | Patelloida | Patelloida pygmaea |
| Neritidae | Clithon | Clithon oualaniensis | |||
| Mesogastropoda | Littorinidae | Littoraria | Littoraria scabra | ||
| Potamididae | Cerithidea | Cerithidea cingulata | |||
| Terebralia | Terebralia sulcata | ||||
| Batillariidae | Batillaria | Batillaria cumingi | |||
| B.zonalis | |||||
| Nassariidae | Nassarius | Nassarius festivus | |||
| N.semiplicatus | |||||
| Cephalaspidea | Retusidae | Retusa | Retusa borneensis | ||
| Bivalvia | Arcoida | Arcidae | Scapharca | Scapharca kagoshimensis | |
| Mytiloida | Mytilidae | Brachidontes | Brachidontes variabilis | ||
| Musculus | Musculus senhousia | ||||
| Modiolus philippinarum | |||||
| Pterioida | Placunidae | Placuna | Placuna placenta | ||
| Ostreidae | Saccostrea | Saccostrea glomerata | |||
| Ostrea | Ostrea denselamellosa | ||||
| Veneroida | Lucinidae | Lucina | Lucina scarlatoi | ||
| Ungulinidae | Cycladicama | Cycladicama cumingii | |||
| Tellinidae | Merisca | Merisca capsoides | |||
| Moerella | Moerella rutila | ||||
| M.jedoensis | |||||
| Nitidotellina | Nitidotellina juvenilis | ||||
| Psammobiidae | Sanguinolaria | Sanguinolaria atrata | |||
| Solenidae | Solen | Solen dunkerianus | |||
| S.grandis | |||||
| S.strictus | |||||
| Trapeziidae | Trapezium | Trapezium sublaevigatum | |||
| Veneridae | Cryptonema | Cryptonema producta | |||
| Clausinella | Clausinella isabellina | ||||
| Dosinia | Dosinia caerulea | ||||
| D.aspera | |||||
| Marcia | Marcia hiantina | ||||
| Gomphina | Gomphina aequilatera | ||||
| Meretrix | Meretrix meretrix | ||||
| Cyclina | Cyclina sinensis | ||||
| Myoida | Corbulidae | Corbulidae sp. | |||
| Laternulidae | Laternula | Laternula truncata | |||
| Arthropoda | Maxillopoda | Sessilia | Balanidae | Amphibalanus | Amphibalanus amphitrite |
| A.rhizophorae | |||||
| Malacostraca | Stomatopoda | Squillidea | Oratosquilla | Oratosquilla oratoria | |
| Decapoda | Penaeidae | Metapenaeopsis | Metapenaeopsis barbata | ||
| Metapenaeus | Metapenaeus affinis | ||||
| Trachysalambria | Trachysalambria malaiana | ||||
| Alpheidae | Alpheus | Alpheus brevicristatus | |||
| A.hoplocheles | |||||
| Palaemonidae | Exopalaemon | Exopalaemon carinicauda | |||
| Menippidae | Sphaerozius | Sphaerozius nitidus | |||
| Leucosiidae | Philyra | Philyra carinata | |||
| Portunidae | Portunus | Portunus trituberculatus | |||
| Charybdis | Charybdis hellerii | ||||
| Grapsidae | Metopograpsus | Metopograpsus quadridentatus | |||
| Sesarminae | Clistocoeloma | Clistocoeloma sinense | |||
| Macrophthalmidae | Macrophthalmus | Macrophthalmus japonicus | |||
| M.pacificus | |||||
| M.brevis | |||||
| M.ababreuiatus | |||||
| Mictyridae | Mictyris | Mictyris brevidactylus | |||
| Merostomata | Xiphosura | Tachypleidae | Tachypleus | Tachypleus tridentatus | |
| Brachiopoda | Lingulata | Lingulida | Lingulidae | Lingula | Lingula adamsi |
| Chordata | Actinopterygii | Perciformes | Gobiidae | Glossogobius | Glossogobius giuris |
| Acanthogobius | Acanthogobius ommaturus | ||||
| Gasterosteiformes | Syngnathidae | Hippichthys | Hippichthys heptagonus | ||
|
| 图 1 4季2种生境的大型底栖动物群落种类数 Fig.1 Number of species of macrobenthic communities of four seasons in the two habitats |
Pinkas相对重要性指数的结果显示,4季2种生境大型底栖动物优势度位居前2的均为古氏滩栖螺(Batillaria cumingi)和珠带拟蟹守螺(Cerithidea cingulata),其中4季海草床的第一优势种均为古氏滩栖螺,而3季裸滩的第一优势种均为珠带拟蟹守螺(表 4)。秋季、冬季、春季、夏季海草床的重要种分别有5、3、6、2种,秋季、冬季、春季、夏季裸滩的重要种分别有5、5、1、4种,其中溪沙蚕(Namalycastis abiuma)为春季海草床和夏季裸滩的重要种,其他重要种均为软体动物。
| 生境类型 Habitat type |
季节 Season |
IRI值 IRI value |
||
| Batillaria cumingi | Cerithidea cingulata | Batillaria zonalis | ||
| Seagrass beds | Autumn | 11 763.64 | 3 375.78 | |
| Winter | 13 356.41 | 2 884.08 | ||
| Spring | 8 101.88 | 6 346.35 | 2 687.53 | |
| Summer | 9 207.18 | 5 787.52 | 2 674.50 | |
| Unvegetated flats | Autumn | 3 954.77 | 7 436.98 | |
| Winter | 9 076.91 | 6 807.81 | ||
| Spring | 5 526.28 | 10 542.72 | 1 329.41 | |
| Summer | 3 905.91 | 12 771.41 | ||
2.2 海草床和裸滩的大型底栖动物丰度、生物量及次级生产力
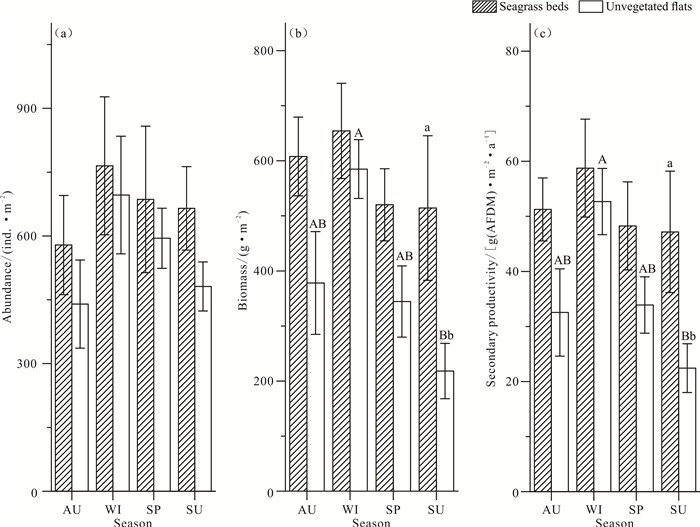
海草床的大型底栖动物4季平均丰度为(673.69±65.22) ind.·m-2,裸滩的大型底栖动物4季平均丰度为(555.21±55.56) ind.·m-2,差异不显著(P>0.05)。4季海草床的丰度均大于裸滩,但差异不显著(P>0.05)[图 2(a)]。海草床的大型底栖动物4季平均生物量为(574.13±44.06) g·m-2,裸滩的大型底栖动物4季平均生物量为(395.75±48.39) g·m-2,差异显著(P < 0.05)。4季海草床的生物量均大于裸滩,其中夏季海草床的生物量显著高于夏季裸滩(P < 0.05),冬季裸滩的平均生物量显著高于夏季裸滩,其他季节差异不显著(P>0.05)[图 2(b)]。海草床的大型底栖动物4季平均次级生产力为(51.37±4.03) g(AFDM)·m-2·a-1,裸滩大型底栖动物4季平均次级生产力为(36.42±4.18) g(AFDM)·m-2·a-1,变化规律及显著性比较与生物量一致[图 2(c)]。
|
| AU: autumn; WI: winter; SP: spring; SU: summer.Different capital letters above bars (A, B) indicate significant differences among seasons (P < 0.05).Different lowercase letters above bars (a, b) indicate significant differences among habitats in the same season (P < 0.05).No letter means no significance. 图 2 4季2种生境的大型底栖动物丰度、生物量和次级生产力 Fig.2 Abundance, biomass and secondary productivity of macrobenthos of four seasons in the two habitats |
2.3 海草床和裸滩的大型底栖动物多样性指数
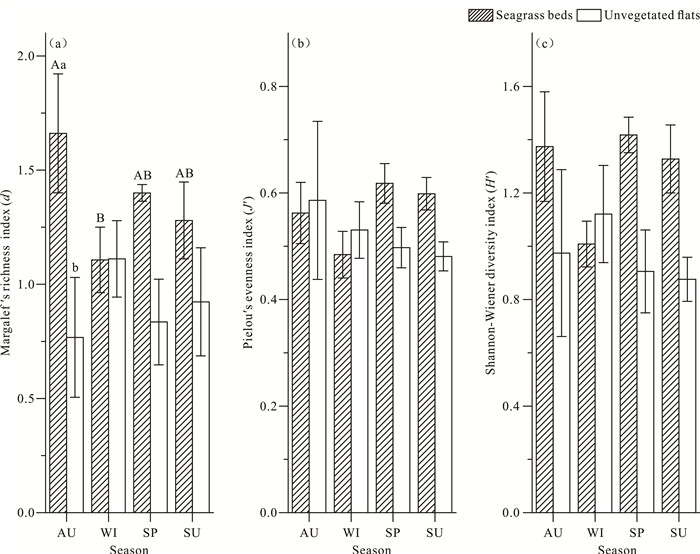
海草床的大型底栖动物4季平均Margalef丰富度指数为1.36±0.09,裸滩的大型底栖动物4季平均Margalef丰富度指数为0.91±0.10,差异极显著(P < 0.01)。春季、夏季、秋季海草床的Margalef丰富度指数均大于裸滩,其中秋季海草床显著大于秋季裸滩,秋季海草床显著大于冬季海草床,其他差异不显著,海草床的Margalef丰富度指数秋季最高,冬季最低,而裸滩与之相反[图 3(a)]。海草床的大型底栖动物4季平均Pielou均匀度指数为0.57±0.02,裸滩的大型底栖动物4季平均Pielou均匀度指数为0.53±0.04,差异不显著(P>0.05)。4季海草床和裸滩的Pielou均匀度指数差异不显著[图 3(b)]。海草床的大型底栖动物4季平均Shannon-Wiener多样性指数为1.28±0.07,裸滩的大型底栖动物4季平均Shannon-Wiener多样性指数为0.98±0.10,差异显著(P < 0.05)。4季海草床和裸滩的Shannon-Wiener多样性指数差异不显著[图 3(c)]。
|
| AU: autumn; WI: winter; SP: spring; SU: summer.Different capital letters above bars (A, B) indicate significant differences among seasons (P < 0.05).Different lowercase letters above bars (a, b) indicate significant differences among habitats in the same season (P < 0.05).No letter means no significance. 图 3 4季2种生境的大型底栖动物Margalef丰富度指数、Pielou均匀度指数和Shannon-Wiener多样性指数 Fig.3 Margalef richness index, Pielou′s evenness index and Shannon-Wiener diversity index of macrobenthos of four seasons in the two habitats |
2.4 海草床和裸滩的大型底栖动物群落结构
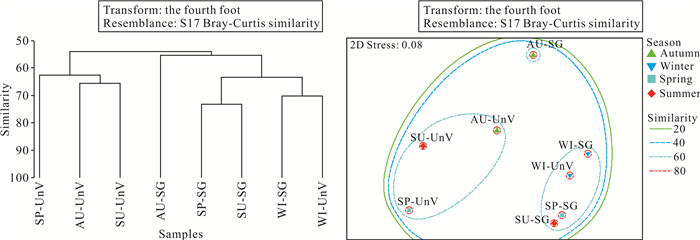
等级聚类和非度量多维尺度排序分析结果如图 4所示。等级聚类分析结果在55.00%相似性水平上将4季2种生境的大型底栖动物样品分成2个聚类大组:冬季裸滩与4季海草床的大型底栖动物群落聚为第一大组,相似性为55.10%;其他3个季节裸滩的大型底栖动物群落为第二大组,相似性高达62.45%。非度量多维尺度排序分析结果中,二维尺度排序的胁迫系数(Stress)为0.08(通常认为Stress < 0.2时可用非度量多维尺度排序的二维点图表示,其图形有一定的解释意义;当Stress < 0.1时,可认为是一个好的排序;当Stress < 0.05时,则具有很好的代表性[45]),对4季2种生境的大型底栖动物群落相似性具有很好的解释意义。以60.00%相似性为划分标准将4季2种生境的大型底栖动物样品划分为3组:秋季、夏季、春季的裸滩大型底栖动物群落聚为第一大组;秋季海草床大型底栖动物群落聚为第二大组;其余大型底栖动物群落聚为第三大组。综上,上述聚类大组之间完全分离,排序结果与聚类分析结果一致。
|
| SG: seagrass beds; UnV: unvegetated flats; AU: autumn; WI: winter; SP: spring; SU: summer. 图 4 4季2种生境的大型底栖动物等级聚类和非度量多维尺度排序分析 Fig.4 Hierarchical clustering and NMDS analysis for macrobenthos of four seasons in the two habitats |
3 讨论 3.1 日本鳗草对大型底栖动物多样性的影响
大型底栖动物的定居有利于提升其丰度、生物量、次级生产力等,因此常用这些指标反映其定居状况。珍珠湾内日本鳗草海草床的大型底栖动物种数除了冬季与裸滩相等外,其余3季的种类数均为裸滩的1.5倍以上。该结果与通过比较珍珠湾内贝克喜盐草海草床和裸滩的大型底栖动物定居状况得到的结果不同[5],原因可能在于沉积物特征的差异[37]。贝克喜盐草海草床靠近红树林,其沉积物类型多为泥质,而泥质环境透气性差、粒度小,定居的动物种类受限;此外,有机质含量也是重要的影响因素[46]。日本鳗草海草床和裸滩均在红树林向海一侧,沉积物类型接近,以砂为主,且海草冠层可以降低水流冲刷速度和泥沙侵蚀等干扰的影响,防止动物被冲刷走[47, 48],故日本鳗草的出现有利于更多种类的大型底栖动物定居。
本研究中,4季日本鳗草海草床的大型底栖动物平均丰度、生物量和次级生产力均大于裸滩,但仅夏季海草床的生物量和次级生产力显著高于裸滩,该结果与其他研究结果[5]一致。Vonk等[33]的研究表明,海草冠层结构对大型底栖动物丰度有影响。植被覆盖区的大型底栖动物保有量常比无植被覆盖区多[7, 47], 主要因为海草不仅直接为大型底栖动物提供更多的食物,而且其附生藻类也是最重要的食物来源之一[32, 49]。海草还可以作为抵御捕食的避难所[50],尤其是躲避鸟类的捕食[51]。Armenteros等[29]的研究表明,在热带和亚热带的大陆架上,软体动物可以代表多达38%的无脊椎动物,在一些地区,它们可以代表大部分的底栖生物生物量。在对黄河口日本鳗草海草床大型底栖动物食物网的研究发现,双壳类动物在消耗生物量和通量方面占主导地位[52, 53]。本研究发现在日本鳗草海草床中软体动物的保有量最高,日本鳗草海草床的优势种和重要种除了在春季为溪沙蚕外,其他均为软体动物,软体动物的丰度、生物量和次级生产力贡献率超过90%。因此,日本鳗草的出现有利于增加潮间带大型底栖动物的丰度、生物量和次级生产力,尤其对软体动物的作用更加明显。
日本鳗草海草床的大型底栖动物4季平均Margalef丰富度指数和Shannon-Wiener多样性指数均显著高于裸滩,该结果与Barnes[21]的研究结果一致。从各季节上看,秋季日本鳗草海草床的大型底栖动物Margalef丰富度指数显著大于裸滩,其他季度差异不显著;日本鳗草海草床的大型底栖动物Shannon-Wiener多样性指数和Pielou均匀度指数与裸滩差异不显著。冬季日本鳗草海草床的Margalef丰富度指数和Shannon-Wiener多样性指数略低于裸滩,可能是与温度有关,研究表明温度与软体动物的物种丰富度呈正相关[29]。日本鳗草海草床为各种功能群中的生物提供了良好的觅食和藏身之处,包括沉积物摄食者、食草动物和捕食者等[7]。Lefcheck等[54]的研究表明,即使很小的海草斑块也可以促进丰富和多样的动物群落迅速形成。因此,日本鳗草的出现有利于提高潮间带大型底栖动物的多样性。
3.2 日本鳗草对大型底栖动物群落结构的影响潮间带的大型底栖动物往往具有较高的季节性和年际变异性[46]。以往研究表明,日本鳗草海草床的大型底栖动物群落随着海草密度、冠层、叶宽等植被因素的季节性差异而变化[33, 34]。本研究的结果却与其相反,尽管本研究区域的日本鳗草密度在采样的4季内逐步减少(未发表数据),但是其大型底栖动物群落结构差异不明显,该结果与Bell等[55]提出海草床的大型底栖动物结构不随海草斑块的破碎而发生改变的结论相符。4季日本鳗草海草床的大型底栖动物种类均为20余种,第一和第二优势种均为古氏滩栖螺和珠带拟蟹守螺,而各季节裸滩的动物种数差异较大,优势种也不一致,等级聚类分析和非度量多维尺度排序分析也将3个季节海草床分为1组,进一步体现了日本鳗草的出现有利于稳定大型底栖动物群落结构。
动物多样性复杂程度越高,其稳定性就越高,反之越低。大型底栖动物群落结构具有复杂的、“自上而下”的捕食者和放牧效应,以及“自下而上”的营养效应[7, 56],其稳定性取决于食物的供应。海草植被及其附生藻类为小型和大型的食植动物提供了主要的食物来源,大型杂食动物在很大程度上依赖于动物来源的有机物,故海草的出现为稳定底栖生物食物网的结构提供了基础[57]。Dolbeth等[58]的研究表明,潮间带底栖生物群落的功能多样性随着海草的出现而升高,而面对潮间带的扰动,功能多样性越高越有利于潮间带生态系统的恢复。
盐度是影响大型底栖动物分布的重要因子[37],常与温度、植被覆盖度等共同作用决定物种的分布与丰度,在不考虑其他因素影响的情况下,一般大型底栖动物在低盐度海区(或季节)的数量较多,高盐度海区(或季节)的数量较少[59]。水体盐度常因水分蒸发而升高,因降雨稀释而降低。采样所在区域春夏季的盐度相对较低,秋冬季的盐度较高[60]。以夏冬两季的大型底栖动物生物量和次级生产力相比为例,夏季裸滩的大型底栖动物生物量和次级生产力显著低于冬季,可能是高温等原因导致动物的逃离,但海草床的大型底栖动物生物量和次级生产力均未发生显著变化,且海草床4季的大型底栖动物丰度、生物量和次级生产力均大于裸滩,可能是海草床植被为大型底栖动物提供了更适宜的生境,尤其在应对一些极端天气(如高温等)影响方面。因此,海草有利于保持大型底栖动物群落结构的稳定。
4 结论通过比较广西珍珠湾日本鳗草海草床和裸滩的4季大型底栖动物群落特征,发现日本鳗草的出现可将大型底栖动物的保有量(丰度、生物量和次级生产力)和多样性(种类、Margalef丰富度指数和Shannon-Wiener多样性指数)分别至少提高20%和30%,日本鳗草海草床的大型底栖动物Pielou均匀度指数也高于裸滩。因此,海草对动物多样性具有促进作用,建议加强海草的保护和恢复力度,通过恢复海草床面积来增加生物多样性,进而维护滨海生态系统稳定。
致谢
感谢邢永泽博士对大型底栖动物样品的鉴定。
| [1] |
JACKSON E L. Importance of seagrass beds as a habitat for fishery species around Jersey[D]. Plymouth: University of Plymouth, 2003.
|
| [2] |
DUARTE C M, LOSADA I J, HENDRIKS I E, et al. The role of coastal plant communities for climate change mitigation and adaptation[J]. Nature Climate Change, 2013, 5(7): 505-509. |
| [3] |
FOURQUREAN J W, DUARTE C M, KENNEDY H, et al. Seagrass ecosystems as a globally significant carbon stock[J]. Nature Geoscience, 2012, 1(3): 297-315. |
| [4] |
KENNEDY H, BEGGINS J, DUARTE C M, et al. Seagrass sediments as a global carbon sink: isotopic constraints[J]. Global Biogeochemical Cycles, 2010, 24(4): GB4026. |
| [5] |
SU Z N, QIU G L, FAN H Q, et al. Seagrass beds store less carbon but support more macrobenthos than mangrove forests[J]. Marine Environmental Research, 2020, 162: 105162. DOI:10.1016/j.marenvres.2020.105162 |
| [6] |
BARNES R S K, HENDY I W. Seagrass-associated macrobenthic functional diversity and functional structure along an estuarine gradient[J]. Estuarine Coastal and Shelf Science, 2015, 164: 233-243. DOI:10.1016/j.ecss.2015.07.050 |
| [7] |
ALFARO A C. Benthic macro-invertebrate community composition within a mangrove/seagrass estuary in northern New Zealand[J]. Estuarine, Coastal and Shelf Science, 2006, 66(1): 97-110. |
| [8] |
HECK JR K L, HAYS G, ORTH R J. Critical evaluation of the nursery role hypothesis for seagrass meadows[J]. Marine Ecology Progress Series, 2003, 253(1/2): 123-136. |
| [9] |
LIN M L, TURVEY S T, HAN C T, et al. Functional extinction of dugongs in China[J]. Royal Society Open Science, 2022, 9(8): 211994. DOI:10.1098/rsos.211994 |
| [10] |
WILLIAMS S L, HECK K L J. Seagrass community ecology[M]//BERTNESS M D, GAINESS S D, HAY M E. Marine community ecology. Sunderland: Sinauer Associates. 2001: 317-337.
|
| [11] |
BOSTRÖM C, BONSDORFF E. Community structure and spatial variation of benthic invertebrates associated with Zostera marina(L.) beds in the northern Baltic Sea[J]. Journal of Sea Research, 1997, 37(1/2): 153-166. |
| [12] |
BECK M W, HECK K L, ABLE K W, et al. The identification, conservation, and management of estuarine and marine nurseries for fish and invertebrates[J]. BioScience, 2001, 51(8): 633-641. DOI:10.1641/0006-3568(2001)051[0633:TICAMO]2.0.CO;2 |
| [13] |
MCMAHON K, COLLIER C, LAVERY P S. Identifying robust bioindicators of light stress in seagrasses: a meta-analysis[J]. Ecological Indicators, 2013, 30: 7-15. DOI:10.1016/j.ecolind.2013.01.030 |
| [14] |
EVANS S M, GRIFFIN K J, BLICK R A J, et al. Seagrass on the brink: decline of threatened seagrass Posidonia australiscontinues following protection[J]. PLoS One, 2018, 14(4): e0216107. |
| [15] |
YAAKUB S M, MCKENZIE L J, ERFTEMEIJER P L A, et al. Courage under fire: seagrass persistence adjacent to a highly urbanised city-state[J]. Marine Pollution Bulletin, 2014, 83(2): 417-424. DOI:10.1016/j.marpolbul.2014.01.012 |
| [16] |
BIRCH G F, COX B M, BESLEY C H. Metal concentrations in seagrass (Halophila ovalis) tissue and ambient sediment in a highly modified estuarine environment (Sydney estuary, Australia)[J]. Marine Pollution Bulletin, 2018, 131: 130-141. DOI:10.1016/j.marpolbul.2018.04.010 |
| [17] |
SU Z N, QIU G L, FAN H Q, et al. Changes in carbon storage and macrobenthic communities in a mangrove-seagrass ecosystem after the invasion of smooth cordgrass in southern China[J]. Marine Pollution Bulletin, 2020, 152: 110887. DOI:10.1016/j.marpolbul.2020.110887 |
| [18] |
HANINGTON P, HUNNAM K, JOHNSTONE R. Widespread loss of the seagrass Syringodium isoetifolium after a major flood event in Moreton Bay, Australia: implications for benthic processes[J]. Aquatic Botany, 2015, 120: 244-250. DOI:10.1016/j.aquabot.2014.09.002 |
| [19] |
COLES R G, RASHEED M A, MCKENZIE L J, et al. The great barrier reef world heritage area seagrasses: managing this iconic Australian ecosystem resource for the future[J]. Estuarine, Coastal and Shelf Science, 2015, 153: A1-A12. DOI:10.1016/j.ecss.2014.07.020 |
| [20] |
WAYCOTT M, DUARTE C M, CARRUTHERS T J B, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381. |
| [21] |
BARNES R S K. Context dependency in the effect of Ulva-induced loss of seagrass cover on estuarine macrobenthic abundance and biodiversity[J]. Aquatic: Conservation-Marine and Freshwater Ecosystems, 2019, 29(2): 163-174. DOI:10.1002/aqc.2977 |
| [22] |
DO V T, DE MONTAUDOUIN X, BLANCHET H, et al. Seagrass burial by dredged sediments: benthic community alteration, secondary production loss, biotic index reaction and recovery possibility[J]. Marine Pollution Bulletin, 2012, 64(11): 2340-2350. DOI:10.1016/j.marpolbul.2012.08.025 |
| [23] |
BORJA A, FRANCO J, PÉREZ V. A marine biotic index to establish the ecological quality of soft-bottom benthos within European estuarine and coastal environments[J]. Marine Pollution Bulletin, 2000, 40(12): 1100-1114. DOI:10.1016/S0025-326X(00)00061-8 |
| [24] |
HAMPEL H, ELLIOTT M, CATTRIJSSE A. Macrofaunal communities in the habitats of intertidal marshes along the salinity gradient of the Schelde estuary[J]. Estuarine Coastal and Shelf Science, 2009, 84(1): 45-53. DOI:10.1016/j.ecss.2009.05.029 |
| [25] |
LI X C, WANG H C, MCCAULEY D J, et al. A wide megafauna gap undermines China's expanding coastal ecosystem conservation[J]. Science Advances, 2023, 9(32): eadg3800. DOI:10.1126/sciadv.adg3800 |
| [26] |
GITHAIGA M N, FROUWS A M, KAIRO J G, et al. Seagrass removal leads to rapid changes in fauna and loss of carbon[J]. Frontiers in Ecology and Evolution, 2019, 7: 1-12. DOI:10.3389/fevo.2019.00001 |
| [27] |
AMBO-RAPPE R, RANI C. Physical structure of artificial seagrass affects macrozoobenthic community recruitment[J]. Journal of Physics: Conference Series, 2018, 979: 012006. DOI:10.1088/1742-6596/979/1/012006 |
| [28] |
LUNDQUIST C J, JONES T C, PARKES S M, et al. Changes in benthic community structure and sediment characteristics after natural recolonisation of the seagrass Zostera muelleri[J]. Scientific Reports, 2018, 8(1): 13250. DOI:10.1038/s41598-018-31398-2 |
| [29] |
ARMENTEROS M, SALADRIGAS D, GONZALEZCÁSUSO L, et al. The role of habitat selection on the diversity of macrobenthic communities in three gulfs of the Cuban Archipelago[J]. Bulletin of Marine Science, 2018, 94(2): 249-268. |
| [30] |
WONG M C. Secondary production of macrobenthic communities in seagrass (Zostera marina, Eelgrass) beds and bare soft sediments across differing environmental conditions in Atlantic Canada[J]. Estuaries and Coasts, 2018, 41(2): 536-548. DOI:10.1007/s12237-017-0286-2 |
| [31] |
CHAND S, BOLLARD B. Detecting the spatial variability of seagrass meadows and their consequences on associated macrofauna benthic activity using novel drone technology[J]. Remote Sensing, 2021, 14(1): 1-16. DOI:10.3390/rs14010001 |
| [32] |
FRANCE R L. Feeding on the edge: δ13C analysis of a macrofauna food web from disappearing seagrass beds in a polluted urban harbour-implications for biomonitoring and restoration efforts[J]. Aquatic Conservation: Marine and Freshwater Ecosystems, 2015, 25(1): 81-90. DOI:10.1002/aqc.2353 |
| [33] |
VONK J A, CHRISTIANEN M J A, STAPEL J. Abundance, edge effect, and seasonality of fauna in mixed-species seagrass meadows in southwest Sulawesi, Indonesia[J]. Marine Biology Research, 2010, 6(3): 282-291. DOI:10.1080/17451000903233789 |
| [34] |
LAWRENCE C M. Quantifying direct and indirect linkages between seagrasses, environment and associated macrofauna in a temperate lagoon[J]. Marine Ecology, 2024, 45(2): e12804. DOI:10.1111/maec.12804 |
| [35] |
BOUOUAROUR O, EL KAMCHA R, BOUTOUMIT S, et al. Effects of the Zostera nolteimeadows on benthic macrofauna in North Atlantic coastal ecosystems of Morocco: spatial and seasonal patterns[J]. Biologia, 2021, 76(8): 2263-2275. DOI:10.1007/s11756-021-00718-9 |
| [36] |
SORDO L, LANA P. Temporal variations of Halodule wrightii meadows and associated fauna near their southern distribution limit in the southwestern Atlantic[J]. Botanica Marina, 2020, 63(3): 215-228. DOI:10.1515/bot-2018-0106 |
| [37] |
BOUTOUMIT S, MAANAN M, EL KAMCHA R, et al. Seasonal trends in benthic macrofauna communities and their relationship with environmental factors in an Atlantic lagoonal system[J]. Biologia, 2022, 77(4): 1039-1055. DOI:10.1007/s11756-022-01043-5 |
| [38] |
周毅, 江志坚, 邱广龙, 等. 中国海草资源分布现状、退化原因与保护对策[J]. 海洋与湖沼, 2023, 54(5): 1248-1257. |
| [39] |
邱广龙, 范航清, 李蕾鲜, 等. 潮间带海草床的生态恢复[M]. 北京: 中国林业出版社, 2014.
|
| [40] |
黄宗国, 林茂. 中国海洋生物图集[M]. 北京: 海洋出版社, 2012.
|
| [41] |
何斌源, 赖廷和. 广西北部湾红树林湿地海洋动物图谱[M]. 北京: 科学出版社, 2013.
|
| [42] |
PINKAS L, OLIPHANT M S, IVERSON I L K. Food habits of albacore, bluefin tuna, and Bonito in California waters[M]. San Diego: Department of Fish and Game, State of California, 1971.
|
| [43] |
CRIPS D J. Energy flow measurements[M]// MC INTYRE A D, HOLME N A. Methods for the study of marine benthos. Oxford: Blackwell Scientific Publications. 1984.
|
| [44] |
BREY T. Estimating productivity of macrobenthic invertebrates from biomass and mean individual weight[J]. Meeresforsch, 1990, 32(4): 329-343. |
| [45] |
KRUSKAL J B. Multidimensional scaling by optimizing goodness of fit to a nonmetric hypothesis[J]. Psychometrika, 1964, 29: 1-26. DOI:10.1007/BF02289565 |
| [46] |
ALSAFFAR Z, CÚRDIA J, IRIGOIEN X, et al. Composition, uniqueness and connectivity across tropical coastal lagoon habitats in the Red Sea[J]. BMC Ecology, 2020, 20(1): 1-17. DOI:10.1186/s12898-019-0268-2 |
| [47] |
DO V T, BLANCHET H, DE MONTAUDOUIN X, et al. Limited consequences of seagrass decline on benthic macrofauna and associated biotic indicators[J]. Estuaries and Coasts, 2013, 36(4): 795-807. DOI:10.1007/s12237-013-9589-0 |
| [48] |
MADSEN J D, CHAMBERS P A, JAMES W F, et al. The interaction between water movement, sediment dynamics and submersed macrophytes[J]. Hydrobiologia, 2001, 444(1): 71-84. |
| [49] |
FREDRIKSEN S, CHRISTIE H, SÆTHRE B A. Species richness in macroalgae and macrofauna assemblages on Fucus serratus L.(Phaeophyceae) and Zostera marinaL.(Angiospermae) in Skagerrak, Norway[J]. Marine Biology Research, 2005, 1(1): 2-19. DOI:10.1080/17451000510018953 |
| [50] |
ORTH R J, HECK K L, VAN MONTFRANS J. Faunal communities in seagrass beds: a review of the influence of plant structure and prey characteristics on predator-prey relationships[J]. Estuaries, 1984, 7(4): 339-350. DOI:10.2307/1351618 |
| [51] |
TOUHAMI F, BAZAIRI H, BADAOUI B, et al. Structure and spatial organization of macrobenthic fauna of intertidal habitats frequented by wintering shorebirds at Merja Zerga lagoon (Moroccan Ramsar Site)[J]. Cahiers de Biologie Marine, 2019, 60(1): 41-50. |
| [52] |
LI X, YANG W, SUN T, et al. Trophic diversity and food web structure of vegetated habitats along a coastal topographic gradient[J]. Frontiers in Marine Science, 2022, 9: 920745. DOI:10.3389/fmars.2022.920745 |
| [53] |
LI X, YANG W, SUN T, et al. Quantitative food web structure and ecosystem functions in a warm-temperate seagrass bed[J]. Marine Biology, 2021, 168(5): 1-17. |
| [54] |
LEFCHECK J S, MARION S R, LOMBANA A V, et al. Faunal communities are invariant to fragmentation in experimental seagrass landscapes[J]. PLoS One, 2016, 11(5): e0156550. DOI:10.1371/journal.pone.0156550 |
| [55] |
BELL S S, BROOKS R A, ROBBINS B D, et al. Faunal response to fragmentation in seagrass habitats: implications for seagrass conservation[J]. Biological Conservation, 2001, 100(1): 115-123. DOI:10.1016/S0006-3207(00)00212-3 |
| [56] |
VALIELA I, BOWEN J L, YORK J K. Mangrove forests: one of the world's threatened major tropical environments[J]. BioScience, 2001, 51(10): 807-815. DOI:10.1641/0006-3568(2001)051[0807:MFOOTW]2.0.CO;2 |
| [57] |
JANKOWSKA E, DE TROCH M, MICHEL L N, et al. Modification of benthic food web structure by recovering seagrass meadows, as revealed by trophic markers and mixing models[J]. Ecological Indicators, 2018, 90: 28-37. DOI:10.1016/j.ecolind.2018.02.054 |
| [58] |
DOLBETH M, CARDOSO P, GRILO T, et al. Drivers of estuarine benthic species distribution patterns following a restoration of a seagrass bed: a functional trait analyses[J]. Marine Pollution Bulletin, 2013, 72(1): 47-54. DOI:10.1016/j.marpolbul.2013.05.001 |
| [59] |
MOHAMAMAD A, JALAL K C A. Macrobenthic diversity and community composition in the Pahang Estuary, Malaysia[J]. Journal of Coastal Research, 2018, 206-211. |
| [60] |
黄映霞. 广西珍珠湾贝克喜盐草的主要碳收支过程: 生产力、碎屑输出及草食作用[D]. 南宁: 南宁师范大学, 2022.
|



