2. 自然资源部北部湾滨海湿地生态系统野外科学观测研究站,广西北海 536015
2. Observation and Research Station of Coastal Wetland Ecosystem in Beibu Gulf, Ministry of Natural Resources, Beihai, Guangxi, 536015, China
小花老鼠簕(Acanthus ebracteatus)隶属于爵床科(Acanthaceae)老鼠簕属(Acanthus),在我国海南、广东和广西均有天然分布[1-3]。小花老鼠簕含有多种类黄酮物质,对淋巴肿大、肝脾肿大、哮喘等有明显疗效,同时民间认为老鼠簕属植物的根可用于治疗乙型肝炎[4]。由于气候变化和人为干扰,近30年来小花老鼠簕在我国的种群数量持续减少,按世界自然保护联盟(IUCN)标准,中国的小花老鼠簕属于濒危等级(EN)[3],2006年海南省已将其列入了《海南省省级重点保护野生植物名录》[5]。
2020年,自然资源部、国家林业和草原局共同发布了《红树林保护修复专项行动计划(2020-2025年)》,指出“保护珍稀濒危红树物种”及“扩大珍稀濒危红树物种面积”。红树林保护修复,不仅要造林增加红树林面积、修复退化红树林,而且还要抢救性保护地带性珍稀濒危红树植物物种,保护红树植物的物种多样性。而广西现存的小花老鼠簕仅防城港市江山半岛西南侧和黄竹江中游潮滩2处,总面积仅766 m2[2]。广西小花老鼠簕种群分布范围极小,生境狭窄,且容易遭到人为干扰,处境严峻,亟需对其进行抢救性保护和种群恢复。
红树植物生长于滨海潮间带环境,在长期的自然选择和进化适应过程中,形成了一系列的适应机制[6]。盐度是影响红树植物生长和分布的主要因素,不同红树植物的耐盐能力不同[7],适盐范围存在差异,盐度过高或过低均不利于其生长。因此,红树植物种植环境的盐度对其生存生长至关重要[8]。有关红树植物对盐度的适应性研究多集中在大规模造林树种,如廖宝文等[9]研究发现尖瓣海莲(Bruguiera sexangula var.rhynchopetala)适合生长于盐度25以下的环境,其最适生长盐度为5;林鹏等[10]研究表明秋茄(Kandelia obovata)在海水盐度为7.5-21.2时生长旺盛;王文卿等[11]的研究显示木榄(B.gymnorrhiza)幼苗的最适生长盐度为10左右;郑文教等[12]的研究表明海莲(B.sexangula)的适宜生长盐度在15以下;陈长平等[13]的研究则表明无瓣海桑(Sonneratia apetala)可正常生长的盐度为0-25;江鎞倩等[7]认为白骨壤(Avicennia marina)的最适盐度为10-20,桐花树(Aegiceras corniculatum)的最适生长盐度在10以内。目前,对珍稀濒危的小种群红树植物的适生环境研究较少,关于小花老鼠簕的研究也主要集中在资源状况[1, 2]、遗传多样性[14]和药用价值[15-17]方面,尚未见其在盐度胁迫下的生长及生理生态方面的报道。因此,本研究通过分析小花老鼠簕幼苗在不同盐胁迫处理下的生长生理状况来了解其耐盐性及对盐胁迫逆境的适应情况,以确定其适宜生长盐度范围,为小花老鼠簕的种群保护和恢复提供理论依据。
1 材料与方法 1.1 材料小花老鼠簕种子采自广西防城港市天然小花老鼠簕植株,于2023年7月在广西海洋科学院(广西红树林研究中心)玻璃温室(109°08′04.39″E,21°28′46.05″N)内育种,出苗后将苗装入营养袋(10.5 cm×14 cm)中,用泥炭土∶椰糠=3∶1(体积比)的土壤培育。实验用苗苗龄为3月龄,株高为(12.98±0.75) cm,基径为(3.55±0.30) mm。
1.2 方法实验在广西海洋科学院(广西红树林研究中心)玻璃温室内进行(图 1)。实验时间为2023年10月20日至12月30日。利用储水箱、植物培养箱、定时器、水泵及遮阴系统等建立人工潮汐模拟系统,通过自动控制装置统一控制各处理组的淹水水位和淹水时长。实验所用海水为人工海水,通过添加海盐和自来水调配不同的盐度,水体盐度分别设计为0、5、10、15、20、25、30和35,共8个处理组,每个处理组4个重复,每个重复实验4株幼苗,共计128株小花老鼠簕幼苗。每天补充适量自来水或海盐以保持水位及盐度的稳定。模拟全日潮,每24 h为一个淹水周期,每个全日潮小花老鼠簕幼苗植株整体被淹没时间为4 h。实验结束后统计各处理组的成活株数并测定各生长指标;采集幼苗第2对完整的成熟叶片,经清水洗净并用吸水纸吸干叶子表面水分后放入-80 ℃冰箱保存,待后期测定相关生理指标。实验期间温室内最高气温为43.5 ℃,最低气温为9.0 ℃,平均气温为24.0 ℃;白天(7:00-18:00)最大光照强度为28 109 Lux,平均光照强度为3 635 Lux。

|
| 图 1 实验现场照片 Fig.1 Photo of experiment site |
1.3 指标的测定 1.3.1 生长指标
小花老鼠簕幼苗的生长情况主要监测其成活率、株高、基径、叶片数、叶面积及生物量(地下部和地上部)。
成活率(%)=实验结束时存活株数/实验种植株数×100%,
株高增量(cm)=实验结束时株高-实验开始时株高,
基径增量(mm)=实验结束时基径-实验开始时基径,
叶片数变化量(ind.)=实验结束时叶片数-实验开始时叶片数。
叶面积:实验结束后,每个处理组随机采集3株幼苗的第2对完整的成熟叶片,使用打印机[HP Laser MFP 136w,惠普科技(北京)有限公司]的扫描功能扫描每片叶子,并用Image J软件计算叶面积[18]。
生物量:实验结束后,每个处理组随机采集4株幼苗,洗净后将植株剪断,分成地上部和地下部装入信封,于105 ℃烘箱中杀青20 min,再在80 ℃下烘至恒重,使用精度为0.001 g的电子天平(YHM-3003,惠州市英衡电子科技有限公司)称量干物质重量。
1.3.2 生理指标过氧化氢酶(CAT)活性测定采用可见光法;过氧化物酶(POD)活性测定采用愈创木酚法;超氧化物歧化酶(SOD)活性测定采用WST-8法;丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)氧化法;游离脯氨酸含量测定采用茚三酮比色法;可溶性糖含量测定采用蒽酮比色法;可溶性蛋白含量测定采用考马斯亮蓝G-250染色法;光合色素含量测定采用95%乙醇直接提取法。以上指标的测定均使用苏州格锐思生物科技有限公司试剂盒,并参照试剂盒说明进行操作。
叶绿素荧光参数于实验后期的某个晴天10:00-16:00进行测定,每个处理组随机选择5株植株,选定第2对健康成熟叶片。用暗适应叶片夹DIVING-LC避光20 min后,将光纤对准叶片夹,用水下调制荧光仪(DIVING-PAM,德国WALZ公司)测定快速光曲线和光响应曲线,得到初始荧光(F0)、最大荧光(Fm)、可变荧光(Fv=Fm-F0)、光系统Ⅱ的最大光化学效率(Fv/Fm)以及光系统Ⅱ的相对电子传递速率(ETR)[19]。F0是叶片光系统Ⅱ完全开放时的光量子产量,Fm为光系统Ⅱ完全关闭时产生的最大光量子产量,Fv反映了植物进行光合作用的能力尺度,ETR值反映了植物叶片进行光合作用时光能电子传递效率。
1.4 统计分析利用Excel 2019和SPSS 18.0软件进行数据处理及统计分析。运用单因素方差分析(one-way ANOVA)结合Duncan多重比较检验不同处理间的差异性(P < 0.05);采用Pearson相关系数法对各生长生理指标进行相关性分析。
2 结果与分析 2.1 盐度对小花老鼠簕幼苗生长的影响受盐胁迫的影响,不同盐度处理下小花老鼠簕幼苗的成活率差异明显(图 2)。盐度0-15处理组,小花老鼠簕幼苗的成活率均为100%;盐度为20时,小花老鼠簕幼苗开始死亡,且随着盐度的升高小花老鼠簕幼苗的成活率不断下降;盐度>25,小花老鼠簕幼苗的成活率为0。盐度25处理组在实验初期部分幼苗出现萎蔫现象,适应15 d后恢复,但叶片开始脱落;盐度30和35处理组,实验胁迫后全部幼苗均出现萎蔫现象,一周后死亡。
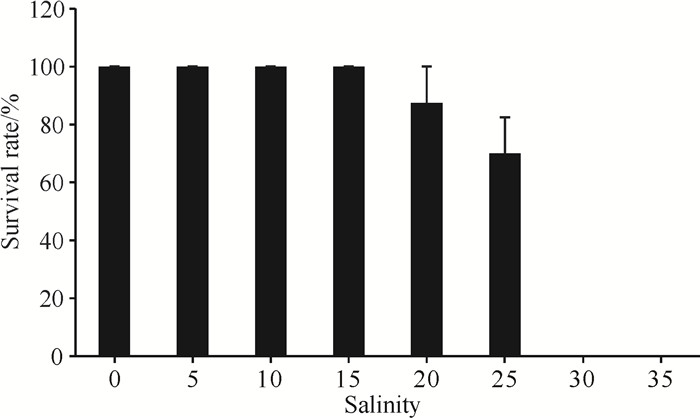
|
| 图 2 不同盐度对小花老鼠簕幼苗成活率的影响 Fig.2 Effects of different salinities on the survival rate of A.ebracteatus seedlings |
如图 3所示,盐度0处理组小花老鼠簕幼苗的根系发育较差,盐度5和10处理组发育最好,且随着盐度的升高,根系发育和枝叶生长均受到不同程度抑制。盐度5处理组的地下部干重最大(0.304 g)且显著高于盐度20和25处理组(P < 0.05),但与盐度0、10、15处理组无显著差异(P>0.05);盐度0至15处理组的地上部干重之间无显著差异(P>0.05), 均约为0.7 g,但显著高于盐度20和25处理组(P < 0.05, 图 4)。

|
| 图 3 不同盐度对小花老鼠簕幼苗生长及生根的影响 Fig.3 Effects of different salinities on the growth and rooting of A.ebracteatus seedlings |
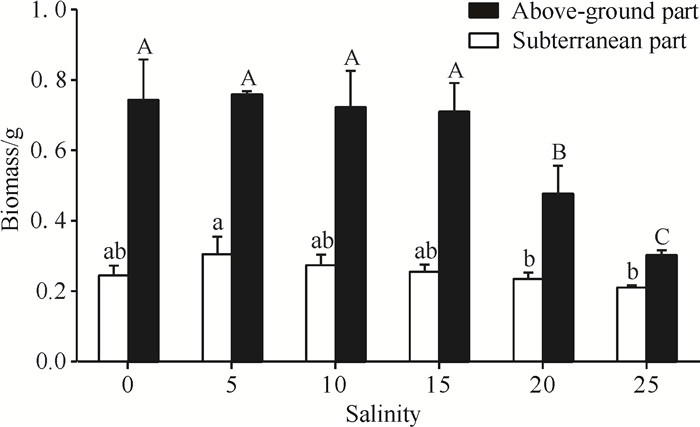
|
| Different lowercase letters indicate significant difference (P < 0.05).Different capital letters indicate significant difference (P < 0.05). 图 4 不同盐度对小花老鼠簕幼苗生物量的影响 Fig.4 Effects of different salinities on biomass of A.ebracteatus seedlings |
不同盐度处理下小花老鼠簕幼苗的株高增量、基径增量、叶片数变化量及叶面积均有显著差异(P < 0.05, 图 5)。随着盐度的增大,小花老鼠簕幼苗的株高增量、基径增量及叶片数变化量整体均减小;盐度0至15处理组的株高增量、基径增量及叶片数变化量总体上无显著差异(P>0.05),只在盐度0与15处理组的株高增量存在显著差异(P < 0.05);盐度20和25处理组的叶片脱落,叶片数变化量出现负增长,株高增量和基径增量均处于较低值。盐度0至20处理组的单片叶面积显著高于盐度25处理组(P < 0.05)。可见,小花老鼠簕幼苗地上部在盐度为0的环境下生长最好,盐度≥20后生长受到严重抑制。
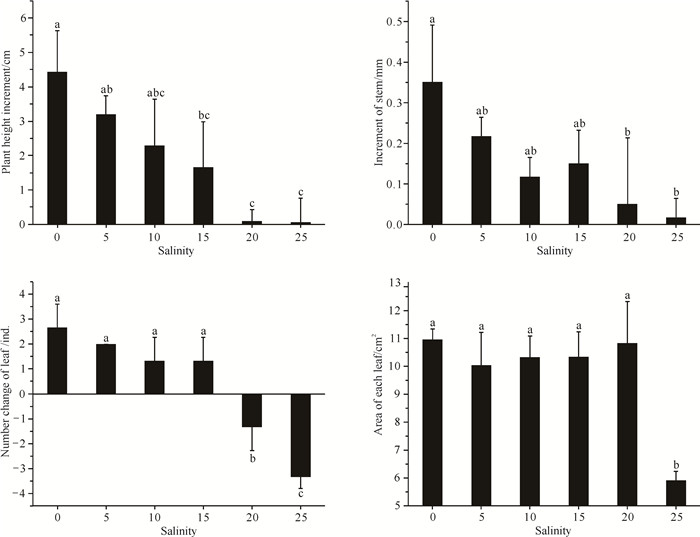
|
| Different lowercase letters indicate significant difference (P < 0.05). 图 5 不同盐度对小花老鼠簕幼苗生长指标的影响 Fig.5 Effects of different salinities on the growth parameters of A.ebracteatus seedlings |
2.2 盐度对小花老鼠簕幼苗生理的影响 2.2.1 叶片保护酶系统
在盐度胁迫下,除盐度5处理组的CAT活性显著高于盐度15处理组(P < 0.05)外,小花老鼠簕幼苗叶片中的CAT活性总体上无显著差异(P>0.05,图 6)。随着盐度的增加,小花老鼠簕幼苗叶片中的POD活性和SOD活性总体呈上升趋势,且差异显著(P < 0.05,图 6),说明小花老鼠簕幼苗叶片中POD活性和SOD活性对盐度变化具有较强的响应调节机制,以适应不同的环境变化。
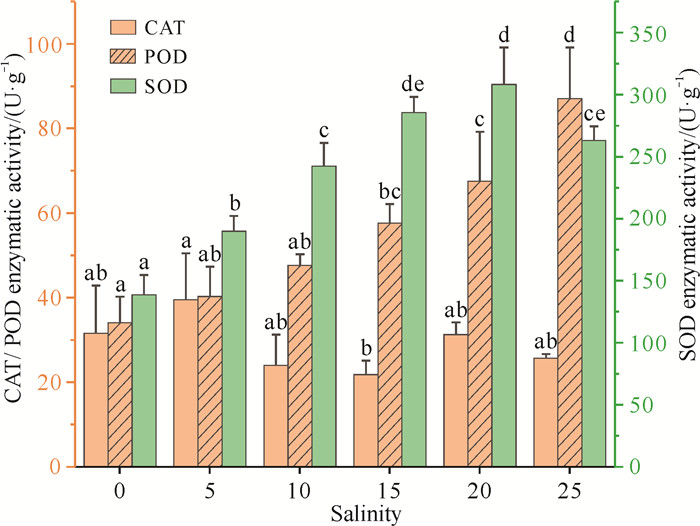
|
| For the same enzyme activity, different lowercase letters indicate significant difference (P < 0.05). 图 6 不同盐度对小花老鼠簕幼苗叶片酶活性的影响 Fig.6 Effects of different salinities on the enzymatic activity in leaves of A.ebracteatus seedlings |
2.2.2 叶片渗透调节物质含量及细胞膜透性
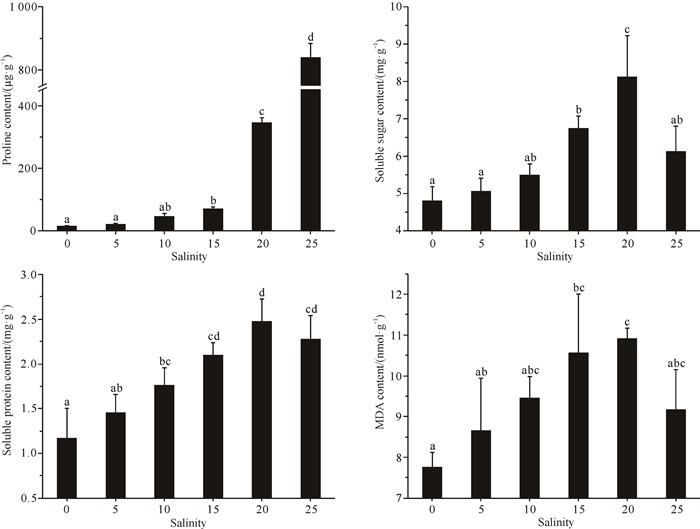
不同盐度处理下小花老鼠簕幼苗叶片内的脯氨酸含量、可溶性糖含量、可溶性蛋白含量和MDA含量均呈显著性差异(P < 0.05,图 7)。随着盐度的不断增大,小花老鼠簕幼苗叶片内的脯氨酸含量不断增大,盐度20和25处理组显著高于其他处理组(P < 0.05);而可溶性糖含量、可溶性蛋白含量和MDA含量表现为先增后减的趋势,在盐度为20时达到最大并开始下降。这些指标的不断增大,表明小花老鼠簕幼苗受盐胁迫伤害程度越来越严重,盐度超过20后小花老鼠簕幼苗的渗透调节系统受到一定的破坏。
|
| Different lowercase letters indicate significant difference (P < 0.05). 图 7 不同盐度对小花老鼠簕幼苗叶片脯氨酸、可溶性糖、可溶性蛋白及MDA含量的影响 Fig.7 Effects of different salinities on the contents of proline, soluble sugar, soluble protein and MDA in leaves of A.ebracteatus seedlings |
2.2.3 叶绿素含量
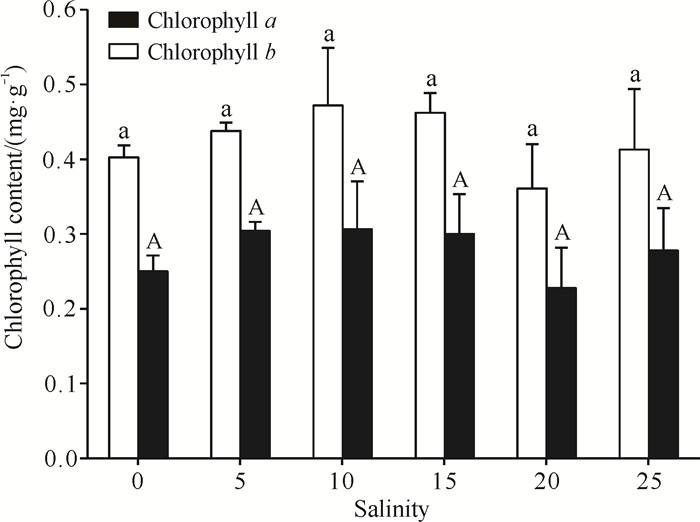
随着盐度的增加小花老鼠簕幼苗叶片中的叶绿素a和叶绿素b总体上呈先增后减的趋势,但均无显著性差异(P>0.05,图 8);叶绿素a含量最高的为盐度10处理组,盐度5、10和15处理组的叶绿素b含量最高,均约为0.3 mg·g-1。
|
| Different lowercase letters indicate significant difference (P < 0.05).Different capital letters indicate significant difference (P < 0.05). 图 8 不同盐度对小花老鼠簕幼苗叶片叶绿素含量的影响 Fig.8 Effects of different salinities on the contents of chlorophyll in leaves of A.ebracteatus seedlings |
2.2.4 叶绿素荧光特性
随着盐度的增加,小花老鼠簕幼苗叶片F0、Fm、Fv和ETR总体上均呈现先增后降的趋势,且存在着显著差异(P < 0.05);Fv/Fm在各处理组间均无显著性差异(P>0.05, 表 1)。
| 处理组 Treatment group |
F0 | Fm | Fv | Fv/Fm | ETR/ (μmol·m-2·s-1) |
| 0 | 233.40±11.06a | 1 096.00±50.14a | 862.60±42.52a | 0.79±0.01a | 17.68±2.85a |
| 5 | 239.40±26.96ab | 1 079.20±139.63a | 839.80±113.71a | 0.78±0.01a | 21.18±2.85b |
| 10 | 293.40±14.94c | 1 345.60±12.72b | 1 052.20±26.30b | 0.78±0.01a | 20.60±0.56bc |
| 15 | 296.40±8.87c | 1 356.20±57.64b | 1 059.80±50.49b | 0.78±0.01a | 20.80±0.46bc |
| 20 | 283.60±13.49c | 1 338.00±85.71b | 1 054.40±74.95b | 0.79±0.01a | 19.52±1.52abc |
| 25 | 266.75±36.82bc | 1 268.75±179.14b | 1 002.00±142.43b | 0.79±0.00a | 18.50±0.85ac |
| Note: different letters at the same column indicate significant difference (P < 0.05). | |||||
2.3 盐度影响下小花老鼠簕幼苗各生长指标的相关性
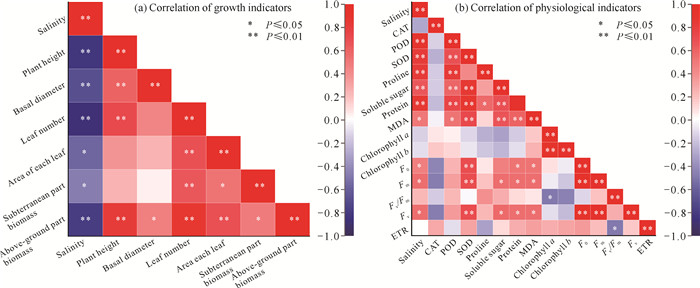
盐度与小花老鼠簕幼苗各生长指标均呈显著负相关[P < 0.05,图 9(a)],表明随着盐度的不断增加,小花老鼠簕幼苗的生长受到不同程度的抑制,株高、基径、叶片数和地上部干重受到的影响最为显著。地上部干重与各生长指标均呈显著正相关(P < 0.05),表明地上部干重受到其他生长指标的显著影响。而总体上各生长指标之间均为正相关,生长指标之间具有相互影响的作用。
|
| The color block column on the right indicates the degree of correlation, red is positive correlation, blue is negative correlation. 图 9 小花老鼠簕幼苗生长、生理指标的相关性 Fig.9 Correlation of growth indicators and physiological indicators of A.ebracteatus seedlings |
2.4 盐度影响下小花老鼠簕幼苗各生理指标的相关性
总体上,盐度与小花老鼠簕幼苗各生理指标均呈显著正相关[P < 0.05,图 9(b)],其中叶片中的酶活性和渗透调节物质受到的影响最为显著,表明盐度的增加促使小花老鼠簕幼苗的生理调控机制不断增强。酶活性和渗透调节物质之间也存在着较显著的相关性,且均为正相关(CAT活性除外),CAT活性与各指标均无显著相关性(P>0.05);叶绿素a和叶绿素b总体上与各指标均无显著相关性(P>0.05);表明CAT活性、叶绿素a和叶绿素b对盐度变化无明显响应,与其他生理指标的关联性较小。叶绿素荧光参数与其他生理指标存在一定的相关性,但无明显规律。
3 讨论 3.1 小花老鼠簕幼苗生长对盐度的响应盐度对红树植物生长影响较大,过高或过低均会抑制其生长发育,甚至导致其死亡[9, 20]。本研究中,盐度为20时,小花老鼠簕幼苗开始死亡,且随着盐度的增加小花老鼠簕幼苗的成活率不断下降,表明小花老鼠簕幼苗的适宜生长盐度在20以下。而在尖瓣海莲的研究中,盐度为25时幼苗才出现死亡现象[9],说明不同红树植物对盐胁迫的耐受程度存在着差异。
植物的生长指标能直观反映植物在逆境胁迫下的生长状况[21]。本研究中,小花老鼠簕幼苗的生长状况总体上随盐度的升高不断变差,表现出低盐促进、高盐抑制的现象,这与其他红树植物的生长现象类似[22]。盐度≥20时小花老鼠簕幼苗株高增量和基径增量均较低,且叶片数变化量为负值,叶片脱落严重;在盐度为25时,单片叶面积显著小于其他处理组,且叶形褶皱较大。尖瓣海莲在盐度25以上时,同样表现出叶片脱落、叶面积变小的症状[9],这可能是植物面对不利环境时的一种应对方式[23]。尖瓣海莲的地上部和根系生物量的积累均表现出随盐度的升高呈先升后降的趋势[9],而在老鼠簕(A.ilicifolius)和秋茄的研究中,生物量积累总体表现出随盐度的升高而显著降低的趋势[24, 25]。小花老鼠簕幼苗则与尖瓣海莲类似,随着盐度的升高,地下部和地上部生物量的积累均呈现先升后降的趋势。基于小花老鼠簕幼苗的株高增量、基径增量和叶片数变化量,盐度为0时,更有利于其地上部的生长发育;而适当的低盐(盐度5、10和15)则促进其根系的生长发育,有利于地下生物量的积累,这与木榄、白骨壤和红海榄(Rhizophora stylosa)的生长发育情况相似[11, 26]。
3.2 小花老鼠簕幼苗生理变化对盐度的响应外界胁迫作用会诱导植物体内产生多种活性氧,SOD、POD和CAT作为植物内源的活性氧清除剂,起到清除活性氧的作用,是反映植物抗逆性的重要指标[20]。随着盐度的不断增大,小花老鼠簕幼苗叶片内的SOD活性和POD活性总体呈上升趋势,这是植物对盐逆境的一种生理反应,表明小花老鼠簕幼苗受盐逆境胁迫程度越来越严重。值得注意的是,在盐度为25时SOD活性下降,表明小花老鼠簕幼苗的抗氧化保护酶系统受到了损伤,调节能力下降,这与红海榄在高盐胁迫下的响应相似,只是红海榄具有较强的耐盐性,盐度为40时SOD活性才下降[27];而在盐胁迫下,尖瓣海莲[9]、杨叶肖槿(Thespesia populnea)[28]和水黄皮(Pongamia pinnata)[29]的SOD活性呈上升趋势,说明实验设置的盐度未对植物的抗氧化保护酶系统造成严重损伤,酶系统可保持正常的响应机制。CAT活性在各处理组中总体上差异不显著(P>0.05),可能是盐度胁迫下,小花老鼠簕幼苗的CAT活性调节较差。
可溶性有机物质的累积有助于植物细胞渗透压的调节。小花木榄(Bruguiera parviflora)在高盐胁迫时通过累积游离脯氨酸,增加还原与非还原糖类、总氨基酸含量来抵抗盐胁迫[30]。在本研究中,小花老鼠簕幼苗叶片内的脯氨酸含量、可溶性糖含量和可溶性蛋白含量总体上均随盐度增加而不断增大。盐度20和25处理组的脯氨酸含量远高于其他处理组,说明盐度≥20时小花老鼠簕所受胁迫加重,脯氨酸含量大量增加,以维持细胞渗透压来保证细胞正常的生理功能[31],而老鼠簕[25]和杨叶肖槿[28]也存在着此现象。可溶性糖含量和可溶性蛋白含量在盐度为20时达到最大值,然后下降,同样也表明盐度20是小花老鼠簕幼苗耐盐胁迫的临界点,盐度超过20会对小花老鼠簕幼苗的渗透调节功能产生不可逆的伤害。逆境胁迫会导致细胞膜的完整性破坏或丧失,而MDA是膜脂质过氧化的重要产物,可以体现植物在逆境中受到的胁迫程度[32, 33]。随着盐度的增加,MDA含量呈现先增后减的趋势,与可溶性糖含量和可溶性蛋白含量的变化存在同步性,说明渗透调节物质的变化与膜透性存在相关性,小花老鼠簕幼苗细胞膜在高盐环境中受到了严重的破坏。
叶绿素a与叶绿素b是高等植物进行光合作用的主要色素,其含量变化在一定程度上可以反映光合作用的强度[34],而光合色素的合成常受到环境因素的影响。随着盐度的增大,小花老鼠簕幼苗叶片内的叶绿素a和叶绿素b总体上呈现先增后减趋势,盐度5、10和15处理组的叶绿素a和叶绿素b含量相对较大,表明盐度5-15有利于小花老鼠簕幼苗光合色素的积累,光合作用强度较大,利于植株生长。
叶绿素荧光参数反映光系统Ⅱ的光化学效率,可以用来指示植物对环境胁迫的耐受能力[35, 36]。本研究发现,随着盐度的增加,F0、Fm、Fv和ETR总体上均呈先增后减的趋势,表明适当的盐度可有效提高小花老鼠簕幼苗的光化学效率。Fv/Fm反映了植物叶片光系统的光能转化效率,多数植物的Fv/Fm稳定维持在0.80以上,但红树植物的Fv/Fm较低,平均约为0.75[36]。当植物受到环境因子胁迫时Fv/Fm值会降低,但本研究中Fv/Fm均大于0.75而小于0.80,且各处理组间均无显著性差异(P>0.05),说明Fv/Fm无法很好地表征小花老鼠簕幼苗受盐度胁迫的影响。
3.3 盐度影响下小花老鼠簕幼苗生长、生理指标的相关性分析植物不同功能性状之间存在着密切的联系,所表现出来的是对环境变化的综合响应[37]。在本研究中,盐度与小花老鼠簕幼苗各生长指标均呈显著负相关,说明盐度的增加对小花老鼠簕幼苗的生长产生了抑制作用,主要体现在株高、基径、叶片数和地上部干重。另外,小花老鼠簕幼苗各生长指标之间总体上均存在正相关,生长上具有协同性,而地上部干重与各生长指标均呈显著正相关(P < 0.05),在生长上具有代表性。
盐度变化对植物的影响主要体现在渗透胁迫、离子毒性、氧化胁迫以及由此所引发的一系列次级胁迫上[38]。因此,需要综合分析植物不同功能性状之间的内在联系,了解植物对环境变化的响应及其内部的调控机制。在本研究中,各生理指标总体上与盐度存在着显著正相关,其中叶片中的酶活性和渗透调节物质受到的影响最为显著,且相互之间也存在着显著相关性。盐胁迫首先对植物造成的伤害是渗透胁迫,导致膜透性增大,为抵御盐胁迫,植物会通过积累一些渗透调节物质(如脯氨酸、可溶性糖和蛋白)来调节自身的渗透势,以此提高植物的耐盐性[39]。而当植物叶片受损,活性氧增加,植株将通过被动增加SOD和POD活性来清除过多的活性氧以减轻膜系统的氧化损伤。因此,在盐度的作用下,小花老鼠簕幼苗叶片的酶活性和渗透调节物质之间相互影响、相互调节。
4 结论小花老鼠簕幼苗对低盐胁迫具有一定的耐受性和适应性。随着盐度的不断增大,小花老鼠簕幼苗的生长受到影响,小花老鼠簕幼苗的POD、SOD、脯氨酸、可溶性糖、可溶性蛋白和MDA等重要生理指标产生盐胁迫响应。本研究表明,盐度与小花老鼠簕幼苗各生长指标均呈显著负相关(P < 0.05),与各生理指标总体上呈显著正相关(P < 0.05);小花老鼠簕幼苗可生长于盐度20以下,盐度≥20对植株生长生理均产生抑制并导致部分植株死亡,适宜生长盐度为0-15,且适当的低盐(盐度5和10)可促进其根系的生长发育,有利于生物量的积累。
| [1] |
林广旋, 朱耀军, 郭嘉, 等. 雷州半岛珍稀红树植物小花老鼠簕资源现状与保护策略[J]. 湿地科学与管理, 2022, 18(3): 62-65. |
| [2] |
黄丽艳, 史小芳, 莫竹承, 等. 广西珍稀濒危真红树植物小花老鼠簕分布及种群特征[J]. 广西科学院学报, 2020, 36(4): 353-360. DOI:10.13657/j.cnki.gxkxyxb.20201027.005 |
| [3] |
张颖, 陈光程, 钟才荣. 中国濒危红树植物研究与恢复现状[J]. 应用海洋学学报, 2021, 40(1): 142-153. |
| [4] |
王文卿, 陈琼. 南方滨海耐盐植物资源(一)[M]. 厦门: 厦门大学出版社, 2013.
|
| [5] |
海南省人民政府. 海南省省级重点保护野生植物名录[EB/OL]. (2007-01-10)[2024-02-29]. http://www.hainan.gov.cn/hainan/szfwj/200701/d7beefbb1fc243a4b7f1a6b3f3cb7123.shtml.
|
| [6] |
林鹏, 张宜辉, 杨志伟. 厦门海岸红树林的保护与生态恢复[J]. 厦门大学学报(自然科学版), 2005, 44(S1): 1-6. |
| [7] |
江鎞倩, 李瑞利, 沈小雪, 等. 红树植物耐盐-耐淹性的荟萃分析及其应用对策[J]. 北京大学学报(自然科学版), 2022, 58(4): 687-699. |
| [8] |
SYAHID L N, SAKTI A D, VIRTRIANA R, et al. Determining optimal location for mangrove planting using remote sensing and climate model projection in Southeast Asia[J]. Remote Sensing, 2020, 12(22): 3734. DOI:10.3390/rs12223734 |
| [9] |
廖宝文, 邱凤英, 张留恩, 等. 盐度对尖瓣海莲幼苗生长及其生理生态特性的影响[J]. 生态学报, 2010, 30(23): 6363-6371. |
| [10] |
林鹏, 陈德海, 肖向明, 等. 海滩盐度对两种红树叶的碳水化合物和含氮化合物含量的影响[J]. 海洋学报(中文版), 1984, 6(6): 851-855. |
| [11] |
王文卿, 林鹏. 盐度对红树植物木榄生长的影响[J]. 厦门大学学报(自然科学版), 1999, 38(2): 121-127. |
| [12] |
郑文教, 林鹏. 盐度对红树植物海莲幼苗的生长和某些生理生态特性的影响[J]. 应用生态学报, 1992, 3(1): 9-14. |
| [13] |
陈长平, 王文卿, 林鹏. 盐度对无瓣海桑幼苗的生长和某些生理生态特性的影响[J]. 植物学通报, 2000, 35(5): 457-461. DOI:10.3969/j.issn.1674-3466.2000.05.013 |
| [14] |
高霆炜, 童立豪, 钟云旭, 等. 基于微卫星标记的小花老鼠簕的遗传多样性研究[J/OL]. 广西科学, 1-12[2024-09-18]. https://doi.org/10.13656/j.cnki.gxkx.20240417.001.
|
| [15] |
OLATUNJI O J, OLATUNDE O O, JAYEOYE T J, et al. New insights on Acanthus ebracteatus Vahl: UP-LC-ESI-QTOF-MS profile, antioxidant, antimicrobial and anticancer activities[J]. Molecules, 2022, 27(6): 1981. DOI:10.3390/molecules27061981 |
| [16] |
KANLAYAVATTANAKUL M, CHAIKUL P, KONGKOW M, et al. Anti-aging of phenolic-rich Acanthus ebracteatus Vahl.extracts[J]. Chemical and Biological Technologies in Agriculture, 2023, 10(1): 32. DOI:10.1186/s40538-023-00403-w |
| [17] |
WISUITIPROT V, INGKANINAN K, CHAKKAVITTUMRONG P, et al. Effects of Acanthus ebracteatus Vahl.extract and verbascoside on human dermal papilla and murine macrophage[J]. Scientific Reports, 2022, 12(1): 1491. DOI:10.1038/s41598-022-04966-w |
| [18] |
方静, 武帅, 孟昭军, 等. 两种丛枝菌根真菌复合接种对青山杨生长生理指标的影响[J]. 东北林业大学学报, 2024, 52(4): 17-22. |
| [19] |
权佳惠. 贝克喜盐草对Zn、Cd胁迫的生理响应[D]. 南宁: 广西大学, 2022.
|
| [20] |
TAKEMURA T, HANAGATA N, SUGIHARA K, et al. Physiological and biochemical responses to salt stress in the mangrove, Bruguiera gymnorrhiza[J]. Aquatic Botany, 2000, 68(1): 15-28. |
| [21] |
梁芳, 潘艳菊, 邓旭, 等. 濒危半红树植物玉蕊对潮汐淹浸逆境的应答特性分析[J]. 福建农业学报, 2020, 35(12): 1346-1356. |
| [22] |
叶勇, 卢昌义, 胡宏友, 等. 三种泌盐红树植物对盐胁迫的耐受性比较[J]. 生态学报, 2004, 24(11): 2444-2450. |
| [23] |
梁芳, 檀小辉, 邓旭, 等. 半红树植物玉蕊对淹水-盐度胁迫的生长及生理响应[J]. 广西植物, 2021, 41(6): 872-882. |
| [24] |
游惠明. 秋茄幼苗对盐度、淹水环境的生长适应[J]. 应用生态学报, 2015, 26(3): 675-680. |
| [25] |
诸姮, 胡宏友, 卢昌义. 盐度对药用红树植物老鼠簕种子萌发和幼苗生长的影响[J]. 厦门大学学报(自然科学版), 2008, 47(1): 131-135. |
| [26] |
CLOUGH B F. Growth and salt balance of the mangroves Avicennia marina (Forsk.) Vierh.and Rhizophora stylosa Griff.in relation to salinity[J]. Functional Plant Biology, 1984, 11(5): 419-430. |
| [27] |
廖岩, 陈桂珠. 三种红树植物对盐胁迫的生理适应[J]. 生态学报, 2007, 27(6): 2208-2214. |
| [28] |
邱凤英, 廖宝文, 肖复明. 半红树植物杨叶肖槿幼苗耐盐性研究[J]. 林业科学研究, 2011, 24(1): 51-55. |
| [29] |
邱凤英, 李志辉, 廖宝文. 半红树植物水黄皮幼苗耐盐性的研究[J]. 中南林业科技大学学报, 2010, 30(10): 62-67. |
| [30] |
PARIDA A K, DAS A B, MOHANTY P. Defense potentials to NaCl in a mangrove, Bruguiera parviflora: differential changes of isoforms of some antioxidative enzymes[J]. Journal of Plant Physiology, 2004, 161(5): 531-542. |
| [31] |
刘逸泠, 覃盈盈, 郑海雷. 红树植物耐水淹和高盐适应性研究进展[J]. 厦门大学学报(自然科学版), 2017, 56(3): 314-322. |
| [32] |
方发之, 桂慧颖, 黎肇家, 等. 6种红树幼苗对不同盐度的生理适应性[J]. 植物研究, 2023, 43(6): 881-889. |
| [33] |
张红梅, 武红, 王如福. 低压条件下冬枣的膜脂过氧化变化[J]. 中国农业大学学报, 2009, 14(6): 51-55. |
| [34] |
WANG T, YANG W, XIE Y, et al. Effects of exogenous nitric oxide on the photosynthetic characteristics of bamboo (Indocalamus barbatus McClure) seedlings under acid rain stress[J]. Plant Growth Regulation, 2017, 82(1): 69-78. |
| [35] |
WANG Y, TONG Y, CHU H, et al. Effects of different light qualities on seedling growth and chlorophyll fluorescence parameters of Dendrobium officinale[J]. Biologia, 2017, 72(7): 735-744. |
| [36] |
朱一民, 李婷, 孙当歌, 等. 遮荫对8种红树植物幼苗叶片叶绿素荧光参数的影响[J]. 热带亚热带植物学报, 2023, 31(6): 797-804. |
| [37] |
张晓婷, 王俊杰. 红树植物功能性状对盐和铜胁迫的响应[J]. 生态学报, 2024, 44(3): 1284-1297. |
| [38] |
吴一鸣, 崔会婷, 张昆, 等. 两种白颖苔草对梯度NaCl胁迫的生理生化响应及综合评价[J]. 草地学报, 2024, 32(3): 736-745. |
| [39] |
吴平, 陈晓梅, 丁宁. 4种湿生植物苗期耐盐性综合评价[J]. 江苏农业科学, 2014, 42(9): 148-150. |



