2. 自然资源部北部湾滨海湿地生态系统野外科学观测研究站,广西北海 536015;
3. 北海市实验学校,广西北海 536000
2. Observation and Research Station of Coastal Wetland Ecosystem in Beibu Gulf, Ministry of Natural Resources, Beihai, Guangxi, 536015, China;
3. Beihai Experimental School, Beihai, Guangxi, 536000, China
红树林是热带和亚热带海岸潮间带木本植物群落的统称[1, 2]。生长于海洋与陆地交接地带的红树林,其形态结构、繁殖传播等方面均存在独特性,如部分红树植物具有胎生现象这一典型特征[3]。植物的胎生现象是指种子成熟后不经过休眠或只短暂休眠就直接在母体萌发的现象[4]。胎生的繁殖方式可为后代提供大量能量与营养,提高新生个体对不良环境的抵抗力,是大部分红树植物适应潮间带生境的典型特征之一[5]。红树植物的胎生可分为显胎生和隐胎生,前者是指繁殖体(主要是下胚轴)突破种皮和果皮两层结构并伸出果实外的现象,主要集中在红树科(Rhizophoraceae)的红树属(Rhizophora)、秋茄树属(Kandelia)、角果木属(Ceriops)和木榄属(Bruguiera);后者是指种子发育只突破种皮但仍包被在果实内的现象,如海榄雌属(Avicennia)和蜡烛果属(Aegiceras)的植物[4]。本研究选取3种我国最常见、分布最广的具备胎生现象的真红树植物白骨壤(Avicennia marina)、桐花树(Aegiceras corniculatum)和木榄(Bruguiera gymnorhiza)为实验树种。其中,隐胎生的白骨壤是耐盐和耐淹能力最强的海洋性演替先锋红树植物,是我国分布面积最大的红树植物种类;隐胎生的桐花树是盐度较低区域红树林演替的先锋树种,在全国的分布面积仅次于白骨壤;显胎生的木榄是我国分布最广的红树植物之一[1, 6, 7]。
关于红树植物胎生现象和繁殖体生理生态特征的研究主要包括:闫中正等[8]和李庆顺等[9]对红树胎生现象、红树潮间带生境适应性及其组学的研究总结;张宜辉[10]对木榄和桐花树胎生繁殖体发育过程中形态、生物量、含水量、胚轴密度、渗透势等的系统研究;邱广龙[11]对红树植物白骨壤繁殖生态研究及其果实品质的具体分析,等等。而关于胎生红树植物繁殖体的形态结构与其漂浮迁移性的关系,以及繁殖体经过漂浮后在不同海域(盐度)下的萌发情况等方面,暂未见具体的研究报道,仅见张磊等[12]报道了非胎生红树植物瓶花木(Scyphiphora hydrophyllacea)、海漆(Excoecaria agallocha)、榄李(Lumnitzera racemosa)和老鼠簕(Acanthus ilicifolius)繁殖体特征与分带的关系。因此,本研究以白骨壤、桐花树和木榄这3种我国最常见的典型胎生红树植物[1, 13]繁殖体为研究对象,探索其质量、长度、体积、密度、耐盐能力等特征与萌发的关系,以更好地了解红树林对潮间带生境胁迫,尤其是繁殖传播方面的适应能力。
1 材料与方法 1.1 材料调查采样已取得广西北海滨海国家湿地公园和广西山口红树林生态国家级自然保护区的同意,并依法依规进行样品采集。实验采集大小、长度相近,成熟饱满未被虫蛀的白骨壤、桐花树和木榄繁殖体各120颗。白骨壤、桐花树繁殖体采集于广西北海滨海国家湿地公园冯家江片区,木榄繁殖体采集于广西山口红树林生态国家级自然保护区英罗港片区。采集时间为2023年9月22-23日。
实验还需高浓度海水、经淡水淘洗的海沙、蒸馏水等。
1.2 仪器与设备体视显微镜(型号:SZX16,日本奥林巴斯株式会社)、千分之一天平(型号:JA11003,上海析牛莱伯仪器有限公司)、盐度计(型号:AZ8371,台湾衡欣实业股份有限公司)、游标卡尺、长枝剪、封口袋、直尺、烧杯、量筒、解剖刀、橡皮泥、带盖的圆柱形水桶(Φ28 cm×30 cm)、32孔育苗托盘(48 cm×27 cm)、塑料筐(60 cm×40 cm)、细纱网等。
1.3 方法 1.3.1 繁殖体测量与解剖依次测量3种胎生红树植物繁殖体的质量、长度,使用排水法测量体积后计算其密度;观测3种植物繁殖体外观特征并进行解剖,使用体视显微镜观察其横切面结构。
1.3.2 繁殖体漂浮实验参照张磊等[12]的研究进行盐度梯度设置,本实验用高浓度海水分别配置盐度为10、20、30的海水,把已编号的胎生红树植物繁殖体放置于室内圆柱形具盖水桶中(具盖可减少水分蒸发),每个桶内分别加入淡水(盐度为0)和盐度梯度10、20、30的海水,每个桶内放入以上3种胎生红树植物繁殖体各10个,每个盐度梯度设置3个重复。观察繁殖体每天在不同盐度梯度海水中的漂浮情况,记录繁殖体在水中漂浮和下沉的个体数,漂浮的繁殖体个体数占全部个体数的比率为漂浮率,以漂浮率来衡量漂浮性。漂浮实验为期9 d,蒸发散失的水分用蒸馏水补充。
1.3.3 繁殖体萌发实验用自来水反复冲洗海沙,直至其冲洗液体盐度接近0,将其作为繁殖体的培养基。取1.3.2节漂浮实验后的3种胎生红树植物繁殖体,放在盛有沙子的育苗托盘中培养,用淡水和盐度分别为10、20、30的海水进行浇灌,每种处理分别放30颗繁殖体,隔天观察并记录沙基质中3种红树植物繁殖体在不同盐度条件下的初始萌发时间和萌发速率,根据繁殖体初始萌发时间和萌发率的差异,来评价繁殖体的萌发状态,实验为期24 d。
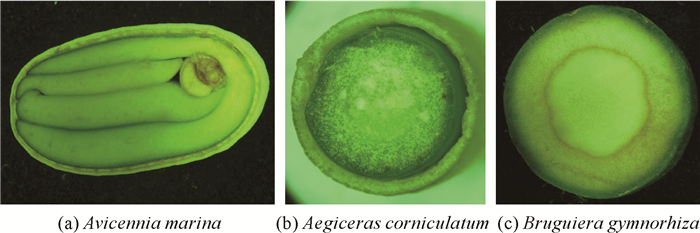
2 结果与分析 2.1 繁殖体形态特征分析采集的3种胎生红树植物繁殖体如图 1所示。白骨壤的隐胎生蒴果近扁球形,直径约2.0 cm;桐花树隐胎生果实圆柱形并弯曲如新月,形似“小辣椒”,长6-8 cm,直径约5 mm;木榄显胎生果实胚轴呈雪茄状,端部钝,长13-25 cm。

|
| 图 1 繁殖体外观 Fig.1 Appearance of the propagules |
由表 1可知,3种胎生红树植物繁殖体的质量依次是木榄>白骨壤>桐花树,木榄繁殖体的质量最大,平均可达到24.42 g/颗。按长度排序则为木榄>桐花树>白骨壤,木榄繁殖体平均长度远大于其他两种胎生红树植物繁殖体,达14.77 cm;三者体积大小顺序是木榄>白骨壤>桐花树,密度大小则是白骨壤>桐花树>木榄,白骨壤密度最大,达0.978 g/cm3;桐花树的平均密度居中,为0.959 g/cm3;木榄密度最小,平均0.939 g/cm3。3种胎生红树植物的繁殖体密度均小于1.000 g/cm3。
| 种类 Species |
质量/g Weight/g |
长度/cm Length/cm |
直径/cm Diameter/cm |
体积/cm3 Volume/cm3 |
密度/(g/cm3) Density/(g/cm3) |
|
| Avicennia marina | 2.84±0.36 | 2.29±0.13 | width 2.04 ±0.14 | thickness 1.11±0.05 | 2.90 | 0.978 |
| Aegiceras corniculatum | 0.96±0.15 | 4.10±0.44 | 0.55±0.03 | 1.00 | 0.959 | |
| Bruguiera gymnorhiza | 24.42±4.25 | 14.77±1.36 | 1.64±0.10 | 26.00 | 0.939 | |
通过对白骨壤、桐花树和木榄这3种胎生红树植物繁殖体的解剖和显微观察(图 2):白骨壤繁殖体附满绒毛,经横切、纵切均发现果实内部有较多缝隙,果皮薄且其保护作用有限,有利于繁殖体脱落后吸水破皮;桐花树繁殖体的木质果皮质地坚硬、韧性强,对繁殖体有很好的保护作用,但其果皮与种子之间缝隙也相对较大,容易脱落;木榄繁殖体个体较大,果皮厚且质地疏松,致使整个繁殖体密度较小,在低盐海域仍可漂浮。木榄果皮外的一层革质可以减少病虫害发生,还能让繁殖体在海水中漂流时更耐腐蚀,有助于其繁殖扩散。
|
| 图 2 繁殖体横切截面 Fig.2 Cross-sections of the propagules |
2.2 繁殖体漂浮特征分析
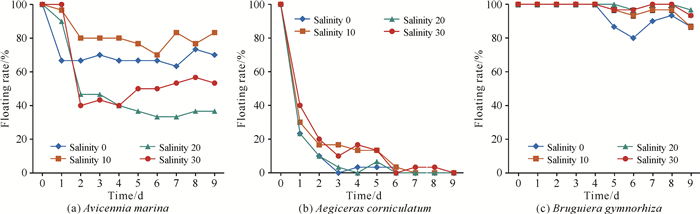
由图 3可知,3种胎生红树植物繁殖体在不同盐度下的漂浮特征存在明显差异。白骨壤繁殖体在不同盐度条件下均会发生下沉,在漂浮实验的第2-3天明显下沉;桐花树繁殖体经2-6 d实验后漂浮性很差,几乎全部下沉,不能长久漂浮在海水中;木榄繁殖体仅在实验中期有少数下沉,其最终漂浮率均>85.00%,表现出极强的漂浮性。综上,只有白骨壤繁殖体在不同盐度海水中的漂浮性存在显著差异,在盐度10、0和30条件下漂浮率高,漂浮实验结束时其漂浮率仍分别达到83.33%、70.00%和53.33%;在盐度20的条件下其漂浮率仅为36.67%。值得一提的是,在实验过程中发现白骨壤繁殖体由于外果皮被浸泡后脱落,子叶展开后有利于繁殖体的漂浮,对漂浮实验结果产生较大的影响;而桐花树繁殖体则由于胚轴迅速吸水将果皮顶破,在较短时间(2-6 d)内快速下沉。
|
| 图 3 不同盐度海水中繁殖体漂浮率 Fig.3 Floating rate of the propagules in seawater of different salinities |
2.3 繁殖体萌发特征分析
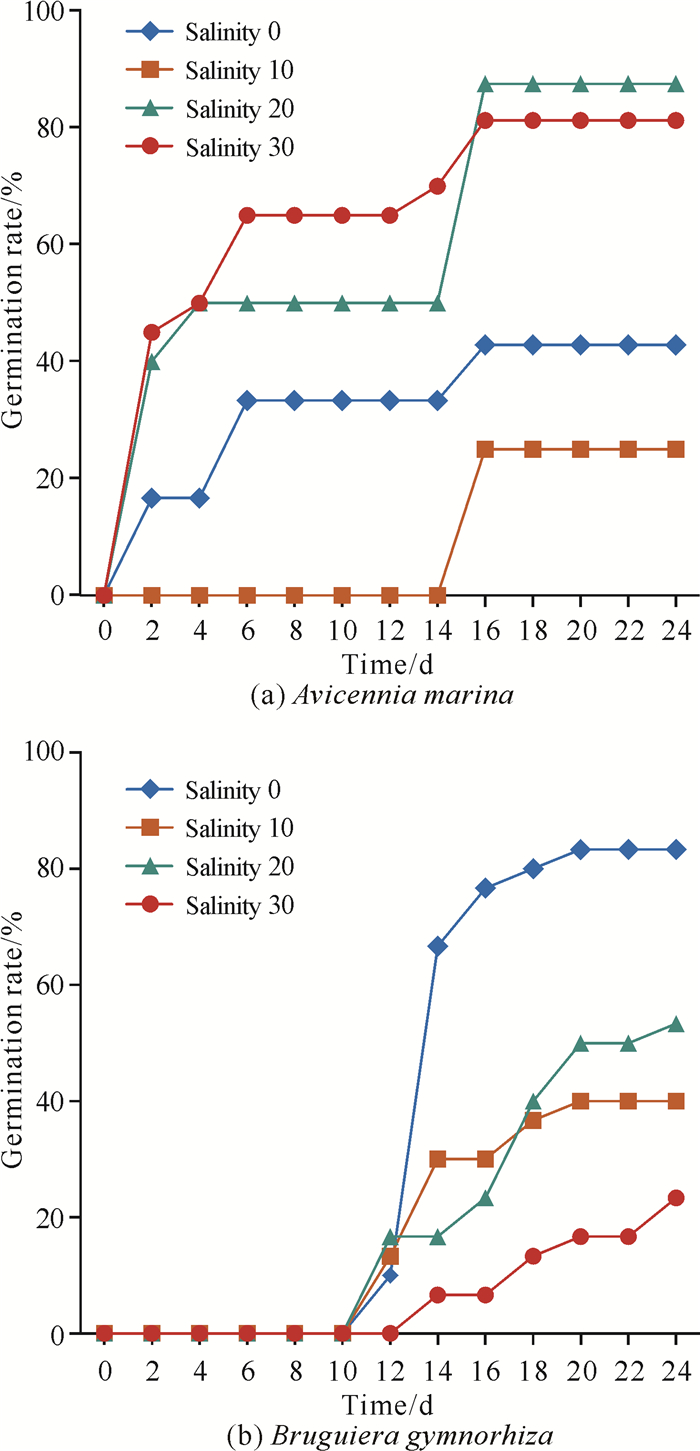
白骨壤、木榄和桐花树繁殖体的部分萌发状态如图 4所示。在初始萌发时间上,白骨壤萌发时间较早,在实验开始的第2天即开始萌芽,而木榄繁殖体在培育10 d后萌发,显著迟于白骨壤。桐花树的繁殖体则始终未见萌发,仅在实验结束后发现部分繁殖体长出根系[图 4(b)]。

|
| 图 4 繁殖体萌芽照 Fig.4 Germination photos of the propagules |
如图 5所示,不同盐度条件下的白骨壤繁殖体都有萌发,实验结束时萌发率介于25.00%-87.50%,平均萌发率达到59.15%,其对盐度有广泛且较强的耐受性,在高盐环境下(海水盐度20和30)的萌发率比低盐环境高;实验结束时木榄繁殖体的萌发率介于23.33%-83.33%,均值为50.00%。与白骨壤繁殖体显著不同的是,木榄繁殖体在低盐环境中的萌发率远高于高盐环境,盐度低于10时的萌发率接近90.00%,盐度30时的最高萌发率仅为23.00%。
|
| 图 5 不同盐度条件下繁殖体萌发率 Fig.5 Germination rate of the propagules under different salinities |
3 讨论 3.1 繁殖体形态、漂浮特征与繁殖扩散的关系
红树植物繁殖体可长时间保持浮力和活力,以增加其有效扩散范围[14-16]。繁殖体密度的差异使得各物种在海水中存在不同的漂浮状态,在经常被水体淹没的环境(如潮间带环境)中,繁殖体的浮力是影响其扩散能力的重要因素之一[17]。红树植物繁殖体的形态特征和红树植物的繁殖传播具有相关性,不同形态、质量和密度的繁殖体(图 1、表 1和图 2)在不同海水环境下的漂浮表现不同(图 3),表明繁殖体形态特征对红树植物繁殖体的传播距离产生影响。本研究选取的3种胎生红树植物繁殖体密度均略低于海水,有利于繁殖体的扩散,其在海水中一段时间后漂浮率下降,可确保繁殖体在合适的区域下沉。白骨壤繁殖体密度相对最高,理论上应该是白骨壤繁殖体漂浮性最差,但经海水浸泡后白骨壤繁殖体外果皮会自动脱落而子叶张开,一定程度上有利于其漂浮;同时白骨壤繁殖体在不同盐度条件下的漂浮率均较高,也充分说明其对环境有很强的适应能力。桐花树繁殖体体积小、质量小的“双小”特征与其漂浮表现相对匹配,但其胚轴迅速吸水将果皮顶破后,繁殖体下沉而导致其漂浮能力差,相对而言不适合长距离的漂流,其本身的繁殖传播可能更多依靠河口水流的带动[10]。木榄作为显胎生红树植物的代表,其繁殖体形态以及强漂浮性为其远距离传播提供基础支撑。Liu等[18]研究也发现红树植物繁殖体密度与其大小没有关系,且红树植物繁殖体能够自行选择合适的栖息地,从而影响红树植物的分布。本研究也在一定程度上证实了繁殖体形态特征对红树植物野外扩散以及野外分布(分带)产生影响[18, 19]。值得注意的是,白骨壤繁殖体和桐花树繁殖体在漂浮过程中由于外果皮脱落而产生漂浮行为的改变,会进一步影响其扩散定植。因此,在今后讨论或预测红树植物分布模式的原因时,应同时考虑其繁殖体形态和漂浮特征。
3.2 繁殖体萌发特征与繁殖扩散的关系红树植物生长在受潮水频繁冲刷的海陆交界带,生长环境十分恶劣,导致红树植物一般具备快速萌发的能力[4, 12],但不同红树植物由于其繁殖体特征的不同而导致其萌发能力有所差异。白骨壤在高、中、低潮间带均能生长,是耐盐和耐淹能力最强的红树植物[20],对土壤的适应性广,在淤泥、半泥沙质和沙质海滩均可出现,是海洋性的红树林演替先锋树种。本实验中白骨壤繁殖体经过漂浮实验后仍然可以在很短时间内萌发[图 5(a)],且还能在不同的盐度条件尤其是高盐度条件下保持较高的萌发率,充分表明白骨壤适应力极强,与其生态属性吻合。桐花树是盐度较低区域的红树林演替先锋树种,常见于淤泥质的河口入海口处[7],纯沙质的底质中几乎找不到桐花树的自然分布。桐花树繁殖体在本次相对短的实验周期内均未观察到萌发现象,仅见部分根系生长[图 4(b)],这可能与培育时间较短、实验采用的纯沙基质不适合桐花树育苗定植有关。木榄繁殖体在沙培10 d后才开始萌发,时间相对较长[图 5(b)],可能与木榄耐水淹能力较弱且不适应沙质底质有较大关系[21]。
由于天然环境复杂,自然界海水盐度会随着季节、降水、潮汐等影响发生变化[19, 22-24],导致室内盐度梯度实验与自然盐度梯度条件下得出的最适盐度存在一定偏差[25]。因此红树植物繁殖体的漂浮及其最终定植萌发受多种因素的影响,了解红树植物繁殖体特征以及所在环境特征的变化,有助于预测红树植物的未来分布。
4 结论我国3种最具代表性的胎生红树植物(白骨壤、桐花树、木榄)的繁殖体虽形态上均有显著差异,但密度均略低于1.000 g/m3,有利于繁殖体在海水中的扩散。研究表明,在不同盐度海水中,木榄繁殖体的漂浮性最好,白骨壤次之,桐花树最差:木榄繁殖体漂浮9 d后的漂浮性均较高且无明显差异;白骨壤繁殖体漂浮率中等但变异较大;桐花树繁殖体漂浮率最低且2-6 d后几乎全部下沉。经漂浮后进行沙培,白骨壤繁殖体可短时间内萌发,且在高盐度条件下萌发率仍保持较高水平;桐花树仅见部分根系生长,未观察到萌芽现象;木榄产生萌芽所需时间较长。研究证实,白骨壤繁殖体可适应高盐度生境; 桐花树则相对更适应低盐度生境;木榄繁殖体漂浮性好但需适应一段时间才能萌芽。综上,白骨壤、桐花树和木榄繁殖体形态特征、漂浮特征和萌发特征等具备较大的种间差异,对其繁殖与扩散产生一定影响。
致谢
感谢北海市实验学校雷翔雄、罗湾湾和宋雨芯同学协助处理样品与监测。
| [1] |
王文卿, 王瑁. 中国红树林[M]. 北京: 科学出版社, 2007.
|
| [2] |
范航清. 红树林: 海岸环保卫士[M]. 南宁: 广西科学技术出版社, 2000.
|
| [3] |
ALONGI D M. The energetics of mangrove forests[M]. Dordrecht: Springer Netherlands, 2009.
|
| [4] |
周晓旋, 蔡玲玲, 傅梅萍, 等. 红树植物胎生现象研究进展[J]. 植物生态学报, 2016, 40(12): 1328-1343. |
| [5] |
陶伊佳. 显胎生红树植物的生长和繁殖特点[D]. 厦门: 厦门大学, 2014.
|
| [6] |
王文卿, 石建斌, 陈鹭真, 等. 中国红树林湿地保护与恢复战略研究[M]. 北京: 中国环境出版集团, 2021.
|
| [7] |
潘良浩, 史小芳, 曾聪, 等. 广西红树林的植物类型[J]. 广西科学, 2018, 25(4): 352-362. |
| [8] |
闫中正, 王文卿, 黄伟滨. 红树胎生现象及其对潮间带生境适应性研究进展[J]. 生态学报, 2004, 24(10): 2317-2323. |
| [9] |
李庆顺, 乔红梅, 周晓旋. 红树植物的胎生现象及其组学研究进展[J]. 厦门大学学报(自然科学版), 2021, 60(2): 339-347. |
| [10] |
张宜辉. 几种红树植物繁殖体发育和幼苗成长过程的生理生态学研究[D]. 厦门: 厦门大学, 2003.
|
| [11] |
邱广龙. 红树植物白骨壤繁殖生态研究与果实品质分析[D]. 南宁: 广西大学, 2005.
|
| [12] |
张磊, 叶勇, 卢昌义. 非胎生红树植物繁殖体特征与分带关系[J]. 厦门大学学报(自然科学版), 2009, 48(6): 905-909. |
| [13] |
国家林业局森林资源管理司. 全国红树林资源调查报告[R]. [出版地不详: 出版者不详], 2002.
|
| [14] |
DUKE N C, BALL M C, ELLISON J C. Factors influencing biodiversity and distributional gradients in mangroves[J]. Global Ecology and Biogeography Letters, 1998, 7(1): 27-47. |
| [15] |
STEINKE T D. Some factors affecting dispersal and establishment of propagules of Avicennia marina (Forsk. ) Vierh[C]//WALSH G E, SNEDAKER S C, TEASH H J. Proceedings of International Symposium on Biology and Management of Mangroves. Florida: [s. n. ], 1975: 402-414.
|
| [16] |
STEINKE T D. A preliminary study of buoyancy behaviour in Avicennia marina propagules?[J]. South African Journal of Botany, 1986, 52(6): 559-565. |
| [17] |
JOHANSSON M E, NILSSON C, NILSSON E. Do rivers function as corridors for plant dispersal?[J]. Journal of Vegetation Science, 1996, 7(4): 593-598. |
| [18] |
LIU C, ZHANG L, SHI X, et al. A re-evaluation of the tidal sorting hypothesis of mangrove zonation: propagule specific gravity matters[J]. Frontiers in Marine Science, 2024, 11: 1368156. |
| [19] |
WANG W Q, LI X F, WANG M. Propagule dispersal determines mangrove zonation at intertidal and estuarine scales[J]. Forests, 2019, 10(3): 245. |
| [20] |
黄灵玉, 胡宝清, 范航清. 白骨壤对关键环境因子的生态响应研究进展[J]. 广西科学院学报, 2014, 30(4): 257-262. |
| [21] |
张宜辉, 王文卿, 池敏杰, 等. 显胎生红树植物木榄(Bruguiera gymnorrhiza)胎生胚轴发育[J]. 海洋学报(中文版), 2006, 28(2): 121-127. |
| [22] |
信长朋. 红树植物的沿河分布格局及其对咸淡水交替环境的适应机制[D]. 厦门: 厦门大学, 2008.
|
| [23] |
XU L, LIU C, XIN C, et al. River mangrove Aegiceras corniculatum maintains certain levels of Na+ and Cl- in leaves to adapt seasonal freshwater[J]. Ecohydrology, 2023, 16(4): e2534. |
| [24] |
刘超. 红树植物沿河口、沿潮间带分布格局及繁殖体扩散对其的影响[D]. 厦门: 厦门大学, 2024.
|
| [25] |
CRASE B, LIEDLOFF A, VESK P A, et al. Hydroperiod is the main driver of the spatial pattern of dominance in mangrove communities[J]. Global Ecology and Biogeography, 2013, 22(7): 806-817. |


