右旋糖酐(Dextran),也称葡聚糖,系蔗糖经乳酸菌如肠膜明串珠菌(Leuconostoc mesenteroides)、荚膜醋酸菌(Acetobacter capsulatum)分泌的右旋糖酐蔗糖酶(Dextransucrase, DSR, EC 2.4.1.5)催化合成的葡萄糖聚合物,其主要由α-D-(1, 6)糖苷键连接形成主链,侧链则由α-D-(1, 2)糖苷键和α-D-(1, 3)糖苷键连接[1]。肠膜明串珠菌产的右旋糖酐含有95%以上的1, 6糖苷键,该右旋糖酐较易溶于水,相对分子质量范围很广,从5×104到3×108不等,质地疏松柔软,具有安全、无毒、无臭、无味、黏性高、生物相容性好及持水性强等优点。右旋糖酐及其衍生物广泛应用于医药、食品、化妆品和化工等多个领域[2]。右旋糖酐的用途依分子量的不同而有所差别,其中低分子量(10 000-20 000 Da)、微分子量(10 000 Da以下)的右旋糖酐具有特殊的生物学功能[3],如低分子量的右旋糖酐与铁形成的复合物可治疗严重贫血,在临床上使用的右旋糖酐铁药物必须采用中、低分子量的右旋糖酐制备,该药物是目前全球公认的优良补铁剂,广泛应用于人、畜类缺铁性贫血症(Iron Deficiency Anemia,IDA)的治疗[3-5]。我国临床上右旋糖酐的用量为1 410万瓶/a,而兽药的需求量比人药的需求量大。因此,就应用价值来说,低分子量右旋糖酐的经济价值更高,具有巨大的应用前景。
微生物发酵法和双酶法是右旋糖酐的主要制备方法。目前国内主要以前者为主,即首先利用肠膜明串珠菌发酵过程分泌的DSR将高浓度蔗糖转化合成高分子量右旋糖酐,然后经乙醇沉淀获得粗酐,再经盐酸水解为不同分子量的右旋糖酐,最后经醇分级沉淀或者超滤膜逐级过滤、纯化浓缩后得到右旋糖酐产品,此法的缺点是能量和乙醇消耗量大、产物分子量分布系数小,而杂质残留等缺点限制了其在医药上的应用[1]。双酶法是首先利用DSR合成相对分子量较大的右旋糖酐,然后利用右旋糖酐酶水解获得对应目标分子量的右旋糖酐。由于酸水解时会引入氯离子,酶水解时会引入新的蛋白杂质,酸水解或酶水解大分子右旋糖酐都使得产物的分子量难以控制,分子量相差很大[6-8]。近年来出现了单酶法合成右旋糖酐的研究。单酶法相比于双酶法具有步骤简单、产物分子量较易控制的优势。因此,通过DSR一步法直接催化蔗糖合成低、微分子量的右旋糖酐成为近年的研究热点。本文综述了单酶法合成右旋糖酐的研究进展情况,由此提出通过基于酶结构指导的蛋白质工程改造使DSR定向合成低分子量右旋糖酐的思路,为进一步控制低聚右旋糖酐的精准合成提供另一种选择。
1 酶法合成低分子量右旋糖酐的影响因素 1.1 DSR的表达生产单酶法合成右旋糖酐主要是利用DSR催化底物蔗糖生成右旋糖酐,为了获得质优、量产的右旋糖酐,必须以高活性的DSR生产菌株为前提。目前国内外报道的DSR生产菌株有来自诱变的乳酸菌株或者大肠杆菌(Escherichia coli)基因工程菌株,研究主要围绕获得更高活性的DSR和生产能力更强的菌株而展开,尤其关注以产α-(1, 6)糖苷键为主的DSR(表 1),因为α-(1, 6)糖苷键含量越多的右旋糖酐越易溶于水,更适于在医药和食品行业上应用。此外,表 1中的数据表明目前DSR的活性还有待进一步提高。
| 原始菌株 Original strain |
处理方法/基因模板 Treament method/Gene template |
表达菌株 Expression strain |
重组菌/酶特性 Recombinant bacteria/Enzyme characteristics |
| Leuconostoc mesenteroides NRRL B-512FMC | Nitrosoguanidine (NTG)[9] | L.mesenteroides NRRL B-512FMC-16 | The characteristic of the recombinant enzyme was the same as that produced by the original strain.But the enzyme activity was 20-25 IU/mL, which was higher than that of the original strain |
| L.mesenteroides NRRL B-1299 | dsrB[10] | Escherichia coli DH1 | 168 kDa,the dextran has only α-(1, 6) glycosidic bonds and does not contain α-(1, 2) glycosidic bonds |
| L.mesenteroides NRRL B-512FMCM | Fmcmds[11] | E.coli DH5α | 170 kDa,α-1, 6-glucan and α-1, 3-branches |
| L.mesenteroides Lcc4 | dsrD[12] | Lactococcus lactis MG1363 | 165 kDa,the highest enzyme activity is 5 IU/mL |
| L.mesenteroides NRRL B-1299CB4 | dsrBCB4[13] | E.coli BL21 (DE3) plysS | Products only contain α-(1, 6) glycosidic bonds,163 kDa,0.147 IU/mL |
| L.mesenteroides-0326 | dsrYG[14] | E.coli BL21 (DE3) | Up to 35.62 IU/mL |
| L.mesenteroides subsp.dextranicum | dsrD[15] | E.coli Rosetta (DE3) | 170 kDa,1.2 IU/mL |
| L.mesenteroides CGMCC1.544 | dsrX[16] | E.coli BL21 (DE3) | 167.57 kDa,8.8 IU/mL |
1.2 DSR的异源表达系统 1.2.1 大肠杆菌表达系统
E.coli具有遗传背景清楚、操作方便、繁殖迅速等特点,常被用作表达宿主,以实现DSR的高效表达。Leemhuis等[9]将源于Leuconostoc mesenteroides的dsr基因在E.coli BL21 (DE3)中表达,重组DSR的活性比原始菌株提高了4.02倍。Du等[17]将来自L.mesenteroides MTCC 10508和Streptococcus mutans MTCC 497的dsr基因,同样在E.coli BL21 (DE3)中进行异源表达,经测定,两种重组酶的活力均比原始菌高。来自乳球菌(Oenococcus kitaharae) DSM 17330的dsr基因,被克隆至E.coli BL21 (DE3)中表达,得到重组酶DSR-OK, 其催化所产的右旋糖酐具有非常高的聚合度和较多的α-(1, 6)糖苷键,这使得该右旋糖酐具有特殊的黏度及易溶于水的特性,在食品、医疗等领域具有应用潜力[18]。
1.2.2 乳酸乳球菌表达系统当乳酸乳球菌(Lactococcus lactis)作为表达宿主时,重组DSR可分泌到胞外,使其更易于回收和纯化,从而降低酶的生产成本。此外,L. lactis不产生任何胞外蛋白酶,被公认为安全的食品级微生物,常被用作表达宿主菌。由于某些宿主菌株在表达过程具有分泌多个DSR的能力,导致副产物产生,因此常采用乳酸链球菌肽控制基因表达系统(Nisin-Controlled Gene Expression System, NICE),该系统启动子为nisA/nisZ的乳酸菌,其能表达多种外源基因,并且在加入安全无毒的诱导物nisin后,该系统的表达效率提高上千倍[19, 20]。Shukla等[21]采用NICE表达魏斯氏菌(Weissella confusa) Cab3的dsr基因,结果表明重组酶的活性比原始菌株高1.4倍。综上可知,L.lactis表达系统的载体、菌株、信号肽、诱导条件等参数是影响DSR分泌表达效果的几个关键性因素。
1.3 单酶法合成右旋糖酐的过程调控 1.3.1 反应条件对酶法合成右旋糖酐的影响底物浓度、酶量、反应温度和pH值等是影响酶法合成右旋糖酐的主要调控参数。Falconer等[22]研究了酶浓度分别为50、10、1.0和0.1 U/mL,蔗糖浓度分别为20、50、100、200和1 000 mmol/L,以及不同温度(20、30 ℃)等条件对合成右旋糖酐平均分子量的影响,结果表明,通过调节反应体系中DSR的用量、蔗糖浓度以及反应温度可改变右旋糖酐分子量的大小,合成的右旋糖酐分子量随反应体系中酶含量的增加而减小,随蔗糖浓度和反应温度的增加而增加。黄双霞等[23]对酶法合成右旋糖酐的规律进行研究,结果表明在单酶体系中,右旋糖酐的分子量随着底物蔗糖浓度的增加先增大后减小;随着DSR加入量的增大而增大,且右旋糖酐的产量与蔗糖浓度、DSR加入量呈正相关。
1.3.2 不同底物对DSR合成产物的影响DSR能催化的底物不止蔗糖。当以蔗糖为唯一底物时,通常合成右旋糖酐的重均分子量超过200 kDa,且单纯依靠缩短时间控制合成微分子量的右旋糖酐,只有少量的蔗糖转化为糖酐,存在转化率低的问题;当蔗糖和麦芽糖同时存在时,DSR的水解和转糖苷作用以麦芽糖为受体合成寡糖为主,通过调节蔗糖和麦芽糖的初始比例可控制寡糖的最终组成[24]。王彪等[25]能将DSR合成以右旋糖酐为主的产物,但所合成糖酐的重均分子量不超过4 000 Da,不符合重均分子量为4 100-12 000 Da的要求。陈发忠等[26]研究了DSR、蔗糖、麦芽糖的用量浓度、比例和添加工艺,发现在蔗糖浓度一定的情况下,麦芽糖添加量越小,合成的右旋糖酐分子量越大,随着时间延长,产物分布系数越小,而微分子量右旋糖酐的分布系数随着分子量的增大而增大。通过补足蔗糖和优化工艺,可以合成重均分子量为4 000 Da的右旋糖酐,还成功通过单酶法合成重均分子量为4 100-12 000 Da的右旋糖酐,具有转化产物集中、蔗糖转化率高、分布系数和微分子量大小可控性高的优点。
1.4 DSR的固定化技术对右旋糖酐合成的影响采用固定化技术可以稳定酶的催化性能,提高酶的稳定性,便于酶与产物的分离。海藻酸钠包埋法因其成本低廉、操作简便和回收率高成为固定化酶的首选方法,但环氧树脂Eupergit C、羟基磷灰石生物陶瓷以及海藻纤维等新型固定化材料也被应用于DSR固定化生物合成的研究中。国外早期研究表明,Eupergit C 250L和羟基磷灰石制备的固定化酶的比活性和稳定性比采用海藻酸钠制备的更具有优势[27],而羟基磷灰石的表现又更优,其在DSR和右旋糖酐酶双酶共固定化时可使酶表现出高比活性和高分散性的特点[28]。Tanriseven等[29]将肠膜明串珠菌B-512FM产DSR固定于海藻纤维中用于合成低分子右旋糖酐,固定化后DSR的酶活回收率达到90%,并且重复利用性较好。
国内合肥工业大学的张洪斌等[30]采用4%海藻酸钠和1%琼脂按1∶1(V∶V)混合法制备固定化重组DSR,在此基础上引入吸附剂羟基磷灰石改良混合固定方法,利用吸附-包埋法协同固定化酶,并优化最适作用条件为温度40 ℃、pH值5.4、底物浓度5%,其固定化酶的酶活力提高了15倍,且稳定性也明显提高。其他研究机构也有采用固定化技术生产右旋糖酐的报道,但是以固定化菌体耦合右旋糖酐酶或者是以DSR和右旋糖酐酶双酶法固定化合成右旋糖酐为主[1],这些研究也为固定化酶在工业中的应用提供了理论基础。
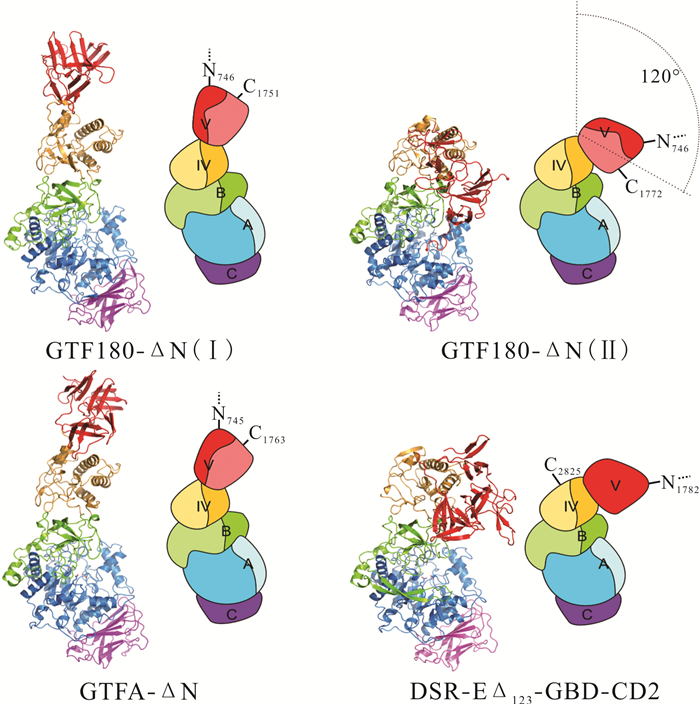
2 DSR的结构及催化机理 2.1 DSR的结构DSR又名葡聚糖酶。Moulis等[31]首次高效表达与纯化了来源于Leuconostoc mesenteroides的完整基因序列的重组DSR,它能合成以α-(1, 6)糖苷键连接为主的右旋糖酐。相继的研究发现,大部分DSR都具有包括信号肽(Signal Peptides,SP)、N-末端可变区(Variable Region,VR)、保守催化结构域(Conservative Domain,CD)和C-末端葡萄糖结合域(Glucan-Binding Domain,GBD)[32]等相似的初级结构。但该酶的催化机理还不明确,许多研究人员致力于通过蛋白质三维结构的研究来解析DSR的催化机理。目前,N端截短的DSR的三维结构已被解析,从N端到C端,DSR-EΔN123-GBD-CD2结构域依次为Ⅴ、Ⅵ、B、A、C、A、B、Ⅳ、Ⅴ,酶多肽链结构呈“U”型(图 1)[33]。与淀粉酶家族GH13酶的结构相比,结构域A、B和C为两者共有,都具有典型的(β/α)8桶状结构,结构域Ⅳ和Ⅴ是DSR所独有的。与目前已知的蛋白质序列并不相似,结构域Ⅳ位于结构域B和Ⅴ之间,具有枢纽伸缩结构,使得结构域Ⅴ靠近或远离活性中心[32-34]。结构域Ⅴ有部分N端和C端的片段,此区域存在YG和A/C序列重复,其中区域GBD是多糖产物结合的位置[35, 36]。由此可推测,改变区域GBD可改变酶催化蔗糖合成右旋糖酐的聚合度。
2.2 DSR的催化机理
有研究学者认为DSR合成多聚糖是通过双取代作用机制进行的[37],但氨基酸残基是如何被催化的仍不清楚。近年来,研究人员侧重于分析酶催化氨基酸残基(亲核、酸碱催化、过渡态稳定残基)的特征以对该机制进行补充。该机制认为底物蔗糖以扭曲的半椅式结构进入到酶分子催化口袋边缘的疏水区,保守酪氨酸残基Y与葡萄糖基产生疏水作用,其羟基与位于催化中心外的保守残基形成氢键,形成一个口袋状的活性中心[38, 39]。亲核天冬氨酸残基D攻击葡萄糖单元形成共价,形成过渡态稳定残基,构成β-葡萄糖基-酶共价中间体。在一定的pH值条件下,酸/碱谷氨酸残基E向糖苷氧提供质子,促进果糖释放,整个催化反应完成一次循环。该研究结果不仅从氨基酸水平解析了右旋糖酐的合成机理,而且发现DSR的结构域Ⅴ存在着大量的β螺线折叠结构,推测结构域Ⅴ中的糖结合域参与了糖类化合物的合成[36]。
3 单酶法合成低分子量右旋糖酐的研究现状 3.1 单酶法合成低分子量右旋糖酐2007年,Moulis等[39]通过蛋白质工程改造L.mesenteroides NRRL B-512F的DSR获得突变酶DSR-S;以蔗糖为底物,根据初始蔗糖浓度和反应温度确定了合成分子量可控的右旋糖酐的最佳反应条件,利用DSR-S催化,一步法合成了分子量为40和10 kDa的右旋糖酐,产率分别为69%和75%。相比于传统的微生物发酵法和双酶法,单酶法具有步骤简单、分子量可控的优点和经济竞争性。随着蛋白质工程技术的不断进步,通过酶的定向设计和改造来获得所需目标酶的可能性大幅度提高。因此,通过蛋白质工程手段获取DSR突变体,直接转化蔗糖生产分子量可控的右旋糖酐的技术引起研究者的关注。2017年,Claverie等[40]通过截取柠檬明串珠菌(L.citreum)NRRL B-1299的DSR中164-1 433区间氨基酸肽段获得突变体酶DSR-M,其可催化蔗糖直接生成以α-(1, 6)糖苷键连接为主的低分子量右旋糖酐,同时,该研究认为催化域Ⅴ起关键作用。同样地,对L.mesenteroides NRRL B-512F的DSR-180在结构域Ⅴ中进行截短后也有类似的结果[36]。张宇馨等[41]通过顺序连接构建了同时具有DSR与右旋糖酐酶功能的双功能融合酶——具有直接催化蔗糖合成精确糖链右旋糖酐功能的双酶复合体。通过不同类型的连接肽将双酶进行连接构建,分别在大肠杆菌和毕赤酵母(Pichia pastoris)中进行表达,并通过改变双酶的连接肽和活性中心的分子通道来控制产物的聚合度。以上研究成果证明通过基因工程和蛋白质工程手段对DSR进行改造,是制备低、微分子量右旋糖酐的有效手段。
然而,通常大片段氨基酸的截短/删除后,由于蛋白质错误折叠而导致催化效率下降。为了有针对性地删除氨基酸片段并保留其催化活力,Claverie等[42]对源自北原肠球菌(Oenococcus kitaharae) DSM17330的DSR-OK中参与右旋糖酐合成的7个糖结合袋与结构域Ⅴ之间的相互作用进行研究,发现糖结合袋数量和亲和力可能影响DSR在长链延伸中多链及单链聚合方式的转变,从而合成高分子量右旋糖酐。此外,研究还发现在空间上更靠近活性中心C端的糖结合袋对控制葡聚糖链的延伸起主要作用[43]。
3.2 DSR的蛋白质工程改造对DSR截短或结构域Ⅴ加工而得的突变体酶虽然可直接合成低分子量右旋糖酐,但是为了适合工业应用,酶的热稳定性仍是需要考虑的重要因素。马江锋等[44]公开了一种DSR突变体,其可催化蔗糖生成单一分量区间的微分子量右旋糖酐,但其存在的缺陷与Claverie等[40]的研究结果大致相同,即酶的热稳定性不高。为了改善酶的热稳定性,张洪斌等[45]公开了一种表达耐热型DSR的基因工程菌及其构建方法和用途,获得的双突变体酶的活性和热稳定性有所提高,在25 ℃有最佳酶活性,但在40 ℃后酶活性急剧下降。韦旭钦等[46]截取源自柠檬明串珠菌DSR-Ⅴ中的37-1 430区间氨基酸肽段并经结构优化获得突变体酶,其最适温度为63 ℃,在58-68 ℃高温条件下有良好的热稳定性,该突变体可催化蔗糖生成微分子量右旋糖酐,在较高反应温度下其催化过程具有转化液黏稠度低、无杂菌生长、能耗低、操作简单的特点,因此该突变体酶具有应用前景。
4 总结和展望对于DSR酶法合成右旋糖酐,研究者们在DSR的高效表达生产,合成右旋糖酐过程的条件控制,DSR的固定化技术、结构和催化机理,以及DSR的蛋白质工程改造所获得的突变酶定向合成低分子量右旋糖酐等4个方面做了相关的研究,并取得了良好的进展。单酶法定向合成低分子量右旋糖酐具有可行性,或将成为未来的发展趋势,但依然存在一些技术问题有待解决。①DSR的三维结构信息使研究者对DSR的结构、功能及催化机理有了一定的了解,但对于DSR如何引导α-葡聚糖链朝向活性位点以及所形成的糖苷键类型尚不清楚,DSR合成右旋糖酐的区域均一性和选择性等机理也还不明确。因此,为阐明与长链或支链寡糖结合的DSR复合物的结构,最好将DSR的三维结构信息与酶的分子动力学相结合,这将有助于解决以上问题。②通过对DSR结构域Ⅴ的加工而获得能够定向合成低分子量右旋糖酐的突变酶,以及通过酶的分子改造而获得热稳定的突变酶的研究仍然比较盲目,工作量仍很大。因此,需要进一步获得更详细的DSR结构信息,然后在对DSR的结构、功能及催化机理有更进一步了解的基础上,对特定的位点/结构域进行改造,从而改变或优化酶的性质。一方面需要获得酶的结构域信息,目前利用人工智能技术预测蛋白质结构取得了突破性的进展,其中AlphaFold2已经具有原子级别的结构预测精度;另一方面,伴随着分子动力学模拟及对蛋白质折叠机理的研究,理性设计得到了更广泛的应用。因此,将蛋白质结构预测工具应用于DSR的改造,具有更强的目的性,可更高效地、更易于获得所需的突变酶。
通过DSR单酶催化反应定向合成低分子量右旋糖酐,可以低成本生产具有良好生物活性及高利用价值的右旋糖酐产品。得益于酶工程、蛋白质工程和基因工程技术的不断进步,可对DSR的结构和功能、合成右旋糖酐的区域选择性、所合成糖苷键的类型、合成过程的条件控制等方面进行深入研究,这将有助于探索开发单酶法定向合成低分子量右旋糖酐技术。在后基因组和人工智能时代,基于蛋白质家族中的海量数据分析,通过有效的蛋白质工程改造,DSR合成多样化右旋糖酐的技术将得到快速发展。
| [1] |
刘丽娜, 姜静, 赵丹. 微生物葡聚糖蔗糖酶的研究进展[J]. 生物技术, 2020, 30(5): 504-510. |
| [2] |
WELMAN A D, MADDOX I S. Exopolysaccharides from lactic acid bacteria: perspectives and challenges[J]. Trends in Biotechnology, 2003, 21(6): 269-274. DOI:10.1016/S0167-7799(03)00107-0 |
| [3] |
TAM S C, BLUMENSTEIN J, WONG J T. Solubled dextran-hemoglobin complex as a potential blood substitute[J]. Proceedings of the National Academy of Sciences of the United States of America, 1976, 73(6): 2128-2131. |
| [4] |
国家药典委员会. 中华人民共和国药典: 二部(2010年版)[M]. 北京: 中国医药科技出版社, 2010.
|
| [5] |
FERREIRA M P A, TALMAN V, TORRIERI G, et al. Dual-drug delivery using dextran-functionalized nanoparticles targeting cardiac fibroblasts for cellular reprogramming[J]. Advanced Functional Materials, 2018, 28(15): 1705134. DOI:10.1002/adfm.201705134 |
| [6] |
徐欣东, 王清, 齐鹏翔, 等. 右旋糖酐蔗糖酶纯化及生产应用的研究进展[J]. 中国调味品, 2020, 45(1): 196-200. |
| [7] |
邹青松, 浦媛媛, 王晓, 等. 酶法合成右旋糖酐及过程调控研究进展[J]. 食品与发酵工业, 2011, 37(12): 100-104. |
| [8] |
黄瑞杰, 李媚, 廖安平, 等. 酸解法与酶解法调控右旋糖酐分子质量的比较[J]. 食品科学, 2020, 41(6): 43-50. |
| [9] |
LEEMHUIS H, PIJNING T, DOBRUCHOWSKA J M, et al. Glucansucrases: three-dimensional structures, reactions, mechanism, α-glucan analysis and their implications in biotechnology and food applications[J]. Journal of Biotechnology, 2013, 163: 250-272. DOI:10.1016/j.jbiotec.2012.06.037 |
| [10] |
MONCHOIS V, REMAUD-SIMEON M, MONSAN P, et al. Cloning and sequencing of a gene coding for an extracellular dextransucrase (DSRB) from Leuconostoc mesenteroides NRRL B-1299 synthesizing only α (1-6) glucan[J]. FEMS Microbiology Letters, 1998, 159(2): 307-315. |
| [11] |
MONCHOIS V, REMAUD-SIMEON M, RUSSELL R R B, et al. Characterization of Leuconostoc mesenteroides NRRL B-512F dextransucrase (DSRS) and identification of amino-acid residues playing a key role in enzyme activity[J]. Applied Microbiology Biotechnology, 1997, 48(4): 465-472. DOI:10.1007/s002530051081 |
| [12] |
NEUBAUER H, BAUCHÉ A, MOLLET B. Molecular characterization and expression analysis of the dextransucrase dsrD of Leuconostoc mesenteroides Lcc4 in homologous and heterologous Lactococcus lactiscul cultures[J]. Microbiology, 2003, 149(4): 973-982. DOI:10.1099/mic.0.26029-0 |
| [13] |
KANG H K, KIM Y M, KIM D M. Functional, genetic, and bioinformatic characterization of dextransucrase (DSRBCB4) gene in Leuconostoc mesenteroides B-1299CB4[J]. Journal of Microbiology and Biotechnology, 2008, 18(6): 1050-1058. |
| [14] |
张洪斌, 朱春宝, 胡又佳, 等. 右旋糖酐蔗糖酶工程菌株的构建及其培养条件的研究[J]. 微生物学报, 2008, 48(4): 492-497. |
| [15] |
农万廷, 韦宇拓, 黄日波, 等. 肠膜明串珠菌葡聚糖蔗糖酶基因的克隆与表达[J]. 工业微生物, 2007, 37(3): 29-32. |
| [16] |
YANG Y L, LUO J, WANG J H, et al. Expression and characterization of dextransucrase gene dsrX from Leuconostoc mesenteroides in Escherichia coli[J]. Journal of Biotechnology, 2008, 133(4): 505-512. DOI:10.1016/j.jbiotec.2007.12.002 |
| [17] |
DU R P, QIAO X, WANG Y, et al. Determination of glucansucrase encoding gene in Leuconostoc mesenteroides[J]. International Journal of Biological Macromolecules, 2019, 137: 761-766. DOI:10.1016/j.ijbiomac.2019.06.200 |
| [18] |
VUILLEMIN M, GRIMAUD F, CLAVERIE M, et al. A dextran with unique rheological properties produced by the dextransucrase from Oenococcus kitaharae DSM 17330[J]. Carbohydrate Polymers, 2018, 179: 10-18. DOI:10.1016/j.carbpol.2017.09.056 |
| [19] |
MIERAU I, KLEEREBEZEM M. 10 years of the nisin-controlled gene expression system (NICE) in Lactococcus lactis[J]. Applied Microbiology and Biotechnology, 2005, 68(6): 705-717. DOI:10.1007/s00253-005-0107-6 |
| [20] |
LE LOIR Y, AZEVEDO V, OLIVEIRA S C, et al. Protein secretion in Lactococcus lactis: an efficient way to increase the overall heterologous protein production[J]. Microbial Cell Factories, 2005, 4(1): 2. DOI:10.1186/1475-2859-4-2 |
| [21] |
SHUKLA S, VERMA A K, KAJALA I, et al. Structure modeling and functional analysis of recombinant dextransucrase from Weissella confusa Cab3 expressed in Lactococcus lactis[J]. Preparative Biochemistry & Biotechnology, 2016, 46(8): 822-832. |
| [22] |
FALCONER D J, MUKERJEA R, ROBYT J F. Biosynthesis of dextrans with different molecular weights by selecting the concentrantion of Leuconostoc mensenteroides B-512FMCM dextransucrase, the sucrose concentration, and the temperature[J]. Caebohydrate Research, 2011, 346(2): 280-284. DOI:10.1016/j.carres.2010.10.024 |
| [23] |
黄双霞, 相萍萍, 齐鹏翔, 等. 酶法合成右旋糖酐过程规律的研究[J]. 中国调味品, 2018, 43(7): 43-49. |
| [24] |
L 玛德森, J 奥斯沃德, D F 戴, 等. 用于生产异麦芽寡糖的方法: 201580053577.1[P]. 2017-10-13.
|
| [25] |
王彪, 李亚玲, 吴燕子, 等. 一种低分子葡聚糖铁的制备方法及其应用: 201910575482.6[P]. 2019-08-30.
|
| [26] |
陈发忠, 韦旭钦, 韦志明, 等. 一种酶法合成微分子右旋糖酐和生产高纯度果糖的方法: 202210698098.7[P]. 2022-11-29.
|
| [27] |
DE SEGURA A G, ALCALDE M, YATES M, et al. Immobilization of dextransucrase from Leuconostoc mesenteroides NRRL B-512F on Eupergit C supports[J]. Biotechnology Progress, 2004, 20(5): 1414-1420. DOI:10.1021/bp0400083 |
| [28] |
ERHARDT F A, JÖRDENING H-J. Immobilization of dextranase from Chaeiomium erraticum[J]. Journal of Biotechnology, 2007, 131(4): 440-447. DOI:10.1016/j.jbiotec.2007.07.946 |
| [29] |
TANRISEVEN A, DOǦAN Ş. Production of isomalto-oligosaccharides using dextransucrase immobilized in alginate fibres[J]. Process Biochemistry, 2002, 37(10): 1111-1115. DOI:10.1016/S0032-9592(01)00319-3 |
| [30] |
张洪斌, 伊晓楠, 吴定涛, 等. 海藻酸钠-琼脂混合固定化重组右旋糖酐蔗酶的研究[J]. 食品科学, 2010, 31(5): 225-228. |
| [31] |
MOULIS C, ARCACHE A, ESCALIER P C, et al. High-level production and purification of a fully active recombinant dextransucrase from Leuconostoc mesenteroides NRRL B-512F[J]. FEMS Microbiology Letters, 2006, 261(2): 203-210. DOI:10.1111/j.1574-6968.2006.00347.x |
| [32] |
PIJNING T, VUJIČIĆ-ŽAGAR, KRALJ S, et al. Structure of the α-1, 6/α-1, 4-specific glucansucrase GTFA from Lactobacillus reuteri 121[J]. Acta Crystallographica Section F: Structural Biology and Crystallization Communications, 2012, 68(12): 1448-1454. DOI:10.1107/S1744309112044168 |
| [33] |
MENG X F, GANGOITI J, BAI Y X, et al. Structure-function relationships of family GH70 glucansucrase and 4, 6-α-glucanotransferase enzymes, and their evolutionary relationships with family GH13 enzymes[J]. Cellular and Molecular Life Sciences, 2016, 73(14): 2681-2706. DOI:10.1007/s00018-016-2245-7 |
| [34] |
VUJIČIĆ-ŽAGAR A, PIJNING T, KRALJ S. Crystal structure of a 117 kDa glucansucrase fragment provides insight into evolution and product specificity of GH70 enzymes[J]. Proceedings of the National Academy of Sciences of the United State of America, 2010, 107(50): 21406-21411. |
| [35] |
KINGSTON K B, ALLEN D M, JACQUES N A, et al. Role of C-terminal YG repeat primer-dependent streptococcal glucosyl transferase, GtfJ, in binding to dextran and mutant[J]. Microbiology (Reading England), 2002, 148(2): 549-558. DOI:10.1099/00221287-148-2-549 |
| [36] |
MENG X F, DOBRUCHOWSKA J M, PIJNING T, et al. Trucation of domain Ⅴ of the multidomain glucansucrase GTF 180 of Lactobacillus reuteri 180 heavily impairs its polysaccharide-synthesizing ability[J]. Applied Microbiology and Biotechnology, 2015, 99(14): 5885-5894. DOI:10.1007/s00253-014-6361-8 |
| [37] |
MONCHOIS V, WILLEMOT R M, MONSAN P. Glucansucrases: mechanism of action and structure-function relationships[J]. FEMS Microbiology Reviews, 1999, 23(2): 131-151. DOI:10.1016/S0168-6445(98)00041-2 |
| [38] |
VAN HIJUM S A, KRALJ S, OZIMEK L K, et al. Structure-function relationships of glucansucrase and fructansucrase enzymes from lactic acid bacteria[J]. Microbiology and Molecular Biology Reviews, 2006, 70(1): 157-176. DOI:10.1128/MMBR.70.1.157-176.2006 |
| [39] |
MOULIS C, MEDINA G V, SUWANNARANGSEE S, et al. One-step synthesis of isomalto-oligosaccharide syrups and dextrans of controlled size using engineered dextransucrase[J]. Biocatalysis & Biotrasformation, 2009, 26(1/2): 141-151. |
| [40] |
CLAVERIE M, CIOCI G, VUILLEMIN M, et al. Investigations on the determinants responsible for low molar mass dextran formation by DSR-M dextransucrase[J]. ACS Catalysis, 2017, 7(10): 7106-7119. DOI:10.1021/acscatal.7b02182 |
| [41] |
张宇馨, 张洪斌, 胡雪芹, 等. 酶法合成低分子量右旋糖酐的研究进展[C]//第十二届中国酶工程学术研讨会论文摘要集. [出版地不详]: [出版者不详], 2019: 103.
|
| [42] |
CLAVERIE M, CIOCI G, VUILLEMIN M, et al. Processivity of dextransucrases synthesizing very-high-molar-mass dextran is mediated by sugar-binding pockets in domain Ⅴ[J]. Journal of Biological Chemistry, 2020, 295(17): 5602-5613. |
| [43] |
BECHTNER J, HASSLER V, WEFERS D, et al. The C-terminal domain of Liquorilactobacillus nagelii dextransucrase mediates the production of larger dextrans compared to Liquorilactobacillus hordei[J]. Gels, 2022, 8(3): 171. |
| [44] |
马江锋, 姜岷, 李进, 等. 一种右旋糖酐蔗糖酶突变体及其制备方法与应用: 202010730704. X[P]. 2020-10-27.
|
| [45] |
张洪斌, 李梦绮, 李瑶, 等. 一种表达耐热型右旋糖苷蔗糖酶的基因工程菌及其构建方法和用途: 201710615998. X[P]. 2017-09-26.
|
| [46] |
韦旭钦, 彭小玉, 吴睿, 等. 一种耐热右旋糖酐蔗糖酶突变体及其制备方法与应用: 202110686273.6[P]. 2021-08-03.
|