2. 广西科学院生态环境研究所, 广西南宁 530007
2. Institute of Eco-Environment Research, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
物种共存(Species coexistence)机制即在一个小的面积或空间尺度中如何维持植物较高的物种多样性[1-3],一直以来困扰着生态学家。例如,在亚马逊森林中,一公顷面积内就有超过280种植物。为了解决这个问题,生态学家提出很多理论假说去解释,其中一个核心的机制就是Janzen-Connell (JC)假说或JC效应,它指的是同种植物的繁殖体(包括种子、幼苗)在同种成株附近(即距离制约,Distance-dependence)或在繁殖体密度较高的地区(即密度制约,Density-dependence)更容易遭受特异性天敌的攻击而导致高死亡率,从而为其他物种的生存腾出空间[4-6]。JC假说一经提出就得到了广泛关注,越来越多的学者通过观察或者控制实验来检验假说的正确性。
目前为止,JC效应在不同地区[7-13]和不同树种[14-17]中维持植物物种多样性的作用上得到了认可,但也有研究认为这种效应的强度在群落中很弱甚至检测不到[18-20],这可能是之前的研究者并未关注导致JC效应的天敌及其作用过程[21, 22]。Janzen[4]早在1970年提出JC假说时,就强调这种效应的驱动因素主要有两种,并提出了两种驱动者的概念,即密度型和距离型驱动者(Density- and distance- responsive agents)[23],而非密度和距离制约。密度型驱动者主要包括食草性动物和杂食性动物,如啮齿动物等植食性脊椎动物,它们通常喜欢攻击高密度植物的繁殖体。距离型驱动者主要包括寄主专一性植食性昆虫和病原菌,它们通常生活在宿主附近并喜欢攻击离宿主较近的繁殖体[2, 4]。因此,笔者提出第一个假设:密度型驱动者是密度制约的主要驱动因素,而距离制约的主要驱动因素是距离型驱动者,如果研究者混淆密度和距离制约的主要驱动者,那么将会人为减弱JC效应。但目前缺乏相关研究验证这一推论,仅在Packer等[24]的研究中有所提及,该假设的验证有助于提高JC效应的检验精度,为植物多样性的维持机制提供参考依据。
密度和距离制约是高营养级(捕食者)对低营养级(植物)的一种级联效应,是一个自上而下的过程。捕食者的生存需要一定面积的生境才能维持[25-27],而生境大小发生变化会直接影响群落营养结构,继而影响级联效应,最终改变植物群落的结构[27-30]。例如,在无食肉动物的岛屿上进行的一项实验表明,食草动物和杂食动物(如啮齿动物)的密度是相邻大陆的10-100倍,导致当地群落植物更新数量严重减少[31]。然而,许多研究表明JC效应主要由病原菌驱动[32-35],由于其体型小、所需生存空间小,所以人们往往认为生境面积大小的变化不会影响它们,但事实并非如此[36]。当生境面积大小改变时,密度和距离制约的响应可能不同,因为密度型驱动者个体比距离型驱动者大,需要的生存空间和资源更多[25, 26]。此外,密度型驱动者种群的大小取决于对生境面积大小更为敏感的顶级捕食者[37, 38],所以一旦生境面积大小发生变化就会影响到食物链的结构,而密度型驱动者的响应会先于距离型驱动者表现出来。因此,笔者提出第二个假设:密度和距离制约的效应均随着生境面积的缩减而呈先增强后减弱趋势,但密度制约趋势线的转折点发生在距离制约之前(图 1)。该假设的验证可为维持生境破碎化下植物的多样性提供科学参考依据。
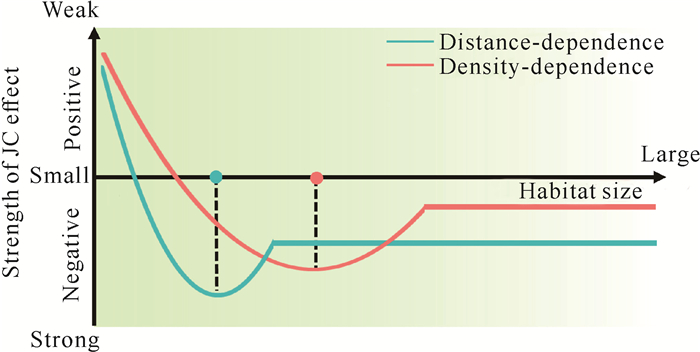
|
| 图 1 本研究有关密度和距离制约假说 Fig.1 Hypothesis of density- and distance- dependence in this study |
在人为干扰导致生境破碎化日益严重的背景下[39],研究生境面积大小对群落生物多样性维持的影响尤为重要。因此,本研究以已发表论文中67项研究收集的161个独立实验数据集为基础数据,采用荟萃分析的方法研究JC效应的驱动者和生境大小对物种共存过程的影响,旨在验证两个问题:(1)密度型和距离型驱动者是否分别是密度和距离制约的主要驱动因素;(2)密度和距离制约的效应大小在不同生境面积大小中变化如何。
1 材料和方法 1.1 文献检索和数据提取 1.1.1 文献检索在美国科学信息研究所(Institute for Scientific Informatio,ISI)(http://apps.webofknowledge.com)网站上检索1970-2019年发表的文献,搜索关键词如下:[TS OR TI OR SU=(Janzen or Janzen-Connell) AND (experiment*)] (搜索1);[TS OR TI OR SU=(density dependent* OR density-dependent* OR distance dependent* OR distance-dependent*) AND (seed* OR seedling* OR sapling*) AND (herbivore* OR pathogen*) AND (experiment*)] (搜索2)。综合两次文献检索结果,搜索1和搜索2分别有725篇和534篇,去掉102篇重复文献后,共检索到1 157篇相关研究。
1.1.2 文献筛选从上述检索到的1 157篇文献中筛选出符合本研究荟萃分析的相关文献。具体筛选方法如下:首先检查每篇论文的实验设计是否包含对密度制约或距离制约的预测;其次,提取相关研究区域的生境面积大小数据,只选择在田间开展实验的研究,但必须要明确样地大小或面积不等于生境大小;最后,排除没有通过文字、图片或表格体现个体存活和死亡数量的研究。除了以上数据外,为了确保研究结果更具有科学性,本研究还结合了Comita等[3] 2014年的部分荟萃分析研究数据。经过筛选,最终符合本研究所有标准的文章有67篇,其中包含161个密度或距离制约实验,这些实验分布在全球50个地点(图 2),其中大部分集中在美洲,特别是赤道附近。这些站点的生境面积跨度较大,面积为0.9-1 716 295.0 ha,平均值为248 588.0 ha。
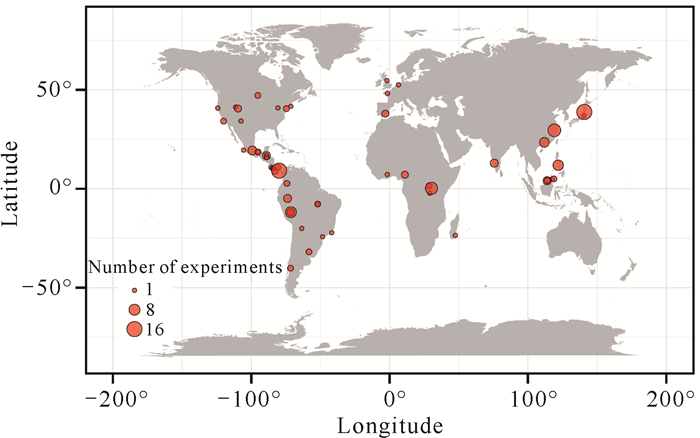
|
| Circle size represents the number of experiments. 图 2 本研究验证密度和距离制约实验地点的全球分布情况 Fig.2 Global distribution of testing density- and distance-dependence experimental sites in this study |
1.1.3 数据提取
从上述筛选出的文献中提取生境大小、天敌类型(即个体死亡的主要驱动者)、作者、年份、研究地点信息(如名称、纬度)等数据。如果文献未提及生境大小,则通过查阅相关文献或网站获取;如果文章没有描述天敌的类型,则将其归为“未知”类型。实验预测分为密度制约预测或距离制约预测两类,如果文章中的实验存在多因素处理水平时,只将其划分为远和近(距离)、高和低(密度)两组,并使用平均存活数和死亡数进行统计分析,这样可以有效避免在计算效应值时出现0值。当文献中相关数据用图表显示而无法得知具体数据时,使用Plot Digitizer软件(http://plotdigitizer.sourceforge.net)提取图片中的数据。如果一项研究中设计了多个物种、不同生命阶段或不同检测类型(密度和距离),则将它们视为多个独立的实验。
1.2 数据处理将自然对数优势比(Odds Ratio,OR)作为效应大小的衡量指标。在荟萃分析中,OR是常用的统计量,lgOR的正负和大小能够直观地反映两种对立事件发生的概率。使用R语言的metafor 2.1-0软件包来计算lgOR及其方差[40]。其中,OR值通过2×2关联表计算而得,当关联表中某个单元格为0时,OR就会出现极值(如0或∞)[18]。通常的解决方法是添加一个很小的常数(默认为0.5)来替换0,但当关联表中有两个或多个单元格出现0值时,就会有问题或效应大小计算不出来[41]。因此,在数据分析过程中,删除了存在两个或两个以上单元格为0的实验数据(N=4)。由于异质性检验结果显示I2(总异质性/总变异性)=99.98%,因此,通过metafor软件包的随机效应模型(REM)并使用极大似然法(Maximum likelihood estimation)来估算所有效应值及其95%置信区间(CI),分析效应值与生境大小之间的关系。具体计算方法如下。
(1) 发表偏倚可能存在于荟萃分析的相关文章中,因为出版机构可能偏好出版那些结果好的研究[42]。效应值的加权直方图[43]和漏斗图[44, 45]普遍用于检验是否存在发表偏倚,即出版机构是否更倾向于发表有显著性的研究结果,本研究通过秩相关检验来判断标准化效应值和各研究样本量之间的关系[46]。
(2) 为了检验本研究的假设1,使用Dunn′s多重比较法(方差非齐次性)对比不同天敌类型(病原体,N=31;无脊椎动物,N=23;脊椎动物,N=81;未知,N=22)的效应大小是否存在显著差异。在同种天敌中,如果其中一种制约(密度或距离)效应值的CI不包含0值,则认为该天敌是这种制约效应的主要驱动因素,相反则不然。由于所有分组之间不存在显著差异(P>0.05),故多重比较的检验结果在后面不再展示。
(3) 为了检验本研究的假设2,采用REM进行非分段回归和分段回归估计不同制约类型的效应值与生境面积大小之间的关系,通过比较不同模型的P值和赤池信息准则(AIC)来确定哪种回归方法更适合。分段回归和断点用segmented 1.1-0软件包分析和估计。在不同实验中,研究者可能关注的天敌类型不同,如果研究者偏好某一类天敌的研究就会影响估计不同制约类型的效应值与生境面积大小之间关系的准确性。因此,采用卡方检验(Chi-square test)来判断不同制约类型实验是否偏重关注某一类天敌。所有统计分析均在R语言软件(R3.5.1,https://www.R-project.org/)中完成。
2 结果与分析 2.1 不同制约类型和天敌的效应值大小不同制约类型的效应值见图 3(a)。近距离或高密度对个体死亡存在显著的正效应,总体效应平均值为-0.510(CI为-0.711至-0.309)。当把密度制约和距离制约效应值分开计算时,二者得到相似的结果,即密度制约lgOR=-0.440,CI为-0.684至-0.197;距离制约lgOR=-0.550,CI为-0.823至-0.277,这表明JC效应在自然生态系统中普遍存在。
不同天敌类型的效应值见图 3(b)。不同天敌类型的总体效应值均显著小于0,且在不同预测中有所差异,病原菌和无脊椎动物的效应值大小仅在距离制约实验中显著(lgOR=-1.219,CI为-2.028至-0.409和lgOR=-0.403,CI为-0.799至-0.006),而在密度制约实验中不显著(lgOR=-0.467,CI为-0.945至0.011和lgOR=-0.177,CI为-0.572至0.219);脊椎动物则与之相反,其效应值大小在密度制约实验中显著(lgOR=-0.553,CI为-0.919至-0.187),而在距离制约实验中不显著(lgOR=-0.383,CI为-0.820至0.054)。这些结果与本研究的假设一致,即密度型驱动者(脊椎动物)和距离型驱动者(病原菌和无脊椎动物)分别是密度和距离制约的主要驱动者。
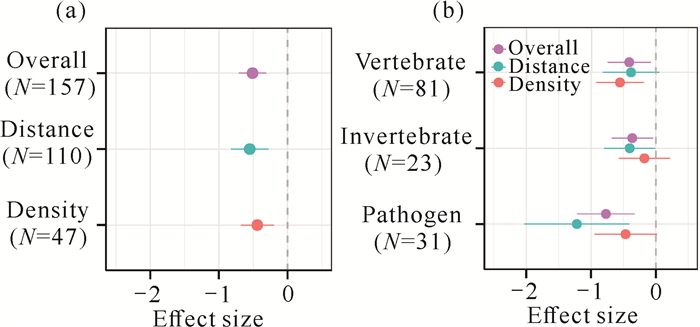
|
| 图 3 不同制约类型(a)和不同天敌类型(b)的效应值 Fig.3 Effect size of different predictions (a) and different natural enemies (b) |
2.2 不同制约效应值与生境面积大小的关系
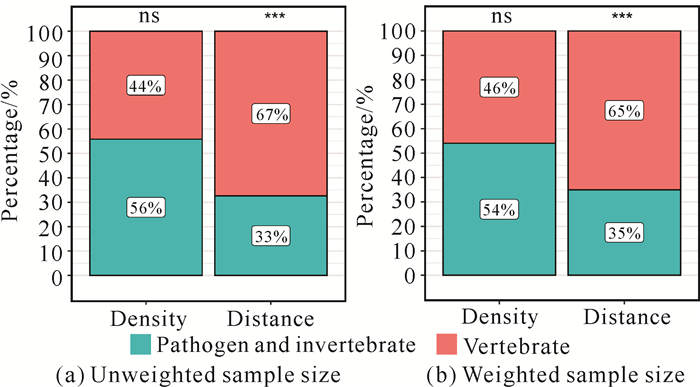
不同制约类型效应值与生境面积大小之间的关系如图 4和表 1所示。非分段回归分析结果表明,密度制约和距离制约效应值与生境面积大小之间无显著关系[图 4(a)];分段回归分析结果表明,不同制约效应值与生境面积大小之间的关系差异较大[图 4(b)]。距离制约效应值与生境面积大小在左、右回归中均显著相关;而密度制约效应值与生境面积大小之间的相关性在左右回归中均不显著, 虽然当生境面积减少时其趋势线的断点出现得比距离制约效应早。由于该预测模型受到天敌类型的影响,且不同实验中研究的天敌类型不同,因此为了验证不同的制约类型实验是否与不同天敌类型有关,本研究采用加权与未加权的卡方检验来验证,结果均表明二者之间存在相关性,主要的天敌类型对生境面积大小的响应不同是导致不同制约效应变化的重要原因(加权:χ2=11.33,df=1,P=0.001;未加权:χ2=6.57,df=1,P=0.010。图 5)。分析上述结果的原因可能是研究人员关注的天敌类型不同,且大多数距离制约效应实验的主要驱动者都是杂食性脊椎动物,此外,还可能是因为缺乏小生境尺度下有关距离型驱动者的相关实验数据。
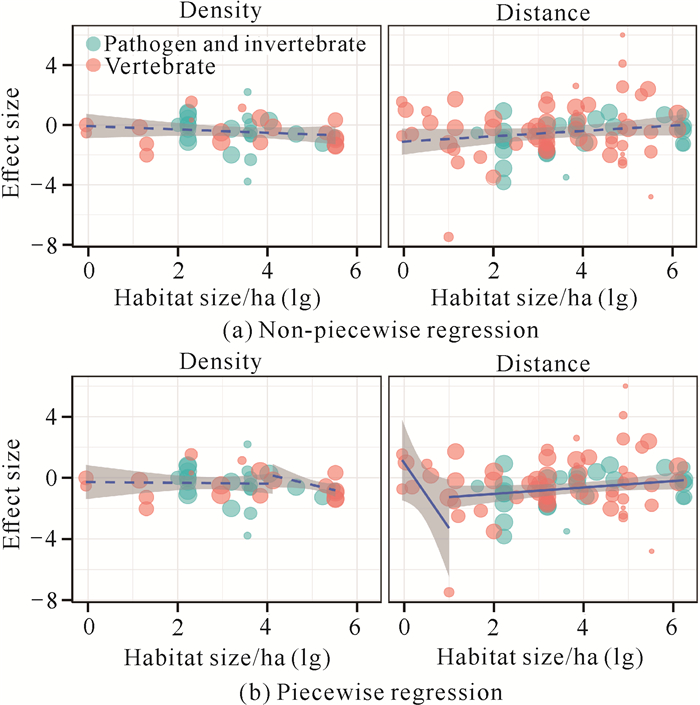
|
| 图 4 不同制约类型效应值与生境面积大小之间的关系 Fig.4 Relationship between effect size of different predictions and habitat sizes |
| 制约类型 Prediction |
模型 Model |
断点 Breakpoint |
统计量 QM |
斜率 Slope |
标准差 SE |
P值 P value |
赤池信息准则 AIC |
| Density | Non-piecewise | 1.716 | -0.119 | 0.091 | 0.190 | 117.296 | |
| Piecewise-left | 104.112 | 0.038 | -0.032 | 0.166 | 0.846 | 97.818 | |
| Piecewise-right | 2.816 | -0.501 | 0.298 | 0.093 | 18.465 | ||
| Distance | Non-piecewise | 1.126 | 0.113 | 0.107 | 0.289 | 349.690 | |
| Piecewise-left | 10 | 4.295 | -4.085 | 1.971 | 0.038 | 33.119 | |
| Piecewise-right | 9.250 | 0.336 | 0.111 | 0.002 | 323.979 |
|
| ns indicates no significant difference (P≥0.05);*** indicates extremely significant difference (P < 0.01). 图 5 不同制约类型实验中不同天敌的卡方检验 Fig.5 Chi-square test for different natural enemies in experiments with different predictions |
2.3 发表偏倚
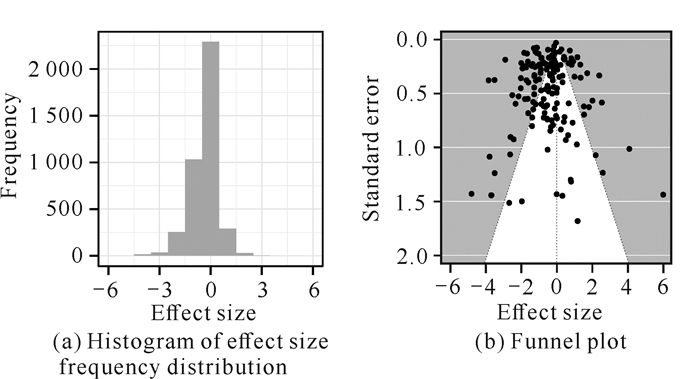
从加权直方图来看,效应值大小在0附近无下降趋势,表明密度和距离制约效应预测实验没有发表偏倚[图 6(a)]。目前关于距离或密度对繁殖体存活率的影响是完全正或负效应的研究较少。此外,漏斗图无倾斜现象且其不对称的秩相关检验呈不显著(Kendall′s τ=0.002,P=0.975),这也表明本研究的数据无发表偏倚[图 6(b)]。
|
| 图 6 发表偏倚检验 Fig.6 Checks for publication bias |
3 讨论
天敌在调控物种共存从而提高和维持森林树种多样性方面具有重要作用。近年来有很多关于JC效应的研究,但关于其驱动因素方面的研究却较少。本研究采用荟萃分析法分析不同天敌类型是否分别是密度和距离制约的主要驱动者,即由Janzen[23]提出的密度型驱动者和距离型驱动者。此外,由于密度型驱动者和距离型驱动者对食物网结构变化的响应不同,从而可能导致在不同生境中它们对植物群落结构的影响也不同。长期以来,JC效应的主要驱动因素一直存在争议,且许多研究的结果也不一致。例如,许多研究表明,在不同的植物群落中,食草性脊椎动物对植物繁殖体的影响大于昆虫和病原菌[29, 47-49],而距离驱动者对距离制约的驱动比密度制约强[3, 2, 50]。Packer等[24]研究表明,幼苗能避免宿主特异性真菌病原体的攻击与两者之间的距离密切相关,而非幼苗密度。因此,如果密度和距离制约实验仅研究单一因素所造成的影响(如在密度制约实验中把距离型驱动者作为主要驱动因素),将很难发现存在JC效应[20, 21],这可能是Hyatt等[18]认为距离制约在植物群落中并不普遍的原因。在今后的研究中应注意这一点,以便得到更加科学合理的解释JC效应的实验结果。同时还需要注意的是,病原菌的整体效应值在不同天敌类型中是最大的,这可能是研究者认为病原菌是维持物种共存的主要驱动因素的原因[7, 32-35]。
本研究中密度制约趋势线的转折点(生境面积为104.112 ha)发生在距离制约趋势线(生境面积为10 ha)之前,即当生境面积减小时密度制约比距离制约先响应,与本研究的第二个假设一致。虽然距离制约的效应值呈先增大后减小的趋势(P < 0.05),但是密度制约与生境面积大小无显著关系(P>0.05),变化趋势与假设不一致。导致这个结果的原因可能有两个:第一,距离制约的样本量远大于密度制约;第二,密度制约在小面积生境的研究数量太少,特别是100 ha以下的。此外,天敌类型对不同生境面积大小的响应不同可能是导致距离和密度制约效应变化不同的重要原因。距离型驱动者的种群变化更依赖于它们的宿主,其原因是它们本身机动性不高,一直在宿主周围活动;而密度型驱动者更容易被集中的资源所吸引,活跃于整个森林中,其种群数量主要取决于顶级捕食者的数量[2, 9, 51]。高营养级的捕食者对生境面积大小会更敏感[38, 52]。因此,当生境面积减少时,密度型驱动者的响应会比距离型驱动者早,这是因为高营养级捕食者的减少会导致密度型驱动者缺少天敌而种群密度快速增加,从而增强JC效应。相反地,只要距离型驱动者的宿主仍然存在,生境面积缩小就不会立即对其产生影响,而且它们的捕食者也不在食物链的顶端。近几十年来,仅发现有两项研究分别以密度型驱动者和距离型驱动者为研究对象,探讨了不同生境面积大小下JC效应的强度变化。其中一项研究表明捕食者对小面积生境(面积 < 4 ha)的种子存活没有影响或有正向影响(与JC假说相反);但当生境面积变大时,捕食者不利于种子存活,这与本研究的结果相似[53]。另一项研究发现,真菌诱导的繁殖体死亡率随着生境面积的减少而降低,但不同物种之间存在差异,甚至某些物种的死亡率随着生境面积的减少而增加[36],这与本研究的结果有所差异,原因可能是本研究中小面积生境的实验数据较少,特别是距离型驱动者。
近年来,由于人为干扰的日益加剧,生境破碎化导致栖息地面积减少或消失的问题日益严重[39],并严重威胁着生物多样性[54, 55]。由于大多数密度型驱动者都是广食性动物,在生境破碎化过程中会因为顶级捕食者的缺失使其种群密度增加而增加取食强度,对稀有物种的生存与植物多样性构成威胁。有研究表明,生境破碎化对专食性物种产生的负面影响大于广食性物种[56],主要是因为边缘地带的稀有物种较多,其天敌通常是专食性的物种[55],这些天敌容易受到边缘效应的影响[57]。而验证JC效应的实验通常在相对稳定的环境(如森林内部)进行,且以常见物种为研究对象,所以关于边缘地带和内部区域如何保持植物多样性的机制,特别是在小生境或碎片区,还需要更多的研究来揭示。
4 结论本研究采用荟萃分析法在全球尺度下探讨生境面积大小对密度和距离制约效应强度的影响,结果表明密度型驱动者和距离型驱动者分别是密度和距离制约的主要驱动因素,但在实验中仅考虑非主要驱动因素可能会低估JC效应强度;生境面积的减少导致营养级结构发生变化进而改变密度和距离制约效应的强度,虽然密度制约随生境面积大小变化趋势线的转折点在距离制约之前,但由于其统计检验不显著,因此密度制约可能比距离制约对生境面积的减少更敏感。
| [1] |
WRIGHT J. Plant diversity in tropical forests: a review of mechanisms of species coexistence[J]. Oecologia, 2002, 130(1): 1-14. DOI:10.1007/s004420100809 |
| [2] |
TERBORGH J. Enemies maintain hyperdiverse tropical forests[J]. The American Naturalist, 2012, 179(3): 303-314. DOI:10.1086/664183 |
| [3] |
COMITA L S, QUEENBOROUGH S A, MURPHY S J, et al. Testing predictions of the Janzen-Connell hypothesis: a meta-analysis of experimental evidence for distance- and density-dependent seed and seedling survival[J]. The Journal of Ecology, 2014, 102(4): 845-856. DOI:10.1111/1365-2745.12232 |
| [4] |
JANZEN D H. Herbivores and the number of tree species in tropical forests[J]. The American Naturalist, 1970, 104(940): 501-528. DOI:10.1086/282687 |
| [5] |
CONNELL J H. On the role of the natural enemies in preventing competitive exclusion in some marine animals and in rain forest trees[C]//Proceedings of the Advanced Study Institute on 'Dynamics of Numbers in Populations'. Oosterbeek: The Netherlands, 1970: 298-312.
|
| [6] |
COMITA L S, MULLER-LANDAU H C, AGUILAR S, et al. Asymmetric density dependence shapes species abundances in a tropical tree community[J]. Science, 2010, 329(5989): 330-332. DOI:10.1126/science.1190772 |
| [7] |
CHEN L, SWENSON N G, JI N N, et al. Differential soil fungus accumulation and density dependence of trees in a subtropical forest[J]. Science, 2019, 366(6461): 124-128. DOI:10.1126/science.aau1361 |
| [8] |
徐瑶. 黄土高原辽东栎林的种内竞争和Janzen-Connell效应的探究[D]. 西安: 西北大学, 2020.
|
| [9] |
CLARK D A, CLARK D B. Spacing dynamics of a tropical rain forest tree: evaluation of the Janzen-Connell model[J]. The American Naturalist, 1984, 124(6): 769-788. DOI:10.1086/284316 |
| [10] |
BENNETT J A, MAHERALI H, REINHART K O, et al. Plant-soil feedbacks and mycorrhizal type influence temperate forest population dynamics[J]. Science, 2017, 355(6321): 181-184. DOI:10.1126/science.aai8212 |
| [11] |
JIA S H, WANG X G, YUAN Z Q, et al. Tree species traits affect which natural enemies drive the Janzen-Connell effect in a temperate forest[J]. Nature Communications, 2020, 11(1): 286. DOI:10.1038/s41467-019-14140-y |
| [12] |
CARSON W P, ANDERSON J T, LEIGH E G, et al. Challenges associated with testing and falsifying the Janzen-Connell hypothesis: a review and critique[M]. New York: Wiley-Blackwell, 2008: 210-241.
|
| [13] |
濮旭才. 东北温带森林密度制约变异及其影响机制[D]. 哈尔滨: 东北林业大学, 2021.
|
| [14] |
LIANG M X, LIU X B, ETIENNE R S, et al. Arbuscular mycorrhizal fungi counteract the Janzen-Connell effect of soil pathogens[J]. Ecology, 2015, 96(2): 562-574. DOI:10.1890/14-0871.1 |
| [15] |
BROWN A J, PAYNE C J, WHITE P S, et al. Shade tolerance and mycorrhizal type may influence sapling susceptibility to conspecific negative density dependence[J]. Journal of Ecology, 2020, 108(1): 325-336. DOI:10.1111/1365-2745.13237 |
| [16] |
WU J J, SWENSON N G, BROWN C, et al. How does habitat filtering affect the detection of conspecific and phylogenetic density dependence?[J]. Ecology, 2016, 97(5): 1182-1193. DOI:10.1890/14-2465.1 |
| [17] |
DU Y J, QUEENBOROUGH S A, CHEN L, et al. Intraspecific and phylogenetic density-dependent seedling recruitment in a subtropical evergreen forest[J]. Oecologia, 2017, 184(1): 193-203. DOI:10.1007/s00442-017-3842-3 |
| [18] |
HYATT L A, ROSENBERG M S, HOWARD T G, et al. The distance dependence prediction of the Janzen-Connell hypothesis: a meta-analysis[J]. Oikos, 2003, 103(3): 590-602. DOI:10.1034/j.1600-0706.2003.12235.x |
| [19] |
BONANOMI G, BOBROVSKIKH A, CARTENÌ F, et al. Adult conspecific density affects Janzen-Connell patterns by modulating the recruitment exclusion zones[J]. Frontiers in Plant Science, 2023, 14: 1079975. DOI:10.3389/fpls.2023.1079975 |
| [20] |
MALIK N, EDWARDS D, FRECKLETON R P. Distance and density dependence in two native Bornean dipterocarp species[J]. Ecology and Evolution, 2023, 13(4): e10004. DOI:10.1002/ece3.10004 |
| [21] |
SONG X, LIM J Y, YANG J, et al. When do Janzen-Connell effects matter? A phylogenetic meta-analysis of conspecific negative distance and density dependence experiments[J]. Ecology Letters, 2021, 24(3): 608-620. DOI:10.1111/ele.13665 |
| [22] |
SONG X, CORLETT R T. Do natural enemies mediate conspecific negative distance and density-dependence of trees? A meta-analysis of exclusion experiments[J]. Oikos, 2022(5): e08509. |
| [23] |
JANZEN D H. Seed predation by animals[J]. Annual Review of Ecology and Systematics, 1971, 2: 465-492. DOI:10.1146/annurev.es.02.110171.002341 |
| [24] |
PACKER A, CLAY K. Soil pathogens and spatial patterns of seedling mortality in a temperate tree[J]. Nature, 2000, 404: 278-281. DOI:10.1038/35005072 |
| [25] |
MCINTOSH A R, MCHUGH P A, PLANK M J, et al. Capacity to support predators scales with habitat size[J]. Science Advances, 2018, 4(7): eaap7523. DOI:10.1126/sciadv.aap7523 |
| [26] |
ROMERO G Q, PICCOLI G C O, DE OMENA P M, et al. Food web structure shaped by habitat size and climate across a latitudinal gradient[J]. Ecology, 2016, 97(10): 2705-2715. DOI:10.1002/ecy.1496 |
| [27] |
戴冬, 邢华, 杨佳绒, 等. 植物群落稀有种维持机制与土壤反馈的研究进展[J]. 生物多样性, 2021, 29(12): 1687-1699. DOI:10.17520/biods.2021141 |
| [28] |
JIA S, WANG X, YUAN Z, et al. Global signal of top-down control of terrestrial plant communities by herbivores[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(24): 6237-6242. |
| [29] |
TERBORGH J W. Toward a trophic theory of species diversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(37): 11415-11422. |
| [30] |
龚筱羚. 天童20公顷样地内基于生长的同种负密度制约格局及实验验证[D]. 上海: 华东师范大学, 2018.
|
| [31] |
TERBORGH J, LOPEZ L, NUÑEZ P, et al. Ecological meltdown in predator-free forest fragments[J]. Science, 2001, 294(5548): 1923-1926. DOI:10.1126/science.1064397 |
| [32] |
BELL T, FRECKLETON R P, LEWIS O T. Plant pathogens drive density dependent seedling mortality in a tropical tree[J]. Ecology Letters, 2006, 9(5): 569-574. DOI:10.1111/j.1461-0248.2006.00905.x |
| [33] |
KULMATISKI A, BEARD K H, STEVENS J R, et al. Plant-soil feedbacks: a meta-analytical review[J]. Ecology Letters, 2008, 11(9): 980-992. DOI:10.1111/j.1461-0248.2008.01209.x |
| [34] |
BAGCHI R, GALLERY R E, GRIPENBERG S, et al. Pathogens and insect herbivores drive rainforest plant diversity and composition[J]. Nature, 2014, 506(7486): 85-88. DOI:10.1038/nature12911 |
| [35] |
BEVER J D, MANGAN S A, ALEXANDER H M. Maintenance of plant species diversity by pathogens[J]. Annual Review of Ecology, Evolution, and Systematics, 2015, 46: 305-325. DOI:10.1146/annurev-ecolsys-112414-054306 |
| [36] |
VISWANATHAN A, GHAZOUL J, HONWAD G, et al. The effects of rainforest fragment area on the strength of plant-pathogen interactions[J]. Biology Letters, 2019, 15(1): 20180493. DOI:10.1098/rsbl.2018.0493 |
| [37] |
HOLT R D, LAWTON J H, POLIS G A, et al. Trophic rank and the species-area relationship[J]. Ecology, 1999, 80(5): 1495-1504. |
| [38] |
THIES C, STEFFAN-DEWENTER I, TSCHARNTKE T. Effects of landscape context on herbivory and parasitism at different spatial scales[J]. Oikos, 2003, 101(1): 18-25. DOI:10.1034/j.1600-0706.2003.12567.x |
| [39] |
HADDAD N M, BRUDVIG L A, CLOBERT J, et al. Habitat fragmentation and its lasting impact on Earth's ecosystems[J]. Science Advances, 2015, 1(2): e1500052. DOI:10.1126/sciadv.1500052 |
| [40] |
VIECHTBAUER W. Conducting meta-analyses in R with the metafor Package[J]. Journal of Statistical Software, 2010, 36(3): 1-48. |
| [41] |
HIGGINS J P T, GREEN S. Cochrane handbook for systematic reviews of interventions[M]. Chichester, England: Wiley, 2008.
|
| [42] |
CSADA R D, JAMES P C, ESPIE R H M. The "file drawer problem" of non-significant results: does it apply to biological research?[J]. Oikos, 1996, 76(3): 591. DOI:10.2307/3546355 |
| [43] |
GREENLAND S. Quantitative methods in the review of epidemiologic literature[J]. Epidemiologic Reviews, 1987, 9: 1-30. DOI:10.1093/oxfordjournals.epirev.a036298 |
| [44] |
LIGHT R J, PILLEMER D B. Summing up: the science of reviewing research[M]. Cambridge, Mass: Harvard University Press, 1984.
|
| [45] |
PALMER A R. Detecting publication bias in meta-analyses: a case study of fluctuating asymmetry and sexual selection[J]. The American Naturalist, 1999, 154(2): 220-233. DOI:10.1086/303223 |
| [46] |
BEGG C B, MAZUMDAR M. Operating characteristics of a rank correlation test for publication bias[J]. Biometrics, 1994, 50(4): 1088-1101. DOI:10.2307/2533446 |
| [47] |
CLARK C J, POULSEN J R, LEVEY D J. Vertebrate herbivory impacts seedling recruitment more than niche partitioning or density-dependent mortality[J]. Ecology, 2012, 93(3): 554-564. DOI:10.1890/11-0894.1 |
| [48] |
POULSEN J R, CLARK C J, BOLKER B M. Experimental manipulation of seed shadows of an Afrotropical tree determines drivers of recruitment[J]. Ecology, 2012, 93(3): 500-510. DOI:10.1890/10-2430.1 |
| [49] |
ROSIN C, POULSEN J R. Seed traits, not density or distance from parent, determine seed predation and establishment in an Afrotropical forest[J]. Eiotropica, 2018, 50(6): 881-888. |
| [50] |
CURIO E, REITER J, TACUD B, et al. Seedling mortality of six Philippine rain forest tree species: a test of the 'escape hypothesis'[J]. Ecotropica, 2003, 9: 59-70. |
| [51] |
VIDAL M C, MURPHY S M. Bottom-up vs.top-down effects on terrestrial insect herbivores: a meta-analysis[J]. Ecology Letters, 2018, 21(1): 138-150. DOI:10.1111/ele.12874 |
| [52] |
ROSSETTI M R, TSCHARNTKE T, AGUILAR R, et al. Responses of insect herbivores and herbivory to habitat fragmentation: a hierarchical meta-analysis[J]. Ecology Letters, 2017, 20(2): 264-272. DOI:10.1111/ele.12723 |
| [53] |
WANG R, SHI Y S, ZHANG Y X, et al. Distance-dependent seed-seedling transition in the tree Castanopsis sclerophylla is altered by fragment size[J]. Communications Biology, 2019, 2: 277. DOI:10.1038/s42003-019-0528-x |
| [54] |
FLETCHER R J, DIDHAM R K, BANKS-LEITE C, et al. Is habitat fragmentation good for biodiversity?[J]. Biological Conservation, 2018, 226: 9-15. DOI:10.1016/j.biocon.2018.07.022 |
| [55] |
LIU J J, WILSON M, HU G, et al. How does habitat fragmentation affect the biodiversity and ecosystem functioning relationship?[J]. Landscape Ecology, 2018, 33(3): 341-352. DOI:10.1007/s10980-018-0620-5 |
| [56] |
BAGCHI R, BROWN L M, ELPHICK C S, et al. Anthropogenic fragmentation of landscapes: mechanisms for eroding the specificity of plant-herbivore interactions[J]. Oecologia, 2018, 187(2): 521-533. DOI:10.1007/s00442-018-4115-5 |
| [57] |
KRISHNADAS M, BAGCHI R, SRIDHARA S, et al. Weaker plant-enemy interactions decrease tree seedling diversity with edge-effects in a fragmented tropical forest[J]. Nature Communications, 2018, 9(1): 4523. DOI:10.1038/s41467-018-06997-2 |



