2. 广西大学资源环境与材料学院, 广西南宁 530004;
3. 柳州职业技术学院环境与食品工程学院, 广西柳州 545006
2. School of Resources, Environment and Materials, Guangxi University, Nanning, Guangxi, 530004, China;
3. College of Environment and Food Engineering, Liuzhou Vocational and Technical College, Liuzhou, Guangxi, 545006, China
当归(Angelica sinensis)为中国传统药材,其化学成分非常复杂,包含多糖、黄酮、挥发油等多种有机化合物。随着市场对当归需求的不断增加,中药资源的开发力度不断加大,生产过程中产生的当归药渣也日益增加[1, 2]。目前当归药渣综合利用率还很低,大部分采用掩埋或焚烧等方式处理,这不仅占用大量土地、污染环境,而且还造成严重的资源浪费[3]。
当归多糖的提取方法包括水提醇沉法、微波辅助提取法和超声波提取法等。其中基于多糖溶解度特性的水提醇沉法是常用的提取方法,在植物多糖的提取和分离中应用广泛[4, 5]。但是,传统的水提醇沉法会导致多糖产物中含有大量的蛋白质、核酸、色素等杂质,使得下游纯化过程复杂且耗时[6, 7]。
作为新一代绿色溶剂,离子液体(Ionic Liquids, ILs)和低共熔溶剂(Deep Eutectic Solvent, DES)被广泛应用于天然成分提取领域。ILs的蒸气压可忽略不计,具有良好的溶解性、热稳定性和可萃取性[8],但其成本高于普通有机溶剂,而且具有潜在的生物毒性和较差的生物降解性[9]。DES是由氢键受体(通常是氯化胆碱)和氢键供体(通常是天然化合物,如氨基酸、有机酸、糖等)组成的共晶混合物[10],它具有生物可降解性、成本低、易合成、增溶作用较高、毒性低甚至没有毒性等优势[11]。DES可以溶解蛋白质、氨基酸和多糖等多种物质[12],可从植物中高效地提取极性或非极性成分。目前已有学者开展DES对酚类[13]、类黄酮[14]和卡拉胶[15]的提取研究,鲜有其对中药渣粗多糖提取的相关报道[16]。因此,本研究主要对DES的种类、组成成分的摩尔比、DES含水量、提取温度、提取时间和液料比对当归药渣粗多糖(Angelica sinensis Residue Crude Polysaccharide,ARP)提取率的影响进行考察,并应用响应面模型设计试验,以确定最优ARP提取工艺,为中药渣活性成分高效、绿色提取提供参考。
1 材料与方法 1.1 材料当归药渣为醇提后的剩余物,由广西强寿药业集团有限公司提供,将其置于50 ℃烘箱烘至恒重,过80目筛,待用。氯化胆碱、尿素、1, 4-丁二醇、乳酸、草酸、葡萄糖、苯酚、浓硫酸和无水乙醇均购自成都市科隆化学品有限公司且均为分析纯。
仪器:HH-4型数显恒温水浴锅(上海力辰邦西仪器科技有限公司),UV-5100型紫外可见分光光度计[尼柯(上海)仪器有限公司],JJ124BC型电子分析天平(常熟市双杰测试仪器厂),DD-5M型低速大容量离心机(湖南湘立科学仪器有限公司),JY98-ⅡIDN多超声波细胞破碎机(上海五相仪器仪表有限公司),Nicolet iS50型红外光谱分析仪(Thermo Scientific公司)。
1.2 低共熔溶剂的制备与筛选通过加热法制备DES[17],配制以氯化胆碱为受氢体(Hydrogen Bond Acceptors,HBA),以酰胺类、多元醇类、羧酸类为供氢体(Hydrogen Bond Donor,HBD)的5种低共熔溶剂,即氯化胆碱-尿素(Choline Chloride-Urea,CCU),氯化胆碱-1,4-丁二醇(Choline Chloride-1, 4-Butanediol,CCB), 氯化胆碱-乙二醇(Choline Chloride-Ethylene Glycol,CCEG),氯化胆碱-乳酸(Choline Chloride-Lactic Acid,CCLA),氯化胆碱-草酸(Choline Chloride-Oxalic Acid,CCOA)。按一定的摩尔比将HBA和HBD混合放入500 mL的锥形瓶中,加入一定量的水,80 ℃水浴加热,搅拌至溶液澄清透明,冷却,备用。
1.3 ARP的提取 1.3.1 DES提取ARP准确称取1 g当归药渣粉末放入锥形瓶中,按照相应的液料比加入适量的DES,在超声波细胞破碎机(超声功率为1 000 W)中进行DES-超声双辅助提取,然后通过真空蒸馏将提取物浓缩至初始体积的20%,再向浓缩物中加入无水乙醇至终浓度为80%完成沉淀,最后干燥得到ARP。采用苯酚-硫酸法测定ARP总糖含量[18],以葡萄糖为对照品,于波长490 nm处测定吸光度。以葡萄糖含量(mg)为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,并由此得到回归方程为Y=0.0098X+0.0404,R2=0.999 1,测定ARP总糖含量。
ARP提取率(%)和ARP总糖含量(%)的计算公式如下:
| $ {\rm{ARP提取率(\%)}}=M_{\mathrm{ARP}} / M \times 100 \%, $ | (1) |
| $ {\rm{ARP总糖含量(\%)}}=(C \times V \times n) / M_{\mathrm{ARP}} \times \\ 100 \% \text {, } $ | (2) |
其中,MARP为ARP的质量,M为当归药渣质量,C为ARP溶液中葡萄糖的浓度,V为ARP溶液的体积,n为稀释倍数。
1.3.2 水提醇沉法提取ARP准确称取5 g当归药渣粉末,按照40 mL/g液料比加入蒸馏水,在1 000 W超声功率下沸水浴浸提2 h。重复提取3次后,往粗多糖提取液中加入3倍体积的无水乙醇并离心(5 000 r/min,20 min),所得粗多糖用乙醚和无水乙醇交替清洗2次,在干燥通风处自然风干,即得当归药渣粗多糖,并按照1.3.1节方法测定ARP总糖含量。
1.4 ARP的红外光谱分析采用傅里叶变换红外光谱(FTIR)分析ARP的化学官能团变化。取约50 mg粗多糖与一定量的溴化钾混合均匀后放入研钵中,研成粉末并压片,扫描范围为400-4 000 cm-1,分辨率为4 cm-1,扫描次数为32次。
1.5 单因素试验设计设置基础试验条件如下:各类DES的含水量为30%,供氢体与氯化胆碱的摩尔比为3∶1,提取时间为40 min,提取温度为90 ℃,液料比为30 mL/g。采用单因素试验设计考察DES的种类(CCU、CCB、CCLA、CCEG、CCOA)、供氢体与氯化胆碱的摩尔比(2∶1、3∶1、4∶1、5∶1、6∶1)、DES含水量(10%、20%、30%、40%、50%)、提取温度(60、70、80、90、100 ℃)、提取时间(20、30、40、50、60 min)和液料比(20、30、40、50、60 mL/g)对ARP提取率的影响。考察某一因素对ARP提取率的影响时,只调整该因素,其他因素条件不变,但所得优化结果作为下一步试验的条件。每个试验重复5次,计算相对标准偏差(RSD)值。
1.6 工艺优化在单因素试验的基础上,利用Design Expert 8.0.6软件设计响应面试验。以提取温度(A)、提取时间(B)、供氢体与氯化胆碱的摩尔比(C)为自变量,以ARP提取率(Y)为考察指标,设计17个试验点进行组合试验,试验因素与水平见表 1。
| 水平 Levels |
因素 Factor |
||
| A:提取温度/℃ A:extraction temperature/℃ |
B:提取时间/min B:extraction time/min |
C:供氢体与氯化 胆碱的摩尔比 C:molar ratio of hydrogen donor to choline chloride |
|
| -1 | 70 | 30 | 4 |
| 0 | 80 | 40 | 5 |
| 1 | 90 | 50 | 6 |
2 结果与分析 2.1 当归药渣粗多糖的FTIR
由图 1可知,所提取的ARP在3 391 cm-1处存在-OH伸缩振动吸收峰,在2 920 cm-1处产生了C-H伸缩振动吸收峰,这两个特征峰是多糖的特征峰[19]。另外,红外谱图显示在1 633 cm-1处有C==O伸缩振动吸收峰,在1 418 cm-1和1 380 cm-1处有C-O弯曲振动吸收峰,在1 059 cm-1处为C-O-C不对称吸收峰,表明ARP中存在吡喃糖[20],因此所提取的当归药渣粗多糖符合多糖官能团结构特征。
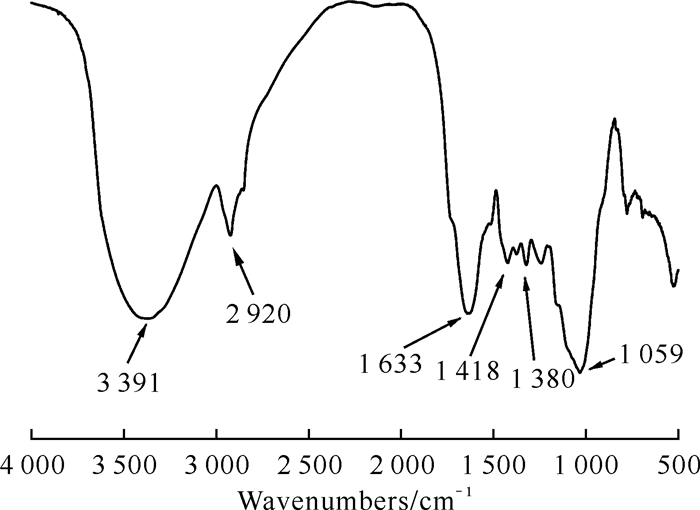
|
| 图 1 当归药渣粗多糖的红外光谱图 Fig.1 FTIR spectra of ARP |
2.2 单因素试验结果 2.2.1 不同类型DES对ARP提取率的影响
使用DES从当归药渣中提取多糖,需要重点研究DES的理化性质,如扩散、溶解度、黏度、表面张力、极性和理化相互作用等,这些性质直接决定了低共熔溶剂对样品基质的渗透能力和目标化合物从样品中的溶出效率。图 2为DES的类型对ARP提取率的影响,其中CCEG提取ARP的效率最高,提取率为13.65%,明显高于其余几种DES,这可能是由于CCEG与ARP形成氢键的能力更高,与ARP的静电相互作用也比其他DES大[21]。因此,CCEG适合提取ARP。
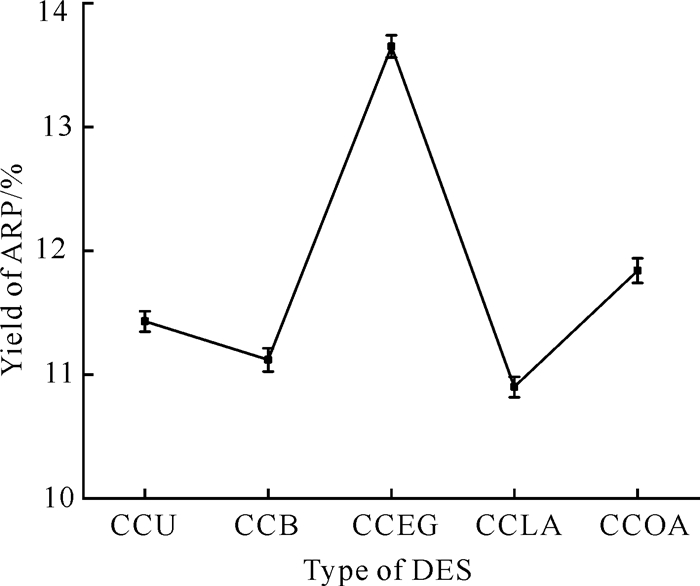
|
| 图 2 不同类型DES对ARP提取率的影响 Fig.2 Effect of the type of DES on the extraction yield of ARP |
2.2.2 乙二醇与氯化胆碱的摩尔比对ARP提取率的影响
DES的组成会影响其供氢体和受氢体之间的氢键,从而决定其黏度和极性[16]。由2.2.1节可知,CCEG适合提取ARP,因此试验进一步比较不同摩尔比的CCEG对ARP提取率的影响(图 3)。随着乙二醇与氯化胆碱摩尔比从2∶1增加到6∶1,提取率首先快速升高,然后趋于平缓,当乙二醇与氯化胆碱的摩尔比为5∶1时,ARP提取率最高,为13.96%。增加乙二醇在DES中的比例,不仅可以降低DES的黏度和表面张力,而且还可以提高DES的传质速率,从而提高提取率。然而,增加到一定程度后,会减弱乙二醇与氯化胆碱的相互作用,使得提取率变化不明显[14, 17]。因此,CCEG中乙二醇与氯化胆碱的摩尔比设置为4∶1-6∶1比较合适。
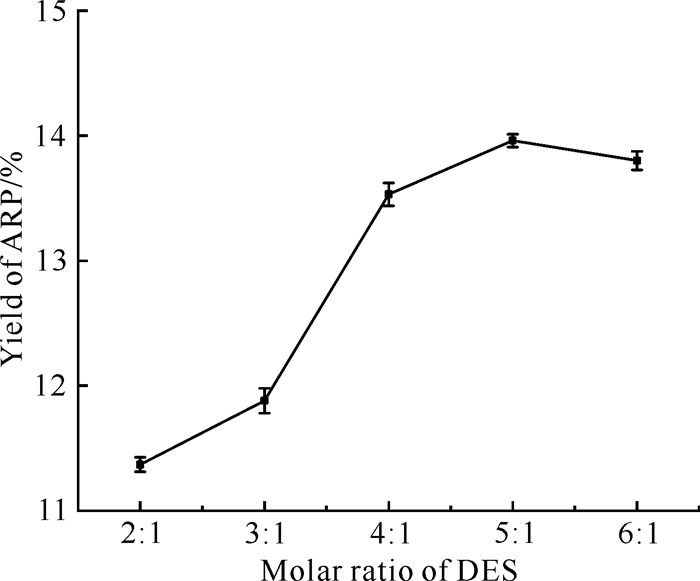
|
| 图 3 DES摩尔比对ARP提取率的影响 Fig.3 Effect of the molar ratio of DES on the extraction yield of ARP |
2.2.3 DES含水量对ARP提取率的影响
DES组分之间存在广泛的氢键网络,这导致其黏度高、迁移率弱。改变DES的黏度是样品基质中活性成分向溶液迁移的关键[22],DES的含水量会影响其黏度,增加其极性,因此试验研究不同含水量条件下ARP提取率的变化(图 4)。在CCEG摩尔比为4∶1、提取时间为40 min、提取温度为90 ℃、液料比为30 mL/g的条件下,当CCEG含水量小于40%(V∶V)时,提取率随含水量的增加而增加,最高为13.43%;而在含水量为40%-50%(V∶V)时,提取率随含水量的增加而下降。上述结果说明ARP提取率与DES溶液的含水量有关,低含水量的CCEG不利于植物细胞的渗透,难以提高提取率。然而,过高含水量会增加CCEG的极性,降低CCEG与ARP的相互作用,进而促进乙二醇和氯化胆碱的简单水溶液的形成,降低ARP提取率[23]。因此,在之后的提取过程中,将CCEG的含水量固定为40%(V∶V)。
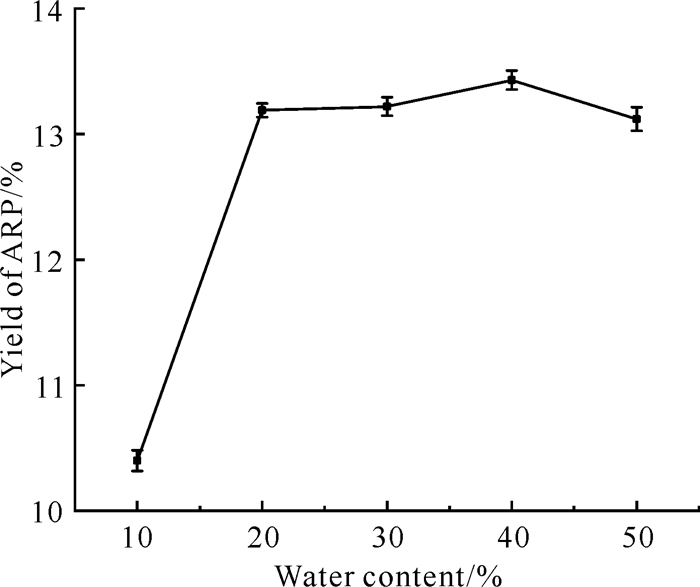
|
| 图 4 DES含水量对ARP提取率的影响 Fig.4 Effect of water content of DES on the extraction yield of ARP |
2.2.4 提取温度对ARP提取率的影响
目标化合物通过物理吸附和化学相互作用吸附在样品基质上。高温往往会降低这些物理吸附和化学相互作用,从而增加提取溶剂中目标化合物的浸出[14]。此外,较高的提取温度可以大大降低萃取溶剂的黏度,增加提取溶剂的扩散,加速目标化合物的质量传递。
不同提取温度条件下ARP提取率变化如图 5所示。在CCEG含水量为40%、乙二醇与氯化胆碱的摩尔比为4∶1、提取时间为40 min、液料比为30 mL/g的条件下,80 ℃时的提取率最高。当提取温度超过80 ℃时,提取率明显下降,这是因为虽然较高的提取温度可以提高提取率,但是可能会使多糖发生热降解[24],从而降低提取率。因此,之后的实验均在80 ℃下进行。
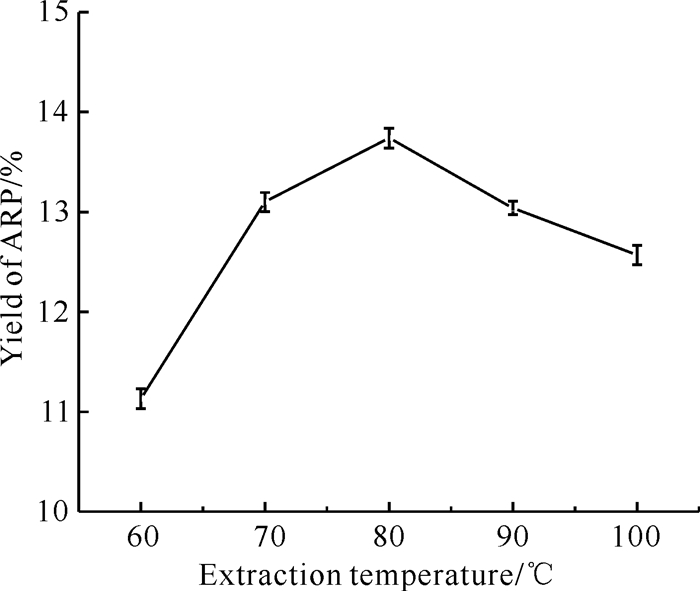
|
| 图 5 提取温度对ARP提取率的影响 Fig.5 Effect of extraction temperature on the extraction yield of ARP |
2.2.5 提取时间对ARP提取率的影响
如图 6所示,在CCEG含水量为40%、乙二醇与氯化胆碱的摩尔比为4∶1、提取温度为80 ℃、液料比为30 mL/g的条件下,当提取时间为20-40 min时,提取率随提取时间的增加而增加;但当提取时间超过40 min时,提取率随提取时间的增加而降低,这可能是由于粗多糖在高温和长时间的提取下发生了水解[25]。因此,提取时间控制在40 min为宜。
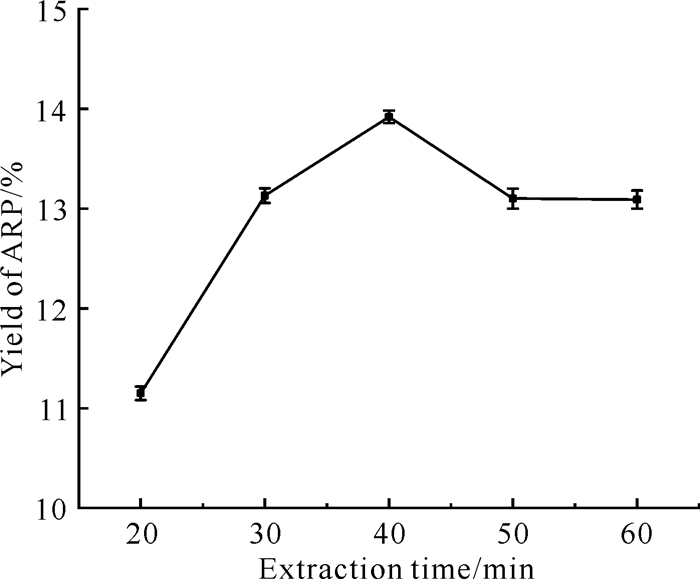
|
| 图 6 提取时间对ARP提取率的影响 Fig.6 Effect of extraction time on the extraction yield of ARP |
2.2.6 液料比对ARP提取率的影响
在CCEG含水量为40%、乙二醇与氯化胆碱的摩尔比为4∶1、提取时间为40 min,提取温度为80 ℃的条件下,分别在20、30、40、50、60 mL/g的液料比下提取ARP,结果如图 7所示。随着液料比的不断增大,提取率先增大后略有下降。虽然增加提取溶剂可以提高目标化合物的浸出率,但是也会导致提取溶剂的浪费并增加液固提取过程的复杂性[22]。因此,40 mL/g的液料比足以保证ARP的提取率。
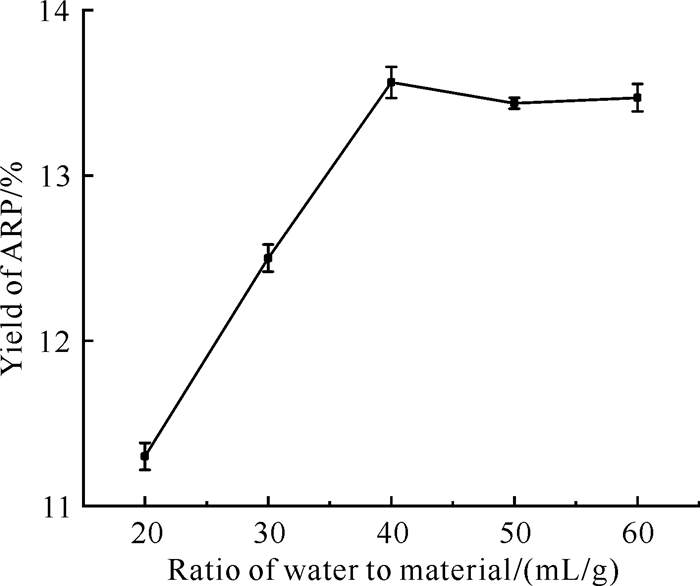
|
| 图 7 液料比对ARP提取率的影响 Fig.7 Effect of ratio of water to material on the extraction yield of ARP |
2.3 响应面试验结果与分析 2.3.1 响应面试验结果
通过三因素三水平Box-Behnken Design(BBD)试验,考察3个自变量的相互作用,确定最佳ARP提取条件,结果见表 2。
| 试验号 Test number |
A: 提取温度/℃ A: extraction temperature/℃ |
B: 提取时间/min B: extraction time/min |
C: 乙二醇与氯化胆碱的摩尔比 C: molar ratio of ethylene glycol to choline chloride |
Y: ARP提取率/% Y: yield of ARP/% |
| 1 | 80 | 40 | 5 | 14.21 |
| 2 | 80 | 40 | 5 | 14.17 |
| 3 | 80 | 50 | 4 | 13.03 |
| 4 | 80 | 40 | 5 | 14.23 |
| 5 | 70 | 30 | 5 | 11.62 |
| 6 | 70 | 40 | 4 | 12.01 |
| 7 | 80 | 40 | 5 | 14.32 |
| 8 | 90 | 50 | 5 | 13.13 |
| 9 | 80 | 30 | 6 | 13.23 |
| 10 | 90 | 40 | 6 | 13.79 |
| 11 | 70 | 40 | 6 | 12.52 |
| 12 | 80 | 30 | 4 | 11.93 |
| 13 | 90 | 40 | 4 | 12.25 |
| 14 | 80 | 50 | 6 | 14.03 |
| 15 | 90 | 30 | 5 | 11.46 |
| 16 | 70 | 50 | 5 | 11.59 |
| 17 | 80 | 40 | 5 | 14.26 |
根据响应面试验结果得到回归方程:Y=14.24+0.36A+0.44B+0.54C+0.42AB+0.26AC-0.075BC-1.35A2-0.94B2-0.25C2。对表 2中的数据进行二阶多项式回归分析和方差统计分析(表 3)。模型的F值为464.51,P < 0.000 1,且失拟误差的P值为0.266 1>0.05,表明模型具有极显著的统计学意义并且失拟性不显著,试验结果受未知因素的影响较小[26]。模型的相关系数R2=0.998 3,表明模型具有良好的可信度;矫正系数RAdj2=0.996 2,表示该模型可以解释99.62%的试验数据。较低的系数变异值(C.V.%=0.51)证实了回归模型实验值的准确性和可靠性。由表 3可知,除BC交互作用影响效果不明显外,其他因素对ARP提取率的影响极显著。
| 来源 Source |
平方和 Sum of square |
自由度 df |
均方 Mean square |
F值 F value |
P值 P value |
| Model | 18.55 | 9 | 2.06 | 464.51 | <0.000 1** |
| A | 1.04 | 1 | 1.04 | 235.33 | <0.000 1** |
| B | 1.57 | 1 | 1.57 | 353.09 | <0.000 1** |
| C | 2.37 | 1 | 2.37 | 533.16 | <0.000 1** |
| AB | 0.72 | 1 | 0.72 | 162.86 | <0.000 1** |
| AC | 0.27 | 1 | 0.27 | 59.78 | 0.000 1** |
| BC | 0.023 | 1 | 0.023 | 5.07 | 0.059 0 |
| A2 | 7.68 | 1 | 7.68 | 1 730.34 | <0.000 1** |
| B2 | 3.70 | 1 | 3.70 | 834.60 | <0.000 1** |
| C2 | 0.25 | 1 | 0.25 | 57.08 | 0.000 1** |
| Residual | 0.031 | 7 | 4.436E-003 | ||
| Lack of fit | 0.018 | 3 | 6.125E-003 | 1.93 | 0.266 1 |
| Pure error | 0.013 | 4 | 3.170E-003 | ||
| Cor total | 18.58 | 16 | |||
| Note: *P<0.05 means significant; **P<0.01 means extremely significant. | |||||
2.3.2 响应面交互作用分析
利用Design Expert 8.0.6软件对3个因素交互作用进行分析比较,并分别给出AB、AC、BC的响应面三维曲线图和二维响应等高线图(图 8)。响应面三维曲线图可以显示自变量对响应变量的影响;二维响应等高线图不仅可以解释自变量之间的相互作用,而且可以反映变量相互作用的重要性,其中圆形响应等高线表明变量之间的相互作用可以忽略不计,而椭圆响应等高线表明变量之间存在显著的相互作用[27]。由图 8可知,A和B交互作用的响应面最陡峭,而B和C的交互作用响应面最平缓,表明B和C的交互作用对ARP提取率的影响相对较小。上述结果与方差分析结果一致,说明回归模型可以较好地描述A、B和C这3个因素对ARP提取率的影响。
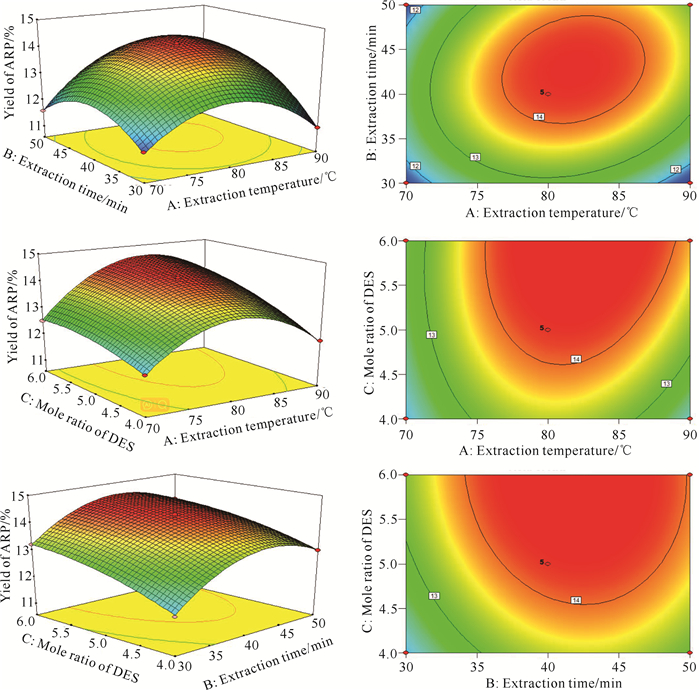
|
| 图 8 交互因素对ARP提取率影响的响应面图 Fig.8 Response surface diagrams of the effect of interactive factors on the yield of ARP |
2.4 ARP的最佳提取工艺
根据前述响应面模型和结果分析,得出ARP的最佳提取条件:提取温度81.76 ℃,提取时间39.88 min,乙二醇与氯化胆碱的摩尔比为5.86∶1。在此条件下,模型预测ARP提取率为14.58%。为方便试验,将试验条件调整为提取温度82 ℃,提取时间40 min,乙二醇与氯化胆碱的摩尔比6∶1。在此条件下进行3次平行验证试验,得到ARP的提取率为(14.43±0.10)%,表示该模型具有较高的可靠性,且提取工艺的重现性较好,说明该模型适用于DES提取工艺的优化。根据公式(2)可知,DES提取ARP的总糖含量为(47.54±1.23)%。传统的水提醇沉法所得的ARP提取率为(9.85±0.12)%,ARP总糖含量为(25.45±1.37)%。因此,低共熔溶剂是一种较好的提取溶剂,可替代传统溶剂进行多糖的提取。
3 结论本研究建立了低共熔溶剂CCEG提取ARP的方法。在单因素试验筛选的基础上,采用响应面试验进一步优化提取条件,得到最优提取工艺为提取温度82 ℃、提取时间40 min、乙二醇与氯化胆碱的摩尔比6∶1。该工艺的ARP提取率为(14.43±0.10)%,ARP总糖含量为(47.54±1.23)%。从提取率和总糖含量上看,低共熔溶剂提取优于传统水提醇沉法提取。
本研究仅讨论CCEG提取条件对ARP提取效果的影响,针对ARP中CCEG的残留未作进一步探讨。前人研究表明,常用的DES对细胞[28]、真菌[29]和动物[30]都表现为无毒或低毒,但也有研究发现,氯化胆碱-尿素型DES对水螅的毒性强于单组分[29]。因此,后续还应增加DES安全性的毒理学研究和动物实验,从而避免多糖提取过程中DES的残留可能对多糖品质和人体健康产生的不利影响[31]。同时,未来可拓展多组分DES对不同活性成分的提取、DES回收再利用方面的研究,从而推动绿色、高效提取技术的发展。
| [1] |
ZHOU Y, SELVAM A, WONG J W C. Chinese medicinal herbal residues as a bulking agent for food waste composting[J]. Bioresource Technology, 2018, 249: 182-188. DOI:10.1016/j.biortech.2017.09.212 |
| [2] |
杨冰, 丁斐, 李伟东, 等. 中药渣综合利用研究进展及生态化综合利用模式[J]. 中草药, 2017, 48(2): 377-383. |
| [3] |
方悦悦, 陈诺, 肖平, 等. "双碳"背景下中药药渣高值化利用技术与途径[J]. 中国中药杂志, 2023, 48(19): 5142-5151. |
| [4] |
SUN S J, DENG P, PENG C E, et al. Extraction, structure and immunoregulatory activity of low molecular weight polysaccharide from Dendrobium officinale[J]. Polymers, 2022, 14(14): 2899. DOI:10.3390/polym14142899 |
| [5] |
曹玉标, 孙亮亮, 杨野, 等. 三七药渣中主要多糖成分的分离纯化及其抗氧化活性研究[J]. 中草药, 2023, 54(1): 100-111. |
| [6] |
CHEN C, YOU L J, ABBASI A M, et al. Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohydrate Polymers, 2015, 130: 122-132. DOI:10.1016/j.carbpol.2015.05.003 |
| [7] |
CHEN M, LI D, MENG X, et al. Review of isolation, purification, structural characteristics and bioactivities of polysaccharides from Portulaca oleracea L[J]. International Journal of Biological Macromolecules, 2024, 257: 128565. DOI:10.1016/j.ijbiomac.2023.128565 |
| [8] |
ANTUNES E C, OLIVEIRA F, TEMMINK H, et al. Separation of polysaccharide and protein by ionic liquid-based extraction techniques[J]. Journal of Ionic Liquids, 2023, 3(2): 100058. DOI:10.1016/j.jil.2023.100058 |
| [9] |
SZABÓ L, MILOTSKYI R, SHARMA G, et al. Cellulose processing in ionic liquids from a materials science perspective: turning a versatile biopolymer into the cornerstone of our sustainable future[J]. Green Chemistry, 2023, 25(14): 5338-5389. DOI:10.1039/D2GC04730F |
| [10] |
CAJNKO M M, VICENTE F A, NOVAK U, et al. Natural deep eutectic solvents (NaDES): translating cell biology to processing[J]. Green Chemistry, 2023, 25(22): 9045-9062. DOI:10.1039/D3GC01913F |
| [11] |
TÜRKER D A, DOǦAN M. Ultrasound-assisted natural deep eutectic solvent extraction of anthocyanin from black carrots: optimization, cytotoxicity, in-vitro bioavailability and stability[J]. Food and Bioproducts Processing, 2022, 132: 99-113. DOI:10.1016/j.fbp.2022.01.002 |
| [12] |
QU H, WU Y, LUO Z, et al. An efficient approach for extraction of polysaccharide from abalone (Haliotis discus hannai Ino) viscera by natural deep eutectic solvent[J]. International Journal of Biological Macromolecules, 2023, 244: 125336. DOI:10.1016/j.ijbiomac.2023.125336 |
| [13] |
GARCÍA A, RODRÍGUEZ-JUAN E, RODRÍGUEZGUTIÉRREZ G, et al. Extraction of phenolic compounds from virgin olive oil by deep eutectic solvents (DESs)[J]. Food Chemistry, 2016, 197(Pt A): 554-561. |
| [14] |
MORE P R, JAMBRAK A R, ARYA S S. Green, environment-friendly and sustainable techniques for extraction of food bioactive compounds and waste valorization[J]. Trends in Food Science & Technology, 2022, 128: 296-315. |
| [15] |
DAS A K, SHARMA M, MONDAL D, et al. Deep eutectic solvents as efficient solvent system for the extraction of κ-carrageenan from Kappaphycus alvarezii[J]. Carbohydrate Polymers, 2016, 136: 930-935. DOI:10.1016/j.carbpol.2015.09.114 |
| [16] |
ZHANG L J, WANG M S. Optimization of deep eutectic solvent-based ultrasound-assisted extraction of polysaccharides from Dioscorea opposita Thunb.[J]. International Journal of Biological Macromolecules, 2017, 95: 675-681. DOI:10.1016/j.ijbiomac.2016.11.096 |
| [17] |
HESSEL V, TRAN N N, ASRAMI M R, et al. Sustainability of green solvents-review and perspective[J]. Green Chemistry, 2022, 24(2): 410-437. DOI:10.1039/D1GC03662A |
| [18] |
WANG S Y, WANG L, LIU M, et al. An effective estimation of distribution algorithm for solving the distributed permutation flow-shop scheduling problem[J]. International Journal of Production Economics, 2013, 145(1): 387-396. DOI:10.1016/j.ijpe.2013.05.004 |
| [19] |
WANG Q Q, HU H M, XIONG L, et al. Structural characterization and prebiotic activity of Bletilla striata polysaccharide prepared by one-step fermentation with Bacillus licheniformis BJ2022[J]. International Journal of Biological Macromolecules, 2024, 258: 128822. DOI:10.1016/j.ijbiomac.2023.128822 |
| [20] |
GHAMGUI H, JARBOUI R, JEDDOU K B, et al. Polysaccharide from Thymelaea hirsuta L.leaves: structural characterization, functional properties and antioxidant evaluation[J]. International Journal of Biological Macromolecules, 2024, 262(Pt 2): 129244. |
| [21] |
MEHRABI F, GHAEDI M, ALIPANAHPOUR DIL E. Magnetic nanofluid based on hydrophobic deep eutectic solvent for efficient and rapid enrichment and subsequent determination of cinnamic acid in juice samples: vortex-assisted liquid-phase microextraction[J]. Talanta, 2023, 260: 124581. DOI:10.1016/j.talanta.2023.124581 |
| [22] |
WANG M, WANG J, ZHANG Y, et al. Fast environment-friendly ball mill-assisted deep eutectic solvent-based extraction of natural products[J]. Journal of Chromatography A, 2016, 1443: 262-266. DOI:10.1016/j.chroma.2016.03.061 |
| [23] |
GUTIÉRREZ M C, FERRER M L, MATEO C R, et al. Freeze-drying of aqueous solutions of deep eutectic solvents: a suitable approach to deep eutectic suspensions of self-assembled structures[J]. Langmuir, 2009, 25(10): 5509-5515. DOI:10.1021/la900552b |
| [24] |
CHEN R, LI S, LIU C, et al. Ultrasound complex enzymes assisted extraction and biochemical activities of polysaccharides from Epimedium leaves[J]. Process Biochemistry, 2012, 47(12): 2040-2050. DOI:10.1016/j.procbio.2012.07.022 |
| [25] |
LIU J C, MIAO S, WEN X, et al. Optimization of polysaccharides (ABP) extraction from the fruiting bodies of Agaricus blazei Murill using response surface methodology (RSM)[J]. Carbohydrate Polymers, 2009, 78(4): 704-709. DOI:10.1016/j.carbpol.2009.06.003 |
| [26] |
陈盛仕, 刘梓宜, 李梦琪, 等. 钝顶螺旋藻藻蓝蛋白的提取工艺优化及其纯化研究[J]. 广西科学院学报, 2022, 38(4): 388-402. |
| [27] |
ZHANG Y L, HE L, LI Q, et al. Optimization of ultrasonic-assisted deep eutectic solvent for the extraction of polysaccharides from Indocalamus tessellatus leaves and their biological studies[J]. Sustainable Chemistry and Pharmacy, 2022, 30: 100855. DOI:10.1016/j.scp.2022.100855 |
| [28] |
HUANG Z L, WU B P, WEN Q, et al. Deep eutectic solvents can be viable enzyme activators and stabilizers[J]. Journal of Chemical Technology & Biotechnology, 2014, 89(12): 1975-1981. |
| [29] |
刘伟, 王晓雨, 周玉溪, 等. 低共熔溶剂在植物多糖提取中的应用研究进展[J]. 食品工业科技, 2023, 44(24): 1-11. |
| [30] |
ZHOU R R, HUANG J H, HE D, et al. Green and efficient extraction of polysaccharide and ginsenoside from American ginseng (Panax quinquefolius L.) by deep eutectic solvent extraction and aqueous two-phase system[J]. Molecules, 2022, 27(10): 3132. DOI:10.3390/molecules27103132 |
| [31] |
FERREIRA I J, MENESES L, PAIVA A, et al. Assessment of deep eutectic solvents toxicity in zebrafish (Danio rerio)[J]. Chemosphere, 2022, 299: 134415. DOI:10.1016/j.chemosphere.2022.134415 |



