2. 广西海洋研究所有限责任公司, 广西海水养殖新品种繁育工程技术研究中心, 广西北海 536000;
3. 北部湾海洋产业研究院, 广西防城港 538000
2. Guangxi Engineering Technology Research Center of Breeding of New Mariculture Varieties, Guangxi Institute of Oceanology Co., Ltd., Beihai, Guangxi, 536000, China;
3. Beibu Gulf Marine Industry Research Institute, Fangchenggang, Guangxi, 538000, China
织锦巴非蛤(Paphia textile)俗称花甲王,属于软体动物门(Mollusca)帘蛤科(Veneridae)巴非蛤属(Paphia),在中国主要分布在南海尤其是北部湾一带,是目前经济价值较高的海产名贵经济贝类之一[1]。由于多年的过度采捕,织锦巴非蛤的自然资源量急剧减少,在广西沿海价格居高不下[2]。据调查,2023年广西织锦巴非蛤的市场价格已达到120-140元/kg。因其高昂的价格,织锦巴非蛤人工养殖在北部湾海域得到快速推广,其人工苗市场供不应求[3]。织锦巴非蛤在室内育苗过程中,由于水环境封闭、低换水率以及幼体密度高,容易使水环境恶化和菌群失衡,再加上幼体敏感的特点,常常易造成幼体特别是在变态期和稚贝期大量死亡。养殖环境中存在大量的微生物类群,直接影响着养殖动物的健康,其中有益微生物能直接参与养殖系统的物质循环、水质调节、病原拮抗并维持育苗系统稳定[4-6],同时养殖环境中也存在大量的条件致病菌,常常引起病害的发生[7, 8]。因此,对织锦巴非蛤育苗各阶段水体菌群的组成进行分析和比较,有助于提高织锦巴非蛤的育苗成活率,为苗期病害防控提供依据。
目前,有关贝类幼体发育过程中水体菌群的研究较少,马英等[9]采用16S rRNA基因克隆文库分析方法研究了九孔鲍(Haliotis diversicolor supertexta)育苗期养殖水体中细菌的群落结构,结果发现弧菌是其优势细菌类群;孙雪莹等[10]同时采用传统培养方法和16S rRNA基因序列分析了虾夷扇贝(Patinopecten yessoensisis)幼体不同发育时期苗种培育中的细菌群落,结果发现细菌组成存在差异;Sun等[11]通过高通量测序技术比较了虾夷扇贝幼体发育5个时期水体的细菌群落,发现幼虫死亡率发生在从D型幼虫期向壳顶期过渡期间以及壳顶期的整个阶段,这与细菌群落发生巨大变化的结果吻合。目前,国内外对织锦巴非蛤的研究主要集中在对其人工育苗的研究上,如织锦巴非蛤幼体对不同种类单胞藻的摄食和消化效果[12],以及温度对其稚贝生存和生长的影响[13]等,尚未见有关织锦巴非蛤幼体不同发育时期细菌群落结构和组成的报道。织锦巴非蛤室内育苗期间水体相对封闭,幼体变态频繁,饵料多次转换,其不同幼体阶段水体微生物的多样性和群落结构尚未可知。因此,本研究在织锦巴非蛤一个全育苗周期内,通过高通量测序技术分析了其D型幼虫期、壳顶期、变态前期、变态后期和稚贝期育苗水体中的群落结构和组成,拟为其苗种规模化人工繁育提供理论依据。
1 材料与方法 1.1 育苗于2022年9月在位于广西北海的广西海洋研究所有限责任公司海水增养殖基地对织锦巴非蛤进行育苗试验,每个育苗池水体16 m3。育苗用水为经砂滤的自然海水,盐度30-31,水温25-27 ℃,pH值为8.1-8.4。育苗期间水体持续通气,每天换水25%,每7 d倒池1次。根据幼体生长规律,D形幼虫期至壳顶期投喂湛江等边金藻(Isochrysis zhanjianggensis),壳顶期之后投喂湛江等边金藻和牟氏角毛藻(Chaetoceros muelleri),投喂比例由3∶1→1∶1→0∶1渐进式转变,之后混合投喂牟氏角毛藻和青岛大扁藻(Platymonas helgolandica),日投喂2次,根据每日摄食情况调整投喂量。幼体壳长达到250 μm左右时分化出足,表示幼体即将附着变态成为稚贝,此时需倒池并投放附着基。健康幼体变态率在45%左右。育苗期间未使用抗生素和其他化学药物,幼体健康,无发病现象。
1.2 水样采集和环境因子检测在织锦巴非蛤幼体发育的5个时期,采用多点取样法分别从3个点无菌采集苗种培育水样1 L,混合作为一个样品,D形幼虫期、壳顶期、变态前期、变态后期和稚贝期分别标记为HD、HK、HB、HA、HZ,所有样品采集后立即放入冰盒中带回实验室做后续处理。分别用温度计、盐度计、pH计和溶氧仪现场测定采样时的水温、盐度、pH值和溶解氧。
1.3 水样基因组DNA提取、PCR扩增及高通量测序将每个池的3 L水样混匀后,取其中1 L水样先经5 μm孔径的混合纤维膜预过滤去除杂质后,再用0.22 μm无菌聚醚砜膜(天津市津腾实验设备有限公司)进行抽滤,将带有水体菌体的滤膜剪碎,用E.Z.N.A Water DNA Extraction Kit试剂盒(Omega Bio-Tek,USA)提取基因组DNA。对16S rDNA基因可变区V3-V4区进行PCR扩增,所用引物序列为细菌特异性引物341F (5′-CCTAYGGGRBGCASCAG-3′)和806R (5′-GGACTACNNGGGTATCTA AT-3′)。PCR产物使用2%浓度的琼脂糖凝胶电泳检测,送武汉贝纳科技有限公司的Illumina HiSeq测序平台检测,利用边合成边测序(Sequence by synthesis)的方法对marker基因进行测序。
1.4 数据分析对原始测序序列使用FLASH软件(version 1.2.11)进行拼接,将拼接得到的序列使用Trimmomatic软件(version 0.33)进行质量过滤,并利用UCHIME软件(version 8.1)去除嵌合体,得到高质量序列(Tags)。分析过程中删除了古菌、叶绿体、未知序列以及只检测到1次的序列。利用USEARCH(version 10.0)软件对所有样品的Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成操作分类单元(Operational Taxonomic Units,OTUs),用SILVA的SSUrRNA数据库对其进行物种注释分析。通过QIIME2软件计算样品的Alpha多样性指数,包括Ace指数、Chao1指数、Shannon指数及Simpson指数,Ace指数和Chao1指数用于衡量物种丰度,Shannon指数和Simpson指数用于衡量物种多样性。
2 结果与分析 2.1 织锦巴非蛤幼体不同发育阶段水体的环境因子采样时所监测的育苗水体主要环境因子如表 1所示。实验期间,pH值和溶解氧均保持在稳定状态,水温随着幼体发育略有下降,盐度在育苗中后期升高。
| 幼体阶段 Larval stage |
时间 Time |
水温/℃ Water tempera- ture/℃ |
溶解氧/ (mg/L) Dissolved oxygen/ (mg/L) |
pH值 pH value |
盐度 Salinity |
| HD | 2022-09-10 | 29.0 | 7.3 | 7.8 | 22.4 |
| HK | 2022-09-13 | 28.9 | 7.4 | 8.0 | 23.1 |
| HZ | 2022-09-19 | 28.5 | 7.4 | 7.8 | 25.0 |
| HA | 2022-09-23 | 28.1 | 7.6 | 8.0 | 25.4 |
| HZ | 2022-09-28 | 27.5 | 7.5 | 8.1 | 26.2 |
2.2 织锦巴非蛤幼体不同发育阶段水体的菌群多样性
织锦巴非蛤育苗水体的菌群多样性见表 2。各幼体发育阶段的OTU数量为380-963,其中HD的OTU数量、Ace指数、Chao1指数远高于其他阶段,是其他阶段的2倍甚至更多,表明其菌群丰度最高;其次依次是HA、HB和HK;而HZ的OTU数量仅有380个,且Ace指数和Chao1指数也最低,表明其菌群丰度最低。从HD到HZ,Shannon指数和Simpson指数呈现出U型分布规律,即随着幼体发育先降低后升高,表明HD育苗水体的菌群多样性最高,在HB时菌群多样性最低。
| 幼体阶段 Larval stage |
OTU数量 OTU number |
Ace指数 Ace index |
Chao1指数 Chao1 index |
Shannon指数 Shannon index |
Simpson指数 Simpson index |
| HD | 963 | 982.418 | 973.132 | 7.078 | 0.982 |
| HK | 413 | 420.874 | 417.375 | 6.119 | 0.973 |
| HB | 475 | 475.858 | 475.034 | 4.903 | 0.920 |
| HA | 481 | 487.377 | 483.478 | 6.214 | 0.974 |
| HZ | 380 | 380.000 | 380.000 | 6.212 | 0.975 |
2.3 织锦巴非蛤不同幼体期水体菌群的相关性分析 2.3.1 织锦巴非蛤不同幼体期水体菌群共有和特有OTUs分析
织锦巴非蛤幼体发育的5个阶段水体中共有和特有的OTUs数量见图 1。HD、HK、HB、HA和HZ特有的OTUs数量分别为679、178、238、250和196个,分别占各自OTUs总数的70.51%、43.10%、50.11%、51.98%和51.58%,HD特有的OTUs比例最高;所有阶段共有的OTUs仅为57个,其余OTUs分别在不同阶段共有。
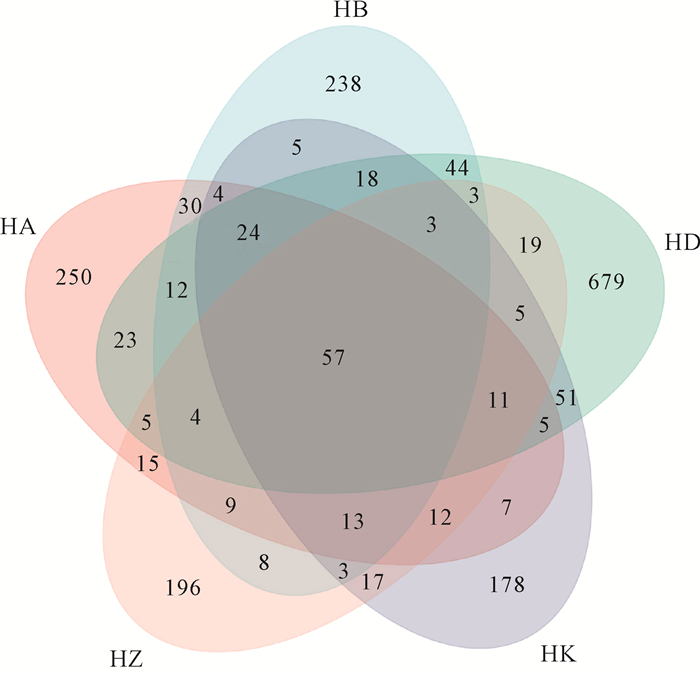
|
| The number in diagram indicates the OTUs in different samples, the number in the overlapping part of different colors represents the shared OTUs between samples, and the non-overlapping parts represent the unique OTUs of each sample. 图 1 织锦巴非蛤幼体不同发育阶段共有和特有OTUs数量的Venn图 Fig.1 Venn diagram of common and unique OTUs number at different development stages of P.amabilis larval |
2.3.2 织锦巴非蛤不同幼体期水体菌群聚类热图分析
选取科水平上丰度前50的菌群构建物种丰度的聚类热图(图 2),比较样品之间群落组成的相似性和差异性。结果显示,HA和HZ先聚为一支,然后依次与HK、HB和HD聚在一起,这说明HA和HZ的菌群组成最相近,而HD与其他4个阶段菌群结构差异较大。
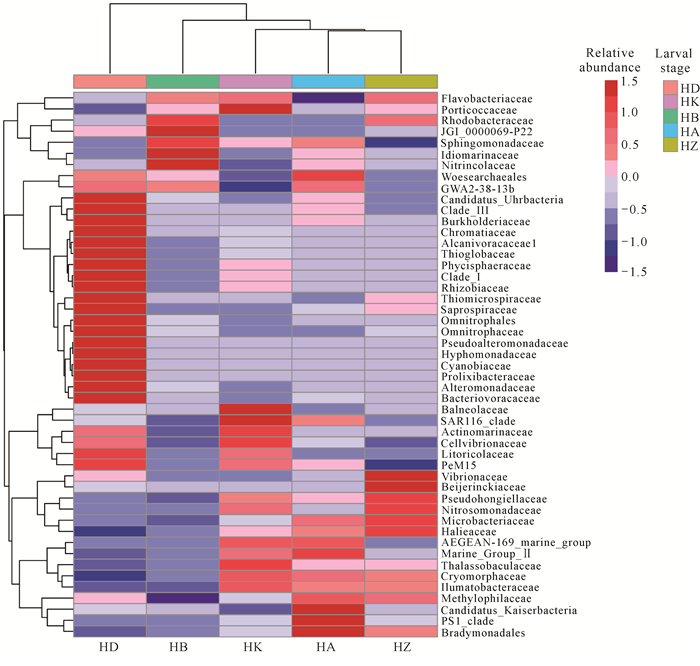
|
| 图 2 科水平上幼体各阶段的物种丰度聚类分析 Fig.2 Cluster analysis of species abundance at each larval stage at family level |
2.4 织锦巴非蛤幼体不同发育阶段水体菌群组成结构变化 2.4.1 门分类水平菌群组成
图 3展示了相对丰度>5.0%的优势门类,其中变形菌门(Proteobacteria)在各阶段均占绝对优势(48.78%-72.07%),其次为拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)。变形菌门主要由α-变形菌纲(Alphaproteobacteria)和γ-变形菌纲(Gammaproteobacteria)组成,α-变形菌纲在所有阶段均为最优或次优势菌,相对丰度为29.38%-34.67%,γ-变形菌纲在不同阶段占比则有较大差异,在HB占比最高(37.40%),在HK最低(19.40%)。拟杆菌门在各阶段均为次优势菌门(16.95%-30.17%),其中在HK和HZ的相对丰度较高,分别为30.17%和27.51%;其次为HB,为21.44%;HD和HA占比较低,分别为17.94%和16.95%。放线菌门在HK、HA、HZ的相对丰度相近,为14.95%-18.49%;在HD和HB占比较低,分别为7.27%和2.11%。综上,织锦巴非蛤幼体不同发育阶段主要优势门类较一致,但其相对丰度在不同阶段存在差异。
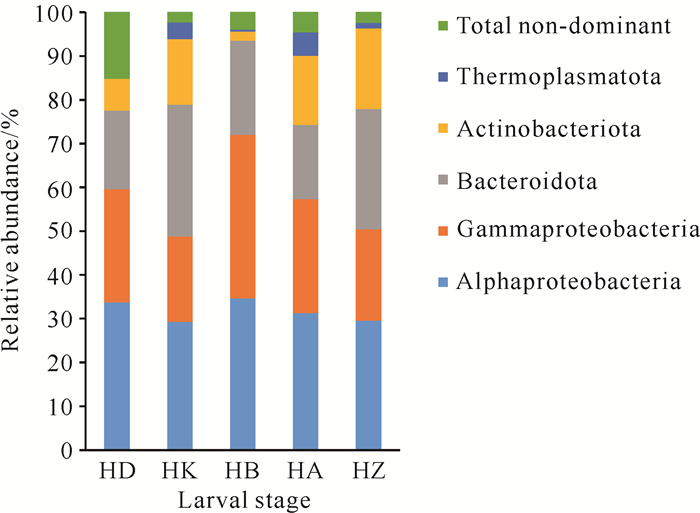
|
| 图 3 幼体不同发育阶段水体菌群优势菌门的相对丰度 Fig.3 Relative abundance of dominant phyla in water at different developmental stages of larvae |
2.4.2 科分类水平菌群组成
织锦巴非蛤幼体发育各阶段的优势菌群共有7个科(相对丰度≥5.0%),其中红杆菌科(Rhodobacteraceae)和黄杆菌科(Flavobacteriaceae)在幼体发育各阶段的相对丰度均较高(图 4)。红杆菌科是HD、HA和HZ的优势菌科,在HB最高,相对丰度为26.51%;其次为HZ,相对丰度为22.33%;在HD、HK和HA占比相近。黄杆菌科是HK的优势菌科,HK和HZ的相对丰度接近,分别为19.54%和19.88%;HA最低,相对丰度为8.32%。海源菌科(Idiomarinaceae)的相对丰度呈现先急剧升高后显著降低的趋势,在育苗初期HD和HK占比极低,均低于1%;但在HB迅速增长,相对丰度达到31.90%,是HB的优势菌科;而后在育苗后期又逐步衰减。微杆菌科(Microbacteriaceae)在育苗中期HB相对丰度不足1%;在育苗后期HA、HZ增长,分别为9.95%和12.82%。冷形菌科(Cryomorphaceae)在HD相对丰度不足1%,而在HK、HA和HZ的相对丰度较高,为5.98%-7.67%。
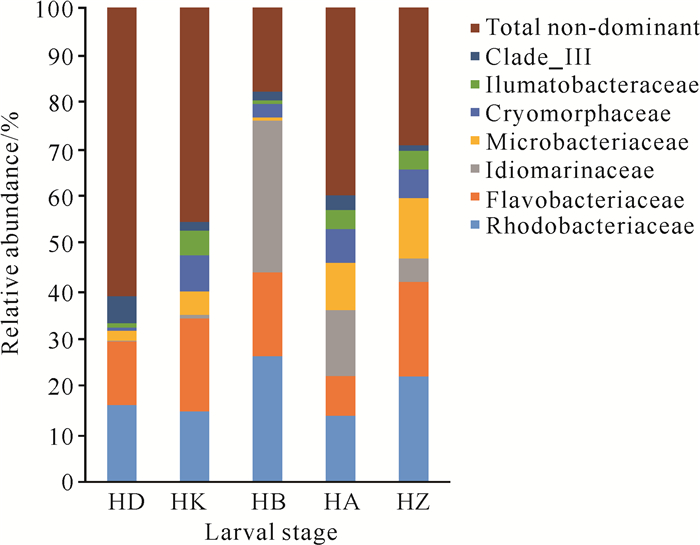
|
| 图 4 幼体不同发育阶段水体菌群优势菌科的相对丰度 Fig.4 Relative abundance of dominant families in water at different developmental stages of larvae |
3 讨论 3.1 织锦巴非蛤不同幼体期水体菌群多样性分析
本研究中Alpha多样性指数结果显示,HD菌群丰度和多样性均高于其他水体。HD处于幼体发育的前期,此时幼体代谢和排泄极少,水体菌群来源于砂滤后海水中的残留菌,从亲贝池收取D形幼虫和投喂湛江等边金藻时所引入的菌群。有研究认为,菌群多样性较高对于维持水体生态系统稳定性和维护幼体健康都起着积极的作用[7, 14]。本研究中HZ的菌群丰度最低,HB的菌群多样性最低,结合实际育苗生产过程中发现的HB和HZ幼体易大量死亡的现象,这可能与此时的菌群丰度和多样性较低有关。
3.2 织锦巴非蛤不同幼体期水体菌群的相关性分析本研究中HD特有的OTUs数量占70.51%,而其他4个阶段特有的OTUs数量占比为43.10%-51.98%,表明HD细菌群落的组成与其他4个阶段差异较大,这与科水平上物种丰度聚类热图的结果一致。然而,这与虾夷扇贝的研究结果不同,虾夷扇贝不同幼体发育阶段只有极少数OTUs为特有,大部分的OTUs为不同阶段共有[11, 15]。另外,热图结果还表明HA和HZ的菌群组成最相似,这与织锦巴非蛤幼体在这两个阶段的高死亡率现象吻合。Zheng等[16]研究认为饵料的差异可能是凡纳滨对虾幼体不同发育阶段水体细菌群落变化的原因。本研究中,HD和HK投喂湛江等边金藻;HK之后投喂湛江等边金藻和牟氏角毛藻,其比例由3∶1→1∶1→0∶1渐进式转变;HA和HZ混合投喂牟氏角毛藻和青岛大扁藻,饵料的转变也可能是造成织锦巴非蛤幼体不同发育阶段水体中细菌群落演替的原因之一。
3.3 织锦巴非蛤不同幼体期水体优势菌群的潜在功能本研究中幼体不同发育阶段水样中占优势的细菌门类主要有变形菌门(α-变形菌纲和γ-变形菌纲)、拟杆菌门和放线菌门,这与所报道的贝类孵化场的海水细菌群落基本一致[10, 17-20]。α-变形菌纲为大扇贝(Pecten maximus)、马氏珠母贝(Pinctada fucata martensii)和太平洋牡蛎(Crassostrea gigas)养殖水体中的第一优势纲[17-19]。γ-变形菌纲是虾夷扇贝和大扇贝苗种培育水体中的优势菌纲,也是紫扇贝(Argopecten purpuratus)幼体养殖水体中的主要优势菌纲[10, 19, 20]。本研究中,α-变形菌纲在织锦巴非蛤幼体发育的所有阶段均为最优或次优势菌,γ-变形菌纲在不同阶段则存在较大差异,在HB的占比约是HK的2倍。织锦巴非蛤幼体发育各阶段的第二优势菌门为拟杆菌门,拟杆菌门是海洋水体中重要的生物类群,能降解环境中的溶解性有机物[21],起到净化水质的作用。放线菌门是水产益生菌的重要来源[22],本研究中,放线菌门在HK、HA和HZ的相对丰度占比均较高,为14.95%-18.49%。
在科水平上,红杆菌科和黄杆菌科是整个育苗周期的主导类群,是除HB以外的其他阶段的最优或次优势菌科。红杆菌科细菌能通过产生胞外酶降解养殖环境中的磷酸[23],同时红杆菌科中的大多数细菌具有合成维生素B12的功能,是水产养殖动物的益生菌[24, 25]。有研究表明,黄杆菌科细菌能转化养殖环境中的氨、亚硝酸盐和硝酸盐,在维持养殖系统的稳定方面起着积极作用[26]。Xiong等[27]把黄杆菌科作为健康虾塘的指示科。但黄杆菌科中的某些菌群也是水产动物的潜在致病菌,如Sakatoku等[28]从患病马氏珠母贝体内分离出黄杆菌科致病菌。微杆菌科属于放线菌门[29],可高效利用低浓度有机碳。本研究中微杆菌科的相对丰度在育苗后期增长明显,在HZ达到最高值。冷形菌科隶属于拟杆菌门,是重要的次级代谢产物分解者,易在有机碳丰富的生境中富集,在海洋碳循环中起着重要的作用[30, 31]。冷形菌科在HD的相对丰度低于1%,在后续各阶段均有不同程度的增加。微杆菌科和冷形菌科在育苗后期相对丰度较高,其具体原因还有待深入研究。值得注意的是,海源菌科的相对丰度在织锦巴非蛤幼体不同发育阶段有较大差异,在HD和HK的相对丰度不足1%,但在HB的相对丰度迅速增加到31.90%,是HB的最优势菌科。本研究中,海源菌科完全由海源菌属(Idiomarina)构成(数据未在结果中显示),海源菌属所有种类都是从含盐环境中分离出来的,主要来自于海洋栖息地,它们能在极端条件下生长,如高盐、广温、高pH值和低氧条件[32]。本研究中,海源菌属在HB、HA和HZ的相对丰度明显高于前2个阶段,该现象与织锦巴非蛤幼体发育的关系有待进一步研究。
4 结论织锦巴非蛤幼体不同发育阶段水体菌群丰度和菌群多样性存在差异,其中D形幼虫期的菌群丰度和菌群多样性均最高。水体菌群组成随幼体发育和饵料更换存在明显演替,核心菌群如红杆菌科、微杆菌科和冷形菌科细菌的潜在功能在净化水质、维持水体生态平衡方面起着重要作用。后续还需通过16S rRNA全长测序和宏基因组技术,并结合环境因子和幼体状况,揭示织锦巴非蛤幼体健康状况的指示菌群,为织锦巴非蛤的育苗和病害防控提供依据。
| [1] |
纪燕如, 林志华, 伍荣聪, 等. 我国东南沿海5个织锦巴非蛤地理群体的形态差异分析[J]. 热带生物学报, 2011, 2(3): 219-225. |
| [2] |
邹杰, 彭慧婧, 杨家林. 织锦巴非蛤人工种苗培育及浅海养殖试验[J]. 科学养鱼, 2019(10): 57-58. |
| [3] |
陈瑞芳, 董兰芳, 许明珠. 广西特色海水养殖品种发展现状与展望[J]. 广西科学院学报, 2020, 36(3): 237-241. |
| [4] |
BLANCHETON J P, ATTRAMADAL K J K, MICH- AUD L, et al. Insight into bacterial population in aquaculture systems and its implication[J]. Aquacultural Engineering, 2013, 53: 30-39. DOI:10.1016/j.aquaeng.2012.11.009 |
| [5] |
XUE M, LIANG H F, HE Y Y, et al. Characterization and in-vivo evaluation of potential probiotics of the bacterial flora within the water column of a healthy shrimp larviculture system[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(3): 484-491. DOI:10.1007/s00343-016-5024-2 |
| [6] |
黄永春. 有效微生物菌群对养虾水体细菌生态和水质的影响[J]. 广东海洋大学学报, 2009, 29(1): 44-48. |
| [7] |
黄雪敏, 温崇庆, 梁华芳, 等. 健康和发病凡纳滨对虾糠虾期育苗池水体的菌群结构比较[J]. 广东海洋大学, 2018, 38(4): 27-34. |
| [8] |
熊向英, 王贤丰, 彭银辉, 等. 健康和患病卵形鲳鲹肠道菌群结构的差异[J]. 水产学报, 2019, 43(5): 1317-1325. |
| [9] |
马英, 关瑞章, 汪琳, 等. 九孔鲍(Haliotis diversicolor supertexta)育苗期养殖水体细菌的群落结构[J]. 福建农林大学学报(自然科学版), 2009, 38(5): 526-531. |
| [10] |
孙雪莹, 刘继晨, 李明, 等. 虾夷扇贝苗种培育水中可培养细菌群落分析[J]. 大连海洋大学学报, 2017, 32(3): 323-328. |
| [11] |
SUN X Y, LIU J C, LI M, et al. Characterization of bacterial communities associating with larval development of yesso scallop (Patinopecten yessoensisis Jay, 1857) by high-throughput sequencing[J]. Journal of Ocean University of China, 2016, 15(6): 1067-1072. DOI:10.1007/s11802-016-3092-8 |
| [12] |
邓正华, 翟子钦, 魏海军, 等. 织锦巴非蛤幼虫对不同种类单胞藻的摄食和消化效果[J]. 南方农业学报, 2022, 53(5): 1448-1456. |
| [13] |
吴加莹, 戴明姝, 刘志刚, 等. 温度对织锦巴非蛤稚贝生存和生长的影响[J]. 南方水产科学, 2023, 19(2): 62-69. |
| [14] |
WANG Y, WANG K, HUANG L, et al. Fine-scale succession patterns and assembly mechanisms of bacterial community of Litopenaeus vannamei larvae across the developmental cycle[J]. Microbiome, 2020, 8(1): 106. DOI:10.1186/s40168-020-00879-w |
| [15] |
MA Y, LIANG J, ZHAO X, et al. Bacterial communities in the water of larval-rearing system for the yesso scallop (Patinopecten yessoensis)[J]. International Journal of Oceanography & Aquaculture, 2017, 1(2): 000110. |
| [16] |
ZHENG Y F, YU M, LIU J W, et al. Bacterial community associated with healthy and diseased pacific white shrimp (Litopenaeus vannamei) larvae and rearing water across different growth stages[J]. Frontiers in Microbiology, 2017, 8: 1362-1373. DOI:10.3389/fmicb.2017.01362 |
| [17] |
陈琨, 黄湾, 廖永山, 等. 马氏珠母贝肠道及其养殖水体可培养细菌群落结构[J]. 广东海洋大学学报, 2021, 41(1): 47-54. |
| [18] |
POWELL S M, CHAPMAN C C, BERMUDES M, et al. Dynamics of seawater bacterial communities in a shellfish hatchery[J]. Microbial Ecology, 2013, 66(2): 245-256. DOI:10.1007/s00248-013-0183-6 |
| [19] |
SANDAA R A, MAGNESEN T, TORKILDSEN L, et al. Characterisation of the bacterial community associated with early stages of great scallop (Pecten maximus), using denaturing gradient gel electrophoresis (DGGE)[J]. Systematic and Applied Microbiology, 2003, 26(2): 302-311. DOI:10.1078/072320203322346164 |
| [20] |
GODOY F A, ESPINOZA M, WITTWER G, et al. Characterization of culturable bacteria in larval cultures of the Chilean scallop Argopecten purpuratus[J]. Ciencias Marinas, 2011, 37(3): 339-348. DOI:10.7773/cm.v37i3.1882 |
| [21] |
COTTRELL M T, KIRCHMAN D L. Natural assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low- and high-molecular-weight dissolved organic matter[J]. Applied and Environmental Microbiology, 2000, 66(4): 1692-1697. DOI:10.1128/AEM.66.4.1692-1697.2000 |
| [22] |
DAS S, WARD L R, BURKE C. Prospects of using marine actinobacteria as probiotics in aquaculture[J]. Applied Microbiology and Biotechnology, 2008, 81(3): 419-429. DOI:10.1007/s00253-008-1731-8 |
| [23] |
李广科, 赵由才, 桑楠. 球形红杆菌磷耐受能力和除磷特性的研究[J]. 农业环境保护, 2002, 21(5): 403-405. |
| [24] |
XIONG J B, DAI W F, ZHU J Y, et al. The underlying ecological processes of gut microbiota among cohabitating retarded, overgrown and normal shrimp[J]. Microbial Ecology, 2017, 73(4): 988-999. DOI:10.1007/s00248-016-0910-x |
| [25] |
杜世聪, 黄雷, 杨坤杰, 等. 凡纳滨对虾健康状态分化前后养殖水体浮游细菌群落的比较[J]. 生态学杂志, 2019, 38(8): 2456-2465. |
| [26] |
MICHAUD L, GIUDICE A L, TROUSSELLIER M, et al. Phylogenetic characterization of the heterotrophic bacterial communities inhabiting a marine recirculating aquaculture system[J]. Journal of Applied Microbiology, 2009, 107(6): 1935-1946. DOI:10.1111/j.1365-2672.2009.04378.x |
| [27] |
XIONG J B, ZHU J L, ZHANG D M. The application of bacterial indicator phylotypes to predict shrimp health status[J]. Applied Microbiology and Biotechnology, 2014, 98(19): 8291-8299. DOI:10.1007/s00253-014-5941-y |
| [28] |
SAKATOKU A, FUJIMURA T, ITO M, et al. Newly isolated bacterium Tenacibaculum sp.strain Pbs-1 from diseased pearl oysters is associated with black-spot shell disease[J]. Aquaculture, 2018, 493: 61-67. DOI:10.1016/j.aquaculture.2018.04.049 |
| [29] |
STACKEBRANDT E, BRAMBILLA E, RICHERT K. Gene sequence phylogenies of the family Microbacteriaceae[J]. Current Microbiology, 2007, 55(1): 42-46. DOI:10.1007/s00284-006-0569-5 |
| [30] |
BOWMAN J P. The family Cryomorphaceae[M]// ROSENBERG E, DELONG E F, LORY S, et al. Berlin, Heidelberg: Springer, 2014: 539-550.
|
| [31] |
WIESE J, SAHA M, WENZEL-STORJOHANN A, et al. Vicingus serpentipes gen.nov., sp.nov., a new member of the Flavobacteriales from the North Sea[J]. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(1): 333-340. DOI:10.1099/ijsem.0.002509 |
| [32] |
FLORES-FERNÁNDEZ C N, CHÁVEZ-HIDALGO E, SANTOS M, et al. Molecular characterization of protease producing Idiomarina species isolated from Peruvian saline environments[J]. Microbiology and Biotechnology Letters, 2019, 47(3): 401-411. |



