杓兰属(Cypripedium)隶属兰科(Orchidaceae)杓兰亚科(Cypripedioideae),为陆生草本植物,株型秀美,花形奇特,因其花唇瓣特化成为兜状、杓状和拖鞋状而得名,观赏价值极高,是观赏兰花中的“旗帜”类群[1]。杓兰属植物在全世界共有50余种,广泛分布于美洲、欧洲、亚洲的温带和亚热带地区。在我国已发现分布有38种杓兰属植物,大多生长在灌丛、林缘中或草坡上[2]。被严重破坏的原生境以及其他人为因素导致杓兰属植物的野生居群急剧减少,该属植物大量种类濒危灭绝[3]。暖地杓兰(Cypripedium subtropicum)是杓兰属中较为原始的种,分布于云南、西藏和广西,是杓兰属目前已知的唯一一种多年生常绿草本植物,数量稀少,具有较高的科学和文化价值,已被列入国家一级重点保护野生植物[4],对其开展保护生物学的研究具有重要的意义。
在植物的进化过程中,叶片比其他器官对环境变化的反应更加敏感,可塑性更强[5],对探讨植物对环境的适应性具有重要意义[6]。叶表皮结构特征及叶片解剖结构特征的类型能够反映植物对环境的适应性[7-9]。叶片解剖结构是叶片生理功能的基础,其结构变化反映了植物的生长和代谢情况[10, 11]。光合作用是植物生长发育和一切代谢活动的生理基础,对植物生长发育具有重要影响[12, 13]。濒危植物在光合生理方面的生存力、适应力均较弱,尤其是光合、呼吸能力,导致其在群落内的种间竞争中往往处于不利地位,竞争能力较弱[14, 15]。研究表明,高光强是导致杓兰属植物光合作用降低的主要原因之一[16],西藏杓兰(C.tibeticum)通过光合和形态变化来适应不同的亚高山环境,全光照或低光照都不利于其种群的生长[17];不同生境下扇脉杓兰(C.japonicum)的生长和生理特性取决于林分的光照条件[18];暖地杓兰的叶片较薄,光合速率和光饱和点均较低,具有阴生植物的特征[19]。这些研究结果为杓兰属植物的保护及引种培育提供了重要的参考依据。
暖地杓兰分布于喀斯特亚热带常绿阔叶林中,其野外居群数量急剧减少。目前,关于暖地杓兰的研究主要集中在传粉生态学[20]、种子繁殖与栽培研究[21, 22]、营养解剖与光合特性[19]、分子系统发育[23, 24]等方面,尚缺乏从不同生长期的光合生理角度对暖地杓兰对自然生长环境适应性的研究。为此,本研究以暖地杓兰为研究对象,通过对其幼苗、结实植株的叶片解剖结构和光合生理特性进行研究,探讨暖地杓兰幼苗和结实植株的叶片解剖结构、光合能力的差异性以及暖地杓兰的光合能力与其叶片解剖结构、叶绿素含量的关联性,拟为该濒危物种的保育和引种驯化提供科学依据。
1 材料与方法 1.1 研究区概况研究地点位于广西壮族自治区百色市那坡县喀斯特亚热带常绿阔叶林(23°16′N,105°54′E),海拔1 200 m,地势较陡。气候为南亚热带季风气候,年平均气温为19.1 ℃,年平均降水量为1 353.1 mm。最热月(7月)平均气温为24.8 ℃,最冷月(1月)平均气温为11.4 ℃。暖地杓兰野生种群的上层群落乔木树种主要有朴树(Celtis sinensis)、黄杞(Engelhardia roxburghiana)、桂南木莲(Manglietia conifera)等,林下荫蔽度约为90%,该群落植被均为自然生长状态,人为干扰较少。
1.2 材料研究材料来自广西百色市那坡县喀斯特亚热带常绿阔叶林中自然生长、长势良好的暖地杓兰植株,选择生长健康、无病虫害的暖地杓兰幼苗和结实植株各4株开展试验(图 1),并选取生长健康的成熟叶片进行光合参数测定。

|
| 图 1 暖地杓兰野外生境和植株 Fig.1 Wild habitat and plants of C.subtropicum |
1.3 方法 1.3.1 叶表皮特征
选取暖地杓兰幼苗和结实植株上在同一方位且生长良好的成熟功能叶片,剪取叶片叶缘至主脉的中央部分,面积约为0.5 cm×0.5 cm,取样后立即投入2.5%的戊二醛固定液中野外固定,带回实验室进行乙醇逐级脱水(脱水梯度依次为30%、50%、70%、90%、100%和100%),临界点干燥以及镀金。使用真空电子扫描电镜(EV018, ZEISS)观察叶片上表皮、下表皮、气孔并拍照记录,每个样品随机观察10个视野, 使用Axio Vision SE64Rel.4.9.1扫描电镜配套软件观测气孔纵轴和横轴、气孔面积和气孔密度等。气孔密度为视野气孔个数/视野面积(单位为个/mm2)。气孔面积S=a×b×π×1/4(a为气孔纵轴,b为气孔横轴,S为气孔面积,单位为μm2)。
1.3.2 叶片解剖结构参照李正理[25]的方法制作叶片石蜡切片,并适当进行优化。摘取暖地杓兰幼苗和结实植株的叶片后沿中脉横切,切块为10 mm×10 mm,用FAA固定液(FAA Fix Soution,70%乙醇∶福尔马林∶冰醋酸=90∶5∶5)固定,乙醇和二甲苯脱水,石蜡包埋,切片用甲苯胺蓝染色,中性树胶封片。采用数字切片扫描仪全景扫描,借助图形分析软件CaseViewer测量各微观参数。测定指标有叶片细胞厚度(LT)、上表皮细胞厚度(UET)、下表皮细胞厚度(LET)、叶肉厚度(MT)、叶主脉厚度(LVT)、相邻维管束距离(DVB)。每个样品随机观察10个视野,测定统计各指标参数。
1.3.3 光合-光响应曲线的测定在2022年9月晴天的9:00-11:00,采用Li-6400便携式光合测定系统分析仪(Li-Cor,Lincoln,Nebraska,USA)测定光响应曲线,各选定4株长势良好的幼苗和结实植株,每株选择1片叶片进行测定。测定前将待测叶片放在200 μmol·m-2·s-1光强下诱导30 min (仪器自带的红蓝光源)以充分活化光合系统。使用开放气路,空气流速为0.5 L·min-1,叶室温度为28 ℃,CO2浓度为400 μmol·mol-1(用CO2钢瓶控制浓度)。设置光强梯度由高到低依次为1 500、1 200、1 000、800、600、400、200、150、100、50、20、10和0 μmol·m-2·s-1,每个梯度设定平衡时间为3 min,记录净光合速率(Pn)。以Pn为纵轴、光量子通量密度(PPFD)为横轴绘制光合-光响应曲线。光合-光响应曲线采用叶子飘等[26]的直角双曲线模型拟合,推导出各项参数。
1.3.4 叶片光合色素含量测定从进行光合测定的植株上各采集1片成熟度和方位与1.3.3节所使用叶片一致的叶片进行光合色素含量的测定。用分析天平准确称取0.2 g的鲜叶,剪碎并浸没于盛有25 ml 95%乙醇的棕色容量瓶中,暗处理24 h,直至叶片绿色褪去,利用紫外分光光度计分别在665、649、470 nm波段测量吸光值,根据李合生等[27]的实验方法,计算出叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)的含量,以及计算Chl a/Chl b和Chl(a+b)/Car。
1.4 数据分析采用Microsoft Excel 2010及Origin 2015进行数据处理及作图,利用光合计算4.1.1软件中的直角双曲线修正模型[28]拟合并计算光响应曲线的光合参数,采用SPSS 25.0软件进行数据处理并进行t检验,P<0.01表示极显著差异,P<0.05表示显著差异,P>0.05表示无显著差异,并对叶片结构特征、叶绿素含量与光合参数进行相关性分析。所有试验数据均采用平均值±标准差(Mean±SD)的形式表示。
2 结果与分析 2.1 叶片表皮特征暖地杓兰叶片上、下表皮形状不规则呈波状,气孔和表皮毛仅分布在下表皮(图 2)。试验结果发现,结实植株气孔纵轴、横轴、面积极显著大于幼苗,气孔密度无显著差异(表 1)。

|
| 图 2 暖地杓兰幼苗和结实植株叶片表皮结构 Fig.2 Leaf epidermal structure of seedlings and fruiting plants of C.subtropicum |
| 生长时期 Growth period |
气孔纵轴/μm Vertical axis of stomata/μm |
气孔横轴/μm Stomatal transverse axis/μm |
气孔面积/μm2 Stomatal area/μm2 |
气孔密度/(个/mm2) Stomatal density/(ind./mm2) |
| Seedlings | 31.59±1.89b | 15.65±1.05b | 388.09±10.21b | 52.02±2.03a |
| Fruiting plants | 35.89±0.75a | 19.04±1.08a | 536.21±15.68a | 54.21±2.05a |
| Note: all the data in the table are mean±standard deviation; different lowercase letters in the same column indicate significant difference between treatments at the 0.05 level. | ||||
2.2 叶片解剖结构特征
暖地杓兰叶片结构由表皮、叶肉和叶脉3部分组成。叶片属于等面叶,上、下表皮均由单层细胞组成,上、下表皮细胞呈方形至椭圆形或圆形;叶肉由3层细胞组成,没有栅栏组织和海绵组织的分化,细胞呈圆形至椭圆形;叶主脉下表皮分布有表皮毛,中间厚壁组织发达,与维管束相连(图 3)。结实植株的叶片厚度、叶肉厚度、上表皮细胞厚度、下表皮细胞厚度、叶主脉厚度和相邻维管束距离均极显著大于幼苗(表 2)。
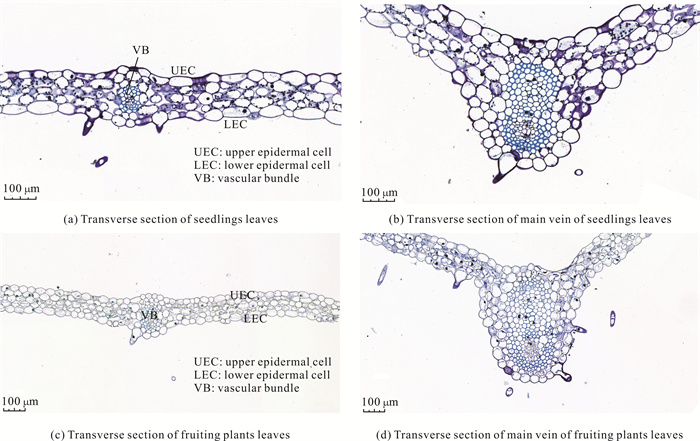
|
| 图 3 暖地杓兰幼苗和结实植株的叶片横切结构 Fig.3 Leaf cross-sectional structures of seedlings and fruiting plants of C.subtropicum |
| 生长时期 Growth period |
叶片细胞厚度 Leaf cell thickness |
上表皮细胞厚度 Upper epidermal thickness |
下表皮细胞厚度 Lower epidermalthickness |
叶肉厚度 Mesophyll thickness |
叶主脉厚度 Leaf main vein thickness |
相邻维管束距离 Distance between adjacent vascular bundles |
| Seedlings | 119.33±5.54b | 21.85±1.34b | 21.7±4.30b | 74.77±7.73b | 512.06±52.72b | 825.43±14.15b |
| Fruiting plants | 156.03±15.09a | 25.17±1.12a | 34.86±3.95a | 101.03±10.57a | 593.45±42.79a | 1 408.84±138.55a |
| Note: all the data in the table are mean±standard deviation; different lowercase letters in the same column indicate significant difference between treatments at the 0.05 level. | ||||||
2.3 暖地杓兰幼苗和结实植株叶片光合-光响应曲线
光合-光响应曲线反映了植物净光合速率随光强改变而变化的规律[29]。图 4中的净光合速率(Pn)随着光量子通量密度(PPFD)的升高呈先升高后降低的趋势,当PPFD为0-100 μmol·m-2·s-1时,Pn均呈上升趋势,而当PPFD大于400 μmol·m-2·s-1时,Pn呈下降趋势,发生光抑制。主要光合特性参数指标如表 3所示,暖地杓兰结实植株最大净光合速率(Pmax)、光饱和点(LSP)、表观量子效率(AQY)均极显著大于幼苗,而光补偿点(LCP)和暗呼吸速率(Rd)极显著小于幼苗。
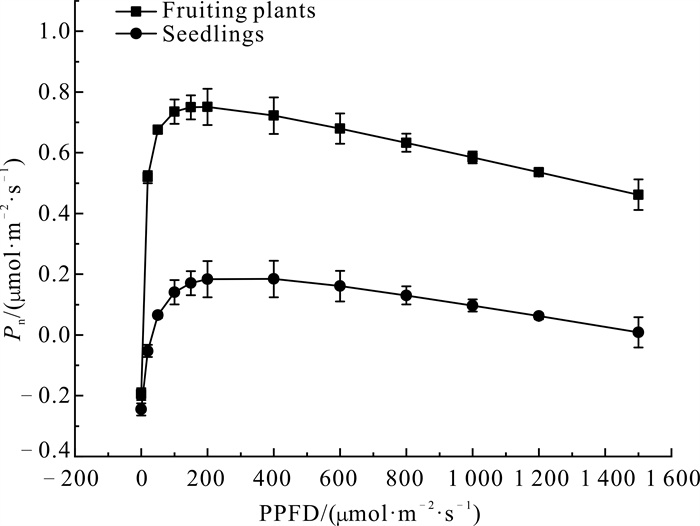
|
| 图 4 暖地杓兰幼苗和结实植株叶片的净光合速率对PPFD的响应 Fig.4 Response of net photosynthetic rate to PPFD in seedlings and fruiting plants′ leaves of C.subtropicum |
| 生长时期 Growth period |
最大净光合速率, Pmax/(μmol·m-2·s-1) Maximum net photosynthetic rate, Pmax/(μmol·m-2·s-1) |
光补偿点, LCP/(μmol·m-2·s-1) Light Compensation Point, LCP/(μmol·m-2·s-1) |
光饱和点, LSP/(μmol·m-2·s-1) Light Saturation Point, LSP/(μmol·m-2·s-1) |
表观量子效率, AQY/(mol·mol-1) Apparent Quantum Efficiency, AQY/(mol·mol-1) |
暗呼吸速率, Rd/(μmol·m-2·s-1) Dark respiration rate, Rd/(μmol·m-2·s-1) |
| Seedlings | 0.192±0.005b | 6.02±0.05a | 132.52±3.24b | 0.046±0.01b | 0.251±0.024a |
| Fruiting plants | 0.751±0.02a | 2.48±0.02b | 182.97±1.06a | 0.117±0.01a | 0.187±0.015b |
| Note: all the data in the table are mean±standard deviation; different lowercase letters in the same column indicate significant difference between treatments at the 0.05 level. | |||||
2.4 暖地杓兰幼苗和结实植株叶片光合色素含量
暖地杓兰结实植株叶片的Chl a、Chl b、Chl(a+b)、Car和Chl(a+b)/Car均极显著大于幼苗,而Chl a/Chl b在结实植株与幼苗之间无显著差异(表 4)。
| 生长时期 Growth period |
叶绿素a/(mg·g-1) Chl a/(mg·g-1) |
叶绿素b/(mg·g-1) Chl b/(mg·g-1) |
叶绿素(a+b)/(mg·g-1) Chl(a+b)/(mg·g-1) |
叶绿素a/叶绿素b Chl a/Chl b |
类胡萝卜素/(mg·g-1) Car/(mg·g-1) |
叶绿素(a+b)/类胡萝卜素 Chl(a+b)/Car |
| Seedlings | 0.611±0.02b | 0.304±0.03b | 0.915±0.05b | 2.010±0.06a | 0.299±0.01b | 3.060±0.12b |
| Fruiting plants | 0.838±0.05a | 0.434±0.02a | 1.272±0.04a | 1.929±0.08a | 0.381±0.02a | 3.342±0.15a |
| Note: all the data in the table are mean±standard deviation; different lowercase letters in the same column indicate significant difference between treatments at the 0.05 level. | ||||||
2.5 暖地杓兰光合特性与叶绿素含量、叶片结构的相关性分析
植物在生长发育的过程中,由于需要不断地适应环境,因此光合参数与其叶片结构、叶绿素含量之间具有相关性。暖地杓兰叶片Pmax、LSP、AQY、Rd与Chl(a+b)、叶主脉厚度(LVT)呈极显著相关(表 5)。
| 最大净光合速率,Pmax Maximum net photosynthetic rate, Pmax |
光补偿点, LCP Light Compensation Point, LCP |
光饱和点, LSP Light Saturation Point, LSP |
表观量子效率, AQY Apparent Quantum Efficiency, AQY |
暗呼吸速率, Rd Dark breathing rate, Rd |
叶绿素(a+b) Chl(a+b) |
叶片细胞厚度, LT Leaf cell thickness, LT |
叶主脉厚度, LVT Leaf main vein thickness, LVT |
|
| Pmax | 1 | |||||||
| LCP | -0.794 | 1 | ||||||
| LSP | 0.986** | -0.696 | 1 | |||||
| AQY | 0.978** | -0.737 | 0.972** | 1 | ||||
| Rd | -0.940** | 0.615 | -0.965** | -0.981** | 1 | |||
| Chl(a+b) | 0.982** | -0.774 | 0.964** | 0.992** | -0.959** | 1 | ||
| LT | 0.736 | -0.708 | 0.705 | 0.795 | -0.764 | 0.741 | 1 | |
| LVT | 0.927** | -0.660 | 0.953** | 0.927** | -0.936** | 0.886* | 0.827* | 1 |
| Note: * means significant association (P<0.05), ** means very significant association (P<0.01). | ||||||||
3 讨论 3.1 叶的结构特征及其对环境的适应性
叶的形态结构是对环境适应性最直观的体现[30]。本研究发现,暖地杓兰的叶片表皮细胞形状不规则呈波状,气孔和表皮毛仅分布于叶下表皮,这不仅有利于其保持足够的水分和减少蒸腾作用[31, 32],而且有利于抵抗外界的生物入侵以及各种胁迫因素[33, 34];暖地杓兰的叶肉无栅栏组织和海绵组织的分化,这一结果与Guan等[30]对杓兰属、Zhang等[19]对暖地杓兰的研究结果一致。本研究发现,暖地杓兰结实植株的气孔面积、叶片厚度极显著大于幼苗,一方面可能与其结实植株具有较大的根块茎能够为其叶片提供足够的营养养分供其生长有关[35],另一方面可能与暖地杓兰的某些共生真菌有关[36, 37],相关机制有待进一步深入探讨。叶脉结构是植物适应特定生态环境的重要因子之一,叶片主脉发达则具有较强的支持力和较完善的输导功能,有利于适应干旱的环境[38, 39]。暖地杓兰为多年生常绿草本植物,生长在海拔800-1 500 m的喀斯特亚热带常绿阔叶林林缘中。幼苗较耐阴,处于透光率较低和土层较厚的林下,结实植株在林缘、林中间隙处,需要一定的透光率[19]。结实植株叶主脉厚度极显著大于幼苗,说明结实植株具有较强的耐旱性,这可能是结实植株对干旱环境胁迫的一种安全性策略,而幼苗的耐旱性较弱,有可能面临死亡的风险。
3.2 光合特性本研究发现,暖地杓兰的Pmax、LSP和LCP均较低,为典型的阴生植物,这一结果与Zhang等[19]对暖地杓兰不同叶龄的研究结果相似。与杓兰属濒危植物相比,暖地杓兰的Pmax大大低于扇脉杓兰(Pmax=6.07 μmol·m-2·s-1)[40]、西藏杓兰(Pmax=7.15 μmol·m-2·s-1)[17]、黄花杓兰(C.flavum)(Pmax=7.39 μmol·m-2·s-1)[41]。这一方面可能是暖地杓兰叶片叶肉厚度较薄[42],另一方面可能是不同物种间光合氮分配模式不同[19],其相关机制有待进一步研究。
本研究发现,暖地杓兰的结实植株Pmax、LSP和AQY极显著高于幼苗,而LCP和Rd则极显著低于幼苗,说明结实植株具有较强的光合能力和适应环境的能力。这可能是由于结实植株拥有较大的根块茎,可利用地下的根块茎储备营养,从而有利于叶片进行光合作用,这一结果与朱红梅等[43]对吊兰(Chlorophytum comosum)的研究结果相似。野外调查发现,暖地杓兰生境的土壤肥沃且土层深厚,有利于其地下部分储存水分,从而有利于该物种生长,这一发现与Guan等[30]对杓兰属的研究结果相似。
3.3 光合色素含量本研究发现,暖地杓兰叶绿素总量与其Pmax呈极显著正相关,表明叶绿素对其光合能力具有显著影响。结实植株光合色素含量和光合能力均高于幼苗,表明结实植株光合能力更强,这可能是由于结实植株叶片较厚,含有较多的叶绿素,增强了光能的吸收和转化能力。
4 结束语暖地杓兰结实植株的光合能力强于幼苗,幼苗在引种驯化过程中需要较高程度的遮阴。暖地杓兰为典型的阴生植物,其适应光环境的能力以及对光能的利用能力均比较低下,在群落竞争中处于劣势,在当今生态环境破坏极为严重、适宜生境越来越少的条件下,这可能是其野外居群急剧减少、濒危的重要原因之一。
本研究仅比较了暖地杓兰在2个生长时期的叶片结构和光合特性,后期可结合同一生境下的广布种草本植物一起开展研究,阐明其濒危机制。本研究仅选取一个生境的暖地杓兰作为研究对象,后期可开展不同生境下的光合生理试验,探讨其对环境的适应性。暖地杓兰为杓兰属唯一一种多年生常绿草本植物,后续仍需与其同属的一年生草本植物开展保护遗传学和保护基因组学等试验,阐明其多年生常绿的遗传基因。因此,后续应加强对暖地杓兰的相关科研工作,同时对该物种做好引种保育和迁地保护工作。
| [1] |
罗毅波, 贾建生, 王春玲. 中国兰科植物保育的现状和展望[J]. 生物多样性, 2003, 11(1): 70-77. |
| [2] |
薛凯, 李敏. 国家重点保护野生植物介绍: 杓兰[J]. 生命世界, 2022(8): 92-95. |
| [3] |
陈丽飞, 刘树英, 江鹏道, 等. 杓兰属植物研究进展[J]. 湖北农业科学, 2012, 51(9): 1733-1735. |
| [4] |
国家林业和草原局, 农业农村部. 国家重点保护野生植物名录[EB/OL]. (2021-09-07)[2023-09-20]. https://www.gov.cn/zhengce/zhengceku/2021-09/09/content_5636409.htm.
|
| [5] |
WANG Y, SHAO L, WANG J, et al. Comparison of mo- rphological and physiological characteristics in two phenotypes of a rare and endangered plant, Begonia fimbristipula Hance[J]. Photosynthetica, 2016, 54(3): 381-389. DOI:10.1007/s11099-016-0199-5 |
| [6] |
申仕康, 张新军, 吴富勤, 等. 极小种群野生植物大树杜鹃的解剖结构研究[J]. 植物科学学报, 2016, 34(1): 1-8. |
| [7] |
李文平, 邓洪平, 张巧霞, 等. 濒危植物缙云黄芩茎叶发育过程的解剖学研究[J]. 西北植物学报, 2017, 37(10): 1980-1987. |
| [8] |
李冬林, 王火, 江浩, 等. 遮光对香果树幼苗光合特性及叶片解剖结构的影响[J]. 生态学报, 2019, 39(24): 9089-9100. |
| [9] |
袁秀云, 许申平, 周一冉, 等. 遮荫对白及形态及叶片结构的影响[J]. 植物研究, 2021, 41(6): 974-981. |
| [10] |
蒋迎红, 刘雄盛, 蒋燚, 等. 濒危植物海南风吹楠营养器官解剖结构特征[J]. 广西植物, 2018, 38(7): 843-850. |
| [11] |
朱栗琼, 徐艳霞, 招礼军, 等. 喀斯特地区莎叶兰的解剖构造及其环境适应性[J]. 广西植物, 2016, 36(10): 1179-1185, 1164. |
| [12] |
徐清, 闭鸿雁, 崔光帅, 等. 珍稀濒危植物毛果木莲幼苗光合特性及对遮阴处理的响应[J]. 南京林业大学学报(自然科学版), 2019, 43(6): 46-52. |
| [13] |
沈立明, 戴中武, 钟惠, 等. 3种独蒜兰属植物的光合特性[J]. 热带作物学报, 2021, 42(5): 1355-1360. |
| [14] |
金则新, 李钧敏, 马金娥. 濒危植物夏蜡梅光合生理生态特性[J]. 浙江大学学报(理学版), 2011, 38(6): 682-688. |
| [15] |
王强, 金则新, 郭水良, 等. 濒危植物长叶榧的光合生理生态特性[J]. 生态学报, 2014, 34(22): 6460-6470. |
| [16] |
CHEN L F, LI S, LI Y, et al. Comparative study of Cy- pripedium plant photosynthetic characteristics from Changbai mountain[J]. Horticulturae, 2023, 9(3): 358. DOI:10.3390/horticulturae9030358 |
| [17] |
ZHENG B Q, ZOU L H, LI K, et al. Photosynthetic, morphological, and reproductive variations in Cypripedium tibeticum in relation to different light regimes in a subalpine forest[J]. PLoS One, 2017, 12(7): e0181274. DOI:10.1371/journal.pone.0181274 |
| [18] |
KIM D, SON S, JUNF J, et al. Photosynthetic charac- teristics and chlorophyll content of Cypripedium japonicum in its natural habitat[J]. Forest Science and Technology, 2022, 18(4): 160-171. DOI:10.1080/21580103.2022.2120544 |
| [19] |
ZHANG W, FENG J Q, KONG J J, et al. Vegetative anatomy and photosynthetic performance of the only known winter-green Cypripedium species: implications for divergent and convergent evolution of slipper orchids[J]. Botanical Journal of the Linnean Society, 2021, 197(4): 527-540. DOI:10.1093/botlinnean/boab033 |
| [20] |
JIANG H, KONG J J, CHEN H C, et al. Cypripedium subtropicum (Orchidaceae) employs aphid colony mimicry to attract hoverfly (Syrphidae) pollinators[J]. The New Phytologist, 2021, 227(2): 1213-1221. |
| [21] |
华梅, 蒋宏, 周彬, 等. 暖地杓兰种子繁育与栽培研究[J]. 西部林业科学, 2023, 52(4): 123-128. |
| [22] |
PERNER H, ZHOU R, PERNER W Q, et al. Cypripedium subtropicum embryo development and cytokinin requirements for asymbiotic germination[J]. Botanical Studies, 2022, 63(1): 28. DOI:10.1186/s40529-022-00359-4 |
| [23] |
LI J H, LIU Z J, SALAZAR G A, et al. Molecular phylogeny of Cypripedium (Orchidaceae: Cypripedioideae) inferred from multiple nuclear and chloroplast regions[J]. Molecular Phylogenetics and Evolution, 2011, 61(2): 308-320. DOI:10.1016/j.ympev.2011.06.006 |
| [24] |
GUO Y Y, YANG J X, LI H K, et al. Chloroplast genomes of two species of Cypripedium: expanded genome size and proliferation of AT-biased repeat sequences[J]. Frontiers in Plant Science, 2021, 12: 609729. DOI:10.3389/fpls.2021.609729 |
| [25] |
李正理. 植物制片技术[M]. 2版. 北京: 科学出版社, 1987: 170.
|
| [26] |
叶子飘, 李进省. 光合作用对光响应的直角双曲线修正模型和非直角双曲线模型的对比研究[J]. 井冈山大学学报(自然科学版), 2010, 31(3): 38-44. |
| [27] |
李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
|
| [28] |
叶子飘, 于强. 光合作用对胞间和大气CO2响应曲线的比较[J]. 生态学杂志, 2009, 28(11): 2233-2238. |
| [29] |
蒋高明, 何维明. 一种在野外自然光照条件下快速测定光合作用-光响应曲线的新方法[J]. 植物学通报, 1999, 34(6): 712-718. |
| [30] |
GUAN Z J, ZHANG S B, GUAN K Y, et al. Leaf anatomical structures of Paphiopedilum and Cypripedium and their adaptive significance[J]. Journal of Plant Research, 2011, 124(2): 289-298. DOI:10.1007/s10265-010-0372-z |
| [31] |
陈健辉, 缪绅裕, 黄惠芳, 等. 五种红树植物叶片结构的比较研究[J]. 广西植物, 2018, 38(5): 655-664. |
| [32] |
LIU H, LIU S B, JIAO J, et al. Trichomes as a natural biophysical barrier for plants and their bioinspired applications[J]. Soft Matter, 2017, 13(30): 5096-5106. DOI:10.1039/C7SM00622E |
| [33] |
HERNANDEZ J O, PARK B B. The leaf trichome, venation, and mesophyll structural traits play important roles in the physiological responses of oak seedlings to water-deficit stress[J]. International Journal of Molecular Sciences, 2022, 23(15): 8640. DOI:10.3390/ijms23158640 |
| [34] |
HUA B, CHANG J, WU M L, et al. Mediation of JA signalling in glandular trichomes by hewoolly/SlMYC1 regulatory module improves pest resistance in tomato[J]. Plant Biotechnology Journal, 2021, 19(2): 375-393. DOI:10.1111/pbi.13473 |
| [35] |
纠凤凤, 卜贤盼, 陈才志, 等. 五唇兰不同器官的光合特性研究[J]. 北方园艺, 2020(2): 80-86. |
| [36] |
PREISS K, ADAM I K U, GEBAUER G. Irradiance governs exploitation of fungi: fine-tuning of carbon gain by two partially myco-heterotrophic orchids[J]. Proceedings Biological Sciences, 2010, 277(1686): 1333-1336. |
| [37] |
张艳艳, 方中明, 黄玮婷, 等. 3种兜兰在华南地区引种时的叶片形态及光合特性变化研究[J]. 广东农业科学, 2014, 41(5): 92-95, 9. |
| [38] |
陈模舜, 柯世省, 杨勇宇, 等. 珍稀濒危植物天台鹅耳枥营养器官的解剖学研究[J]. 浙江林业科技, 2010, 30(5): 14-19. |
| [39] |
龚容, 高琼. 叶片结构的水力学特性对植物生理功能影响的研究进展[J]. 植物生态学报, 2015, 39(3): 300-308. |
| [40] |
汪小飞, 靳文文. 扇脉杓兰耐阴性的测定与分析[J]. 南京林业大学学报(自然科学版), 2014, 38(S1): 57-61. |
| [41] |
孔德良, 严宁, 胡虹. 开花对两种杓兰光合作用和同化产物分配的影响[J]. 云南植物研究, 2006, 28(6): 639-644. |
| [42] |
OGUCHI R, HIKOSAKA K, HIROSE T. Does the ph- otosynthetic light-acclimation need change in leaf anatomy?[J]. Plant, Cell & Environment, 2003, 26(4): 505-512. |
| [43] |
朱红梅, 山颖, 张彤. 吊兰的子株和母株之间光合特性的比较[J]. 湖北农业科学, 2010, 49(5): 1123-1125. |



