2. 广西壮族自治区产品质量检验研究院, 广西南宁 530200
2. Guangxi Zhuang Autonomous Region Testing Institute of Product Quality, Nanning, Guangxi, 530200, China
火龙果属于仙人掌科(Cactaceae),是一种可食用的植物。与其他仙人掌科植物相似,火龙果具有极强的耐旱性,主要分布在亚热带和热带地区[1],它最初起源于巴西、墨西哥、古巴、尼加拉瓜、哥伦比亚等美洲国家,后传入越南、泰国等东南亚国家[2],目前在我国广西、广东、海南、云南、贵州等地广泛种植[3]。根据果皮和果肉的颜色,火龙果分为红皮白肉、红皮红肉和黄皮白肉3个品种[4]。火龙果果实口感甜美,营养丰富,不仅可以作为新鲜水果食用,而且还可以加工成果汁、果冻、果酱、果酒和饮料[5]。火龙果果肉中含有葡萄糖、果糖、果胶等碳水化合物,而果皮则是果胶和膳食纤维的重要来源。此外,其果肉中还含有油酸、亚麻酸、棕榈酸等多种不饱和脂肪酸,以及矿物质、维生素、蛋白质和氨基酸等多种营养物质[6]。
火龙果富含甜菜红素、酚类化合物、多糖和萜类化合物等生物活性物质,且不含胆固醇、饱和脂肪酸和反式脂肪酸,常食用火龙果有助于调节血压、控制胆固醇以及维持血糖平衡[6]。Jiang等[7]研究表明,火龙果在预防肥胖、2型糖尿病、心血管疾病、癌症和其他代谢综合征方面具有积极作用。此外,火龙果还可以作为天然抗氧化剂和抑菌剂,在预防医学和食品工业中具有巨大潜力[8]。因此,本文综述了近年来关于火龙果在营养成分、生物活性物质及其功能特性等方面的研究进展,并指出了未来开发利用火龙果的研究方向,以推动火龙果的开发和广泛应用。
1 营养价值 1.1 脂肪酸火龙果的果籽和果仁中含有丰富的脂肪酸,其中以不饱和脂肪酸为主[9]。根据Liu等[10]的研究,火龙果籽油中有152种脂质成分,这些脂质成分主要由136种甘油三酯和16种磷脂组成,包括亚油酸(42.78%)、油酸(27.29%)和棕榈酸(16.66%),其中不饱和脂肪酸占脂肪酸总量的75%。另外有研究发现,火龙果籽油中必需脂肪酸(亚油酸和亚麻酸)的比例超过50%,而这些必需脂肪酸是人体新陈代谢所必需的重要物质,无法在体内合成[11]。鉴于其脂肪酸的组成,黄皮火龙果籽被认为是可以改善人类健康的食品[12],这表明火龙果籽中的油脂具有丰富的营养价值;而且,亚麻酸、亚油酸和花生四烯酸等多不饱和脂肪酸具有多种生理功能,如抑制炎症、调节血压和血脂、预防心脑血管疾病、免疫调节以及促进生长发育等[13],因此火龙果具备良好的应用开发前景[11]。
火龙果籽油的成分、含量受到品种和提取工艺的影响。例如,江鑫等[14]通过不同的提取方法提取火龙果籽油,并测试了油脂中的脂肪酸组成和含量,结果发现相比于其他方法,采用索氏抽提法的油脂得率较高,但该方法会破坏以亚油酸为主的不饱和脂肪酸,导致其含量下降。Ünver[15]分析了产自土耳其的两种火龙果[红皮红肉火龙果(Hylocereus polyrhizus)和红皮白肉火龙果(H.undatus)],结果显示红皮白肉火龙果籽油中的亚油酸含量比红皮红肉火龙果籽油高4.1%。
虽然火龙果籽中富含多种脂肪酸,并且不饱和脂肪酸含量较高,具有作为功能性油脂开发来源的潜力,但是其油脂主要贮存在火龙果籽中,而火龙果籽的分离和回收相对困难,因此相比于已广泛应用的油菜籽等油料作物,火龙果籽油的研究报道相对较少,仍需要进一步深入研究。
1.2 蛋白质和氨基酸蛋白质是人体的重要组成部分,也是人体所必需的营养素,承担着重要的生理功能[16]。火龙果果肉中的蛋白质平均含量为11.2%,红肉火龙果更是达到13%[17]。高曼等[9]研究表明,与其他热带和亚热带水果相比,火龙果中的蛋白质含量更高,约为芒果的2倍、荔枝的1.5倍以及菠萝的3倍。Ünver[15]研究发现,火龙果籽中的蛋白质含量约占20%,是较好的蛋白质来源。顾鑫慧等[18]从火龙果种子中提取纯净的清蛋白(HPA),而且发现其具有较高的胰蛋白酶抑制活性,可能成为一种新型的胰蛋白酶抑制剂。
此外,火龙果还含有多种氨基酸,其中包括8种人体必需氨基酸(亮氨酸、异亮氨酸、苯丙氨酸、苏氨酸、赖氨酸、色氨酸、甲硫氨酸和缬氨酸)[16]。这些人体必需氨基酸约占火龙果总氨基酸含量的35%,接近人体蛋白质的理想含量要求[19]。谷氨酸是火龙果果肉中含量最高的氨基酸,约为217.79 mg/100 g;赖氨酸和精氨酸的含量也相对较高,分别为88.83 mg/100 g和130.62 mg/100 g[19]。另外,江鑫等[14]研究发现,火龙果籽中的氨基酸含量更加丰富,红心火龙果籽中谷氨酸含量最高(3 963.29 mg/100 g),其次依次为精氨酸(2 420.31 mg/100 g)、天冬氨酸(1 428.29 mg/100 g)和亮氨酸(1 136.70 mg/100 g)。
1.3 矿物质和维生素矿物质元素是构成人体组织的重要成分,对于各种生理和生化过程起着至关重要的作用[17]。火龙果富含丰富的矿物质,包括磷、钾、钙、镁、锌、铁和硒等元素,其中钾、磷、钙、镁的含量比山竹、芒果、菠萝等其他热带水果更高[15, 20]。方志峰等[21]研究发现,红心火龙果中常量元素磷含量为19.71 mg/100 g,营养参考值(NRV%)为2.8;钾含量为181.33 mg/100 g,NRV%为9.1;镁含量为12.69 mg/100 g,NRV%为4.2;微量元素锌平均含量为0.11 mg/100 g,NRV%为1.1,锰的平均含量为0.13 mg/100 g,NRV%为5.1;与金橘、脐橙、蜜橘、柿子、葡萄和柚子等常见水果相比,火龙果中磷、钾、镁、锌、锰的含量更为丰富。此外,火龙果果肉中还含有丰富的维生素,如维生素B1、维生素B2、维生素B3、维生素C、烟酸、吡哆醇和钴胺素等[6, 22]。因此,经常食用火龙果有利于补充膳食中的矿物质和维生素。
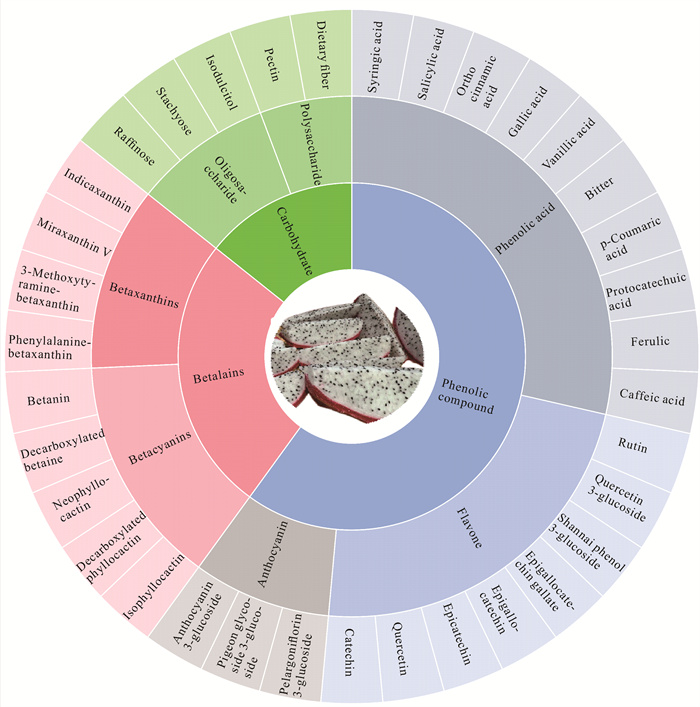
2 功能价值 2.1 功能物质火龙果中富含大量的生物活性物质,主要为多糖、低聚糖、酚酸、黄酮、甜菜红素、甜菜黄素等(图 1),在保健品以及药物开发等方面具有巨大的应用前景[4, 7, 23-25]。
|
| 图 1 火龙果中主要功能物质 Fig.1 Main functional substances in dragon fruit |
2.1.1 多糖
火龙果中含有丰富的糖类物质,包括葡萄糖、果糖、蔗糖、低聚糖以及膳食纤维和果胶等多糖成分。唐雅园等[26]采用水提醇沉法对火龙果茎多糖进行提取,发现火龙果茎多糖含量为346.88 mg/g,主要包括甘露糖(2.33 mg/g)、鼠李糖(20.91 mg/g)、半乳糖醛酸(25.43 mg/g)、葡萄糖(5.50 mg/g)、木糖(2.86 mg/g)、半乳糖(70.89 mg/g)和阿拉伯糖(15.28 mg/g),其中半乳糖含量最高。王超雪[27]应用超高压提取技术提取火龙果茎多糖,结果表明半乳糖是其主要单糖,与前述唐雅园等[26]的研究结果一致,但二者单糖比例与类型都有所差异,这可能与火龙果茎来源、提取工艺、测定方法等有关。此外,吴冬凡等[28]运用乙醇提取法对火龙果果皮中的多糖进行提取,发现火龙果果皮中多糖含量为114.05 mg/g。慕雪等[29]研究发现,火龙果的果茎和果皮中存在的一些植物多糖具有抗衰老、抗凝血、降血糖、免疫调节、抑制肿瘤和抗氧化等多种生物活性功能。这些发现揭示了火龙果作为药用植物的巨大潜力,但目前的研究主要集中在提取工艺优化和体外抗氧化活性测定方面,对于其分子量、结构以及热稳定性等方面仍需要进一步研究。
膳食纤维是指可食性木质素、多糖和植物细胞等无法被人体内源性酶消化的物质,包括可溶性膳食纤维和不可溶性膳食纤维。膳食纤维对人体健康非常重要,适当补充膳食纤维可以预防便秘和肠癌,不仅可以降低患胆固醇、高血脂以及心血管疾病的风险,而且还可以改善肠道菌群[30]。Biswas等[31]研究表明,火龙果皮是良好的膳食纤维(59.8%)来源。Vilcapoma等[32]采用超声波辅助提取黄火龙果果皮,结果表明不溶性膳食纤维的含量达到61.3%,可溶性膳食纤维的含量达到10.8%,且酯化度较低(39.7%)。
果胶是一种结构复杂的多糖,因其不同的主链结构和侧链组成而具有不同的保健功效和功能特性。根据酯化度(DE)不同,果胶被分为两大类:DE>50%的果胶被称为高甲氧基果胶,DE<50%的果胶为低甲氧基果胶[33]。Liaotrakoon等[34]发现白肉火龙果和红肉火龙果的果肉和果皮的细胞壁多糖中含有大量低甲基酯化的果胶物质,其中水溶性果胶物质占38%-47%。Chen等[33]采用热酸法从火龙果果皮中提取得到的超低甲氧基果胶含有果胶中天然存在的特征官能团,并在低浓度下表现出良好的乳化效果。但Muhammad等[35]用1%柠檬酸从火龙果皮不同部位提取果胶,结果显示从新鲜的果皮内层获得最高的果胶产率(26.38%),而且与其他部位的果胶相比,该部位的果胶表现出最高的酯化度(63.74%),属于高甲氧基果胶。
2.1.2 酚类化合物天然酚类化合物是从植物中获得的,包括酚酸、黄酮、花青素和二苯乙烯等物质(其中部分酚类化合物的结构式如图 2所示)。这些化合物具有较好的抑菌、抗氧化和抗炎等生理活性,能够降低患心血管疾病和癌症等慢性疾病的风险[4]。
Suleria等[37]使用液相色谱-电喷雾电离-四极杆飞行时间质谱(LC-ESI-QTOF-MS/MS)分析来自澳大利亚种植的红肉火龙果果皮中的酚类物质,测得果皮中的总多酚、类黄酮和总单宁含量分别为0.45、0.03和0.03 mg/g干重;其中主要的酚类物质为绿原酸、咖啡酸、丁香酸、香豆酸和阿魏酸,其含量分别为4.1、3.5、3.1、2.8和2.7 mg/g干重,主要的黄酮类化合物为儿茶素、槲皮素-3-O-半乳糖苷、山奈酚-3-O-葡萄糖苷和槲皮素-3-O-葡萄糖醛酸苷,其含量分别为7.5、4.5、2.4 mg/g干重;此外,还存在其他酚类化合物,如花青素(飞燕草素-3-O-葡萄糖苷和矢车菊素-3,5-O-二葡萄糖苷)、黄烷醇(原花青素二聚体B1和原花青素三聚体C1)、黄酮(茜草素和芹菜素-7-O-葡萄糖醛酸苷)等。火龙果中酚类化合物的含量和生物活性与火龙果的品种、部位以及提取工艺密切相关。Chen等[38]从火龙果中鉴定出了80种酚类化合物,包括酚酸(25种)、黄酮类(38种)、木脂素(6种)、二苯乙烯(3种)和其他多酚类化合物(8种),而且火龙果果肉的总多酚含量和抗氧化能力比果皮中的高,但果皮中的黄酮和单宁含量却高于果肉。孙卉等[39]研究显示,在测试的6种火龙果中越南1号的总多酚(181.7 μg/mL)和原花青素(124.7 μg/mL)含量最高,抗氧化性也是最强的,而黔白1号中总黄酮(222.1 μg/mL)含量最高,同时白肉火龙果果皮中多酚类化合物的含量及抗氧化能力均高于红肉火龙果果皮。这与Attar等[6]的研究结果相反,即测试的2种产自土耳其的火龙果果肉中的主要酚类化合物均为槲皮素,但是红肉火龙果果肉的总酚含量和抗氧化能力显著高于白肉火龙果果肉。
2.1.3 甜菜素甜菜素,又称为β-花青苷,是一种属于吡啶衍生物的天然色素,具有强大的自由基清除能力和抗氧化活性。这种天然色素具有多种生物活性,包括抗氧化、抗肥胖、抗癌、抗菌、预防氧化性肝损伤和缓解冠状动脉疾病等。此外,甜菜素作为一种良好的天然色素,常用于冰淇淋、酸奶和饼干等食品加工中[7]。
火龙果是目前唯一大规模商业种植的、富含甜菜素的水果,火龙果中的甜菜素主要是从红肉火龙果和火龙果果皮中获得[40]。宋海昭[41]研究发现,红皮白肉火龙果果皮提取物中含有14种甜菜素成分,红肉火龙果果肉提取物中含有12种甜菜素成分。Fathordoobady等[42]采用不同溶剂种类、溶剂配比以及提取工艺(超临界流体萃取和常规溶剂萃取)提取火龙果果皮和果肉中的甜菜红素,结果发现采用超临界流体萃取,在25 MPa压力和10%乙醇/水混合物作为共溶剂下,得到的火龙果果皮和果肉中的总甜菜素含量分别为24.58、91.27 mg/100 mL,主要成分包括甜菜苷、异甜菜苷、叶红素、丁酰甜菜苷、异叶素和异丁酰甜菜苷。与花青素相比,甜菜素具有更强的抗氧化活性,在食品工业中具有更大的应用潜力[7]。然而,从火龙果中提取的甜菜素的稳定性可能会受光照、氧气、金属离子、pH值和高温等外部因素的影响,在提取过程中甜菜素可能发生异构化、糖酵解和水解等反应,导致其快速降解[43]。Vellano等[44]发现,在低温和避光条件下贮藏,甜菜素的降解速度较缓慢,颜色损失也较小。此外,Lin等[45]采用脂质体包封技术来改善甜菜素的稳定性,结果显示甜菜素的包封率在93%以上,而且通过脂质体包封,甜菜素在不同储存温度下的储存稳定性显著提高,当环境pH值为4.3-7.0时,约80%的甜菜素在第21天仍然保持较高的稳定性。
近年来,学者们对火龙果中甜菜素的生物合成途径进行了研究。程美女[46]研究发现,HpWRKY3、HpWRKY18和HpWRKY44基因参与火龙果甜菜素的合成。化青珠[47]进一步研究发现,HpCYP76ADl、HpDODAal和HpCDOPA5GT等3个基因是参与火龙果甜菜素生物合成的关键基因。谢芳芳[48]通过沉默红皮红肉火龙果鳞片中的HmB5GT-like1和HmUDP-GT-like6基因,发现甜菜红素、甜菜黄素含量及其相关基因的表达量均显著减少,说明HmB5GT-like1和HmUDP-GT-like6基因参与了火龙果甜菜素的生物合成。Xie等[40]采用RNA-Seq技术研究筛选发现了类似的研究结果,即HmB5GT1和HmHCGT2基因可能参与了甜菜色素的生物合成。Zhang等[49]研究发现在火龙果着色期间,甜菜色素含量和HmoWRKY40的表达量迅速增加,并在人工授粉后的第23天达到最大值,而HmoWRKY40基因的沉默会导致甜菜素含量的显著降低,这表明HmoWRKY40基因可能与火龙果甜菜色素的生物合成有关。Chen等[50]以红皮红肉火龙果为材料进行转录组测序,筛选出43个参与火龙果甜菜素生物合成的结构基因,其中MYB、bHLH、AP2-EREBP和HB基因家族数量占比最多。Ibrahim等[51]的研究表明,L-酪氨酸在酪氨酸酶(或多酚氧化酶)作用下转化为左旋多巴胺(L-DOPA),该反应是甜菜素生物合成的第一步。L-DOPA在4, 5-DOPA外二醇双加氧酶催化作用下裂解产生4, 5-开环多巴。4, 5-开环多巴的醛基与L-DOPA中的氨基在酶促作用下分子内自发缩合而成甜菜醛氨酸,甜菜醛氨酸的醛基和胺的氨基之间自发缩合反应生成相应的亚胺,从而得到甜菜素。甜菜素还可以从多巴黄素和酪氨酸-甜菜素缩聚物中获得,酪氨酸-甜菜素缩聚物和多巴黄素在酪氨酸酶的作用下分别转化为多巴黄素和多巴黄质醌,在缺乏还原剂的情况下,分子内亲核进攻导致多巴黄质醌环化为甜菜素;另外,甜菜苷配基可在5-O-葡糖基转移酶的作用下糖基化生成甜菜素[51]。这些研究为火龙果中甜菜素生物合成相关基因的转录调控提供了参考,但是目前甜菜素的生物合成机制还不完全明确,关于甜菜素的合成途径需要进一步研究。
2.2 功能特性火龙果富含的生理活性物质赋予了其多种功能特性,使其在抗氧化、抗菌、抗炎、降脂、降血糖等方面发挥着重要的作用(表 1)。
| 功能特性 Function characteristics |
作用机理 Mechanism of action |
参考文献 References |
| Antioxidant | It can effectively inhibit the production of ROS, RNS, iNOS and COX-2, and remove free radicals such as DPPH·,·OH and O2- | [52-54] |
| Antibacterial | It affects the energy supply, material transportation and biofilm structure of microorganisms, thereby inhibiting the growth of Bacillus cereus, Staphylococcus aureus and Escherichia coli | [55] |
| Anti-inflammatory | Inhibiting the activities of 5-lipoxygenase and cyclooxygenase-2, thereby blocking the prostaglandin and leukotriene pathways; inhibiting acetylcholinesterase (AChE) activity, thereby reducing the hydrolysis of acetylcholine, enhancing vagal nerve stimulation and inhibiting local pro-inflammatory factors; inhibiting the production of ROS | [52, 56] |
| Lipid lowering | Regulating gene expression, maintaining energy balance and steady state; increasing high density lipoprotein cholesterol; decreasing total cholesterol; lowing density lipoprotein cholesterol and triacylglycerol; providing protection against oxidation | [57, 58] |
| Hypoglycemic | Reducing the oxidative damage and inflammation of endothelial cells under high glucose without cytotoxicity | [59] |
2.2.1 抗氧化作用
抗氧化剂主要通过清除自由基、螯合引发氧化损伤物质、还原某些化合物、激活生物抗氧化系统活性等途径发挥抗氧化作用[60, 61]。火龙果是良好的抗氧化剂来源,从火龙果中提取的化合物(酚酸、黄酮、花青素、甜菜红素、多糖等物质)具有很强的自由基清除能力,而不同的抗氧化成分由于其结构和含量的差异,其功能活性也会有所差异。
李国胜等[53, 54]研究了火龙果花中提取的多酚和黄酮类化合物的抗氧化能力,结果表明火龙果黄酮类化合物清除二苯基苦基苯肼自由基(DPPH·)、羟基自由基(·OH)的能力与叔丁基对苯二酚(TBHQ)大致相同,火龙果多酚清除DPPH·、·OH的能力与二丁基羟基甲苯(BHT)相当。此外,Qian等[62]从火龙果皮中分离纯化得到的水溶性多糖DFPWSP-1,在一定浓度下对DPPH·、·OH、超氧阴离子自由基(O2-·)表现出明显的清除活性。Saenjum等[63]通过细胞实验发现火龙果提取物可以抑制活性氧(ROS)、活性氮(RNS)、诱导型一氧化氮合酶(iNOS)和环氧化酶-2 (COX-2)的产生,而且对细胞无毒性作用。胡元庆等[64]发现火龙果果皮色素对DPPH·、·OH、O2-· 均具有较明显的清除效果,且在一定浓度范围内自由基清除率与色素浓度呈正相关。
2.2.2 抗菌作用火龙果中的多种物质如多酚类化合物、甜菜红素、多糖等在抑制微生物生长方面有着明显的效果[7],而天然生物活性物质往往具有良好的安全性和广泛的抑菌活性,是天然防腐剂的良好来源[7]。
Zain等[65]采用微波辅助提取法从火龙果皮中提取并鉴定出了13种多酚化合物并作用于金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli),结果显示这些提取物对两种微生物均有一定的抑菌活性。Tenore等[66]采用亚分馏方法对火龙果果肉和果皮中的多酚进行定量分析,并且评估了火龙果果肉和果皮提取物的体外抗菌活性,结果表明在所提取的成分中,多酚组分显示出了更广谱的抑菌活性,它可以抑制所有被测试的食源性病原体、酵母和霉菌;而且,提取物的抑菌活性与微生物种类相关,与革兰氏阴性病原体相比,革兰氏阳性病原体更容易受所测试馏分的影响;另外,研究发现果肉和果皮中都含有较高的甜菜红素、类黄酮和酚酸物质,但果皮中的含量比果肉中更高,特别是甜菜红素,其含量几乎是果肉中的10倍。方晓晖等[67]研究发现,从火龙果果皮中提取的多糖对大肠杆菌、蜡样芽孢杆菌(B.cereus)、枯草芽孢杆菌(B.subtilis)和金黄色葡萄球菌均有不同程度的抑制作用,其抑菌活性随多糖浓度的增加而不断增强。Yong等[68]采用肉汤微量稀释法测定经不同贮藏条件处理后的红肉火龙果提取物的抑菌活性,结果表明4 ℃条件下贮藏6 d后,提取的甜菜红素含量提高了57.2%,其中甜菜苷的含量从37.9%上升到42.7%,相比新鲜采收的红肉火龙果,冷藏处理后提取物的最低抑菌浓度降低,这表明采用合适的处理方法对红肉火龙果甜菜红素含量和抗菌活性有积极影响。在另一项研究中,胡元庆等[64]采用纸片法检测抑菌圈来测定火龙果果皮色素提取物的抑菌效果,结果表明火龙果果皮色素对大肠杆菌、金黄色葡萄球菌、副溶血弧菌(Vibrio parahaemolyticus)、志贺氏菌(Shigella castellani)和蜡状芽孢杆菌均具有抑制作用,其中对大肠杆菌的抑制效果最好,其最低抑菌浓度为1.25 mg/mL、最低杀菌浓度为2.50 mg/mL。另外,研究还发现浓度为600 μg/mL的红肉火龙果叶提取物和浓度为800 μg/mL的白肉火龙果叶提取物对脑膜炎奈瑟氏菌(Neisseria meningitidis)、肺炎链球菌(S.pneumoniae)和单增李斯特菌(Listeria monocytogenes)等脑膜炎细菌具有潜在的抗菌活性[69]。这些活性成分对于防止感染和食品腐败具有重要意义,可以作为天然的食品防腐剂使用。
2.2.3 抗炎作用由于抗生素耐药性的增加,细菌感染引发的炎症损伤已经受到越来越多的研究人员的关注。在对抗炎症方面,天然产物及其衍生药物展现出巨大的应用潜力[70]。火龙果作为一种富含多种天然生物活性物质的水果,在抗炎方面具有良好的应用前景。
火龙果中的多种生理活性物质,如天然色素、角鲨烯等物质均具有抗炎活性,Nur等[71]运用冷萃取法提取两种火龙果中的色素,并通过实验评估了其抗炎活性,结果显示两种火龙果的色素提取物均具有抗炎活性;与其他两种(乙醇和乙酸乙酯)提取物相比,水提取物富含更多的功能活性物质(酚类物质和类黄酮),并展现出更显著的抗炎活性,因此两种火龙果的水提取物可以作为潜在的抗炎药物。Eldeen等[56]分别对火龙果果肉和果皮提取物、角鲨烯和阳性标准药物进行抗炎性能测定,结果表明火龙果果肉提取物对环氧合酶-2、乙酰胆碱酯酶、5-脂氧合酶活性均有显著的抑制作用,其中对乙酰胆碱酯酶活性的抑制作用较强;火龙果果皮提取物对5-脂氧合酶和乙酰胆碱酯酶活性抑制效果较好;通过抑制促炎酶活性实验,发现火龙果果肉和果皮提取物在治疗炎症方面显示出较大的潜力,而且角鲨烯可能是火龙果果肉中发挥抗炎活性的重要成分,这为火龙果抗炎成分的进一步研究提供了重要参考。此外,体内过量的ROS会损伤细胞或导致慢性炎症[72, 73],因此清除体内过剩的ROS是发挥抗炎能力的一种有效方式。Saenjum等[63]研究发现,红火龙果果肉和果皮提取物对ROS的产生具有抑制作用,新鲜果肉提取物表现出最高的抑制作用,而含有花青素的样品对ROS的抑制活性更强。因此,从火龙果中提取得到的富含矢车菊素-3-葡萄糖苷的提取物可能通过抑制ROS的产生来抑制炎症反应。
综上所述,火龙果中的某些成分可发挥抗炎功能,具有预防感染、防止食品腐败的潜在价值,然而还需要进一步研究,以深入了解这些成分的作用机理和应用前景。
2.2.4 降脂作用已有研究表明,火龙果在预防肥胖、2型糖尿病、心血管疾病、癌症以及其他的代谢综合征方面具有积极影响。例如,Ramli等[57]向经高碳水化合物、高脂肪饮食诱导代谢综合征的大鼠补充红肉火龙果果汁,结果显示补充红肉火龙果果汁可以逆转高碳水化合物、高脂肪饮食所导致的体重增加和腹部脂肪沉积过多,并调节相关基因(Pomc和Insr)的表达来维持能量平衡稳态。Holanda等[74]进行小鼠体内实验,根据处理条件将实验小鼠分成6组:标准饮食(SD)、高胆固醇饮食(HD)、辛伐他汀(SIMV)、火龙果100 mg/kg(P100)、火龙果200 mg/kg (P200)和火龙果400 mg/kg (P400),每天给血脂异常的C57BL/6小鼠服用火龙果(P100、P200和P400),实验结果表明服用火龙果小鼠的高密度脂蛋白(HDL-c)胆固醇增加,总胆固醇、低密度脂蛋白(LDL-c)胆固醇、三酰甘油、血糖、丙氨酸氨基转移酶和天冬氨酸氨基转移酶降低。Khoo等[75]发现,相较于红肉火龙果果肉提取物,红肉火龙果果皮提取物对H2O2诱导的氧化应激具有更显著的抑制效果;在较高样品浓度下,果皮提取物对分化的3T3-L1细胞中脂质积累的抑制作用更明显,因此火龙果的提取物特别是其果皮提取物具有降脂作用,可以降低肥胖带来的风险。Hernawati等[76]研究发现红肉火龙果果皮粉灌胃治疗30 d后,雄性高脂血症小鼠的总胆固醇、甘油三酯、LDL-c含量均降低,且随着红肉火龙果果皮粉剂量的增加,效果更加显著;进一步研究发现红肉火龙果果皮粉可提高HDL-c水平,因此红肉火龙果果皮粉能改善雄性高血脂症小鼠的血脂水平。
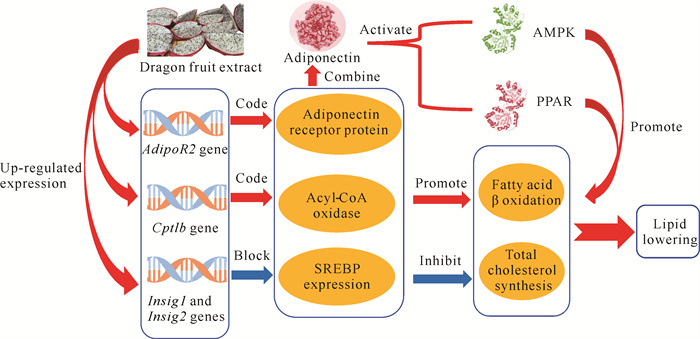
火龙果果皮色素提取物可能通过上调AdipoR2基因、Cptlb基因、Insig1和Insig2基因的表达来发挥其降脂功能[41, 77](图 3)。AdipoR2基因是编码脂联体受体蛋白的基因,火龙果果皮色素提取物通过上调AdipoR2基因的表达,产生更多的脂联体受体蛋白,从而更多地与脂联素结合,增强脂联素对腺苷酸活化蛋白激酶(AMPK)、过氧化物酶体增殖物激活受体(PPAR)的活化效果,促进脂肪酸的β氧化;同时通过上调Cptlb基因的表达,可产生更多的长链脂肪酸β氧化关键限速酶,促进脂肪酸的β氧化。此外,火龙果果皮色素提取物还可通过上调Insig1和Insig2基因的表达,阻断SREBP表达途径,从而抑制总胆固醇的合成,达到降脂效果。
综上所述,火龙果通过调节能量平衡、降低血脂和血糖水平以及提供抗氧化保护等多种途径,对预防肥胖、癌症和代谢相关疾病具有一定帮助。
2.2.5 降血糖作用血糖水平反映了食物消耗后释放到血液中的葡萄糖量。血糖水平超过一定范围会导致糖尿病、高血压和其他慢性疾病,通常需要药物干预来降低血糖水平。火龙果作为一种潜在的药用植物,具有降低血糖的作用。它通过促使胰腺β细胞再生和减弱成纤维细胞生长因子-21 (FGF-21)抗性的方式,合成和分泌胰岛素、胰淀素(调节血糖水平的两种激素)[78]。Lira等[79]评估了火龙果对糖尿病小鼠血糖和氧化应激的影响,结果显示200 mg/kg火龙果喂养能显著降低小鼠的血糖水平。Lodi等[80]利用糖尿病小鼠模型对火龙果提取物进行研究,发现火龙果果皮提取物及二甲双胍(MET)联合治疗可以减少高葡萄糖下内皮细胞的氧化损伤和炎症,且对细胞无毒性作用。Shah等[81]的研究结果表明糖尿病患者摄入火龙果低聚糖可以减少胰岛素血症的影响,这表明火龙果有望作为糖尿病病人新型药物的开发来源。
2.2.6 其他有益价值除了上述提及的功能特性,火龙果及其提取物在其他疾病治疗中同样表现出积极作用。癌症是目前全球范围内人类死亡的主要原因之一,天然成分的抗癌活性在癌症治疗方面具有重要价值。Kim等[82]研究发现火龙果的果肉、果皮中的多酚和类黄酮物质对多种自由基具有抗氧化活性,并且能在一定程度上抑制人体胃腺癌细胞(AGS)和乳腺癌细胞(MCF-7)的增殖。Toktay等[83]通过动物实验发现,火龙果提取物对吲哚美辛诱导的大鼠溃疡模型胃具有积极的作用,其结果显示大鼠在摄入500 mg/kg或1 000 mg/kg剂量的火龙果提取物后,可预防吲哚美辛诱导的机体溃疡损伤,该功能可通过降低丙二醛(MDA)水平、提高谷胱甘肽水平、抑制胱天蛋白酶3 (Caspase 3)、Bcl2关联X蛋白(BAX)和环氧化酶-2 (Cox-2)的表达,并激活环氧化酶-1 (Cox-1)机制实现。Cheok等[84]研究发现每天摄入24 g火龙果粉(含33 mg甜菜素)可以改善人的内皮功能和动脉硬化。
3 展望火龙果富含不饱和脂肪酸、蛋白质、必需氨基酸、矿物质等多种营养物质,是补充膳食营养的良好选择。另外,火龙果果肉和果皮中含有丰富的生物活性物质如多糖、多酚、甜菜素等,已被证明具有抗氧化、抗菌、抗炎、降血脂、降血糖等功能特性,并且在预防肥胖、糖尿病、癌症、心血管疾病等方面具有积极作用。
火龙果因其丰富的营养价值和多种功能活性,在食品、保健品以及医药等领域具有广阔的应用前景,然而目前关于火龙果的利用多为直接食用或初级加工,对火龙果副产物的利用率低。此外,现有研究主要停留在实验室阶段,对火龙果生物活性成分的功能特性尚不完全明确,这将限制火龙果在医药领域的应用。今后对火龙果活性成分及其功能特性的研究还有待深入,可以考虑从以下5个方面进行。(1)目前在火龙果抗氧化、抗炎及抑菌等生物活性的研究中,不同活性成分在体内代谢过程中的代谢机理、过程路径、次级代谢产物等方面研究不足,各种活性成分对特定疾病发展的影响机制尚不完全清楚,需要进一步深入研究。(2)虽然火龙果被证明具备一些生理活性且对人体健康有益,但是目前关于火龙果的生理活性研究多停留在体外实验和动物实验阶段,需逐步开展更多的包括临床干预在内的人群纵贯性研究,全面评估火龙果对人体健康的影响。(3)火龙果的活性成分如甜菜素、多糖等在果皮、果茎中含量较高,但果皮、果茎活性成分提取的中试化研究鲜有报道。火龙果的果皮、茎叶在加工过程中多被丢弃,资源浪费严重,综合利用率不足,因此加强果皮、茎叶资源的综合开发利用,将有助于提高火龙果在食品工业和药物开发等方面的应用。(4)火龙果的活性成分如甜菜素、多糖、多酚等在提取、贮藏过程中易被破坏,可通过优化提取工艺以及采取微胶囊化、分子结构修饰、添加稳定剂或偶联使用多种技术等方法提高其生物利用率。(5)火龙果生物活性成分的功能研究目前基本处于量效关系阶段,例如,火龙果多糖具有多种生理活性,但目前对其高级结构研究不够深入,结构鉴定、结构修饰改造和构效关系研究等鲜见报道。未来可利用光谱技术、生物医学方法和生物活性导向分析,充分识别和表征火龙果中生物活性成分的化学结构和生物特性,深入探索生物活性与其结构之间的规律。
| [1] |
XU L, ZHANG Y, WANG L. Structure characteristics of a water-soluble polysaccharide purified from dragon fruit (Hylocereus undatus) pulp[J]. Carbohydrate Polymers, 2016, 146: 224-230. DOI:10.1016/j.carbpol.2016.03.060 |
| [2] |
乔谦, 于泳, 王江勇, 等. 火龙果研究进展及北方引种可行性分析[J]. 中国农学通报, 2020, 36(25): 53-59. |
| [3] |
孙佩光, 程志号, 孙长君, 等. 16份火龙果种质资源果实营养品质分析[J]. 分子植物育种, 2022, 20(19): 6585-6592. |
| [4] |
HUANG Y, BRENNAN M A, KASAPIS S, et al. Maturation process, nutritional profile, bioactivities and utilisation in food products of red pitaya fruits: a review[J]. Foods, 2021, 10(11): 2862. DOI:10.3390/foods10112862 |
| [5] |
PAŚKO P, GALANTY A, ZAGRODZKI P, et al. Dragon fruits as a reservoir of natural polyphenolics with chemopreventive properties[J]. Molecules, 2021, 26(8): 2158. DOI:10.3390/molecules26082158 |
| [6] |
ATTARŞ H, ALI GÜNDEŞLI M A, URÜN I, et al. Nutritional analysis of red-purple and white-fleshed pitaya (Hylocereus) species[J]. Molecules, 2022, 27(3): 808. DOI:10.3390/molecules27030808 |
| [7] |
JIANG H, ZHANG W, LI X, et al. Nutrition, phytoche-mical profile, bioactivities and applications in food industry of pitaya (Hylocereus spp.) peels: a comprehensive review[J]. Trends in Food Science & Technology, 2021, 116: 199-217. |
| [8] |
NISHIKITO D F, BORGES A C A, LAURINDO L F, et al. Anti-inflammatory, antioxidant, and other health effects of dragon fruit and potential delivery systems for its bioactive compounds[J]. Pharmaceutics, 2023, 15(1): 159. DOI:10.3390/pharmaceutics15010159 |
| [9] |
高曼, 甘祖于, 王维, 等. 红肉火龙果营养价值及产品研发现状[J]. 贵州农机化, 2022(1): 16-20. |
| [10] |
LIU Y, TU X, LIN L, et al. Analysis of lipids in pitaya seed oil by ultra-performance liquid chromatography–time-of-flight tandem mass spectrometry[J]. Foods, 2022, 11(19): 2988. DOI:10.3390/foods11192988 |
| [11] |
ARIFFIN A, BAKAR J, TAN C, et al. Essential fatty acids of pitaya (dragon fruit) seed oil[J]. Food Chemistry, 2009, 114(2): 561-564. DOI:10.1016/j.foodchem.2008.09.108 |
| [12] |
VERONA-RUIZ A, URCIA-CERNA J, PAUCAR-MENACHO L. Pitahaya (Hylocereus spp.): culture, physicochemical characteristics, nutritional composition, and bioactive compounds[J]. Scientia Agropecuaria, 2020, 11(3): 439-453. DOI:10.17268/sci.agropecu.2020.03.16 |
| [13] |
吴洪号, 张慧, 贾佳, 等. 功能性多不饱和脂肪酸的生理功能及应用研究进展[J]. 中国食品添加剂, 2021, 32(8): 134-140. |
| [14] |
江鑫, 曹君, 白新鹏, 等. 红心火龙果籽的营养成分分析[J]. 天然产物研究与开发, 2018, 30(2): 232-238. |
| [15] |
ÜNVER A. Antioxidant properties, oxidative stability, and fatty acid profile of pitaya fruit (Hylocereus polyrhizus and Hylocereus undatus) seeds cultivated in Turkey[J]. BioResources, 2023, 18(2): 3342-3356. DOI:10.15376/biores.18.2.3342-3356 |
| [16] |
李靓, 朱涵彬, 袁晓晴, 等. 火龙果营养成分及保健功能的研究[J]. 现代食品, 2020(10): 26-28. |
| [17] |
王壮, 王立娟, 蔡永强, 等. 火龙果营养成分及功能性物质研究进展[J]. 中国南方果树, 2014, 43(5): 25-29. |
| [18] |
顾鑫慧, 俞超, 王碧, 等. 火龙果种子清蛋白的理化性质及其胰蛋白酶抑制活性研究[J]. 核农学报, 2021, 35(8): 1858-1864. |
| [19] |
邢晋宁, 陈训, 樊丛令. 不同品种火龙果的氨基酸含量测定及其营养评价[J]. 贵州农业科学, 2011, 39(5): 193-195, 200. |
| [20] |
蔡永强, 向青云, 陈家龙, 等. 火龙果的营养成分分析[J]. 经济林研究, 2008, 26(4): 53-56. |
| [21] |
方志峰, 朱婷, 张若杰, 等. 广西9种主要水果食物营养成分分析及评价[J]. 应用预防医学, 2018, 4(4): 281-284, 287. |
| [22] |
LUU T, LE T, HUYNH N, et al. Dragon fruit: a review of health benefits and nutrients and its sustainable development under climate changes in Vietnam[J]. Czech Journal of Food Sciences, 2021, 39(2): 71-94. DOI:10.17221/139/2020-CJFS |
| [23] |
LE N L. Functional compounds in dragon fruit peels and their potential health benefits: a review[J]. International Journal of Food Science & Technology, 2022, 57(5): 2571-2580. |
| [24] |
MADANE P, DAS A K, NANDA P K, et al. Dragon fruit (Hylocereus undatus) peel as antioxidant dietary fibre on quality and lipid oxidation of chicken nuggets[J]. Journal of Food Science and Technology, 2020, 57(4): 1449-1461. DOI:10.1007/s13197-019-04180-z |
| [25] |
ZAID R M, MISHRA P, TABASSUM S, et al. High methoxyl pectin extracts from Hylocereus polyrhizus's peels: extraction kinetics and thermodynamic studies[J]. International Journal of Biological Macromolecules, 2019, 141: 1147-1157. DOI:10.1016/j.ijbiomac.2019.09.017 |
| [26] |
唐雅园, 何雪梅, 孙健, 等. 火龙果茎多糖在护手霜中的应用及性能评价[J]. 日用化学工业, 2022, 52(4): 410-417. |
| [27] |
王超雪. 红心火龙果果皮、茎叶中多糖分离纯化及抗氧化活性研究[D]. 长春: 长春师范大学, 2020.
|
| [28] |
吴冬凡, 庞杜贤, 林清盛. 火龙果果皮总黄酮和多糖的提取工艺及抗氧化研究[J]. 华南师范大学学报(自然科学版), 2021, 53(5): 68-75. |
| [29] |
慕雪, 刘垠泽, 吴恒梅. 白心火龙果果皮多糖提取及抗氧化研究[J]. 中国野生植物资源, 2023, 42(3): 21-25, 37. |
| [30] |
牛春艳, 郑思蒙, 吴琼. 火龙果果皮中水溶性膳食纤维的制备[J]. 现代食品, 2020(1): 186-188. |
| [31] |
BISWAS O, KANDASAMY P, DAS S K. Effect of dragon fruit peel powder on quality and acceptability of fish nuggets stored in a solar cooler (5±1℃)[J]. Journal of Food Science and Technology, 2022, 59(9): 3647-3658. DOI:10.1007/s13197-022-05377-5 |
| [32] |
VILCAPOMA W, DE BRUIJN J, ELÍAS-PEÑAFIEL C, et al. Optimization of ultrasound-assisted extraction of dietary fiber from yellow dragon fruit peels and its application in low-fat alpaca-based sausages[J]. Foods, 2023, 12(15): 2945. DOI:10.3390/foods12152945 |
| [33] |
CHEN H, LIU Y, ZHANG J, et al. Pectin extracted from dragon fruit peel: an exploration as a natural emulsifier[J]. International Journal of Biological Macromolecules, 2022, 221: 976-985. DOI:10.1016/j.ijbiomac.2022.09.069 |
| [34] |
LIAOTRAKOON W, VAN BUGGENHOUT S, CHR-ISTIAENS S, et al. An explorative study on the cell wall polysaccharides in the pulp and peel of dragon fruits (Hylocereus spp.)[J]. European Food Research and Technology, 2013, 237(3): 341-351. DOI:10.1007/s00217-013-1997-7 |
| [35] |
MUHAMMAD K, ZAHARI N I M, GANNASIN S P, et al. High methoxyl pectin from dragon fruit (Hylocereus polyrhizus) peel[J]. Food Hydrocolloids, 2014, 42(pt.2): 289-297. |
| [36] |
FERREIRA V C, AMPESE L C, SGANZERLA W G, et al. An updated review of recent applications and future perspectives on the sustainable valorization of pitaya (Hylocereus spp.) by-products[J]. Sustainable Chemistry and Pharmacy, 2023, 33: 101070. DOI:10.1016/j.scp.2023.101070 |
| [37] |
SULERIA H A R, BARROW C J, DUNSHEA F R. Screening and characterization of phenolic compounds and their antioxidant capacity in different fruit peels[J]. Foods, 2020, 9(9): 1206. DOI:10.3390/foods9091206 |
| [38] |
CHEN Z, ZHONG B, BARROW C J, et al. Identification of phenolic compounds in Australian grown dragon fruits by LC-ESI-QTOF-MS/MS and determination of their antioxidant potential[J]. Arabian Journal of Chemistry, 2021, 14(6): 103151. DOI:10.1016/j.arabjc.2021.103151 |
| [39] |
孙卉, 康蒙, 陈玉凤, 等. 火龙果果皮多酚及其抗氧化活性研究[J]. 食品安全导刊, 2022(31): 124-129. |
| [40] |
XIE F, HUA Q, CHEN C, et al. Transcriptomics-based identification and characterization of glucosyltransferases involved in betalain biosynthesis in Hylocereus megalanthus[J]. Plant Physiology and Biochemistry, 2020, 152: 112-124. DOI:10.1016/j.plaphy.2020.04.023 |
| [41] |
宋海昭. 火龙果甜菜红素提取物对肥胖的干预作用及相关机理研究[D]. 杭州: 浙江大学, 2016.
|
| [42] |
FATHORDOOBADY F, MIRHOSSEINI H, SELA-MAT J, et al. Effect of solvent type and ratio on betacyanins and antioxidant activity of extracts from Hylocereus polyrhizus flesh and peel by supercritical fluid extraction and solvent extraction[J]. Food Chemistry, 2016, 202: 70-80. DOI:10.1016/j.foodchem.2016.01.121 |
| [43] |
HERBACH K M, STINTZING F C, CARLE R. Betalain stability and degradation: structural and chromatic aspects[J]. Journal of Food Science, 2006, 71(4): R41-R50. |
| [44] |
VELLANO P, MORAIS R, SOARES C, et al. Extraction and stability of pigments obtained from pitaya bark flour (Hylocereus costaricensis)[J]. Food Science and Technology, 2022, 42: e25421. DOI:10.1590/fst.25421 |
| [45] |
LIN X, LI B, WEN J, et al. Storage stability and in vitro bioaccessibility of liposomal betacyanins from red pitaya (Hylocereus polyrhizus)[J]. Molecules, 2022, 27(4): 1193. DOI:10.3390/molecules27041193 |
| [46] |
程美女. WRKY转录因子调控火龙果果实甜菜素合成和糖代谢的分子机制[D]. 广州: 华南农业大学, 2018.
|
| [47] |
化青珠. 火龙果甜菜素生物合成关键基因的筛选与鉴定[D]. 广州: 华南农业大学, 2020.
|
| [48] |
谢芳芳. 火龙果甜菜素生物合成关键基因的筛选及其功能初步分析[D]. 广州: 华南农业大学, 2019.
|
| [49] |
ZHANG L, CHEN C, XIE F, et al. A novel WRKY transcription factorHmoWRKY40 associated with betalain biosynthesis in pitaya (Hylocereus monacanthus) through regulatingHmoCYP76AD1[J]. International Journal of Molecular Sciences, 2021, 22(4): 2171. DOI:10.3390/ijms22042171 |
| [50] |
CHEN J Y, XIE F F, CUI Y Z, et al. A chromosome-scale genome sequence of pitaya (Hylocereus undatus) provides novel insights into the genome evolution and regulation of betalain biosynthesis[J]. Horticulture Research, 2021, 8(1): 164. DOI:10.1038/s41438-021-00612-0 |
| [51] |
IBRAHIM S R M, MOHAMED G A, KHEDR A I M, et al. Genus Hylocereus: beneficial phytochemicals, nutritional importance, and biological relevance-a review[J]. Journal of Food Biochemistry, 2018, 42(3): e12491. |
| [52] |
SAENJUM C, PATTANANANDECHA T, NAKA-GAWA K. Antioxidative and anti-inflammatory phytochemicals and related stable paramagnetic species in different parts of dragon fruit[J]. Molecules, 2021, 26(12): 3565. DOI:10.3390/molecules26123565 |
| [53] |
李国胜, 姚秋桂, 张伟敏. 火龙果花中黄酮类化合物抗氧化活性研究[J]. 北方园艺, 2016(2): 121-125. |
| [54] |
李国胜, 张伟敏. 火龙果花中多酚类化合物抗氧化活性研究[J]. 热带农业科学, 2016, 36(2): 5-10. |
| [55] |
王旭旭, 马领领, 马卓云, 等. 火龙果的功能及其作用机制研究进展[J]. 食品工业科技, 2019, 40(21): 352-360. |
| [56] |
ELDEEN I S, FOONG S, ISMAIL N, et al. Regulation of pro-inflammatory enzymes by the dragon fruits from Hylocereus undatus (Haworth) and squalene: its major volatile constituents[J]. Pharmacognosy Magazine, 2020, 16(68): 81-86. DOI:10.4103/pm.pm_271_19 |
| [57] |
RAMLI N S, ISMAIL P, RAHMAT A. Red pitaya juice supplementation ameliorates energy balance homeostasis by modulating obesity-related genes in high-carbohydrate, high-fat diet-induced metabolic syndrome rats[J]. BMC Complementary and Alternative Medicine, 2016, 16: 243. DOI:10.1186/s12906-016-1200-3 |
| [58] |
HOLANDA M O, LIRA S M, DA SILVA J Y G, et al. Intake of pitaya (Hylocereus polyrhizus (F.A.C.Weber) Britton & Rose) beneficially affects the cholesterolemic profile of dyslipidemic C57BL/6 mice[J]. Food Bioscience, 2021, 42: 101181. DOI:10.1016/j.fbio.2021.101181 |
| [59] |
POOLSUP N, SUKSOMBOON N, PAW N J, et al. Effect of dragon fruit on glycemic control in prediabetes and type 2 diabetes: a systematic review and meta-analysis[J]. PLoS One, 2017, 12(9): e0184577. DOI:10.1371/journal.pone.0184577 |
| [60] |
MUNTEANU I G, APETREI C. Analytical methods used in determining antioxidant activity: a review[J]. International Journal of Molecular Sciences, 2021, 22(7): 3380. DOI:10.3390/ijms22073380 |
| [61] |
VIUDA-MARTOS M, RUIZ-NAVAJAS Y, SÁN-CHEZ-ZAPATA E, et al. Antioxidant activity of essential oils of five spice plants widely used in a mediterranean diet[J]. Flavour and Fragrance Journal, 2010, 25(1): 13-19. DOI:10.1002/ffj.1951 |
| [62] |
QIAN S, FANG X, DAN D, et al. Ultrasonic-assisted enzymatic extraction of a water soluble polysaccharide from dragon fruit peel and its antioxidant activity[J]. RSC Advances, 2018, 8(73): 42145-42152. DOI:10.1039/C8RA06449K |
| [63] |
SAENJUM C, PATTANANANDECHA T, NAKA-GAWA K. Antioxidative and anti-inflammatory phytochemicals and related stable paramagnetic species in different parts of dragon fruit[J]. Molecules, 2021, 26(12): 3565. DOI:10.3390/molecules26123565 |
| [64] |
胡元庆, 王建荟, 李凤霞. 微波辅助法提取火龙果果皮色素及其功能活性研究[J]. 食品工业科技, 2020, 41(23): 182-188, 202. |
| [65] |
ZAIN N M, NAZERI M A, AZMAN N A. Assessment on bioactive compounds and the effect of microwave on pitaya peel[J]. Jurnal Teknologi, 2019, 81(2): 11-19. |
| [66] |
TENORE G C, NOVELLINO E, BASILE A. Nutra-ceutical potential and antioxidant benefits of red pitaya (Hylocereus polyrhizus) extracts[J]. Journal of Functional Foods, 2012, 4(1): 129-136. DOI:10.1016/j.jff.2011.09.003 |
| [67] |
方晓晖, 但德苗, 钱时权, 等. 红皮火龙果皮多糖过氧化氢脱色工艺及抑菌活性研究[J]. 食品与机械, 2018, 34(1): 149-153, 181. |
| [68] |
YONG Y Y, DYKES G, LEE S M, et al. Effect of re-frigerated storage on betacyanin composition, antibacterial activity of red pitahaya (Hylocereus polyrhizus) and cytotoxicity evaluation of betacyanin rich extract on normal human cell lines[J]. LWT, 2018, 91: 491-497. DOI:10.1016/j.lwt.2018.01.078 |
| [69] |
RITARWAN K, NERDY N. Antibacterial activity of red dragon fruit leaves extract and white dragon fruit leaves extract against meningitis bacterial[J]. Oriental Journal of Chemistry, 2018, 34(5): 2534-2538. DOI:10.13005/ojc/340540 |
| [70] |
ALNOMAN M M. Multi-therapeutic and biomolecular exploration of andrographolide against bacterial-induced oxidative and inflammatory damages[J]. Pharmacognosy Magazine, 2023, 19(3): 539-550. DOI:10.1177/09731296231171219 |
| [71] |
NUR M A, UDDIN M R, MEGHLA N S, et al. In vitro anti-oxidant, anti-inflammatory, anti-bacterial, and cytotoxic effects of extracted colorants from two species of dragon fruit (Hylocereus spp.)[J]. Food Chemistry Advances, 2023, 2: 100318. DOI:10.1016/j.focha.2023.100318 |
| [72] |
GAUTAM G, PARVEEN B, KHAN M U, et al. A systematic review on nephron protective AYUSH drugs as constituents of NEERI-KFT (A traditional Indian polyherbal formulation) for the management of chronic kidney disease[J]. Saudi Journal of Biological Sciences, 2021, 28(11): 6441-6453. DOI:10.1016/j.sjbs.2021.07.008 |
| [73] |
LI L, GUO J, WANG Y, et al. A broad-spectrum ROS-eliminating material for prevention of inflammation and drug-induced organ toxicity[J]. Advanced Science, 2018, 5(10): 1800781. DOI:10.1002/advs.201800781 |
| [74] |
HOLANDA M O, LIRA S M, DA SILVA J Y G, et al. Intake of pitaya (Hylocereus polyrhizus (F.A.C.Weber) Britton & Rose) beneficially affects the cholesterolemic profile of dyslipidemic C57BL/6 mice[J]. Food Bioscience, 2021, 42: 101181. DOI:10.1016/j.fbio.2021.101181 |
| [75] |
KHOO H E, HE X M, TANG Y Y, et al. Betacyanins and anthocyanins in pulp and peel of red pitaya (Hylocereus polyrhizus cv.Jindu), inhibition of oxidative stress, lipid reducing, and cytotoxic effects[J]. Frontiers in Nutrition, 2022, 9: 894438. DOI:10.3389/fnut.2022.894438 |
| [76] |
HERNAWATI, SETIAWAN N A, SHINTAWATI R, et al. The role of red dragon fruit peel (Hylocereus polyrhizus) to improvement blood lipid levels of hyperlipidaemia male mice[J]. Journal of Physics: Conference Series, 2018, 1013: 012167. DOI:10.1088/1742-6596/1013/1/012167 |
| [77] |
YANG T, ESPENSHADE P J, WRIGHT M E, et al. Crucial step in cholesterol homeostasis: sterols promote binding of SCAP to INSIG-1, a membrane protein that facilitates retention of SREBPs in ER[J]. Cell, 2002, 110(4): 489-500. DOI:10.1016/S0092-8674(02)00872-3 |
| [78] |
POOLSUP N, SUKSOMBOON N, PAW N J. Effect of dragon fruit on glycemic control in prediabetes and type 2 diabetes: a systematic review and meta-analysis[J]. PLoS One, 2017, 12(9): e0184577. DOI:10.1371/journal.pone.0184577 |
| [79] |
LIRA S M, HOLANDA M O, DA SILVA J Y G, et al. Pitaya [Hylocereus polyrhizus (F.A.C Weber) Britton & Rose] effect on glycemia and oxidative stress in aloxan-induced diabetic mice[J]. Food Science and Technology, 2023, 43: e56822. DOI:10.1590/fst.56822 |
| [80] |
LODI K Z, CASSINI C, SCARIOT F J, et al. Pitaya (Hylocereus lemairei) extracts avoid mitochondrial dysfunction and NF-kβ/NLRP-3-mediated inflammation in endothelial cells under high glucose and are in vivo safe[J]. PharmaNutrition, 2023, 26: 100356. DOI:10.1016/j.phanu.2023.100356 |
| [81] |
SHAH K, CHEN J, CHEN J, et al. Pitaya nutrition, biology, and biotechnology: a review[J]. International Journal of Molecular Sciences, 2023, 24(18): 13986. DOI:10.3390/ijms241813986 |
| [82] |
KIM H, CHOI H K, MOON J Y, et al. Comparative antioxidant and antiproliferative activities of red and white pitayas and their correlation with flavonoid and polyphenol content[J]. Journal of Food Science, 2011, 76(1): C38-C45. |
| [83] |
TOKTAY E, YAYLA M, SAHIN L, et al. The effects of dragon fruit (Hylocereus polyrhizus) extract on indomethacin-induced stomach ulcer in rats[J]. Journal of Food Biochemistry, 2022, 46(9): e14274. |
| [84] |
CHEOK A, XU Y F, ZHANG Z C, et al. Betalain-rich dragon fruit (pitaya) consumption improves vascular function in men and women: a double-blind, randomized controlled crossover trial[J]. The American Journal of Clinical Nutrition, 2022, 115(5): 1418-1431. DOI:10.1093/ajcn/nqab410 |