广西北海市地处北部湾北部,三面环海。这里有着曲折的海岸线,大陆岸线长528.17 km。0-15 m水深面积23.07万公顷,砂泥质或泥砂质滩涂广阔,北海海域的自然条件非常适合底栖贝类的生长,是各种底栖经济贝类的主产区。最新发布的中国渔业统计年鉴[1]显示,广西底播贝类养殖面积20.6万公顷,底播贝类产量达到36.87万吨。北海海域出产的獭蛤(Lutraria spp.,俗称象鼻螺)、钝缀锦蛤(Tapes dorsatus,俗称沙包螺)、巴非蛤(Paphia spp.)等经济贝类肉质鲜美、营养丰富,深受广大消费者喜爱[2-5]。进入21世纪以来,北海市的贝类增养殖业蓬勃发展,据潘英等[6]报道,广西贝类的增养殖几乎占了全部海水养殖业产量的半壁江山。北海市的贝类养殖业由浅海滩涂的文蛤、牡蛎养殖,逐渐发展到低潮线以下至-10 m等深线的潮下带贝类底播养殖,主要养殖的种类有獭蛤、钝缀锦蛤等个体较大的高值贝类[7]。近年来,由于环境变化及过度捕捞等原因,贝类资源有逐年衰退的趋势,因此北海市贝类产业逐渐由资源型向人工增养殖发展[1],这使得判别底栖贝类适养区和养殖容量成为了产业发展的首要问题。
因此,对于贝类适养区及养殖容量的判别成为了研究热点。卢振彬等[8-11]对福建沿海的湄洲湾、泉州湾、围头湾和诏安湾的贝类适养区及其养殖容量进行了评估;尹晖等[12]对山东乳山湾滩涂贝类养殖容量进行了估算,以上都是以当地贝类资源调查数据为基础进行的研究。对于北海海域贝类资源,袁秀珍[13]、阮桂文[14]、李永强[15]、谢文海等[16]对北海海域不同生境潮间带底栖贝类的分布及资源状况作了报道;黄雯等[17]报道了涠洲岛潮下带珊瑚礁区底栖贝类的群落特征。但是,对于北海海域潮下带(最低潮线至-10 m等深线)底栖贝类的资源调查未见报道,而潮下带为江珧(Atrina spp.)、獭蛤、钝缀锦蛤、菲律宾蛤仔(Ruditapes philippinarum)、大竹蛏(Solen grandis)和巴非蛤等经济贝类的主要栖息地。因此,本研究采用潜水员水肺潜水、海底样方定量采集方法,开展潮下带底栖贝类的调查,从而掌握北海海域潮下带底栖贝类的分布特征和资源状况,为底栖贝类的保护和增养殖开发提供基础数据。
1 材料与方法 1.1 调查时间及调查站位 1.1.1 调查时间本研究在秋季(2020年11月3-18日)和春季(2021年4月21-28日)进行采样。
1.1.2 调查站位本研究把北海海域划分为4个海区,分别为廉州湾、侨港、白龙和营盘海区。秋季采样站位共73个,其中廉州湾海区20个,侨港海区19个,白龙海区17个,营盘海区17个;春季采样站位67个,其中廉州湾海区12个,侨港海区18个,白龙海区14个,营盘海区23个(图 1)。
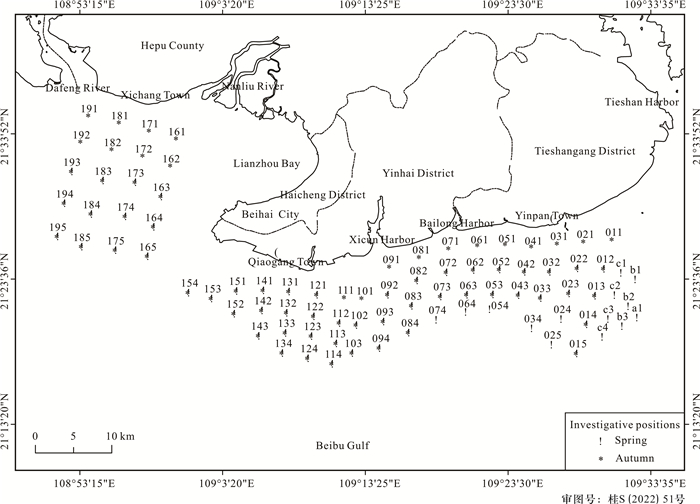
|
| 图 1 北海海域潮下带底栖贝类调查站位 Fig.1 Subtidal benthic shellfish survey station in the sea area of Beihai |
1.2 采样方法
采用潜水员水肺潜水、海底样方定量采集方法采样。事先做好一个50 cm×50 cm×30 cm的不锈钢采样框(图 2)。每个站位采4个样方,每个样方之间间隔10 m。采样时,潜水员戴水肺潜入海底,首先将采样框插入底质,再用工具把采样框中的底质装入孔径为0.5 mm的网袋中,在海水中筛除泥砂后把留在网袋内的贝类及杂质等带上岸,最后从中分离底栖贝类装入样品袋,放入-18 ℃冷柜中冰冻保存。

|
| 图 2 北海海域潮下带底栖贝类调查采样框 Fig.2 Subtidal benthic shellfish survey sampling frame in the sea area of Beihai |
1.3 样品分析
将采集到的贝类样品在实验室采用形态学的方法进行种类鉴定[18, 19]。同时,用电子天平称量每个样品的质量。
1.4 生物多样性评价方法采用香农-威纳(Shannon-Wiener)生物多样性指数(H′)、皮洛(Pielou)均匀度指数(J)、马格列夫(Margalef)物种丰富度指数(d)、物种多样性阈值(Dv)、优势度(Y)等指数对底栖贝类的群落结构特征进行评价。
| $ H^{\prime}=-\sum P i \ln (P i), $ | (1) |
| $ J=H^{\prime} / \ln S, $ | (2) |
| $ d=(S-1) / \ln N, $ | (3) |
| $ D v=H^{\prime} \times J, $ | (4) |
| $ Y=P i \times f i, $ | (5) |
公式中,S为样品中的种类总数,Pi为第i种的个体数ni与总个体数N的比值。fi为物种i在各个海区的出现频率。当某物种Y>0.02时,即代表该物种为该海域的优势种。
当H′、d均小于1时,表示群落受到重度干扰;当3≥H′、d≥1时,表示群落受到中度干扰;当H′、d均大于3时,表示群落受干扰小或无干扰[20]。Dv值分级评判标准见表 1[21]。
| 生物多样性阈值 Biodiversity threshold (Dv) |
评价等级 Evaluation level |
等级描述 Rank description |
| >3.5 | Ⅰ | Very abundant |
| 2.6-3.5 | Ⅱ | Abundant |
| 1.6-2.5 | Ⅲ | Good |
| 0.6-1.5 | Ⅳ | General |
| < 0.6 | Ⅴ | Inferior |
2 结果与分析 2.1 种类组成、分布及优势种
北海4个海区潮下带底栖贝类有2纲9目31科60属102种(表 2),分别为腹足纲(Gastropoda)13科14属17种,双壳纲(Bivalvia)18科46属85种。其中,帘蛤科(Veneridae)的种类最多,有25种,占总种数的24.51%,其个体数也是最多的,占本次调查总个体数的65.93%;其次是樱蛤科(Tellinidae),有12种,占总种数的11.76%。从季节来看,春季有55种,秋季有76种,春季和秋季共有的种类有29种。从季节及分布区域来看,秋季的廉州湾海区种类数和个体数都是最少的,12个站位只有6种12个个体;其次,秋季营盘海区底栖贝类的种类数及个体数也较少。秋季的侨港海区出现的种类数最多,达到了39种,而个体数最多的出现在春季的营盘海区,个体数达到629个。
| 纲 Class |
目 Order |
科 Family |
种类 Species |
数量/个Quantity/ind. | 经济种 Economic species |
||||||||
| 春季 Spring | 秋季 Autumn | ||||||||||||
| 廉州湾 Lianzhou Bay |
侨港 Qiaogang |
白龙 Bailong |
营盘 Yingpan |
廉州湾 Lianzhou Bay |
侨港 Qiaogang |
白龙 Bailong |
营盘 Yingpan |
||||||
| Gastropoda | Neogastropoda | Buccinidae | Phos senticosus | 2(2) | 1(1) | 1(1) | |||||||
| Buccinidae sp. | 3(3) | 1(1) | |||||||||||
| Olovidae | Oliva mustelina | 1(1) | 1(1) | ||||||||||
| Muricidae | Thais lacerus | 2(1) | 1(1) | √ | |||||||||
| T.gradata | 1(1) | √ | |||||||||||
| Columbellidae | Euplica versicolor | 1(1) | |||||||||||
| Cancellariidae | Trigonostoma scalariformis | 1(1) | 1(1) | ||||||||||
| Cancellariidae sp. | 1(1) | ||||||||||||
| Turridae | Guraleus deshayesii | 1(1) | √ | ||||||||||
| Nassariidae | Nassarius javanus | 1(1) | √ | ||||||||||
| N.festivus | 2(1) | √ | |||||||||||
| Archaeogastropoda | Calliostomatidae | Calliostoma unicum | 1(1) | 2(1) | 1(1) | 2(1) | 1(1) | ||||||
| Turbinidae | Turbo Bruneus | 1(1) | |||||||||||
| Trochidae | Umbonium vestiarium | 6(1) | |||||||||||
| Mesogastropoda | Cerithiidae | Cerithium sp. | 3(1) | ||||||||||
| Capulidae | Capulus dilatatus | 1(1) | |||||||||||
| Turritellidae | Turritella bacillum | 7(3) | 5(1) | 22(3) | 13(3) | 6(3) | √ | ||||||
| Bivalvia | Myoida | Gastrochaenacea | Eufistulana grandis | 1(1) | |||||||||
| Corbulidae | Anisocorbula pallida | 2(2) | 1(1) | 1(1) | √ | ||||||||
| A.crassa | 2(1) | √ | |||||||||||
| Solidicorbula erythrodon | 26(7) | 3(3) | 1(1) | 1(1) | 17(8) | 9(3) | 1(1) | √ | |||||
| Arcoida | Arcidae | Anadara crebricostata | 1(1) | √ | |||||||||
| A.crathrata | 1(1) | 1(1) | √ | ||||||||||
| Anadara consociata | 2(1) | √ | |||||||||||
| Arca navicularis | 1(1) | 8(3) | 1(1) | √ | |||||||||
| Scapharca binakaganensis | 2(2) | √ | |||||||||||
| S.cornea | 5(3) | 1(1) | 24(3) | 2(2) | 1(1) | √ | |||||||
| S.inaequivalvis | 1(1) | √ | |||||||||||
| S.kagoshimensis | 1(1) | 22(2) | 1(1) | 2(2) | √ | ||||||||
| Barbatia obliquata | 1(1) | 1(1) | √ | ||||||||||
| Trisdos semitorta | 1(1) | √ | |||||||||||
| Glycymerididae | Glycymeris vestita | 2(2) | √ | ||||||||||
| Cucullaeidae | Cucullara labiosa granulosa | 1(1) | |||||||||||
| Nuculoida | Nuculanidae | Saccella cuspidata | 1(1) | 1(1) | |||||||||
| Veterodonta | Mactridae | Meropesta nicobarica | 1(1) | √ | |||||||||
| Mactra sp. | 5(2) | 2(2) | √ | ||||||||||
| Mactra alta | 4(1) | √ | |||||||||||
| M.aphrodina | 1(1) | √ | |||||||||||
| Coelomactra cumingii | 1(1) | √ | |||||||||||
| Lutraria arcuata | 1(1) | 1(1) | √ | ||||||||||
| Mactridae sp. | 4(1) | √ | |||||||||||
| Veneridae | Paphia (Protapes) gallus | 1(1) | 1(1) | 3(2) | √ | ||||||||
| P.(Noetapes) undulata | 1(1) | √ | |||||||||||
| Paphia sp. | 1(1) | √ | |||||||||||
| Timoclea scabra | 1(1) | 40(8) | √ | ||||||||||
| Antigona lamellaris | 3(3) | 1(1) | 1(1) | √ | |||||||||
| Lioconcha ornata | 1(1) | ||||||||||||
| Ruditapes philippinarum | 545(2) | 21(1) | 3(1) | 1(1) | √ | ||||||||
| Dosinia (Phacosoma) exasperata | 1(1) | 1(1) | √ | ||||||||||
| Cyclosunetta concinna | 1(1) | ||||||||||||
| Cryptonema producta | 238(2) | √ | |||||||||||
| Dosinia sp. | 1(1) | 1(1) | √ | ||||||||||
| Dosinia (Phacosoma) japomnica | 1(1) | 1(1) | 5(3) | 1(1) | √ | ||||||||
| D. (Phacosoma) biscocta | 13(4) | 1(1) | |||||||||||
| D. (Phacosoma) corrugata | 1(1) | 1(1) | √ | ||||||||||
| D. (Bonarternis) histrio | 7(3) | 34(8) | 12(5) | 13(5) | √ | ||||||||
| D. (Phacosoma) troschelli | 2(2) | 1(1) | 1(1) | 1(1) | √ | ||||||||
| Circe scripta | 3(2) | 1(1) | 2(1) | √ | |||||||||
| Circe personata | 1(1) | √ | |||||||||||
| C.tumfacata | 1(1) | 1(1) | 2(1) | √ | |||||||||
| Circe sp. | 1(1) | 5(4) | 1(1) | 1(1) | √ | ||||||||
| Meretrix lyrata | 1(1) | 1(1) | √ | ||||||||||
| M.lusoria | 1(1) | 1(1) | √ | ||||||||||
| Clausinella foliacea | √ | ||||||||||||
| Tapes sp. | 1(1) | √ | |||||||||||
| Veneridae sp. | 1(1) | √ | |||||||||||
| Lucinidae | Pillucina vietnamica | 42(2) | √ | ||||||||||
| Cardiidae | Fulvia aperta | 1(1) | √ | ||||||||||
| Trachycardium arenicolum | 1(1) | √ | |||||||||||
| Vepricardium asiaticum | 3(2) | √ | |||||||||||
| Fragum bannoi | 1(1) | √ | |||||||||||
| Tellinidae | Cycladiacama ethima | 1(1) | √ | ||||||||||
| Cycladiacama sp.1 | 9(6) | 2(1) | 6(5) | √ | |||||||||
| Cycladiacama sp.2 | 3(2) | 8(4) | 25(8) | 5(1) | √ | ||||||||
| C.amboinensis | 1(1) | 17(3) | 2(2) | √ | |||||||||
| C.oblonga | 1(1) | √ | |||||||||||
| C.cumingii | 1(1) | 1(1) | √ | ||||||||||
| Ungulinidae sp. | 1(1) | 6(4) | 3(1) | 7(4) | |||||||||
| Tellinidae | Pulvinus micans | 1(1) | |||||||||||
| Tellinides chinensis | 1(1) | √ | |||||||||||
| Hanleyanus vestalis | 1(1) | 1(1) | √ | ||||||||||
| Jitlada sp. | 1(1) | ||||||||||||
| Angulus emaringinatus | 1(1) | 2(1) | 1(1) | 1(1) | 2(2) | 1(1) | √ | ||||||
| Nitidotellina pallidula | 1(1) | √ | |||||||||||
| Psammacoma flallax | 1(1) | √ | |||||||||||
| Tellinidae sp. | 1(1) | ||||||||||||
| Semelangulus miyatensis | 1(1) | 1(1) | |||||||||||
| Cadella semen | 1(1) | 4(3) | 13(7) | 7(3) | 3(3) | ||||||||
| Cadella nucleolus | 1(1) | 1(1) | |||||||||||
| Leporimetis coarctata | 2(2) | 1(1) | |||||||||||
| Solenidae | Solen grandis | 1(1) | 3(3) | 3(3) | 1(1) | 2(2) | √ | ||||||
| S.sloanii Hanley | 1(1) | √ | |||||||||||
| S.dunkerianus | 3(2) | 1(1) | √ | ||||||||||
| Mytiloida | Pinnidae | Atrina (Servatrina) pectinata | 1(1) | √ | |||||||||
| Mytilidae | Modiolus (Modiolus) metcalfei | 12(1) | √ | ||||||||||
| M.flavidus | 2(1) | √ | |||||||||||
| Pteriina | Plicatulidae | P.imbricata | 2(1) | ||||||||||
| P.simplex | 3(2) | 1(1) | 2(1) | ||||||||||
| Pteriidae | Pinctada chemnitzi | 2(2) | √ | ||||||||||
| P.fucata martensii | 1(1) | √ | |||||||||||
| Ostreidae | Crassostrea sikamea | 7(1) | √ | ||||||||||
| Talonostrea talonata | 1(1) | √ | |||||||||||
| Note:the numbers in brackets in the table represent the number of stations where the species occurs in the sea area. | |||||||||||||
根据公式(5)计算优势度,北海4个海区潮下带底栖贝类优势种见表 3。结果表明,春、秋两季4个海区的优势种差异大,只有廉州湾海区的棒锥螺(Turritella bacillum)和侨港海区中的红齿硬篮蛤(Solidicorbula erythrodon)在春、秋两季都是优势种。
| 季节 Season |
海区 Sea area |
优势种 Dominant species |
优势度 Dominance index (Y) |
| Spring | Lianzhou Bay | Turritella bacillum | 0.146 |
| Qiaogang | Solidicorbula erythrodon | 0.126 | |
| Cycladiacama sp. | 0.038 | ||
| Bailong | Dosinia (Bonarternis) histrio | 0.185 | |
| Cycladiacama amboinensis | 0.035 | ||
| Yingpan | Ruditapes philippinarum | 0.075 | |
| Autumn | Lianzhou Bay | Scapharca kagoshimensis | 0.025 |
| Turritella bacillum | 0.022 | ||
| Qiaogang | Timoclea scabra | 0.113 | |
| Solidicorbula erythrodon | 0.048 | ||
| Cadella semen | 0.032 | ||
| Bailong | Cryptonema producta | 0.069 | |
| Cycladiacama sp. | 0.029 | ||
| Yingpan | Ungulinidae sp. | 0.053 |
2.2 栖息密度与生物量
北海4个海区潮下带底栖贝类栖息密度与生物量见表 4。春季平均栖息密度最高的是营盘海区,达到27.35个/m2;平均栖息密度最低的是廉州湾海区,只有1.00个/m2。秋季平均栖息密度最高为白龙海区,达到23.59个/m2;平均栖息密度最低的是营盘海区,平均栖息密度为1.71个/m2。
| 季节 Season |
海区 Sea area |
站位数 Survey station number |
种类数 Species number |
个体数/个 Individual number/ind. |
平均栖息密度/(个/m2) Mean habitat density/(ind./m2) |
平均生物量/(g/m2) Mean biomass/(g/m2) |
| Spring | Lianzhou bay | 12 | 6 | 12 | 1.00 | 5.06 |
| Qiaogang | 18 | 27 | 80 | 4.44 | 44.73 | |
| Bailong | 14 | 29 | 105 | 7.50 | 104.48 | |
| Yingpan | 23 | 20 | 629 | 27.35 | 33.43 | |
| Autumn | Lianzhou bay | 20 | 24 | 89 | 4.45 | 20.79 |
| Qiaogang | 19 | 39 | 149 | 7.79 | 34.18 | |
| Bailong | 17 | 35 | 402 | 23.59 | 92.36 | |
| Yingpan | 17 | 18 | 31 | 1.71 | 1.84 |
春季平均生物量最高的出现在白龙海区,达到了104.48 g/m2,平均生物量最低的出现在廉州湾海区,为5.06 g/m2。秋季,平均生物量最高的也出现在白龙海区,达到了92.36 g/m2。而营盘海区的平均生物量最低,只有1.84 g/m2。
结果表明,春季和秋季对比,营盘海区的底栖贝类平均栖息密度和平均生物量差异很大。
2.3 贝类生物多样性通过公式(1)-(4)计算得到的北海4个海区各项生物多样性指数见表 5。
| 季节 Season |
海区 Sea area |
香农-威纳生物多样性指数 Shannon-Wiener biodiversity index (H′) |
波络均匀度指数 Pielou evenness index (J) |
马格列夫丰富度指数 Margalef diversity index (d) |
物种多样性阈值 Species diversity threshold (Dv) |
| Spring | Lianzhou Bay | 1.947 | 0.753 | 1.395 | 1.467 |
| Qiaogang | 3.733 | 0.785 | 4.113 | 2.931 | |
| Bailong | 3.713 | 0.764 | 4.170 | 2.838 | |
| Yingpan | 0.980 | 0.227 | 2.044 | 0.222 | |
| Antumn | Lianzhou Bay | 3.432 | 0.749 | 3.552 | 2.570 |
| Qiaogang | 4.097 | 0.775 | 5.264 | 3.176 | |
| Bailong | 2.595 | 0.506 | 3.930 | 1.313 | |
| Yingpan | 3.728 | 0.894 | 3.431 | 3.333 |
春季,廉州湾海区和营盘海区各项生物多样性指数稍低,营盘海区的H′、J、d和Dv分别为0.980、0.227、2.044和0.222,表明营盘海区春季底栖贝类生物多样性差,贝类群落结构处于重度受干扰状态。其他2个海区的各项生物多样性指数都比较高。秋季,北海4个海区潮下带底栖贝类各项生物多样性指数较高,底栖贝类生物多样性较丰富,底栖贝类群落结构秋季总体处于比较健康的状态。
3 讨论 3.1 北海海域潮下带底栖贝类群落现状根据李楚璞等[22]对贝类种类性质的划分,北海海域潮下带底栖贝类除了波纹巴非蛤(Paphia undulata)、薄片镜蛤(Dosinia corrugata)、日本镜蛤(D. japomnica)和大竹蛏等少数种类属于广温性种类外,其余大部分种类属于热带或者热带-亚热带性种类。关于北海海域潮下带底栖贝类群落特征至今未见报道,全国其他海域潮下带底栖贝类群落特征也鲜见报道。Bai等[23]报道了海南分界洲岛潮下带的底栖贝类,其中腹足纲占多数,并且均属于和珊瑚礁有密切关系的热带种或亚热带种。本次调查北海海域的底栖贝类种类,双壳纲占多数,这可能是因为调查的北海海域潮下带属于砂泥质或泥砂质底质,生存的底栖贝类主要是埋栖型的双壳贝类,这与谢恩义等[24]报道的同样位于北部湾海域的广东流沙湾贝类分布情况相类似。
从群落结构来看,除了廉州湾海区和营盘海区秋季外,北海其他海区春、秋两季潮下带底栖贝类的生物多样性及群落结构处于比较健康的状态。由本调查数据可知,种群数量比较大的有毛蚶属(Scapharca sp.)的一些种类、红齿硬篮蛤(Solidicorbula erythrodon)、菲律宾蛤仔、突畸心蛤(Cryptonema producta)等这些小型低值贝类。而个体较大的獭蛤、钝缀锦蛤、大竹蛏、江珧等大型高值贝类则比较少见。对于捕捞产业,高值大型贝类的减少会直接造成产量的下降,这给人造成一种贝类资源在衰退的假象。但是,这种由于过度捕捞造成的少数种类衰退的现象,并不代表北海海域底栖贝类整体都在衰退。只要合理安排捕捞作业,并进行人工增殖放流等措施,个别种类资源衰退的情况是可以恢复的。
3.2 北海海域潮下带底栖贝类的经济利用目前,北海海域潮下带底栖贝类进行养殖和采捕的主要有江珧、獭蛤、钝缀锦蛤、大竹蛏、巴非蛤等个体较大、价值较高的种类[2]。养殖产业早期的模式是把一片海域加以管护,依靠天然苗种自然增殖,然后采捕。近几年,随着贝类人工苗种繁育的开展,潮下带底栖贝类养殖产业从原来的天然捕捞、天然半成品养殖逐渐发展到现在的全人工养殖,并且产业链也在逐渐形成中[2-4]。从表 2可以看到,北海海域潮下带底栖贝类还有不少的经济种类,比如蚶科(Arcidae)、蛤蜊科(Mactridae)、帘蛤科(Veneridae)、鸟蛤科(Cardiidae)和樱蛤科(Tellinidae)中的大多数种类都具有经济价值。然而,由于潮下带底栖贝类的采捕需要潜水作业或者采用大马力的拖耙船作业,采捕成本较高。而上述的大多数底栖贝类经济种类分布密度不大,产量有限,并且它们的价格较低,用上述方法采捕难以得到好的经济效益,因此几乎没有得到利用。
从本研究结果出现的种类看,比较具有开发利用价值的种类是菲律宾蛤仔。菲律宾蛤仔适合高密度养殖,养殖密度一般为500-1 500个/m2[25],且人工育苗技术已经成熟[26]。近几年,高效率采捕菲律宾蛤仔的机械装备也被研发出来[27],这对菲律宾蛤仔大规模养殖、降低其采捕成本有着重要的意义。北海海域潮下带某些区域非常适合菲律宾蛤仔生长,例如本次调查中位于营盘海域的021站位,其春季菲律宾蛤仔栖息密度达到545个/m2。综上,北海海域潮下带高密度菲律宾蛤仔养殖具有很好的发展前景。
3.3 北海海域潮下带贝类资源保护和开发建议本研究发现,北海海域潮下带贝类资源丰富,经济种类多。但对于高价值贝类品种的开发力度过大,导致这些种类在本调查中出现较少,对这些种类的种质资源保护亟待加强。另外,对于其他开发潜力较大的种类,应加大开发力度。鉴于此,提出以下几点建议:①对一些采捕强度过大的高值贝类种类,建立种质资源库,加强种质资源保护。②依靠科技力量,加强底栖贝类的基础研究,尤其是开展底栖贝类适养区和养殖容量的研究,指导养殖户开展合理有序的养殖、开发。③加强养殖海域管理,明确海域使用权,组织养殖户开展有序生产。④加强贝类人工育苗研发,稳定生产和供应优质的贝类苗种,保证贝类养殖开发的可持续发展。
4 结论通过春、秋两季的采样调查,北海海域4个海区潮下带底栖贝类有2纲9目31科60属102种,其中腹足纲13科14属17种,双壳纲18科46属85种。主要种类为埋栖型的小型低值双壳贝类。除了秋季廉州湾海区和营盘海区秋季外,其他海区底栖贝类的群落结构和生物多样性在春、秋两季处于较健康状态。
| [1] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023.
|
| [2] |
陈瑞芳, 董兰芳, 许明珠. 广西特色海水养殖品种发展现状与展望[J]. 广西科学院学报, 2020, 36(3): 237-241. |
| [3] |
聂振平, 彭慧婧, 邹杰, 等. 钝缀锦蛤选育群体F2生长性状相关性及遗传力分析[J]. 广西科学, 2020, 27(3): 241-247. |
| [4] |
邹杰, 张守都, 彭慧婧, 等. 施氏獭蛤早期生长性状遗传参数和育种值估计[J]. 海洋科学, 2021, 45(2): 99-105. |
| [5] |
陈瑞芳, 刘海娟, 董兰芳, 等. 织锦巴非蛤海区悬挂养殖新模式[J]. 中国水产, 2022(7): 87-88. |
| [6] |
潘英, 李坚明, 黄伟德. 广西贝类养殖现状及产业发展策略建议[J]. 海洋科学, 2015, 39(11): 132-137. |
| [7] |
广西生态养殖水产品占比近七成[J]. 渔业致富指南, 2018(6): 5-6.
|
| [8] |
卢振彬, 杜琦, 许翠娅, 等. 福建泉州湾贝类养殖容量评估[J]. 热带海洋学报, 2005, 24(4): 22-29. |
| [9] |
卢振彬, 杜琦, 钱小明, 等. 福建诏安湾贝类养殖容量的研究[J]. 南方水产, 2005, 1(5): 1-9. |
| [10] |
卢振彬, 杜琦, 蔡清海, 等. 福建湄洲湾贝类养殖容量的估算[J]. 江西水产科技, 2006(2): 33-40. |
| [11] |
卢振彬, 杜琦, 钱小明, 等. 福建围头湾贝类的养殖容量[J]. 南方水产, 2006, 2(6): 31-38. |
| [12] |
尹晖, 孙耀, 徐林梅, 等. 乳山湾滩涂贝类养殖容量的估算[J]. 水产学报, 2007, 31(5): 669-674. |
| [13] |
袁秀珍. 北海涠洲岛潮间带底栖贝类调查[J]. 生物学通报, 1998, 33(6): 11-13. |
| [14] |
阮桂文. 广西北海市海滨多板纲、双壳纲和腹足纲种类的初步研究[J]. 玉林师范学院学报, 2003, 24(3): 73-78. |
| [15] |
李永强. 北部湾(广西段)潮间带大型底栖动物的调查研究[D]. 青岛: 青岛理工大学, 2011.
|
| [16] |
谢文海, 谢积慧, 阮桂文, 等. 广西北海不同生境海岸贝类群落调查[J]. 玉林师范学院学报, 2013, 34(2): 69-77. |
| [17] |
黄雯, 温铮, 胡利莎, 等. 北部湾涠洲岛珊瑚礁底栖贝类的群落特征[J]. 海洋学报, 2020, 42(6): 62-69. |
| [18] |
张素萍. 中国海洋贝类图鉴[M]. 北京: 海洋出版社, 2008.
|
| [19] |
王海艳, 张涛, 马培振, 等. 中国北部湾潮间带现生贝类图鉴[M]. 北京: 科学出版社, 2016.
|
| [20] |
李永祺, 丁美丽. 海洋污染生物学[M]. 北京: 海洋出版社, 1991.
|
| [21] |
尹天齐, 王庆, 杨宇峰, 等. 基于形态学和DNA分子鉴定的珠江口浮游动物群落结构比较研究[J]. 热带海洋学报, 2022, 41(3): 172-185. |
| [22] |
李楚璞, 沈寿彭, 李映萍. 南海东北部海区软体动物的分布及区系特点[J]. 热带海洋, 1986, 5(1): 20-27. |
| [23] |
BAI L R, ZHAO Z Y, LIU Q M, et al. Investigation on shellfish species living in the intertidal zone to subtidal zone of Fenjiezhou island of Hainan[J]. Agricultural Science & Technology, 2016, 17(5): 1204-1210. |
| [24] |
谢恩义, 陈秀丽, 朱小江, 等. 流沙湾贝类资源调查[J]. 广东海洋大学学报, 2010, 30(3): 39-46. |
| [25] |
潘渊博, 孙秀俊, 郭贺, 等. 围隔生境下养殖密度对菲律宾蛤仔生长的影响[J]. 中国海洋大学学报(自然科学版), 2023, 53(1): 53-65. |
| [26] |
陈志, 陈启春, 黄健, 等. 福建沿海菲律宾蛤仔工厂化人工育苗技术[J]. 福建农业科技, 2019(7): 25-28. |
| [27] |
郝玉孝. 滩涂菲律宾蛤仔振动采捕设备设计与仿真分析[D]. 大连: 大连海洋大学, 2019.
|



