2. 广西海洋科学院(广西红树林研究中心),广西红树林保护与利用重点实验室,广西北海 536000;
3. 南宁市蛭澳生物科技有限公司,广西南宁 530004
2. Guangxi Key Laboratory of Mangrove Conservation and Utilization, Guangxi Academy of Marine Sciences (Guangxi Mangrove Research Center), Beihai, Guangxi, 536000, China;
3. Nanning Zhi'ao Biotechnology Co., Ltd., Nanning, Guangxi, 530004, China
獭蛤属(Lutraria)的弓獭蛤(L.arcuata)、大獭蛤(L.maxima)和施氏獭蛤(L.sieboldii)形态相似,民间统称象鼻螺,属瓣鳃纲(Lamellibranchia)异齿亚纲(Heterodonta)帘蛤目(Veneroida)蛤蜊总科(Mactracea)蛤蜊科(Mactridae),广泛分布于我国南方及东南海域,尤其在北部湾海域分布丰富[1-3]。象鼻螺是重要的经济养殖品种,其生长速度快,养殖周期短,市场需求量大,市场售价高达100-150元/kg,据相关统计,2020年广西北海市象鼻螺产量达7.6万吨[4]。国内对大獭蛤和施氏獭蛤的生理生态、胚胎发育以及人工育苗、遗传多样性等方面的研究较多[5-7],而对北部湾目前主要养殖的弓獭蛤研究较少。弓獭蛤斧足发达,运动能力强,有在沙质中钻穴的习性,多生长于潮下带至水下30 m处的沙质海底,距离人类活动海岸较近,易暴露在海洋污染物中。双壳贝类营滤食性,在进食时会将水体中的重金属污染物吸附至体内并富集。由于贝类自身用于代谢的混合氧化酶系统存在缺陷,导致其对污染物的代谢排放能力比其他水产类动物弱,体内的重金属富集浓度持续处于高水平状态[8-10]。但是,即便体内重金属含量高,双壳贝类成贝并不表现出明显的组织畸变现象,因此极易造成重金属超标的食品安全风险[10]。
镉(Cd)在自然环境中含量低但广泛存在[11]。开采含Cd的Zn、Cu矿会引起Cd及其化合物的迁移与泛滥,导致水源污染,严重损害人和动物的健康,甚至引起重大中毒事件[12-14]。世界卫生组织将Cd确定为优先研究的食品污染物之一;1984年联合国环境规划署提出的12种具有全球性意义的危险化学物质中,Cd排在首位;Cd被美国农业委员会认为是当前最主要的农业环境污染物[15]。Cd对人体肾脏、免疫系统、生殖系统等各方面具有毒性与致病性[16-18]。林功师[19]调查厦门常见贝类的重金属Cd含量发现,120份贝类样品的Cd检出率为100%。Borchardt等[20]研究发现,双壳贝类对Cd具有强大的富集能力,贻贝的Cd富集系数可以达到4 700倍左右,远高于对人体危害较大的其他重金属如As、Cr、Pb、Hg等,引发一定的食用风险,因此学者们开展了一系列研究。目前双壳贝类在重金属Cd胁迫下的研究主要集中在富集动力学[21]、急性毒性[22, 23]以及免疫反应调控[24, 25]等方面。研究发现Cd胁迫后双壳贝类如泥蚶(Tegillarca granosa)、钝缀锦蛤(Tapes dorsatus)、四角蛤蜊(Mactra veneriformis)的内脏团中与氧化代谢相关的超氧化物歧化酶(SOD)、三磷酸腺苷酶、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)和丙二醛(MDA)均随着胁迫时间增加而增加,达到峰值后呈下降趋势[26-28]。但是,关于Cd胁迫下獭蛤属贝类的生理影响研究尚未见报道。弓獭蛤是北部湾重要的经济贝类,弓獭蛤对海水中重金属的富集系数、Cd胁迫下弓獭蛤的组织富集效应以及生理指标的变化对养殖生产和民生食用安全有着重要的意义。本研究采用实验生态学的方法,评价北海3处近海海域弓獭蛤的污染指数,计算弓獭蛤对7种重金属的富集能力,同时对暴露于Cd胁迫下的弓獭蛤进行组织-时间-剂量效应、生理指标的研究,以期为北部湾经济贝类的生态毒理学研究提供基础资料,并对弓獭蛤的安全食用提出建议。
1 材料与方法 1.1 弓獭蛤重金属污染评价和富集系数测算 1.1.1 样品采集2020年9月于北海沿岸侨港镇、白龙村和营盘镇3处海域选取12个站点采集海水水样,侨港镇站点编号为QG1-QG4,白龙村站点编号为BL1- BL4,营盘镇站点编号为YP1-YP4 (图 1)。按照《海洋监测规范:第3部分样品采集、贮存与运输》(GB 17378.3-2007)进行水样采集、贮存,并将其带回实验室进行分析。同时,于侨港镇、白龙村和营盘镇(采样站点编号分别为QG、BL、YP)的3处养殖基地各采集弓獭蛤成体样本350个,其中50个用来检测重金属含量,300个用于Cd胁迫实验。样品平均壳长为(90.15±14.72) mm,壳宽为(26.18±6.31)mm,壳高为(43.63±5.31) mm,湿重为(100.28±33.64) g。
|
| 图 1 采样站点 Fig.1 Sampling site |
1.1.2 7种重金属含量的测定
(1) 海水样品:水样处理方法参照《海洋监测规范:第4部分海水分析》(GB 17378.4-2007)。使用PinAAcle 900T型原子吸收光谱仪(美国珀金埃尔默仪器公司),采用火焰原子吸收分光光度法(Zn、Pb和Cu)与无火焰原子吸收分光光度法(Cd和Cr)测定重金属的含量。使用SK-2003AZ型原子荧光光谱仪(北京金索坤技术开发有限公司),采用原子荧光法测定重金属As与Hg的含量。
(2) 弓獭蛤体内:贝类样品制备和软组织中的重金属含量的测定参照《海洋监测规范:第6部分生物体分析》(GB 17378.6-2007),其中Pb和Zn采用火焰原子吸收分光光度法测定;Cu、Cd和Cr采用无火焰原子吸收分光光度法,用PinAAcle 900T型原子吸收光谱仪进行上机检测;Hg和As使用原子荧光仪采用原子荧光法测定。每组实验设置空白对照和3个平行样,所有测定都以生物样品湿重计算。
1.1.3 弓獭蛤的重金属污染评价方法弓獭蛤的重金属污染评价参考Guo等[29]的方法使用单因子指数法,计算公式如下:
| $ P_i=C_i / C_{s i}, $ |
式中,Pi为第i种污染物的生物质量指数;Ci 为第i种污染物的实测值(湿重);Csi 为第i种污染物的标准值(湿重)。Pb、Cd、Hg、As、Cr评价标准参照《食品安全国家标准食品中污染物限量》(GB 2762-2017), Cu评价标准参照《无公害食品水产品中有毒有害物质限量》(NY 5073-2006)。我国目前对水产品中Zn含量无明确限量规定,Zn评价标准参照澳大利亚食品标准法规,限量值为1 000 mg/kg(湿重)[30]。采用林功师[19]、隋茜茜等[31]、刘立婷等[32]推荐的重金属污染标准方法进行评价,即Pi<0.2时为正常背景值水平,0.2≤Pi<0.6为轻度污染水平,0.6≤Pi<1为中度污染水平,Pi≥1为重度污染水平。
1.1.4 弓獭蛤的重金属富集系数滤食性贝类通常以重金属富集系数(BCF)来计算贝类从水体中富集重金属的能力。本研究参照李学鹏等[33]使用生物富集双箱动力学模型所推导出的公式计算:
| $ \mathrm{BCF}=\lim C_a / C_w(t \rightarrow \infty), $ |
式中,Ca为所测样品的重金属含量(mg/kg),Cw为样品生存环境中的重金属浓度(mg/L),t为样品实验时间。
1.2 Cd胁迫对弓獭蛤生理的影响 1.2.1 胁迫实验及取样参照《渔业水质标准》(GB 11607-89)中养殖水质Cd限量的0、5、10、30、60倍设置胁迫实验,共5个Cd胁迫浓度:0(对照组)、0.025、0.050、0.150、0.300 mg/L。准备5组独立的实验海水缸,容积皆为(485±20) L。实验前在容器中放入配置好的、含不同浓度Cd的海水浸泡容器2 d,使得容器壁对Cd的吸附达到饱和状态,避免实验过程中容器吸附重金属对实验产生的影响。另外,将养殖基地的弓獭蛤样品在过滤海水中暂养2 d,暂养条件为温度(24±2) ℃,海水盐度30‰,pH值为7.90±0.08,自然光照12 h/d。
暂养结束后进行胁迫实验。每个胁迫浓度的海水缸中放置弓獭蛤60个,实验期间每天定时投喂叉鞭金藻(Dicrateria sp.),投喂时维持藻浓度为1 000-3 000个/L。每个实验海水缸带独立底滤系统,实验期间海水流动循环,避免换水,每天测定水体Cd浓度并及时补充以维持胁迫浓度。为避免重金属污染环境,实验过程中产生的重金属污染废水用EDTA处理后排出。
取样时间为实验的第0、1、4、7、15天,每种胁迫浓度一次取9只弓獭蛤,每3只混合为一个样品进行后续实验,3个生物学重复。实验期间观察并记录弓獭蛤的健康状态和死亡情况。
1.2.2 弓獭蛤组织的Cd含量测定獭蛤属的可食用部位可分为内脏团(肝胰腺)、虹吸管和斧足肌肉,解剖胁迫实验后的弓獭蛤样品,使用无火焰原子吸收分光光度法测定上述组织中的Cd含量,测定方法同1.1.2节第2点所述。实验设置3次技术重复。
1.2.3 弓獭蛤4种生理指标的测定SOD、GPx、CAT 3种酶的活力测定及MDA、总蛋白含量(BCA法)的测定所使用试剂盒均购置于苏州格锐思生物科技有限公司,于Synergy HTX多功能酶标仪(美国伯腾仪器有限公司)上机测定。实验均设置3次技术重复以及阴性对照。
1.3 数据处理实验所用数据经GraphPad Prism 8处理后进行多重组间水平分析并作图,采用SPSS 24.0分析显著性水平。
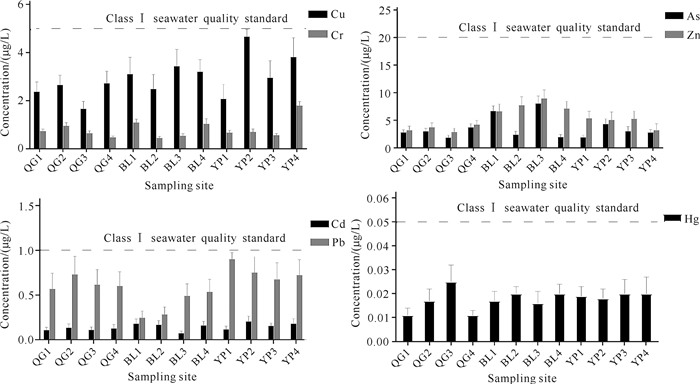
2 结果与分析 2.1 监测站点样品的重金属含量与污染评价 2.1.1 海水的重金属含量如图 2所示,12个站点7种重金属的含量都未超过《海水水质标准》(GB 3097-1997)中的一类海水标准的阈值线,营盘镇海域的Cu、Pb含量接近一类海水标准线。采样区海域海水重金属含量特征值的详细情况如表 1所示。根据标准中海水水质分类,第一类海水适用于海洋渔业水域,第二类海水适用于水产养殖区,本研究监测的3处海域的水质(重金属含量)均适合底播贝类养殖。
|
| 图 2 各采样点海水中的重金属浓度 Fig.2 Concentration of heavy metals in seawater of each sampling site |
| 重金属 Heavy metal |
含量/(μg/L) Content/(μg/L) |
平均含量/(μg/L) Average content/(μg/L) |
变异系数/(%) Coefficient of variation/(%) |
一类海水标准/(μg/L) Limit value/(μg/L) |
||
| 侨港镇 Qiaogang Town |
白龙村 Bailong Village |
营盘镇 Yinpan Town |
||||
| Hg | 0.016±0.007 | 0.018±0.002 | 0.019±0.001 | 0.018±0.004 | 22.20 | ≤0.05 |
| As | 2.871±0.761 | 4.791±3.049 | 3.033±0.997 | 3.565±1.947 | 54.61 | ≤20 |
| Zn | 3.518±0.578 | 7.610±0.996 | 4.750±0.995 | 5.293±1.959 | 37.01 | ≤20 |
| Cd | 0.121±0.014 | 0.139±0.057 | 0.165±0.038 | 0.142±0.039 | 27.55 | ≤1.0 |
| Pb | 0.630±0.070 | 0.390±0.144 | 0.767±0.118 | 0.580±0.191 | 32.93 | ≤1.0 |
| Cu | 2.360±0.484 | 3.063±0.406 | 3.383±1.114 | 2.935±0.804 | 27.39 | ≤5 |
| Cr | 0.710±0.198 | 0.787±0.330 | 0.938±0.576 | 0.812±0.375 | 46.24 | ≤5 |
2.1.2 弓獭蛤组织的重金属含量和污染评价
侨港镇、白龙村和营盘镇3个养殖站点的弓獭蛤体内7种重金属含量如表 2所示。各站点的弓獭蛤体内Hg、As、Zn、Cd、Pb和Cr含量的变异系数分别是32.73%、19.96%、8.73%、26.47%、51.23%和49.09%,体现出一定的站位差异;各站位样品中Cu的含量均低于仪器可检出的阈值(2.0 mg/kg)。
| 重金属 Heavy metal |
含量/(mg/kg) Content/(mg/kg) |
平均含量/(mg/kg) Average content/(mg/kg) |
变异系数/(%) Coefficient of variation/(%) |
限定标准/(mg/kg) Limit value/(mg/kg) |
平均Pi Average Pi |
||
| 侨港镇 Qiaogang Town |
白龙村 Bailong Village |
营盘镇 Yinpan Town |
|||||
| Hg | 0.005 0±0.000 2 | 0.006 0±0.000 3 | 0.003 0±0.000 1 | 0.005 0±0.001 0 | 32.73 | ≤0.5 | 0.009±0.002 |
| As | 0.282±0.026 | 0.206±0.021 | 0.200±0.035 | 0.229±0.045 | 19.96 | ≤0.5 | 0.459±0.090 |
| Zn | 6.136±0.426 | 6.279±0.321 | 7.188±0.336 | 6.534±0.570 | 8.73 | ≤1 000 | 0.007±0.001 |
| Cd | 0.731±0.075 | 0.629±0.026 | 1.035±0.094 | 0.798±0.211 | 26.47 | ≤2.0 | 0.399±0.106 |
| Pb | 0.087±0.001 | 0.127±0.002 | 0.040±0.001 | 0.085±0.043 | 51.23 | ≤1.5 | 0.056±0.029 |
| Cu | Null | Null | Null | Null | Null | ≤50 | Null |
| Cr | 0.073±0.001 | 0.222±0.006 | 0.164±0.004 | 0.153±0.075 | 49.09 | ≤2.0 | 0.077±0.038 |
| Note: "Null" means the content is below the threshold that the instrument can detect. | |||||||
整体来看,弓獭蛤样品的Cr、Pb、Zn和Hg的平均Pi均低于0.1,属于正常背景值,排名靠前的是As和Cd。3个站位的弓獭蛤可食用部分的Cd平均含量为(0.798±0.211) mg/kg,平均Pi为0.399±0.106,按照《食品安全国家标准食品中污染物限量》(GB 2762-2017),弓獭蛤可食用部分的Cd污染程度属于轻度污染水平。而12个站位海水样品中Cd的平均含量仅为一类海水标准的14.2%(表 1),说明弓獭蛤从环境中富集Cd的能力很强。12个站位海水样品中As的平均含量为一类海水标准的17.8%(表 1),但是弓獭蛤可食用部分中As的平均Pi为0.459±0.090,在7种重金属中排第1,处于轻度污染水平。
2.1.3 弓獭蛤的重金属富集能力通过计算重金属的富集系数(BCF)发现,弓獭蛤对各重金属富集能力差异较大,各站位前3名分别为Cd、Zn和Hg,其中Cd的富集系数均大于5 000 (图 3),因组织样品中未检测到Cu的含量,图 3中只展示了6种重金属的富集系数。

|
| 图 3 采样站点弓獭蛤的重金属富集系数 Fig.3 Bioconcentration factors of each heavy metal of L.arcuata at different sampling site |
2.2 Cd胁迫后弓獭蛤组织中Cd含量的变化
15 d的Cd胁迫实验过程中,0.050 mg/L Cd的海水缸中弓獭蛤于7 d死亡2只,0.150 mg/L Cd的海水缸中弓獭蛤于13 d死亡1只,累计死亡率1%,其余实验贝肉眼观察状态良好,钻沙、摄食、排泄均正常。
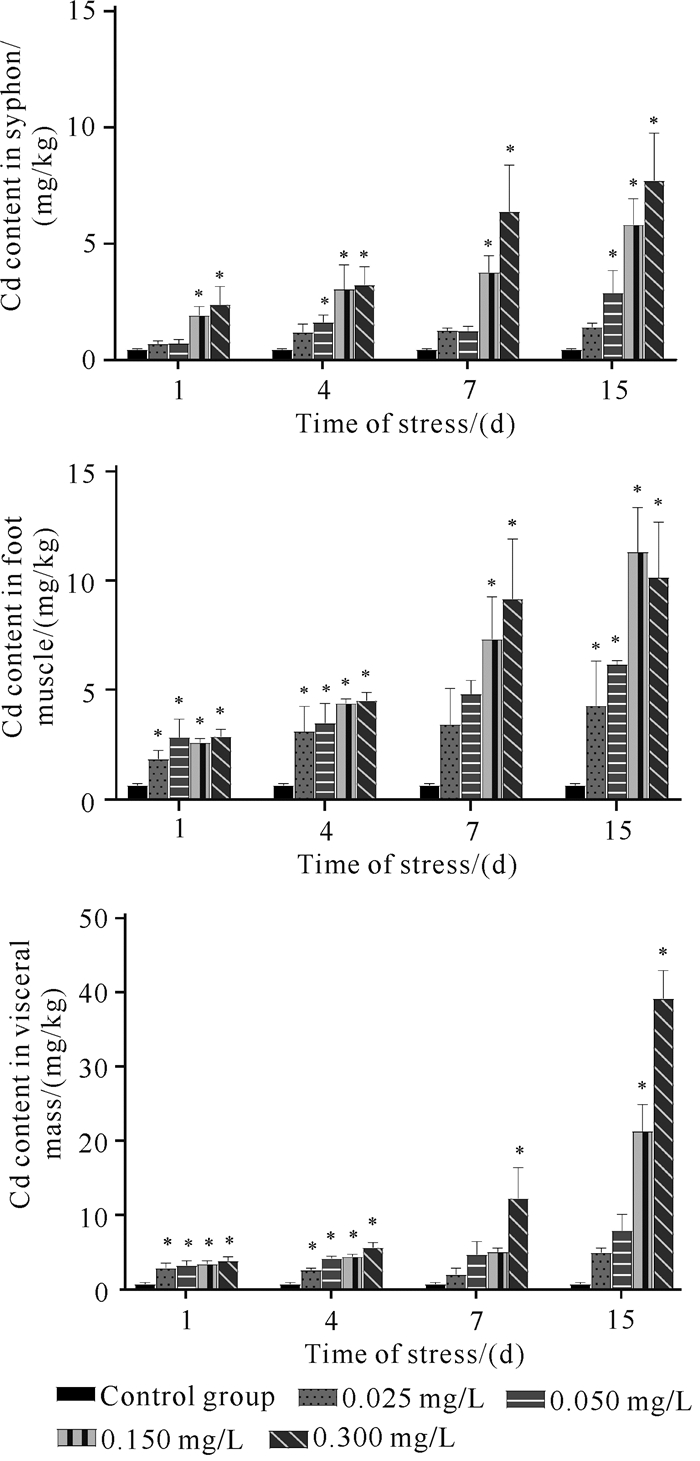
对胁迫后的弓獭蛤组织(虹吸管、斧足肌肉、内脏团,以下相同叙述表示相同含义)中Cd含量的测定发现,各组织的Cd含量均随着外部水体Cd浓度的增大而增大。如图 4所示,Cd胁迫1 d的各浓度实验组的弓獭蛤组织中Cd含量已高于对照组,且部分差异显著(P<0.05)。随着胁迫时间的增加,弓獭各组织Cd含量继续增加,胁迫15 d时0.025 mg/L实验组的各组织Cd含量分别是对照组的3.2、6.3、6.4倍;0.050 mg/L实验组的各组织Cd含量分别是对照组的6.5、9.0、6.7倍;0.150 mg/L实验组的各组织Cd含量分别是对照组的13.3、16.5、27.0倍;0.300 mg/L组的各组织Cd含量分别是对照组的17.6、14.8、49.5倍。总体来看,虹吸管中富集的Cd含量最低,斧足肌肉次之,内脏团最高。
|
| *indicates that there is a significant difference between the experimental group and the control group at the same time (P < 0.05). 图 4 Cd胁迫下弓獭蛤各组织Cd的含量 Fig.4 Contents of Cd in various tissues of L.arcuata under Cd stress |
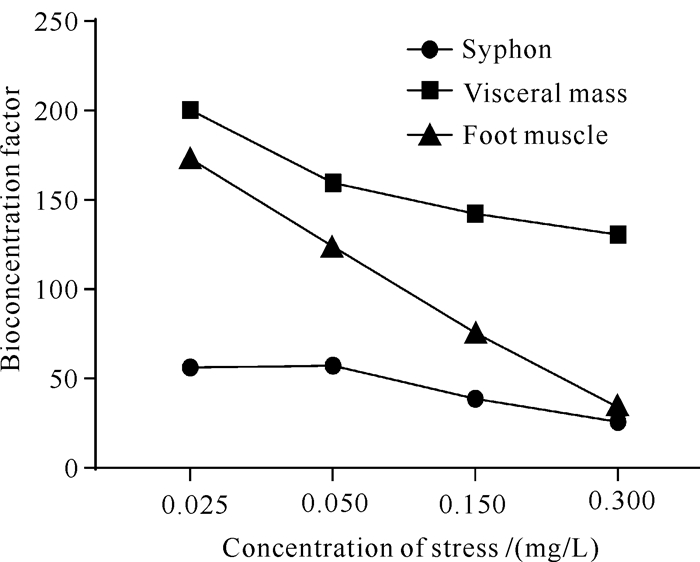
本研究计算了胁迫15 d时各胁迫浓度下弓獭蛤组织的重金属富集系数(图 5),发现各组织中Cd的富集系数与水体中Cd浓度成负相关。该结果与李学鹏等[33]对双壳贝类泥蚶、张少娜等[34]对紫贻贝(Mytilus edulis)进行的重金属Cd生物富集研究结果一致,即贝类对Cd的富集系数随着水体Cd浓度的升高而降低。弓獭蛤3种组织对Cd的富集系数的大小顺序为内脏团>斧足肌肉>虹吸管。
|
| 图 5 受不同浓度Cd胁迫15 d时弓獭蛤各组织对Cd的富集系数 Fig.5 BCF of various tissues of L.arcuata at 15 d under different concentrations of Cd stress |
2.3 Cd胁迫对弓獭蛤生理指标的影响
不同浓度Cd胁迫下弓獭蛤内脏团SOD酶活力变化如图 6(a)所示。0.050 mg/L实验组的SOD酶活力在1 d时明显上升,0.025 mg/L实验组的SOD酶活力在4 d时明显升高,并与对照组差异显著;各实验组在7 d时上升至最高值。各实验组SOD酶活力在Cd胁迫7 d时分别为46.27、38.32、36.25、51.50 U/mg prot。15 d时,各实验组SOD酶活力下降至与对照组相当的水平,且与对照组差异不显著(P>0.05)。
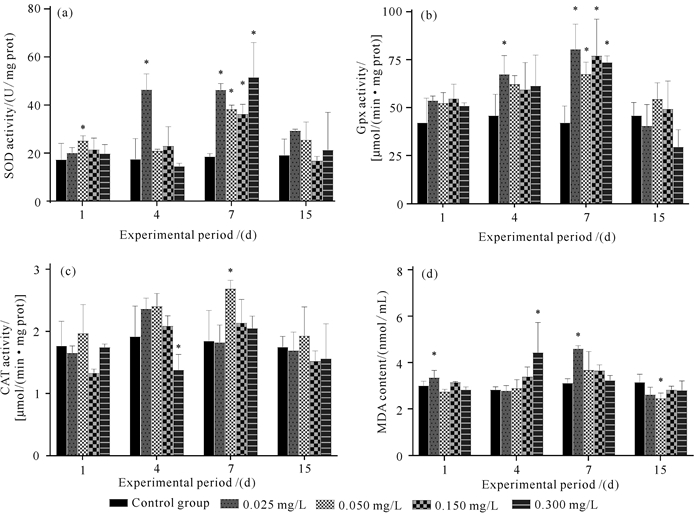
|
| *indicates that there is a significant difference between the experimental group and the control group at the same time (P < 0.05). 图 6 不同浓度Cd胁迫下弓獭蛤GPx、CAT、SOD活性和MDA含量情况 Fig.6 Activities of GPx, CAT, SOD and MDA contents of L.arcuata under different concentrations of Cd stress |
GPx的酶活力影响如图 6(b)所示。在实验第1天时,4个实验组的GPx酶活力略有上升。随着时间的变化,GPx酶活力逐渐上升,到7 d时达到最高值,各实验组酶活力与对照组差异显著(P<0.05),但各实验组的酶活力很接近,无显著差异。15 d时,各实验组的GPx酶活力都下降至与对照组相当的水平。总体来说,在15 d的胁迫实验期间4个实验组酶活力表现出先上升后下降的趋势。
CAT酶活力变化如图 6(c)所示,0.025 mg/L实验组在4 d时达到最高,为2.36 μmol/(min·mg prot);其余各胁迫浓度实验组的酶活力均在7 d时达到最高值,分别为2.69、2.14、2.05 μmol/(min·mg prot),但仅0.050 mg/L实验组的CAT酶活力与对照组有显著性差异(P<0.05)。胁迫15 d时,实验组的CAT酶活水平降低至接近对照组水平,与对照组差异不显著(P>0.05)。
MDA含量变化如图 6(d)所示,各实验组MDA含量变化趋势不明显。低浓度0.025 mg/L实验组的MDA含量在1 d时小幅度升高;在7 d时达到最高值,且与对照组差异显著;15 d时回落并低于对照组。高浓度0.300 mg/L实验组的MDA含量值在4 d时达到最高值,与对照相比差异显著,随后降低至与对照组相当的水平。
3 讨论 3.1 弓獭蛤的重金属监测和食品安全分析根据《海水水质标准》(GB 3097-1997),第二类海水适用于水产养殖区,本研究对7种重金属浓度测定的结果显示12个站位均属于一类海水水质,优于水产养殖标准。各海域的Cd平均含量为一类海水Cd含量阈值的14.2%,但是3处海域养殖的弓獭蛤可食用部分的重金属Cd的平均Pi为0.399,达到了轻度污染的范围。《无公害食品水产品中有毒有害物质限量》(NY 5073-2006)中无公害贝类产品中Cd标准限量为1.0 mg/kg,营盘镇海域一个站位的样品已超过该标准限量的范围。弓獭蛤中重金属Cd的污染问题应当引起人们的重视。但由于本研究采集的弓獭蛤样本数总体上比较少,调查站位仅3处养殖海域,对于全面反映北海市弓獭蛤的重金属污染水平存在一定的局限性。
通过计算弓獭蛤对7种重金属的富集系数发现,弓獭蛤对Cd的富集系数最高,说明弓獭蛤对Cd的富集能力很强,该结果也与前人研究得到的贻贝等对Cd具有高富集能力的结论一致[19]。因此如果海水中Cd含量增加,则弓獭蛤容易达到中度甚至重度污染水平。弓獭蛤对海水环境中Cd的高富集能力,提示弓獭蛤可以作为海水Cd污染的指示生物。另外,各站位海水中的Cu含量在7种重金属中相对较高,但是弓獭蛤可食用部分未检测出Cu (含量未达仪器检测最低值),弓獭蛤机体选择性地不富集来自海水环境中的Cu的机制也值得进一步研究。
3.2 Cd在弓獭蛤体内的富集特征及生理影响Cd通过渗透和滤食的方式从海洋环境中进入双壳贝类体内,根据进入部位的不同,进入机体的方式有所区别,不同贝类各组织对不同金属的富集程度也有所区别[35-37]。本研究结果表明,Cd胁迫后,伴随着滤食呼吸作用,弓獭蛤通过滤食、呼吸作用,各组织中的Cd含量与胁迫浓度、胁迫时间呈正相关关系,胁迫环境的Cd浓度越高胁迫时间越长,组织中的Cd富集含量越高,呈现明显的时间-剂量效应。各组织中富集的Cd浓度有所差异,表现为内脏团>斧足肌肉>虹吸管,与类延菊[38]、李宗访等[26]的研究结果相似。上述学者发现皱纹盘鲍(Haliotis discus hannai Ino)、泥蚶在各浓度Cd的暴露下,内脏团(肝胰腺)和足中的Cd含量随着环境Cd浓度的增加和时间的延长呈上升趋势,且内脏团的Cd积累量高于肌肉。
在受到重金属Cd胁迫时,动物体内会诱导产生活性氧(ROS)产物而导致机体的氧化损伤,此时抗氧化防御系统启动清除活性氧自由基,抵御氧化损伤[39]。SOD、GPx和CAT是其中具有代表性的抗氧化酶,通过清除细胞内多余的ROS以维持细胞氧化还原内稳态。在本研究中SOD、GPx、CAT 3种酶的活性整体趋势表现为先上升后下降,提示在Cd胁迫刺激前期,弓獭蛤机体自身防御系统做出响应,通过增加抗氧化酶的活性,减少Cd诱导下产生的ROS对机体的损害,随着体内Cd的不断累积,弓獭蛤通过调整酶活性来适应外界环境的干扰。
当机体氧化应激超过抗氧化防御能力时,双壳贝类的氧化损伤主要表现为脂质过氧化和DNA链断裂,ROS将引起脂质过氧化并产生丙二醛(MDA),其含量的高低与过氧化反应的程度相关。本研究中实验组的MDA含量相对于对照组来说并没有明显变化,甚至高浓度组的MDA含量相对于对照组来说还有一些下降,说明脂质过氧化程度低。前人研究发现,长牡蛎(Crassostrea gigas)、Perna canaliculus等贝类长期暴露在高浓度的Cd下也会出现MDA含量减少的现象,与本研究结论一致[40, 41]。
结合本研究中弓獭蛤的重金属富集系数、Cd胁迫后体内3种组织的Cd含量变化等情况可以发现,弓獭蛤对Cd有着非常强的富集能力。在高剂量的Cd胁迫下,弓獭蛤活动正常,未出现组织外观畸变现象,死亡率仅1%。3种常用的抗氧化酶活性表现出随胁迫时间的推移先增高后降低的特征,但MDA含量变化不大,说明机体并未产生大量的脂质氧化。另外,本研究还进行了金属硫蛋白含量的测定,结果发现胁迫后的金属硫蛋白的含量也并无显著变化(数据未展示)。综上所述,弓獭蛤具有很强的适应Cd的能力,体内虽然富集高含量的Cd,但是对其生理状态影响不大。Wakimoto等[42]在P.canaliculus中发现了一种呋喃类脂肪酸,有着强大的清除ROS的能力,说明双壳贝类体内可能存在着和常规认识不一样的抗氧化机制,从而减少Cd暴露诱导的脂质过氧化。弓獭蛤是否也存在着独特的抵抗重金属Cd对其机体损伤的机制,还有待进一步研究。
4 结论本研究对北海市3处海域12个站位的7种主要重金属含量进行测定,计算了弓獭蛤可食用部分的重金属污染指数和富集系数,并在实验室内对弓獭蛤进行了高浓度含Cd海水的胁迫实验,得到以下结论。(1) 12个检测点的重金属含量均符合海水养殖区标准,但根据国家标准,弓獭蛤可食用部分的Cd平均Pi达到轻度污染水平,其中营盘镇某站位样品Cd含量超过了无公害水产品限量标准。弓獭蛤对Cd的富集系数大于5 000,在7种重金属中最高,说明弓獭蛤对环境中的重金属Cd吸收能力极强,如果海水中的Cd浓度进一步增加,则易造成食品安全问题,应引起警醒。(2)胁迫实验结果揭示了弓獭蛤体内各组织富集的Cd含量与胁迫浓度、胁迫时间呈正相关关系。内脏团对Cd的富集能力最强、富集速率最快,斧足肌肉次之,虹吸管最低,根据这一结论建议消费者在食用弓獭蛤时去除内脏团。(3)胁迫实验后,弓獭蛤内脏团组织中SOD、GPx、CAT的酶活力呈现规律性变化,MDA含量的变化与对照组相比不明显。
弓獭蛤作为底栖双壳贝类,其体内的重金属富集与底栖沉积物环境息息相关,今后可进一步研究弓獭蛤体内重金属含量和沉积物之间的关系。此外,在体内Cd含量很高的情况下,弓獭蛤的生活状况仍然正常,组织形态未出现明显异常,弓獭蛤如何抵抗Cd对其机体损伤的机制有待深入研究。
| [1] |
CHEN K, WANG W, ZHU W, et al. Morphological cha-racteristics and genetic differentiation of Lutraria maxima in coast waters off southeast China[J]. Journal of Oceanology and Limnology, 2021, 39(4): 1387-1402. DOI:10.1007/s00343-020-0172-9 |
| [2] |
邹杰, 彭慧婧, 张守都, 等. 施氏獭蛤壳体表型性状对体质量的影响分析[J]. 水产科学, 2020, 39(4): 573-578. DOI:10.16378/j.cnki.1003-1111.2020.04.015 |
| [3] |
郑淑雅, 饶小珍, 陈昭娜. 弓獭蛤受精及早期卵裂过程核相变化的细胞学观察[J]. 福建师范大学学报(自然科学版), 2014, 30(1): 98-103. |
| [4] |
佚名. 北海: 浅海开放式底播养殖象鼻螺, 年产7.6万吨[J]. 农家之友, 2020(12): 28. |
| [5] |
彭慧婧, 张守都, 郑德斌, 等. 施氏獭蛤全同胞家系建立及生长与存活性状分析[J]. 海洋科学, 2019, 43(7): 132-138. |
| [6] |
邹杰, 张守都, 彭慧婧, 等. 施氏獭蛤早期生长性状遗传参数和育种值估计[J]. 海洋科学, 2021, 45(2): 99-105. |
| [7] |
王斌, 栗志民, 刘志刚, 等. 施氏獭蛤室内规模化人工育苗技术研究[J]. 广东海洋大学学报, 2015, 35(1): 35-42. |
| [8] |
赵鹏, 张荣灿, 覃仙玲, 等. 北部湾钦州港近江牡蛎重金属污染分析[J]. 水产学报, 2017, 41(5): 806-815. |
| [9] |
罗海军, 吴益春, 宋洪强, 等. 菲律宾蛤仔中铅、镉、汞、无机砷的含量分析及食用安全性评价[J]. 食品科学, 2015, 36(4): 189-192. |
| [10] |
高翔, 王源. 贝类镉胁迫功能基因研究进展[J]. 中国农业大学学报, 2017, 22(3): 122-130. |
| [11] |
田恒川, 徐国志. 镉地球化学行为与我国西南地区镉污染[J]. 现代矿业, 2014, 30(11): 134-136. |
| [12] |
蒋丽. 深海高效除镉菌株对磷镉去除的相互作用及其生物学机制[D]. 济南: 山东大学, 2019.
|
| [13] |
闫家蕾, 李雁宾. 海洋镉生物地球化学循环研究进展[J/OL]. 环境化学, 2022: 1-13(2022-11-21)[2023-02-12]. https://kns.cnki.net/kcms/detail/11.1844.X.20221118.1342.013.html.
|
| [14] |
蔡嘉旖, 张文丽. 人群暴露环境镉污染与健康危害的流行病学研究进展[J]. 环境卫生学杂志, 2019, 9(6): 621-627. |
| [15] |
吴艾琳, 练雪梅. 镉的膳食暴露评估研究进展[J]. 现代医药卫生, 2021, 37(18): 3130-3134. |
| [16] |
REYES-HINOJOSA D, LOZADA-PÉREZ C A, ZAM-UDIO CUEVAS Y, et al. Toxicity of cadmium in musculoskeletal diseases[J]. Environmental Toxicology and Pharmacology, 2019, 72: 103219. |
| [17] |
SUHANI I, SAHAB S, SRIVASTAVA V, et al. Impact of cadmium pollution on food safety and human health[J]. Current Opinion in Toxicology, 2021, 27: 1-7. |
| [18] |
LIN H C, HAO W M, CHU P H. Cadmium and cardiovascular disease: an overview of pathophysiology, epidemiology, therapy, and predictive value[J]. Revista Portμguesa de Cardiologia (English Edition), 2021, 40(8): 611-617. |
| [19] |
林功师. 厦门市售贝类中重金属镉含量分析与评价[J]. 中国渔业质量与标准, 2022, 12(2): 54-59. |
| [20] |
BORCHARDT T. Influence of food quantity on the kinetics of cadmium uptake and loss via food and seawater in Mytilus edulis[J]. Marine Biology, 1983, 76(1): 67-76. |
| [21] |
WINTER S. Cadmium uptake kinetics by freshwater mollusc soft body under hard and soft water conditions[J]. Chemosphere, 1996, 32(10): 1937-1948. |
| [22] |
JU Y R, CHEN W Y, SINGH S, et al. Trade-offs between elimination and detoxification in rainbow trout and common bivalve molluscs exposed to metal stressors[J]. Chemosphere, 2011, 85(6): 1048-1056. |
| [23] |
BAURAND P E, CAPELLI N, SCHEIFLER R, et al. An assessment of the embryotoxicity of cadmium in the terrestrial mollusk Cantareus aspersus: from bioaccumulation to impacts at different levels of biological organization[J]. Ecotoxicology and Environmental Safety, 2014, 110: 89-94. |
| [24] |
YU D, PENG Z, WU H, et al. Stress responses in expressions of microRNAs in mussel Mytilus galloprovincialis exposed to cadmium[J]. Ecotoxicology and Environmental Safety, 2021, 212: 8. |
| [25] |
张晶晶. 基于mRNA转录和调控水平研究中国蛤蜊对镉胁迫的响应[D]. 大连: 大连海洋大学, 2016.
|
| [26] |
李宗访, 滕爽爽, 张炯明, 等. Cd胁迫对泥蚶Cd积累及相关生理代谢的影响[J]. 中国水产科学, 2021, 28(11): 1436-1446. |
| [27] |
何裕宁, 陈琨, 何智能, 等. 镉胁迫对钝缀锦蛤的生理影响[J]. 海南大学学报(自然科学版), 2023, 41(1): 21-29. |
| [28] |
王晓宇. 四角蛤蜊Mactra veneriformis对镉和汞污染胁迫的生理响应[D]. 北京: 中国科学院研究生院, 2009.
|
| [29] |
GUO G L, ZHOU Q X. Evaluation of heavy metal contamination in Phaeozem of northeast China[J]. Environmental Geochemistry and Health, 2006, 28(4): 331-340. |
| [30] |
徐轶肖, 张腾, 赵鹏, 等. 北部湾贝类重金属污染特征及健康风险评价[J]. 环境科学与技术, 2019, 42(S2): 38-44. |
| [31] |
隋茜茜, 余金橙, 朱金艳, 等. 秦皇岛海域食用贝类重金属污染情况分析[J]. 食品工业科技, 2020, 41(10): 196-202. |
| [32] |
刘立婷, 陈希超, 于云江, 等. 广州市售水产品中重金属健康风险评价及消费建议[J]. 环境与健康杂志, 2019, 36(8): 731-735. |
| [33] |
李学鹏, 励建荣, 段青源. 泥蚶对重金属铜、铅、镉的生物富集动力学[J]. 水产学报, 2008, 32(4): 592-600. |
| [34] |
张少娜, 孙耀, 宋云利, 等. 紫贻贝(Mytilus edulis)对4种重金属的生物富集动力学特性研究[J]. 海洋与湖沼, 2004, 35(5): 438-445. |
| [35] |
林艺佳, 蹇丽, 寇彦巧, 等. 东寨港近岸底栖贝类重金属的富集特征研究[J]. 环境科学与技术, 2018, 41(8): 17-23. |
| [36] |
庞艳华, 隋凯, 王秋艳, 等. 大连近岸海域双壳贝类重金属污染调查与评价[J]. 海洋环境科学, 2012, 31(3): 410-413. |
| [37] |
阮金山, 罗冬莲, 李秀珠. 福建中、东部沿海主要养殖贝类体重金属的含量与评价[J]. 海洋环境科学, 2003, 22(2): 44-48. |
| [38] |
类延菊. Cu和Cd对皱纹盘鲍幼鲍的毒性及饲料硒和硫辛酸对其解毒作用的研究[D]. 青岛: 中国海洋大学, 2014.
|
| [39] |
PATHAK N, KHANDELWAL S. Influence of cadmium on murine thymocytes: potentiation of apoptosis and oxidative stress[J]. Toxicology Letters, 2006, 165(2): 121-132. |
| [40] |
GÉRET F, JOUAN A, TURPIN V, et al. Influence of metal exposure on metallothionein synthesis and lipid peroxidation in two bivalve mollusks: the oyster (Crassostrea gigas) and the mussel (Mytilus edulis)[J]. Aquatic Living Resources, 2002, 15(1): 61-66. |
| [41] |
CHANDURVELAN R, MARSDEN I D, GAW S, et al. Biochemical biomarker responses of green-lipped mussel, Perna canaliculus, to acute and subchronic waterborne cadmium toxicity[J]. Aquatic Toxicology, 2013, 140/141: 303-313. |
| [42] |
WAKIMOTO T, KONDO H, NII H, et al. Furan fatty acid as an anti-inflammatory component from the green-lipped mussel Perna canaliculus[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(42): 17533-17537. |



