2. 广西中医药大学海洋药物研究院, 广西南宁 530200;
3. 广西中医药大学, 广西中医基础研究重点试验室, 广西南宁 530200
2. Institute of Marine Drugs, Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China;
3. Guangxi Key Laboratory of Chinese Medicine Foundation Research, Guangxi University of Chinese Medicine, Nanning, Guangxi, 530200, China
藻蓝蛋白(Phycocyanin)是一种存在于蓝藻中,含开链四吡咯构造的天然蓝色色素,具有吸收和传递功能的性质,属胞内蛋白,在螺旋藻中含量较高[1]。由于藻蓝蛋白具有极高的营养价值以及抗炎、抗疲劳、抗肿瘤、提高人体免疫力等药理作用,因而被普遍应用于食品、化妆品、保健品和医药等领域,具有广阔的应用前景[2-6]。
目前,藻蓝蛋白的提取纯化工艺较成熟,但仍仅适用于实验室操作,工业上大规模生产仍是其重难点,且价格昂贵。藻蓝蛋白提取纯化主要分为破壁、粗提和纯化3步,其中细胞破碎的方法有溶胀法[7]、超声波细胞破壁法、冻融法[8]、机械破壁法、化学试剂法[9]、溶酶法[10]等,实验中常用其中一种或两种方法联用对藻蓝蛋白进行破壁[11, 12]。藻蓝蛋白提取一般采用盐析法、等电点沉淀法、超滤法[13-17]和吸附法[18-21],其中吸附法是利用吸附剂吸附杂质或蛋白从而提取蛋白,常用的吸附剂有活性炭和壳聚糖。此方法相比盐析法,所用的试剂价格便宜、不造成环境污染,少量的吸附剂即可吸附杂质,无须大量的硫酸铵; 缺点是需要精确控制吸附剂的用量和吸附时间,否则容易将目标蛋白吸附走,降低提取率。总体来说此方法有很大的开发潜力,有望取代盐析法提取藻蓝蛋白,但目前国内外对此方法的研究仍较少。
高纯度藻蓝蛋白的提取成本高,价格昂贵,由于溶胀法、冻融法都具有成本低、操作简单、条件温和以及不引入其他化学试剂等优点,因此本研究主要对溶胀法中的料液比、溶胀时间、溶胀次数,冻融法中的不同溶剂、料液比、冻融次数进行考察,应用响应面模型设计试验,对螺旋藻的两种破壁方法进行优化得到最优破壁条件。同时为了克服活性炭容易吸附目的蛋白降低回收率的缺点,采用响应面分析法优化,考察活性炭目数、活性炭加入量和吸附时间3个因素对藻蓝蛋白纯度及回收率的影响,以期获得最优活性炭吸附条件,最后采用一步疏水层析法纯化得到食品级和医药级藻蓝蛋白。
1 材料与方法 1.1 材料 1.1.1 样品与试剂钝顶螺旋藻(Spirulina platensis),由北海生巴达生物科技有限公司提供。粉末活性炭(100目、200目、300目、400目、500目),购自北京美嘉源环保工程有限公司;Butyl Fourose 4FF疏水层析填料,购自北京慧德易科技有限责任公司;磷酸二氢钾、磷酸氢二钾、氯化钠、硫酸铵等试剂均为分析纯,购自国药集团化学试剂有限公司。
1.1.2 仪器LQ-C3001电子天平,购自深圳市飞亚衡器有限公司;GL224-1SCN电子天平,购自赛多利斯科学仪器(北京)有限公司;HYCD-205医用冷藏冰冻箱,购自青岛海尔特种电器有限公司;PHS-25 pH计,购自上海仪电科学仪器股份有限公司;UV-2600紫外-可见光分光光度计,购自岛津仪器(苏州)有限公司;BA2100igital数码显微镜,购自麦克奥迪实业集团有限公司;BT600-2J精密蠕动泵,购自保定兰格恒流泵有限公司;SBS-100样品自动收集器,购自上海泸西分析仪器厂有限公司。
1.2 方法 1.2.1 分析方法藻蓝蛋白在620 nm处有最大吸收峰,蛋白在280 nm处有最大吸收峰,别藻蓝蛋白在650 nm下有最大吸收峰。根据该性质可使用紫外可见光分光光度计测定蛋白液280 nm、620 nm和650 nm处的吸光度(A),从而计算出藻蓝蛋白的纯度、浓度、得率及回收率。
① 藻蓝蛋白纯度。
藻蓝蛋白的纯度(Purity)用P表示,不同纯度的藻蓝蛋白有不同的用途,P≥0.7时为食品级,P≥3.0时为医药级,P≥4.0时为分析级,根据Yan等[22]提出的公式进行计算,具体如下:
| $ P=A_{620} / A_{280} \text { 。} $ | (1) |
② 藻蓝蛋白浓度。
藻蓝蛋白的浓度用C表示,根据Bennett等[23]提出的公式进行计算,具体如下:
| $ C(\mathrm{mg} / \mathrm{mL})=\left(A_{620}-0.474 \times A_{650}\right) / 5.34 \text { 。} $ | (2) |
③ 藻蓝蛋白得率。
藻蓝蛋白的得率用Y表示,计算公式如下:
| $ Y(\%)=\left(C \times V_0\right) /\left(m_0 \times 1000\right) \times 100 \%, $ | (3) |
式中,C是藻蓝蛋白浓度(mg/mL),V0是粗提液体积(mL),m0是螺旋藻干粉质量(g)。
1.2.2 溶胀法溶胀法是以纯水或低盐溶液为溶剂,螺旋藻吸水涨破细胞,从而流出有效成分的方法。具体操作如下:精密称取螺旋藻干粉,分别考察料液比(1∶10 g/mL、1∶20 g/mL、1∶50 g/mL、1∶100 g/mL、1∶200 g/mL)、溶胀时间(6 h、12 h、18 h、24 h、36 h)、溶胀次数(1次、2次、3次)对藻蓝蛋白纯度及得率的影响。将以上各个试验的藻液超声5 min,4℃静置12 h,4 000 r/min离心15 min,得上清液,分别测定280 nm、620 nm、650 nm处的吸光度。
采用Design-Expert软件的Box Behnken设计优化溶胀法破壁参数,以料液比、溶胀时间、溶胀次数为自变量,藻蓝蛋白得率为响应值,设计响应面分析法(RSM)试验。分别给各试验因素设置3个水平(表 1),以藻蓝蛋白的纯度和回收率作为响应变量,共17个析因点,其中有5个重复的中心点。
| 水平 Levels |
因素Factors | ||
| A: 料液比(g/mL) A: Solid liquid ratio(g/mL) |
B: 溶胀时间(h) B: Swelling time (h) |
C: 溶胀次数(次) C: Swelling times(times) |
|
| -1 | 1∶20 | 4 | 1 |
| 0 | 1∶50 | 8 | 2 |
| 1 | 1∶80 | 12 | 3 |
1.2.3 冻融法
冻融法是将螺旋藻液置于低温(-20℃)下,使海藻细胞中的水分被迅速冷冻形成冰晶,在室温下迅速解冻,从而破碎细胞的方法。单因素试验操作如下:①精密称取4份1 g螺旋藻干粉,分别加入20 mL纯水、0.01 mol/L磷酸盐缓冲液(PBS)、0.05 mol/L PBS缓冲液和0.1 mol/L PBS缓冲液,超声5 min,-20℃静置12 h;②精密称取3份1 g螺旋藻干粉,溶剂为①试验所得的最优溶液,超声5 min,-20℃分别静置4 h、8 h、12 h;③精密称取5份1 g螺旋藻干粉,分别加入最适溶剂,溶剂为①试验所得的最优溶液,使料液比分别为1∶10 (g/mL)、1∶20 (g/mL)、1∶50 (g/mL)、1∶100 (g/mL)、1∶200 (g/mL),超声5 min,冷冻时间为②所得的最优条件;④精密称取3份1 g螺旋藻干粉,加入最佳料液比溶剂,冻融次数分别为1次、2次和3次,超声5 min,-20℃静置。上述各个试验于室温下解冻,4 000 r/min离心15 min,分别吸取上清液1 mL,稀释10倍,分别测定280 nm、620 nm、650 nm处的吸光度,分析不同溶剂、冷冻时间、料液比、冻融次数对藻蓝蛋白纯度及得率的影响。
采用Design Expert软件的Box Behnken设计优化冻融法破壁参数,以料液比、冷冻时间、冻融次数为自变量,藻蓝蛋白得率为响应值,设计RSM试验。分别给各试验因素设置3个水平(表 2),以藻蓝蛋白的纯度和回收率作为响应变量设计试验,共17个析因点,其中有5个重复的中心点。
| 水平 Levels |
因素Factors | ||
| A: 料液比(g/mL) A: Solid liquid ratio(g/mL) |
B: 冷冻时间(h) B: Freezing time (h) |
C: 冻融次数(次) C: Freeze thaw times(times) |
|
| -1 | 1∶20 | 12 | 1 |
| 0 | 1∶50 | 18 | 2 |
| 1 | 1∶80 | 24 | 3 |
1.2.4 活性炭吸附法提取藻蓝蛋白
活性炭吸附法是利用活性炭吸附杂质或蛋白从而提取蛋白的方法。单因素试验操作如下:①取5份20 mL溶胀法所得的海藻液体,分别加入100目、200目、300目、400目、500目活性炭,静置吸附5 min;②取5份20 mL溶胀法所得海藻液体,分别加入活性炭0.1 g、0.3 g、0.5 g、0.7 g、0.9 g,活性炭目数为上一步试验所得的最优目数,静置吸附5 min;③取5份20 mL溶胀法所得的海藻液体,加入的活性炭量为上一步试验所得的最优条件,分别静置吸附5 min、10 min、15 min、20 min、25 min。将以上各个试验海藻液体以8 000 r/min转速离心5 min,弃去沉淀,分别吸取上清液1 mL,稀释适当倍数,分别测定280 nm、620 nm、650 nm处的吸光度,分析不同活性炭目数、活性炭加入量、吸附时间对藻蓝蛋白纯度及得率的影响。
在单因素试验的基础上,应用Design-Expert 10.0软件的Box-Behnken试验设计原理进行响应面试验,选取活性炭目数、活性炭加入量和吸附时间3个因素作为试验因素,分别给各试验因素设置适宜的3个水平(表 3),以藻蓝蛋白的纯度和回收率作为响应变量设计试验,共17个析因点,其中有5个重复的中心点。
| 水平 Levels |
因素Factors | ||
| A: 活性炭目数(目) A: Number of active carbon mesh(mesh) |
B: 活性炭加入量(g/20 mL) B: Amount of active carbon added(g/20 mL) |
C: 吸附时间(min) C: Adsorption time(min) |
|
| -1 | 200 | 0.3 | 5 |
| 0 | 300 | 0.5 | 10 |
| 1 | 400 | 0.7 | 15 |
1.2.5 疏水层析纯化藻蓝蛋白
将活性炭吸附法提取得到的藻蓝蛋白液,经超滤浓缩至一定浓度后,采用0.05 mol/L PBS磷酸缓冲液(含0.6 mol/L硫酸铵)预平衡的疏水层析填料进行梯度洗脱,洗脱液梯度依次为0.05 mol/L PBS (含0.6 mol/L硫酸铵)、0.05 mol/L PBS (含0.3 mol/L硫酸铵)、0.05 mol/L PBS、纯水,流速控制为2 mL/min,3 min每管,测定各管280 nm、620 nm、650 nm处吸光度,计算纯度,分别合并纯度1-2、纯度2-3和纯度大于3的蛋白液,计算纯度及回收率。
2 结果与分析 2.1 溶胀法结果分析 2.1.1 料液比、溶胀时间、溶胀次数对藻蓝蛋白纯度及得率的影响随着料液比的增加,藻蓝蛋白的得率显著上升,而纯度显著下降,且在料液比为1∶200 (g/mL)时,藻蓝蛋白得率最高,纯度最低[图 1(a)]。说明随着料液比的增加,螺旋藻细胞内外渗透压差越来越大,细胞壁破碎释放出的藻蓝蛋白增多,同时很多其他蛋白质成分可能一起溶胀出来,因此藻蓝蛋白得率逐渐增加而纯度逐渐减少。料液比太高会造成实际生产成本的增加,故选用1∶50 (g/mL)作为藻蓝蛋白料液比的最优值。随着溶胀时间的延长,藻蓝蛋白的得率和纯度均显著升高[图 1(b)]。说明随着溶胀时间的延长,更多藻蓝蛋白释出,但是较长的溶胀时间会造成实际生产成本增加和生产效率降低,故选用24 h作为溶胀时间的最优值。随着螺旋藻溶胀次数的增加,藻蓝蛋白的得率上升,而纯度下降[图 1(c)]。根据实际生产的需要,选择溶胀2次作为最优值。
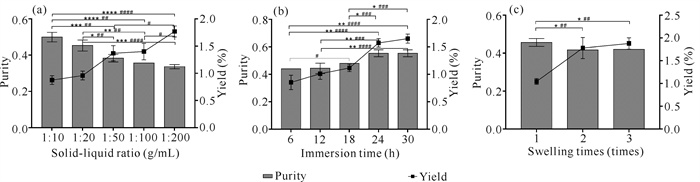
|
| * indicates significant difference in purity, **P < 0.01, ***P < 0.001, ****P < 0.000 1;# indicates significant difference in yield, # P < 0.05, ## P < 0.01, ### P < 0.001, #### P < 0.0001 图 1 料液比、溶胀时间、溶胀次数对藻蓝蛋白纯度及得率的影响 Fig.1 Effects of solid-liquid ratio, swelling time and swelling times on the purity and yield of phycocyanin |
2.1.2 溶胀试验响应面分析法优化
采用Design-Expert软件对表 4的试验结果进行回归拟合,得到藻蓝蛋白得率对3个因素的多元二次回归模型:得率Y=2.28+0.12A+0.22B+0.50C,从二次响应面回归模型的方差分析结果可知,模型相关系数R2=0.835 7,P=0.000 1 < 0.05,失拟项P=0.097 0>0.05,说明回归方程拟合度和可信度均较高,能较为真实地对最优工艺进行预测。
| 试验号 Test number |
A: 料液比(g/mL) A: Solid liquid ratio(g/mL) |
B: 溶胀时间(h) B: Swelling time (h) |
C: 溶胀次数(次)C: Swelling times(times) | 纯度 Purity |
得率(%) Yield(%) |
| 1 | -1 | -1 | 0 | 0.45 | 1.85 |
| 2 | 1 | -1 | 0 | 0.38 | 2.39 |
| 3 | -1 | 1 | 0 | 0.55 | 2.64 |
| 4 | 1 | 1 | 0 | 0.42 | 2.73 |
| 5 | -1 | 0 | -1 | 0.52 | 1.43 |
| 6 | 1 | 0 | -1 | 0.33 | 1.96 |
| 7 | -1 | 0 | 1 | 0.38 | 2.68 |
| 8 | 1 | 0 | 1 | 0.39 | 2.48 |
| 9 | 0 | -1 | -1 | 0.46 | 1.52 |
| 10 | 0 | 1 | -1 | 0.47 | 1.80 |
| 11 | 0 | -1 | 1 | 0.41 | 2.59 |
| 12 | 0 | 1 | 1 | 0.44 | 2.93 |
| 13 | 0 | 0 | 0 | 0.46 | 2.35 |
| 14 | 0 | 0 | 0 | 0.42 | 2.40 |
| 15 | 0 | 0 | 0 | 0.43 | 2.42 |
| 16 | 0 | 0 | 0 | 0.41 | 2.16 |
| 17 | 0 | 0 | 0 | 0.41 | 2.42 |
由回归方程系数显著性检测结果(表 5)可知,因素A、C的P值分别为0.000 6,0.000 1(P < 0.01),BC的P值为0.001 3 (P < 0.01)。各影响因素所对应的P值越小,F值越大,意味着该因素对响应变量的影响越显著,因此根据表 5中F值大小可以看出,影响溶胀法破壁效果的因素为溶胀次数>料液比>溶胀时间。
| 来源 Source |
平方和 Quadratic sum |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significance |
| Model | 3.720 | 6 | 0.620 | 15.51 | 0.000 2 | ** |
| A | 0.970 | 1 | 0.970 | 24.23 | 0.000 6 | ** |
| B | 0.097 | 1 | 0.097 | 2.42 | 0.150 8 | |
| C | 1.510 | 1 | 1.510 | 37.64 | 0.000 1 | ** |
| AB | 0.058 | 1 | 0.058 | 1.44 | 0.257 7 | |
| AC | 0.130 | 1 | 0.130 | 3.15 | 0.106 2 | |
| BC | 0.770 | 1 | 0.770 | 19.36 | 0.001 3 | ** |
| Residual error | 0.400 | 10 | 0.040 | |||
| Misfit term | 0.290 | 6 | 0.048 | 1.78 | 0.300 0 | |
| Net error | 0.110 | 4 | 0.027 | |||
| Total dispersion | 4.120 | 16 | ||||
| Note: ** indicates extremely significant difference (P < 0.01) | ||||||
2.1.3 溶胀法各因素之间的相互作用
根据Box-Behnken设计试验结果作响应曲面图,考察拟合的曲面形状,分析料液比、溶胀时间,溶胀次数三者之间交互作用对藻蓝蛋白得率的影响(图 2)。由图 2可知,这3个因素之间无相互影响,故根据每个因素的最佳结果组合可以得到溶胀法破壁的最佳方案为料液比1∶50 (g/mL),溶胀时间24 h,溶胀次数2次。模型预测纯度为0.47,预测提取率为2.16%。
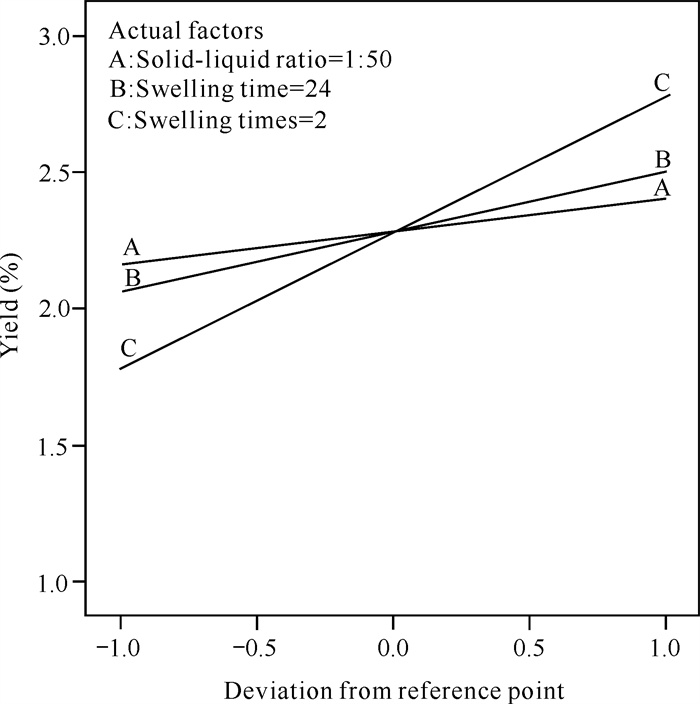
|
| 图 2 料液比、溶胀时间及溶胀次数的相互影响 Fig.2 Interaction of solid-liquid ratio, swelling time and swelling times |
2.1.4 验证性试验
采用响应面分析法优化所得的最优破壁条件:料液比1∶50 (g/mL),溶胀时间24 h,溶胀次数2次,进行验证性试验,重复3次,取平均值,测得藻蓝蛋白纯度为0.47,得率为2.17%,与模型预测纯度0.47相同,与模型预测得率2.16%接近,表明该方案稳定可靠,具有实用价值。
2.1.5 细胞破碎前后对比螺旋藻细胞破碎前后的显微结构如图 3所示。破壁后螺旋藻圆柱形螺旋结构发生了断裂,同时产生了大量细胞碎片,可见溶胀法破壁效果良好。
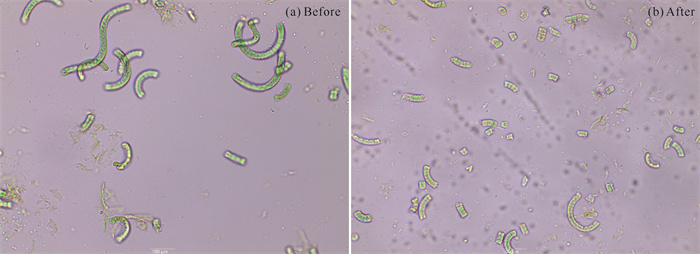
|
| 图 3 螺旋藻细胞破碎前后的显微结构 Fig.3 Microstructure of Spirulina cells before and after fragmentation |
2.2 冻融法结果分析 2.2.1 不同溶剂、冷冻时间、料液比、冻融次数对藻蓝蛋白纯度及得率的影响
与纯水比较,当用0.10 mol/L PBS缓冲液提取藻蓝蛋白时,藻蓝蛋白的得率和纯度极显著升高,故选择0.10 mol/L PBS缓冲液作为冻融法提取藻蓝蛋白的溶剂[图 4(a)]。冷冻时间从4 h增加到12 h时,藻蓝蛋白的得率先上升后下降,而藻蓝蛋白的纯度缓慢下降[图 4(b)]。随着时间的增加,螺旋藻细胞会破碎从而释放出藻蓝蛋白,但与此同时其他杂质增加导致纯度缓慢下降,故选择8 h作为冷冻时间的最优值。料液比从1∶10 (g/mL)变化到1∶200 (g/mL)时,藻蓝蛋白的得率逐渐上升,而藻蓝蛋白的纯度下降但差异不显著[图 4(c)],故选用1∶50 (g/mL)作为藻蓝蛋白料液比的最优值。冻融次数从2次增加到3次时,藻蓝蛋白的得率和纯度无显著性差异[图 4(d)],说明在冻融2次后大部分藻蓝蛋白已释出,因此选择2次作为冻融次数的最优值。

|
| * indicates significant difference in purity, **P < 0.01, ***P < 0.001, ****P < 0.000 1;# indicates significant difference in yield, # P < 0.05, ## P < 0.01, ### P < 0.001 图 4 不同溶剂、冷冻时间、料液比、冻融次数对藻蓝蛋白纯度及得率的影响 Fig.4 Effects of different solvent, freezing time, solid-liquid ratio and freezing-thawing times on the purity and yield of phycocyanin |
2.2.2 冻融试验响应面分析法优化
采用Design-Expert软件对表 6的试验结果进行回归拟合,得到藻蓝蛋白得率对3个因素的多元二次回归模型:得率Y=2.30+0.43A+0.055B+0.53C-0.060AB+0.18AC+0.22BC。模拟相关系数R2=0.903 0,P=0.000 2 < 0.05,失拟项P=0.3>0.05,说明回归方程拟合度和可信度均很高,能较准确地对最优工艺进行预测。因素A、B、C的P值分别为0.001 6,0.155 8,0.000 6,可知试验中一次项A极显著(P < 0.01),B不显著,C极显著(P < 0.01)(表 7)。交互项AB、AC、BC的P值分别为0.146 0,0.107 3,0.002 3,可知交互项AB、AC不显著,BC极显著(P < 0.01)。根据表 7中F值大小,可得出影响冻融法破壁得率的因素为冷冻次数>料液比>冷冻时间。
| 试验号 Test number |
A: 料液比(g/mL) A: Solid-liquid ratio (g/mL) |
B: 冷冻时间(h) B: Freezing time (h) |
C:冷冻次数(次) C:Freezing times (times) |
纯度 Purity |
得率(%) Yield (%) |
| 1 | -1 | -1 | 0 | 0.42 | 1.56 |
| 2 | 1 | -1 | 0 | 0.4 | 2.88 |
| 3 | -1 | 1 | 0 | 0.47 | 1.71 |
| 4 | 1 | 1 | 0 | 0.38 | 2.55 |
| 5 | -1 | 0 | -1 | 0.46 | 1.77 |
| 6 | 1 | 0 | -1 | 0.51 | 2.28 |
| 7 | -1 | 0 | 1 | 0.46 | 2.01 |
| 8 | 1 | 0 | 1 | 0.41 | 3.23 |
| 9 | 0 | -1 | -1 | 0.45 | 2.15 |
| 10 | 0 | 1 | -1 | 0.4 | 1.80 |
| 11 | 0 | -1 | 1 | 0.38 | 1.92 |
| 12 | 0 | 1 | 1 | 0.37 | 3.33 |
| 13 | 0 | 0 | 0 | 0.37 | 2.13 |
| 14 | 0 | 0 | 0 | 0.37 | 2.13 |
| 15 | 0 | 0 | 0 | 0.39 | 2.42 |
| 16 | 0 | 0 | 0 | 0.38 | 1.98 |
| 17 | 0 | 0 | 0 | 0.38 | 2.26 |
| 来源 Source |
平方和 Quadratic sum |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significance |
| Model | 3.680 | 6 | 0.620 | 16.71 | 0.001 4 | ** |
| A | 0.970 | 1 | 0.970 | 23.60 | 0.001 6 | ** |
| B | 0.097 | 1 | 0.096 | 2.36 | 0.155 8 | |
| C | 1.390 | 1 | 1.490 | 36.70 | 0.000 6 | ** |
| AB | 0.156 | 1 | 0.058 | 1.44 | 0.146 0 | |
| AC | 0.130 | 1 | 0.130 | 3.15 | 0.107 3 | |
| BC | 0.760 | 1 | 0.770 | 20.06 | 0.002 3 | ** |
| Residual error | 0.380 | 10 | 0.039 | |||
| Misfit term | 0.280 | 6 | 0.049 | 1.79 | 0.300 0 | |
| Net error | 0.140 | 4 | 0.024 | |||
| Total dispersion | 3.890 | 16 | ||||
| Note: ** indicates extremely significant difference (P < 0.01) | ||||||
2.2.3 冻融法不同因素间的相互作用
根据Box-Behnken试验结果作响应曲面图,考察拟合的曲面形状,分析冷冻时间、料液比、冻融次数三者之间交互作用对藻蓝蛋白得率的影响(图 5)。各因素及交互作用经响应面分析法优化所得的最优提取条件为料液比1∶50 (g/mL),冷冻时间8 h,冻融次数3次。模型预测纯度为0.38,预测得率为2.24%。
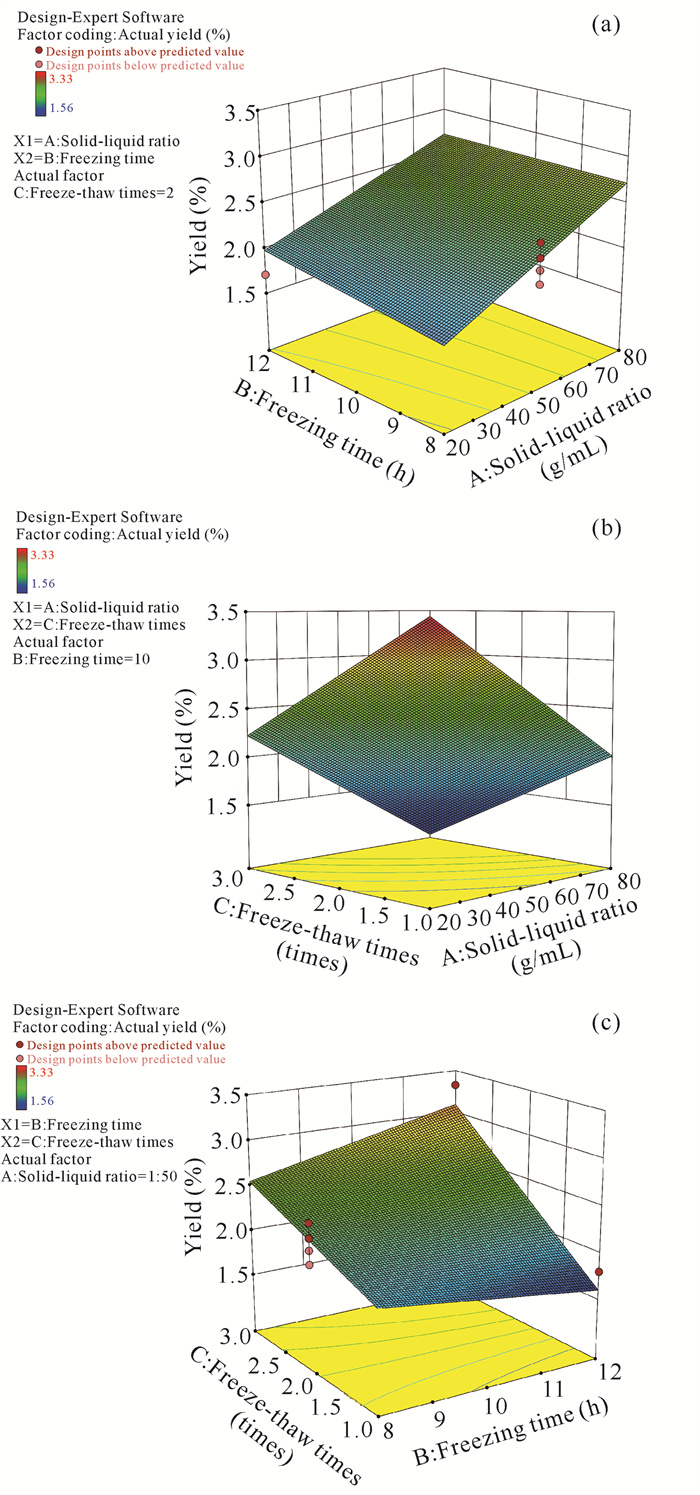
|
| 图 5 冷冻时间、料液比、冻融次数交互作用图 Fig.5 Interaction diagram of freezing time, solid-liquid ratio and freeze-thaw times |
2.2.4 验证性试验
根据响应面分析法优化所得的最优提取条件:料液比1∶50 (g/mL),冷冻时间8 h,冻融次数3次,进行验证性试验,重复3次,取平均值,测得藻蓝蛋白纯度为0.34,得率为2.19%,与模型预测纯度0.38、预测得率2.24%接近,表明该方案稳定可靠,具有实用价值。
2.3 活性炭吸附法提取藻蓝蛋白 2.3.1 活性炭目数、活性炭加入量和吸附时间对藻蓝蛋白纯度和得率的影响活性炭吸附法各因素对藻蓝蛋白纯度和得率的影响如图 6所示。活性炭目数在300目时,藻蓝蛋白的纯度最高,得率最低;当活性炭目数为400目和500目时,纯度有下降趋势,而得率升高[图 6(a)]。

|
| * indicates significant difference in purity, *P < 0.05, **P < 0.01;# indicates significant difference in yield, # P < 0.05, ## P < 0.01, ### P < 0.001, #### P < 0.0001 图 6 活性炭目数、活性炭加入量、吸附时间对藻蓝蛋白纯度及得率的影响 Fig.6 Effect of active carbon mesh number, active carbon amount and adsorption time on purity and yield of phycocyanin |
因此,选择活性炭目数300目作为最优吸附条件。随着活性炭加入量的增加,藻蓝蛋白纯度先显著增加而后下降,而得率呈显著下降趋势[图 6(b)]。当活性炭加入量为0.7 g/20 mL时,纯度最高,因此可作为最优吸附条件。当吸附时间为10 min时,藻蓝蛋白纯度处于最大值;随着吸附时间的延长,得率呈下降趋势,整体呈“W”型;当吸附时间为10-25 min时,得率差异不显著[图 6(c)],因此选择10 min作为最优活性炭吸附时间。
2.3.2 活性炭吸附试验响应面分析法优化根据单因素试验结果,选取活性炭目数(A)、活性炭加入量(B)和吸附时间(C)3个因素进行Box-Behnken试验设计,共17个析因点,其中有5个重复的中心点,试验设计方案与结果如表 8所示。
| 试验号 Test number |
A: 活性炭目数(目) A: Number of active carbon mesh (mesh) |
B: 活性炭加入量(g/20 mL) B: Amount of active carbon added (g/20 mL) |
C: 吸附时间(min) C: Adsorption time (min) |
纯度 Purity |
回收率(%) Recovery rate (%) |
| 1 | -1 | -1 | 0 | 0.84 | 67.40 |
| 2 | 1 | -1 | 0 | 0.63 | 70.17 |
| 3 | -1 | 1 | 0 | 0.75 | 55.24 |
| 4 | 1 | 1 | 0 | 0.72 | 65.12 |
| 5 | -1 | 0 | -1 | 0.72 | 68.53 |
| 6 | 1 | 0 | -1 | 0.73 | 67.84 |
| 7 | -1 | 0 | 1 | 0.77 | 62.63 |
| 8 | 1 | 0 | 1 | 0.66 | 71.57 |
| 9 | 0 | -1 | -1 | 0.66 | 75.16 |
| 10 | 0 | 1 | -1 | 0.64 | 68.57 |
| 11 | 0 | -1 | 1 | 0.66 | 73.51 |
| 12 | 0 | 1 | 1 | 0.71 | 65.2 |
| 13 | 0 | 0 | 0 | 0.68 | 70.63 |
| 14 | 0 | 0 | 0 | 0.66 | 71.32 |
| 15 | 0 | 0 | 0 | 0.67 | 72.31 |
| 16 | 0 | 0 | 0 | 0.64 | 72.51 |
| 17 | 0 | 0 | 0 | 0.66 | 72.78 |
采用Design-Expert 10.0软件对试验数据进行多元二次回归拟合,得到回归模型为藻蓝蛋白纯度P=0.66-0.042A+3.750×10-3B+6.250×10-3C+0.045AB+0.030AC+0.017BC+0.063A2+0.010B2-4.750×10-3C2(R2=0.910 2),藻蓝蛋白回收率RP=71.91+2.61A-4.01B-0.90C+1.78AB+2.41AC- 0.43BC-5.20A2-2.23B2+0.93B2(R2=0.980 4)。
藻蓝蛋白纯度和回收率的回归方程及偏回归系数方差分析分别见表 9和表 10。从表 9可以看出,纯度模型P < 0.05,表明该模型可靠,达到了显著水平,决定系数R2=0.910 2,说明该模型可以解释91.02%的响应值变化,拟合度较精确;该模型失拟项P>0.05,不显著,说明整个模型在该回归区域内合理,可用来分析藻蓝蛋白纯度结果。根据F值大小可得出影响藻蓝蛋白纯度的因素为活性炭目数>吸附时间>活性炭加入量。
| 来源 Source |
平方和 Quadratic sum |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significance |
| Model | 0.045 | 9 | 5.017E-003 | 7.88 | 0.006 3 | ** |
| A | 0.014 | 1 | 0.014 | 22.70 | 0.002 0 | ** |
| B | 1.125E-004 | 1 | 1.125E-004 | 0.18 | 0.686 8 | |
| C | 3.125E-004 | 1 | 3.125E-004 | 0.49 | 0.506 1 | |
| AB | 8.100E-003 | 1 | 8.100E-003 | 12.73 | 0.009 1 | ** |
| AC | 3.600E-003 | 1 | 3.600E-003 | 5.66 | 0.049 0 | * |
| BC | 1.225E-003 | 1 | 1.225E-003 | 1.92 | 0.207 9 | |
| A2 | 0.017 | 1 | 0.017 | 26.05 | 0.001 4 | * |
| B2 | 4.424E-004 | 1 | 4.424E-004 | 0.70 | 0.432 0 | |
| C2 | 9.500E-005 | 1 | 9.500E-005 | 0.15 | 0.710 7 | |
| Residual error | 4.455E-003 | 7 | 6.364E-004 | |||
| Misfit term | 3.575E-003 | 3 | 1.192E-003 | 5.42 | 0.068 1 | |
| Net error | 8.800E-004 | 4 | 2.200E-004 | |||
| Total dispersion | 0.05 | 16 | ||||
| Note: * indicates significant difference (P < 0.05),** indicates extremely significant difference (P < 0.01) | ||||||
| 来源 Source |
平方和 Quadratic sum |
自由度 Degree of freedom |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significance |
| Model | 367.85 | 9 | 40.87 | 38.84 | < 0.000 1 | ** |
| A | 54.60 | 1 | 54.60 | 51.89 | 0.000 2 | ** |
| B | 128.88 | 1 | 128.88 | 122.48 | < 0.000 1 | ** |
| C | 6.46 | 1 | 6.46 | 6.14 | 0.042 3 | * |
| AB | 12.64 | 1 | 12.64 | 12.01 | 0.010 5 | * |
| AC | 23.18 | 1 | 23.18 | 22.03 | 0.002 2 | ** |
| BC | 0.74 | 1 | 0.74 | 0.70 | 0.429 5 | |
| A2 | 113.74 | 1 | 113.74 | 108.10 | < 0.000 1 | ** |
| B2 | 20.94 | 1 | 20.94 | 19.90 | 0.002 9 | ** |
| C2 | 3.64 | 1 | 3.64 | 3.46 | 0.105 2 | |
| Residual error | 7.37 | 7 | 1.05 | |||
| Misfit term | 4.10 | 3 | 1.37 | 1.68 | 0.308 1 | |
| Net error | 3.26 | 4 | 0.82 | |||
| Total dispersion | 375.21 | 16 | ||||
| Note: * indicates significant difference (P < 0.05), ** indicates extremely significant difference (P < 0.01) | ||||||
从表 10可以看出,回收率模型P < 0.05,表明该模型可靠,达到了显著水平,决定系数R2=0.980 4,说明该模型可以解释98.04%的响应值变化,拟合度非常精确;该模型失拟项P>0.05,不显著,说明整个模型在该回归区域内合理,可用来分析藻蓝蛋白回收率结果。根据F值大小可得出影响藻蓝蛋白回收率的因素为活性炭加入量>活性炭目数>吸附时间。
由图 7中纯度和回收率预测值和实际值的对比结果可以看出,本次试验回收率的预测值和实际值比较接近,而纯度的预测值和实际值有一定差距,可能是由于在各个条件下纯度的变化范围较小,导致结果较难预测,从而造成一定误差,但总体上模型可靠。
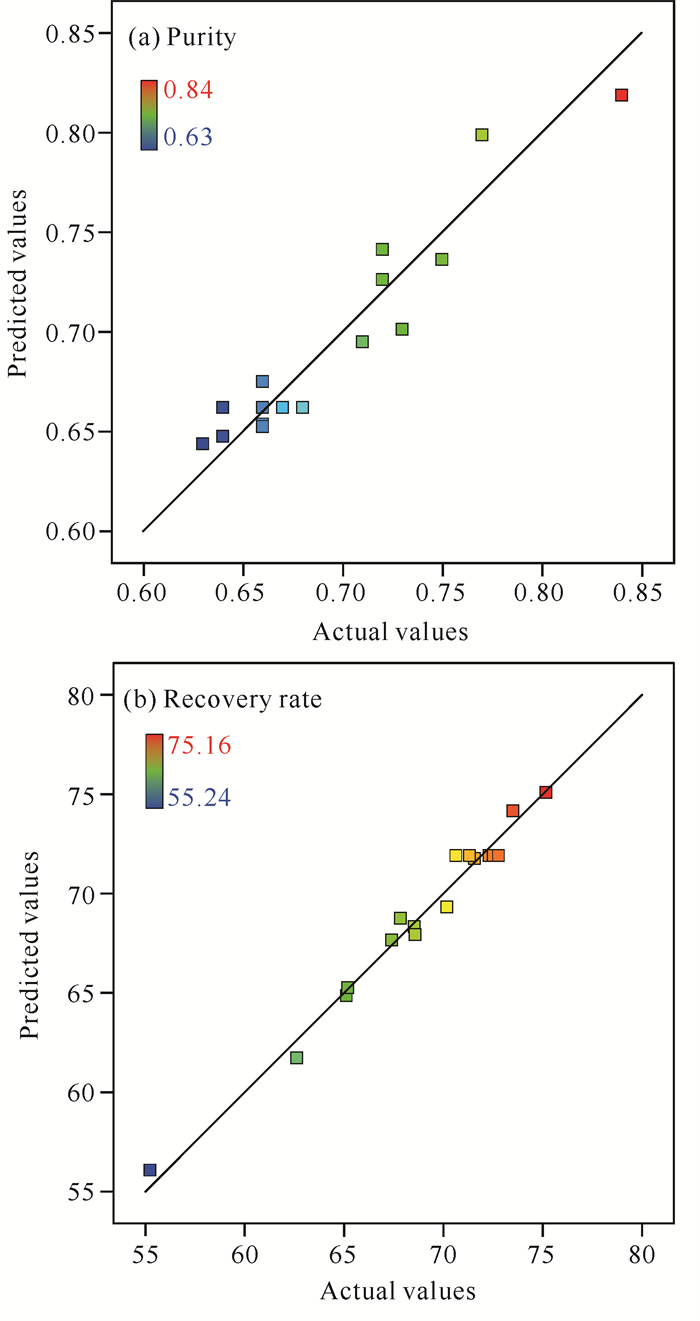
|
| 图 7 纯度和回收率预测值与实际值对比 Fig.7 Comparison of predicted values with actual values of purity and recovery rate |
2.3.4 活性炭吸附法不同因素间的相互作用
活性炭加入量与吸附时间交互作用的响应面图如图 8、图 9所示。通过响应面的最优组合分析可得到活性炭吸附法粗提藻蓝蛋白的最优条件为300目活性炭,活性炭加入量0.5 g/20 mL,吸附时间10 min。预测值纯度为0.80,回收率为70.56%。
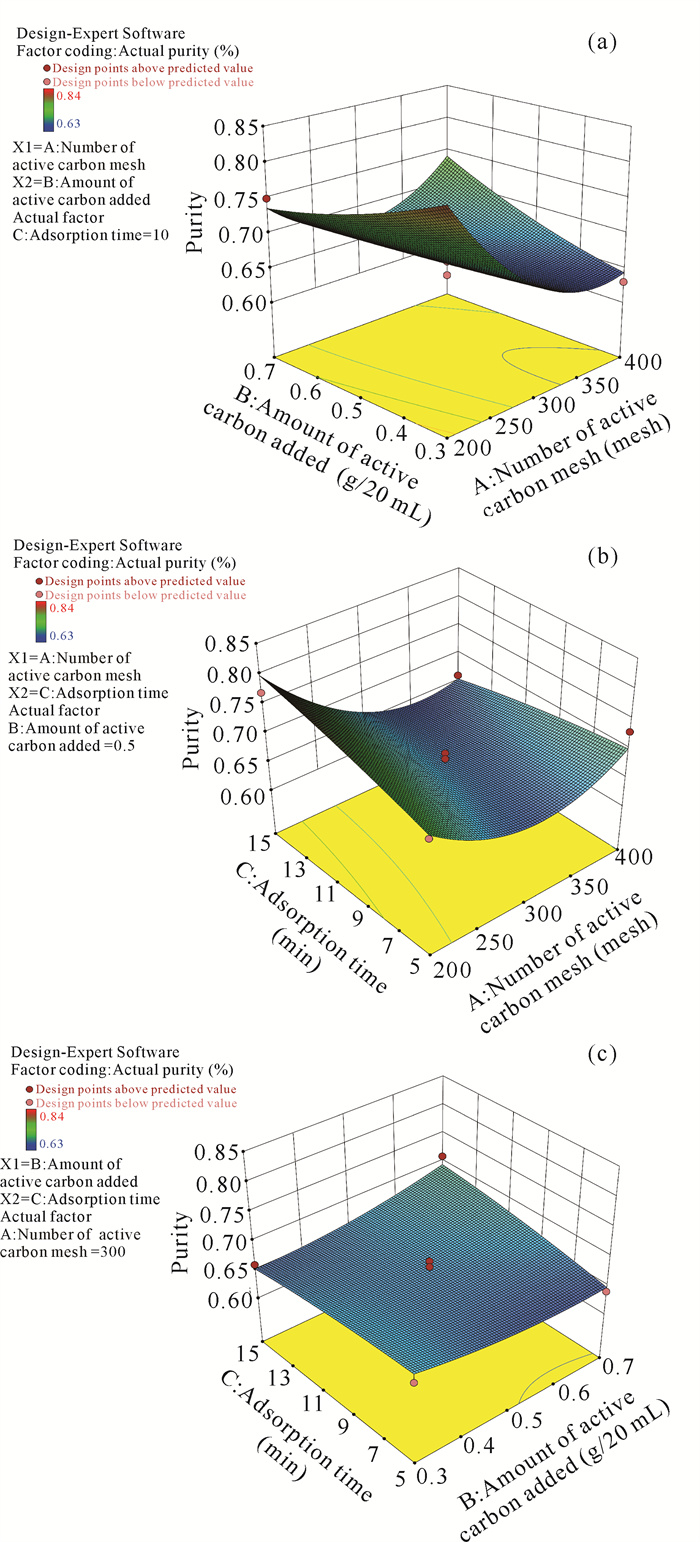
|
| 图 8 纯度模型中活性炭加入量与吸附时间交互作用图 Fig.8 Interaction diagram of active carbon added amount and adsorption time in purity model |
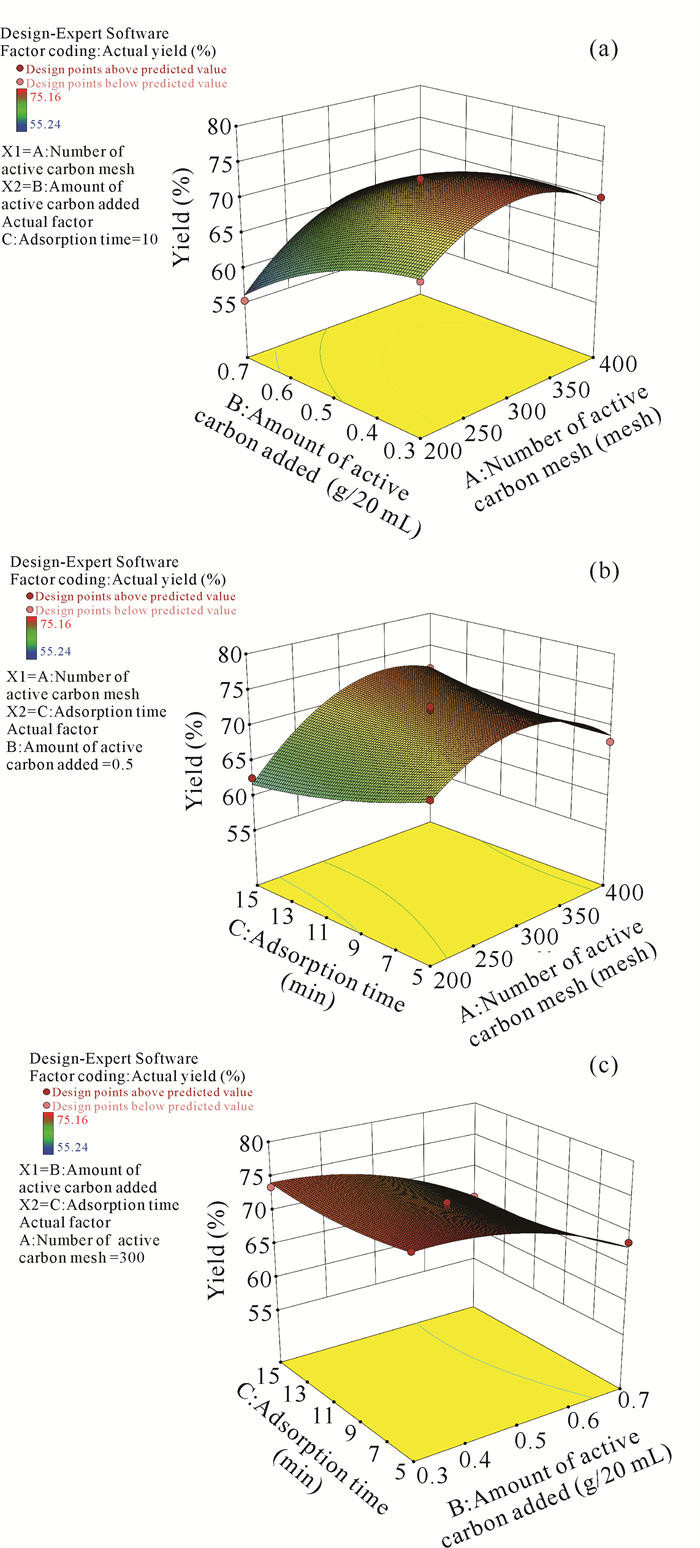
|
| 图 9 回收率模型中活性炭加入量与吸附时间交互作用图 Fig.9 Interaction diagram of active carbon added amount and adsorption time in the recovery rate model |
2.3.5 验证性试验
采用响应面优化法所得的最优提取条件:300目活性炭,活性炭加入量0.5 g/20 mL,吸附时间10 min,进行验证性试验,重复3次,取平均值,测得藻蓝蛋白纯度为0.80,回收率为73.23%。表明该方案稳定可靠,具有实用价值。
2.4 疏水层析洗脱结果及其光谱图分析对藻蓝蛋白依次进行洗脱,首先,采用0.05 mol/L PBS缓冲液(含0.6 mol/L PBS硫酸铵)洗脱,得到近200 mL黄绿色藻液;其次,采用0.05mol/L PBS缓冲液(含0.3 mol/L PBS硫酸铵)洗脱,得到亮蓝色藻液;再次,采用0.05 mol/L PBS缓冲液洗脱,得到亮蓝色藻液;最后,采用纯水洗脱,得到蓝绿色藻液。将依次洗脱得到的各藻液进行紫外测定,分别合并纯度1-2、纯度2-3和纯度大于3的藻液,各藻液全波长扫描光谱见图 10。采用0.05 mol/L PBS缓冲液(含0.6 mol/L PBS硫酸铵)以及最后采用纯水洗脱出的物质主要是叶绿素、杂蛋白等杂质;采用0.05 mol/L PBS缓冲液(含0.3 mol/L PBS硫酸铵)和0.05 mol/L PBS缓冲液梯度洗脱出来的物质主要是藻蓝蛋白。藻蓝蛋白提纯结果如表 11所示,经过溶胀-活性炭吸附-疏水层析三步提纯藻蓝蛋白后,纯度1-2的藻蓝蛋白回收率为14.63%,纯度2-3的藻蓝蛋白回收率为37.49%,纯度>3的藻蓝蛋白回收率为9.03%,总回收率为61.15%。纯度2-3的藻液可用于后续纯化,以得到更高纯度的藻蓝蛋白。
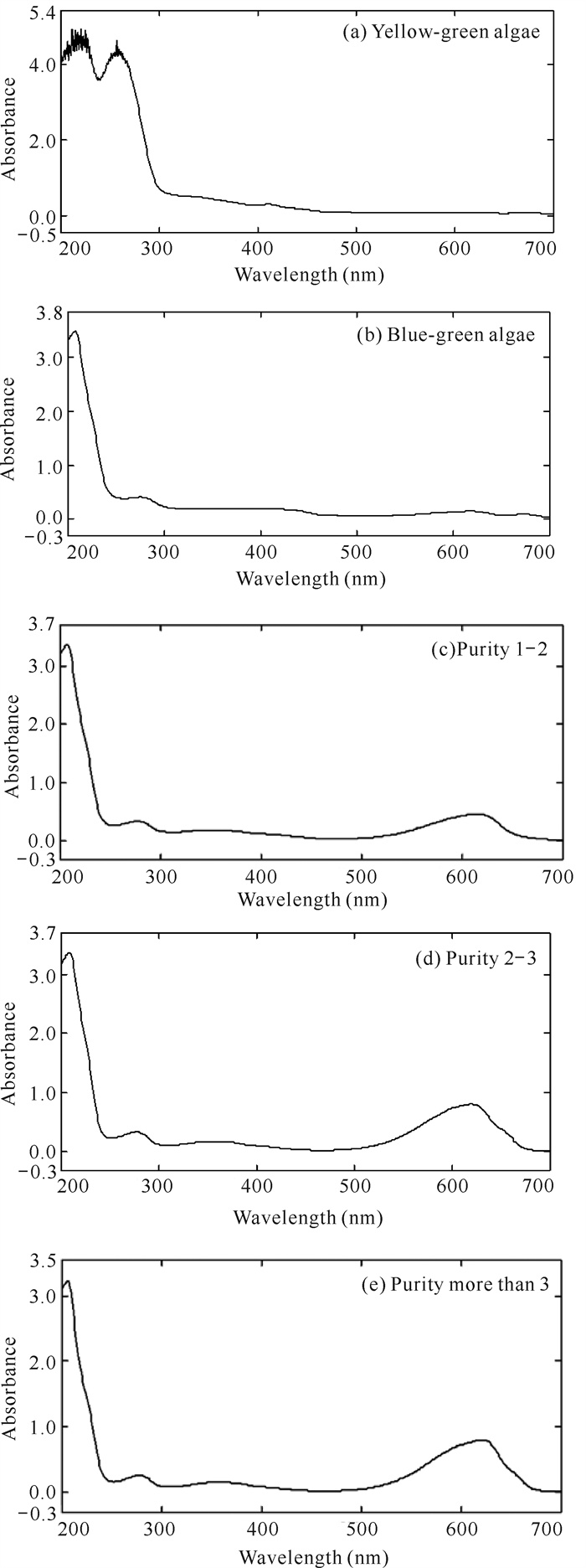
|
| 图 10 各藻液的紫外光谱图 Fig.10 Ultraviolet spectrum of each algal liquid |
| 方法 Method |
纯度 Purity |
回收率(%) Recovery rate (%) |
| Swell method | 0.47 | 2.17 |
| Charcoal adsorption process | 0.8 | 73.23 |
| Hydrophobic chromatography | 1.34(1-2) | 14.63 |
| 2.47(2-3) | 37.49 | |
| 3.16(>3) | 9.03 |
3 讨论
藻蓝蛋白是螺旋藻中的一种天然蓝色色素,具有很高的营养价值和药用价值[24],总蛋白质含量高达55%-65%[12],但是其来源单一,纯化难度较大,生产成本较高[25]。为进一步提高螺旋藻的破壁效率,降低提取成本,提高产品回收率和纯度,分离出医药级藻蓝蛋白,本研究以响应面分析法优化藻蓝蛋白的破壁条件和提取方法。
溶胀法和冻融法提取藻蓝蛋白所需设备简单,操作性强[26, 27]。本研究通过对溶胀法和冻融法中不同破壁影响因素进行响应面模型设计试验,结果表明溶胀法优于冻融法,冻融法规模化生产时间长,难以实现。高浓度的硫酸铵溶液(饱和度大于40%)可以沉淀藻蓝蛋白,缺点是引入大量的硫酸铵,易使土壤酸化板结,为后续的处理带来麻烦[12, 26],而活性炭相比硫酸铵具有价廉易得、安全无污染、比表面积较大、吸附能力强和吸附时间短等特点[7, 28]。本研究通过采用活性炭代替传统盐析法所用的硫酸铵,可有效去除藻蓝蛋白粗提液中的杂蛋白与小分子杂质,不必经过透析等特殊处理即可上柱纯化,提升藻蓝蛋白纯度,使提取过程更加简单可行,同时在使用过程中不会影响提取物的性质,为后期规模化试验的开展以及生产线的建设提供了参考。但活性炭吸附法仍存在吸附条件难以控制、吸附杂质选择性机理尚不明确等缺点,还有待进一步改进。
柱层析法存在进口填料昂贵、清洗不方便、上样量低等缺陷,本研究采用北京生产的疏水层析填料进行藻蓝蛋白纯化,不仅降低了成本,而且获得了医药级藻蓝蛋白,但未能得到试剂级藻蓝蛋白,后续试验考虑将藻蓝蛋白液进行二次过柱以提高纯度。目前,本研究提出的藻蓝蛋白提取纯化工艺仍存在提升空间,后续将进一步综合考察各类方法,筛选出更适合藻蓝蛋白工业化生产的提纯工艺,为藻蓝蛋白的提取工艺优化提供理论参考。
4 结论本研究结果表明,经过溶胀法破壁-活性炭吸附法提取-疏水层析纯化三步提纯藻蓝蛋白的工艺优化后,从钝顶螺旋藻中可分离出医药级(P≥3.0)藻蓝蛋白,所用试剂及耗材价廉易得、安全无污染、提取成本较低,为日后的深加工与应用提供了前期基础。
| [1] |
LI Y, ZHANG Z, PACIULLI M, et al. Extraction of phycocyanin-A natural blue colorant from dried spirulina biomass: Influence of processing parameters and extraction techniques[J]. Journal of Food Science, 2020, 85(3): 727-735. DOI:10.1111/1750-3841.14842 |
| [2] |
CAO J, PAN Q W, ZHENG M X, et al. Phycocyanin nanoparticle as a novel sonosensitizer for tumor sonodynamic therapy of michigan cancer foundation-7 cells in vitro[J]. Journal of Nanoscience and Nanotechnology, 2021, 21(5): 3035-3040. DOI:10.1166/jnn.2021.19139 |
| [3] |
HAMDAN N T, JWAD B A A A A, JASIM S A. Synergistic anticancer effects of phycocyanin and Citrullus colocynthis extract against WiDr, HCT-15 and HCT-116 colon cancer cell lines[J]. Gene Reports, 2021(22): 100972. |
| [4] |
翟诗翔, 李文军, 李莉莉, 等. 藻蓝蛋白对四氯化碳诱导的大鼠肝纤维化及肠道微生物的影响[J]. 海洋科学, 2021, 45(7): 103-109. |
| [5] |
BANNU S M, LOMADA D, GULLA S, et al. Potential therapeutic applications of C-phycocyanin[J]. Current Drug Metabolism, 2019, 20(12): 967-976. |
| [6] |
KUDDUS M, SINGH P, THOMAS G, et al. Recent developments in production and biotechnological applications of C-phycocyanin[J]. BioMed Research International, 2013, 2013: 742859. |
| [7] |
肖海芳, 马海乐, 孙进良, 等. 不同破壁方法对条斑紫菜藻红蛋白提取效果的影响[J]. 食品研究与开发, 2006, 27(10): 54-56. DOI:10.3969/j.issn.1005-6521.2006.10.017 |
| [8] |
侯兆乾, 刘鑫阳, 史超, 等. 冻融法和超声破碎法提取螺旋藻中藻蓝蛋白的工艺研究[J]. 内蒙古农业大学学报(自然科学版), 2017, 38(2): 69-75. |
| [9] |
林红卫, 伍正清, 黄文榜, 等. 钝顶螺旋藻中藻蓝蛋白的提取新工艺[J]. 广西化工, 1997, 26(4): 5-7. |
| [10] |
张以芳, 刘旭川, 李琦华. 螺旋藻藻蓝蛋白提取及稳定性试验[J]. 云南大学学报(自然科学版), 1999, 21(3): 1-5. |
| [11] |
俞建峰, 傅剑, 马潇, 等. 细胞破壁对螺旋藻藻蓝蛋白提取效果的影响[J]. 食品与机械, 2017, 33(5): 173-177. |
| [12] |
陈裕. 巢湖蓝藻藻蓝蛋白提取的破壁方法研究[D]. 合肥: 合肥工业大学, 2015.
|
| [13] |
刘鑫阳, 郜晋楠, 段开红, 等. 2步盐析法纯化螺旋藻中藻蓝蛋白[J]. 内蒙古农业大学学报(自然科学版), 2019, 40(1): 60-66. |
| [14] |
徐润, 陈野, 孙平. 钝顶螺旋藻藻蓝蛋白储存稳定性研究[J]. 食品研究与开发, 2017, 38(12): 25-30. |
| [15] |
ASHAOLU T J, SAMBORSKA S K, LEE C C, et al. Phycocyanin, a super functional ingredient from algae; properties, purification characterization, and applications[J]. International Journal of Biological Macromolecules, 2021, 193(Pt B): 2320-2331. |
| [16] |
苏雨, 张发宇, 余金卫, 等. 分段盐析联合两步柱层析纯化巢湖蓝藻藻蓝蛋白[J]. 安徽农业大学学报, 2018, 45(3): 487-491. |
| [17] |
黄峙, 杨芳, 郑文杰, 等. 用液相等电聚焦电泳纯化藻蓝蛋白亚基[J]. 高等学校化学学报, 2006(6): 1051-1054. |
| [18] |
张晓萌, 张发宇, 余金卫, 等. 粉末活性炭联合柱层析法纯化藻蓝蛋白的研究[J]. 安徽农业大学学报, 2020, 47(4): 554-558. |
| [19] |
盛晶梦, 张发宇, 袁梦媛, 等. 粉末活性炭联合盐析法纯化藻蓝蛋白的研究[J]. 合肥工业大学学报(自然科学版), 2017, 40(2): 242-247. |
| [20] |
廖晓霞, 张学武. 高效分离纯化藻蓝蛋白新法[J]. 食品工业科技, 2011, 32(6): 273-275, 280. |
| [21] |
徐蕾然. 钝顶螺旋藻中藻蓝蛋白提取纯化及稳定性研究[D]. 天津: 天津科技大学, 2013.
|
| [22] |
YAN S G, ZHU L P, SU H N, et al. Single-step chromatography for simultaneous purification of C-phycocyanin and allophycocyanin with high purity and recovery from Spirulina (Arthrospira) platensis[J]. Journal of Applied Phycology, 2011, 23: 1-6. |
| [23] |
BENNETT A, BOGORAD L. Complementary chromatic adaptation in a filamentous blue-green alge[J]. The Journal of Cell Biology, 1973, 58: 419-435. |
| [24] |
YU P, WU Y T, WANG G W, et al. Purification and bioactivities of phycocyanin[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(18): 3840-3849. |
| [25] |
郝帅, 秦玉, 王成涛. 功能食品藻蓝蛋白的生理活性研究进展[J]. 食品与生物技术学报, 2017, 36(12): 1233-1240. |
| [26] |
姜国庆, 闫秋丽, 李东, 等. 螺旋藻中藻蓝蛋白提取、纯化及稳态化研究进展[J]. 食品安全质量检测学报, 2021, 12(6): 2332-2338. |
| [27] |
于淑坤, 岳思君, 李敏, 等. 钝顶螺旋藻藻蓝蛋白分离纯化[J]. 食品科技, 2019, 44(5): 248-252. |
| [28] |
莫柳达. 螺旋藻中藻蓝蛋白的分离纯化、荧光探针研制及其在快速检测中的应用[D]. 福州: 福州大学, 2020.
|



