江苏省作为我国水产养殖大省之一,拥有丰富的海水贝类资源。2020年,江苏省海水贝类产量约为63.09万t,占全省海水养殖总产量的68.4%。其中,以文蛤(Meretrix meretrix)为代表的蛤类是江苏省主要的养殖品种,产量达38.88万t,占海水贝类产量的61.6%[1]。然而,由于围填海、港口建设等因素的影响,文蛤等经济贝类所处的潮间带滩涂栖息环境受到影响,滩涂养殖资源量有所下降[2]。为了弥补滩涂养殖文蛤对销售市场供应的严重不足,池塘养殖文蛤已成为稳定市场供给的必要补充,并逐渐形成了由粗放型养殖向集约化养殖发展的新趋势。
目前,我国养殖池塘正处于生态化改造实施阶段,多营养层次综合养殖(Integrated Multi-Trophic Aquaculture,IMTA)等生态健康养殖模式得到大力推广。多营养层次综合养殖狭义上是指在同一水体进行不同营养层次生物的混养[3],在生产过程中常见的综合养殖模式有虾贝混养、鱼虾混养、虾蟹混养等[4-6]。混养模式相比传统的单一养殖模式能提高单位水体利用效率,获取额外经济效益,提升产品品质[7]。在肌肉营养品质[8, 9]、水体稳定性[10]、生化免疫[11]等方面混养模式要优于单养模式。因此,探讨不同养殖模式下文蛤的生理状况,对文蛤的健康养殖及绿色生态模式构建具有重要意义。
代谢组(Metabolome)是指在某段时间细胞内代谢物的集合,是生物体生理状态的直观反映,能够切实有效地反映环境因素的影响[12]。代谢组学通过多元统计方法和液相色谱质谱联用(LC-MS)技术结合,可以更直观地看到生物体在特定环境中代谢物的变化,相比于单一指标的测定,其所反映的生物体生理状况更为全面准确[13]。目前有关文蛤生理情况的研究主要集中在排氨率和耗氧率、基因或蛋白表达量及酶活指标测定等[14-16],关于红壳色文蛤(以下简称“红文蛤”)选育系的研究主要利用代谢组分析不同世代营养品质的差异[17],但尚未见有不同养殖模式对红文蛤代谢生理影响的研究报道。因此,本实验拟从代谢组学角度研究红文蛤在不同养殖模式下代谢产物的差异,旨在探究红文蛤在不同养殖模式下的代谢响应机制,为文蛤的科学健康养殖提供理论参考。
1 材料与方法 1.1 材料与设计实验所用文蛤为江苏省文蛤良种场繁育的红文蛤选育系,红文蛤养殖采用单养(D组)和虾蛤混养(H组)两种模式,实验地点位于江苏省启东市某家庭农场。池塘四周平台建3-5 m宽的贝埕用于红文蛤养殖(放养密度50万粒/667 m2),贝埕水深控制在0.5-1.0 m,混养池塘深水区放养脊尾白虾(Exopalaemon carinicauda)种虾(养殖密度为1-1.5 kg/667 m2),其余环境条件基本一致(pH值为7.6-8.0)。H组和D组各设置3个平行,红文蛤4月份投苗养殖至当年9月份取样,样品规格如表 1所示。从池塘南北两处平台上分别随机选取30个活力良好的红文蛤组成2个样品,将红文蛤样品置于冰面解剖获取部分肝胰腺,于液氮中速冻,放置于-80℃超低温冰箱保存备用;另取足部肌肉混样用于游离氨基酸测定。称取样品并加入5%三氯乙酸,于均质机(FSH-2A,常州市亿能实验仪器厂)均质并定容至25 mL,超声波提取20 min后,静置2 h,用双层滤纸过滤,吸取1 mL过滤液,离心10 min (4℃,10 000 g),吸取上清液,采用高效液相色谱仪测定氨基酸组成和含量。
| 养殖模式 Culture mode |
壳长(mm) Shell length (mm) |
壳宽(mm) Shell width (mm) |
壳高(mm) Shell height (mm) |
粒重(g) Grain weight (g) |
| Mixed culture (H) | 32.24±2.96 | 14.86±1.24 | 26.95±2.21 | 8.80±2.20 |
| Single culture (D) | 31.12±2.66 | 14.81±1.30 | 26.39±2.30 | 8.33±2.13 |
1.2 方法 1.2.1 代谢物提取
精确称取样品(100±0.02) mg至5 mL EP管中,加入1 mL组织提取液(75%甲醇∶氯仿=9∶1,25% ddH2O),再加入3颗钢珠,于组织研磨仪50 Hz研磨1 min,重复上述操作2次。室温超声波提取30 min,冰上放置30 min,12 000 g离心20 min,取上清液650 μL至2 mL离心管中,真空浓缩仪浓缩后,加入200 μL 50%乙腈溶液配置4 mg/L 2-氯苯丙氨酸溶液复溶样品,经过0.22 μm膜过滤,得到待测液[18]。
1.2.2 LC-MS检测色谱条件:仪器采用液相色谱仪(赛默飞Thermo Vanquish),使用ACQUITY UPLC HSS T3 1.8 μm (2.1 mm×150 mm)色谱柱,自动进样器温度设为8℃,以0.25 mL/min的流速、40℃的柱温,进样2 μL进行梯度洗脱,流动相为正离子0.1%甲酸水(A2)-0.1%甲酸乙腈(B2),负离子5 mmol/L甲酸铵水(A3)-乙腈(B3)。梯度洗脱程序为0-1 min,2% B2/B3;1-9 min,2%-50% B2/B3;9-12 min,50%-98% B2/B3;12-13.5 min,98% B2/B3;13.5-14 min,98%-2% B2/B3;14-20 min,2% B2-正模式, 14-17 min,2% B3-负模式。
质谱条件:仪器使用质谱仪(赛默飞Thermo Q Exactive Plus),电喷雾离子源(ESI),正(Positive, PDS)、负(Negative, NEG)离子电离模式,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气30 arb,辅助气10 arb。毛细管温度325℃,以分辨率70 000进行全扫描,扫描范围m/z为81-1 000,并采用高能诱导裂解(HCD)进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除无必要的MS/MS信息。
1.3 数据处理与代谢物筛选使用ProteoWizard软件(v3.0.8789)将获得的原始数据转换成xcms输入文件格式,利用R软件(v3.3.2)的XCMS程序包进行峰识别、峰过滤和峰对齐,得到包括质核比、保留时间及峰面积等信息的数据矩阵,将数据导出通过Excel等软件进行后续分析,进而通过峰面积批次归一化等手段比较不同量级的数据[19]。在多元统计分析前对数据进行自适(UV)换算处理,以获得更加可靠且直观的结果。转化后的数据矩阵通过主成分分析(PCA)获得样本总体分布情况,然后应用偏最小二乘法(PLS-DA)和正交偏最小二乘法(OPLS-DA)判别分析组间差异。同时,基于京都基因及基因组百科全书(KEGG,https://www.genome.jp/kegg/pathway.html)数据库和代谢通路分析(MetPA,https://www.metaboanalyst.ca)进行代谢物ID的转换以及代谢物富集分析。
筛选条件:在P≤0.05且变量投影重要度(VIP)≥1的条件下进行代谢物筛选。筛选后对代谢物进行鉴定,首先须确认代谢物精确分子量(分子量误差 < 30 ppm),然后根据MS/MS模式所得碎片信息在人类代谢组数据库(HMDB,https://www.hmdb.ca)、Metlin数据库(https://metlin.scripps.edu)、Massbank数据库(https://www.massbank.jp/)、LipidMaps数据库(https://www.lipidmaps.org)以及Mzcloud数据库(https://www.mzcloud.org)进一步匹配注释。
2 结果与分析 2.1 多元统计分析将两种不同养殖模式的红文蛤样品进行PCA,结果显示所有样本均出现在95%置信区间的椭圆内,正负离子模式下D组和H组数据点在空间分布上明显分离,表明两组之间的代谢模式有差异[图 1: (a)(b)]。在PLS-DA和OPLS-DA两种模型下,D组和H组样本均发生组内聚集且组间分离趋势,以OPLS-DA模型下更加明显[图 1: (c)(d)(e)(f)],说明单养模式和虾蛤混养模式下红文蛤代谢模式产生了变化。PLS-DA和OPLS-DA模型中R2和Q2用于判别模型的稳定性,由表 2可知,PLS-DA和OPLS-DA模型中R2和Q2均大于0.5,表明模型稳定可靠,且数值越接近1说明模型越好。
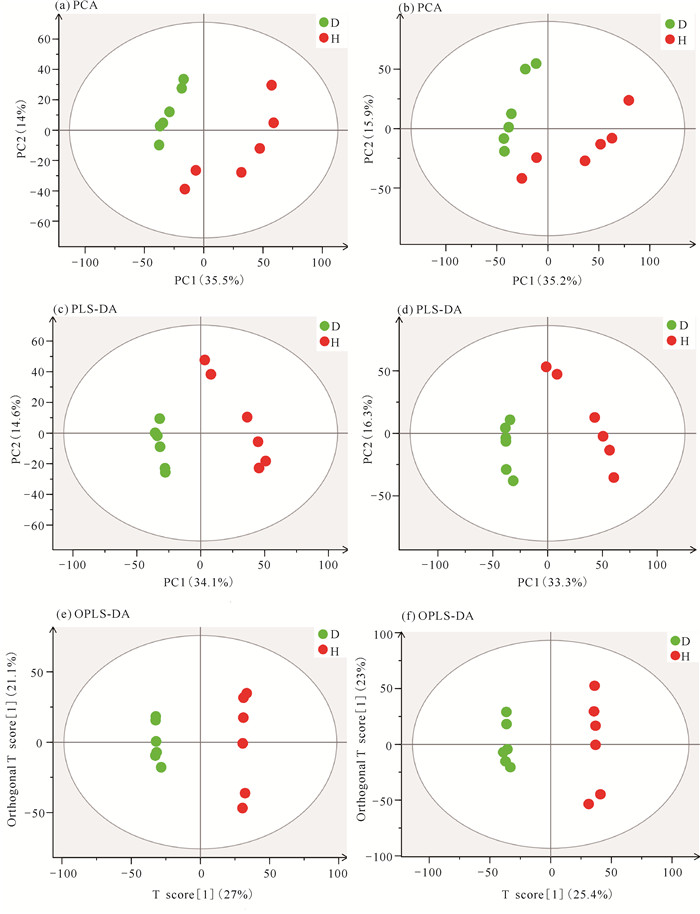
|
| 图 1 红文蛤肝胰腺的代谢物谱散点图 Fig.1 Scatter diagram of hepatopancreas metabolite spectra of red M.meretrix |
| 模型 Model |
样品比较 Sample comparison |
离子模式 Ion mode |
RX2 | RY2 | Q2 |
| PLS-DA | D vs H | Positive | 0.557 | 0.998 | 0.938 |
| Negative | 0.573 | 0.996 | 0.925 | ||
| OPLS-DA | D vs H | Positive | 0.557 | 0.998 | 0.861 |
| Negative | 0.573 | 0.996 | 0.859 | ||
| Note: RX2 and RY2 represent the interpretation rate of model;Q2 represents the predictive ability of model | |||||
2.2 差异代谢物的筛选
通过代谢物筛选,最终获得3 192种差异代谢物,其中POS模式中有1 386种,NEG模式中有1 806种。其中,在POS模式中上调的差异代谢物有491种,下调的差异代谢物有895种[图 2(a)];在NEG模式中上调的差异代谢物有601种,下调的差异代谢物有1 205种[图 2(b)]。进一步通过代谢物鉴定,可获得准确信息的代谢物有151种,其中POS模式中有105种,NEG模式中有46种。
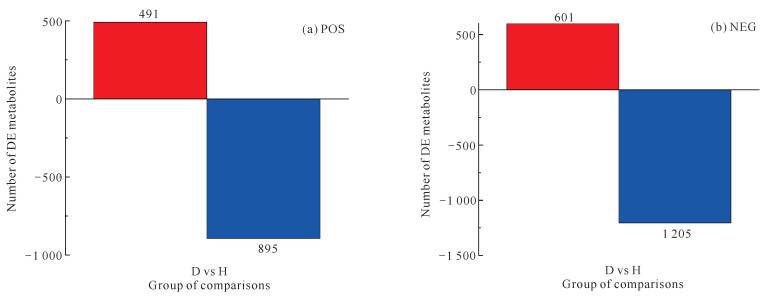
|
| Red indicates significantly up-regulated metabolites, blue indicates significantly down-regulated metabolites 图 2 差异代谢物柱状图 Fig.2 Bar plots of differential metabolites |
差异代谢物聚类分析热图结果如图 3所示。与D组相比,H组有54种差异代谢物上调,97种差异代谢物下调。这些差异显著的代谢物主要包括氨基酸及其衍生物(如天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺等)、核苷酸(如AMP、胞嘧啶苷酸、尿嘧啶苷酸等)、能量物质等。其中,氨基酸及其衍生物上调的有L-天冬氨酸、L-天冬酰胺、L-谷氨酰胺、L-谷氨酸等,下调的有L-丙氨酸、2-氧精氨酸等。
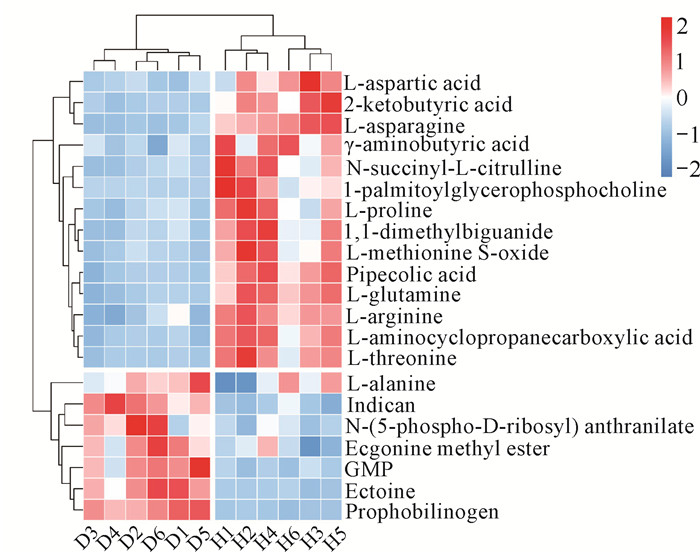
|
| 图 3 红文蛤显著差异代谢物的凝聚层次聚类分析热图 Fig.3 Aggregation hierarchical cluster analysis heat map of significantly different metabolites of red M.meretrix |
2.3 差异代谢物的代谢通路分析
将H组和D组比较后得到的显著性差异代谢物进行KEGG代谢通路富集,共富集到76条代谢通路。IP (Impact)>0.2中排名前9的代谢通路分别为丙氨酸、天冬氨酸和谷氨酸代谢,D-精氨酸和D-鸟氨酸代谢,精氨酸和脯氨酸代谢,精氨酸生物合成,谷胱甘肽代谢,D-谷氨酰胺和D-谷氨酸代谢,泛酸和辅酶A的生物合成,嘧啶代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成(图 4)。可见两种养殖模式以氨基酸代谢通路影响为主,富集显著性最高的是丙氨酸、天冬氨酸和谷氨酸代谢通路。筛选出的8种差异代谢物(谷氨酸、谷氨酰胺、天冬氨酸、L-精氨酸、鸟氨酸、γ-氨基丁酸、2-氧精氨酸、尿嘧啶)的位置、相互作用关系以及它们指向的代谢路径如图 5所示。其中谷氨酸、谷氨酰胺、天冬氨酸是上述9条代谢通路中的关键差异代谢物(表 3)。

|
| 图 4 红文蛤差异代谢物的代谢通路影响因子分析 Fig.4 Metabolic pathway influencing factors analysis of different metabolites of red M.meretrix |

|
| Red arrow represents up regulation, green arrow represents down regulation, blue arrow represents the relationship between metabolites 图 5 关键差异代谢物在主要代谢通路上的关系示意图 Fig.5 Schematic diagram of the relationship between key differential metabolites on major metabolic pathways |
| KEGG通路 KEGG pathway |
代谢物数目 Number ofmetabolites |
代谢通路影响值 Influence value of metabolic pathway |
通路ID Pathway ID |
包含的代谢物 Metabolites included |
| Alanine, aspartate and glutamate metabolism | 8 | 0.755 | ko00250 | L-aspartic acid↑, L-asparagine↑, Adenylsuccinic acid↓, L-alanine↓, L-glutamine↑, L-glutamic acid↑, γ-aminobutyric acid↑, N-acetyllysine↑ |
| D-arginine and D-ornithine metabolism | 3 | 0.500 | ko00472 | 2-oxoarginine↓, 5-amino-2-oxopentanoic acid↑, L-arginine↑ |
| Arginine and proline metabolism | 9 | 0.413 | ko00330 | L-arginine↑, Creatine↑, 2-oxoarginine↓, γ-aminobutyric acid↑, L-proline↑, Ornithine↑, L-glutamic acid↑, L-glutamic γ-semialdehyde↑, 5-aminopentanoate↑ |
| Arginine biosynthesis | 6 | 0.347 | ko00220 | L-arginine↑, L-glutamine↑, N-acetylornithine↓, L-glutamic acid↑, L-aspartic acid↑, Ornithine↑ |
| Glutathione metabolism | 5 | 0.286 | ko00480 | Glutathione↑, L-glutamic acid↑, Pyroglutamic acid↓, Ornithine↑, Ascorbate↑ |
| D-glutamine and D-glutamate metabolism | 2 | 0.262 | ko00471 | L-glutamic acid↑, L-glutamine↑ |
| Pantothenate and CoA biosynthesis | 4 | 0.243 | ko00770 | Pantothenic acid↑, L-aspartic acid↑, Uracil↑, 2-dehydropantoate↑ |
| Pyrimidine metabolism | 5 | 0.225 | ko00240 | UMP↑, L-glutamine↑, CMP↑, Thymidine↓, Uracil↑ |
| Phenylalanine, tyrosine and tryptophan biosynthesis | 6 | 0.218 | ko00400 | Quinate↑, N-(5-phospho-D-ribosyl)anthranilate↓, Prephenate↑, L-phenylalanine↓, 3-dehydroshikimate↑, L-tryptophan↑ |
| Note: ↑and↓indicate up-regulation and down-regulation, respectively | ||||
2.4 氨基酸测定验证
两种不同养殖模式下红文蛤斧足组织氨基酸的测定结果显示,D组和H组存在差异。由表 4可知,H组与D组相比,天冬酰胺、谷氨酸等9种氨基酸含量发生了显著变化(P < 0.05),这与代谢组的分析结果基本一致。
| 氨基酸 Amino acid |
H组(mg/g) Group H (mg/g) |
D组(mg/g) Group D (mg/g) |
| Asp | 187.10±4.34 | 162.50±4.08** |
| Glu | 727.54±5.37 | 704.22±9.14* |
| Ser | 12.06±0.26 | 12.55±0.63 |
| His | 37.60±0.93 | 32.60±0.75** |
| Gly | 545.87±7.11 | 532.09±4.01 |
| Thr | 173.36±1.66 | 135.52±1.66** |
| Arg | 521.95±4.17 | 470.94±5.46** |
| Ala | 1 250.47±23.93 | 1 399.69±28.71** |
| Tyr | 55.68±2.11 | 54.81±2.06 |
| Cys | 7.10±0.64 | 7.41±0.40 |
| Val | 69.81±2.15 | 69.24±1.75 |
| Met | 35.15±2.87 | 42.46±3.13** |
| Phe | 49.20±1.11 | 54.20±0.96* |
| Ile | 51.78±1.87 | 52.27±2.95 |
| Leu | 71.78±1.25 | 63.55±3.03 |
| Lys | 101.65±1.35 | 99.26±1.68 |
| Pro | 53.59±2.55 | 71.26±2.92** |
| Note: * indicates significantly difference (P < 0.05) and ** indicates extremely significantly difference (P < 0.01) between group H and D in the same row | ||
3 讨论
本研究结果表明,混养模式和单养模式下红文蛤的代谢存在差异,可能是由于不同的养殖模式下其群落结构、浮游植物数量及水体理化指标等诸多因素均有不同,对养殖生物的生理状态和物质积累有不同程度的影响。有研究表明,蟹虾贝混养生态系统的细菌群落结构与功能得到了优化,所以混养系统中水体细菌群落代谢活性显著高于单养系统[20],而且这些微生物涉及动物的营养、安全和健康,对于保持养殖池塘的生产力和生态效率有着重要意义[21]。虾贝混养可以使品种间生长、饵料利用等方面相互促进。有研究表明混养模式对化学需氧量(COD)、悬浮物、活性磷、叶绿素a、浮游藻类数量和弧菌数量均有较大影响,而混养模式中这些水体环境的生物因子比单养池塘更有利于养殖品种的生长[5];虾在水体里频繁活动对底质碎屑的扰动可以提高碎屑的利用率,底栖生物的生长则与碎屑的利用率息息相关[4]。本研究的虾蛤混养系统中,脊尾白虾和红文蛤均属于池塘底部生活品种,而且红文蛤埋栖较浅,有的泥质松软处甚至出现泥面上的大量层叠分布,脊尾白虾的觅食、游动等生物搅动可能也会对养殖红文蛤的生理生态产生影响。笔者认为养殖过程中虾的排泄物及残饵的积累促进了底泥中微生物群落,如底栖硅藻、氨氧化菌(AOB)、亚硝酸盐氧化菌(NOB)等的生长与繁殖,从而为红文蛤的埋栖生活营造了适宜的养殖微环境,促进了红文蛤生长与营养物质的积累。王煜坤等[22]的研究表明罗非鱼(Oreochromis niloticus)混养模式下的氨基酸总量要高于单养模式。张爱芳等[8]也认为混养模式不会降低草鱼(Ctenopharyngodon idellus)的营养价值,反而会提高蛋白质含量、降低脂肪含量,在一定程度上能提高草鱼的肌肉品质。本研究通过氨基酸测定进一步验证了两种养殖模式下氨基酸的差异,虾蛤混养组的天冬氨酸、谷氨酸这两种鲜味氨基酸要显著高于单养组,这与代谢组测定结果一致。因此,虾蛤混养同样有助于红文蛤对氨基酸的积累。
本研究通过LC-MS技术对单养和混养两种模式的红文蛤代谢物进行了研究,共观察到76条代谢通路,筛选出9条差异最显著的代谢通路,且主要集中在氨基酸代谢和合成通路,除最主要的丙氨酸、天冬氨酸和谷氨酸代谢通路外,精氨酸和脯氨酸代谢等4条通路皆与谷氨酸密切相关,而谷氨酸是决定文蛤口感鲜美度最重要的游离氨基酸[23]。近年来在文蛤新品种选育中也发现,丙氨酸、天冬氨酸和谷氨酸代谢通路是传代过程中主要的代谢通路,随着选育代次的增加,子代F5的滋味强度明显强于原代F0[24]。本研究发现,虾蛤混养和文蛤单养对红文蛤氨基酸代谢有显著影响,谷氨酸、天冬氨酸、谷氨酰胺、γ-氨基丁酸、精氨酸均显著上调。谷氨酰胺能有效提高机体抗应激能力,主要表现在营养代谢、能量供给、抑制病菌和抗氧化等方面[25]。精氨酸作为功能性氨基酸,在体内免疫调节中起着重要作用,是最具免疫增强功能的氨基酸[26]。鱼类的研究表明,机体内精氨酸水平升高能够促进谷氨酰胺生成,谷氨酰胺又可作为能源物质氧化,清除细胞内氧化物质以保护细胞组分免受氧化损伤[27]。在栉孔扇贝(Chlamys farreri)的研究中发现,γ-氨基丁酸参与了细胞功能尤其是免疫功能的发挥[28]。天冬氨酸通过脱氨生成草酰乙酸而促进三羧酸循环,是三羧酸循环的重要成分。杨创业[29]研究表明,在海水贝类的三羧酸循环中,谷氨酸和谷氨酰胺能起到补充作用,并且二者是免疫系统与神经系统间的重要信号传导物质。此外,谷氨酸是合成谷胱甘肽所需的关键转氨基配合物,而谷胱甘肽是防御氧化应激的重要组分[30]。因此,上述氨基酸及其衍生物的上调可能也说明了其在红文蛤免疫和抗氧化能力方面发挥了作用,推测虾蛤混养池塘有助于红文蛤氨基酸的积累,提高红文蛤的免疫和抗氧化状态,其原因可能有以下两点:一是在混养模式中,单细胞藻类数量充足、藻相复杂,能够给红文蛤提供相对充足的营养;二是红文蛤在躲避虾类扰动的过程中,代谢旺盛,免疫力增强。关于混养模式对红文蛤生理的其他积极影响,后续还需结合转录组学和宏基因组分析进一步验证。
4 结论在单养和虾蛤混养两种养殖模式下,红文蛤的代谢产物存在差异,其中谷氨酸、谷氨酰胺、天冬氨酸等氨基酸及其衍生物是主要的差异代谢物。氨基酸测定结果也验证了两种养殖模式的氨基酸差异,虾蛤混养组的天冬氨酸和谷氨酸这两种鲜味氨基酸要显著高于单养组,这与代谢组中主要差异代谢物结果一致。本研究为后续进一步研究红文蛤养殖品质差异及开发利用养殖模式提供了参考。
| [1] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021.
|
| [2] |
刘鑫. 淤泥质海岸围填海现状评估与潜力预测研究[D]. 南京: 南京师范大学, 2014.
|
| [3] |
唐启升, 方建光, 张继红, 等. 多重压力胁迫下近海生态系统与多营养层次综合养殖[J]. 渔业科学进展, 2013, 34(1): 1-11. DOI:10.3969/j.issn.1000-7075.2013.01.001 |
| [4] |
胡高宇. 基于Ecopath模型的虾贝海水池塘综合养殖模式研究[D]. 上海: 上海海洋大学, 2020.
|
| [5] |
孔谦. 凡纳滨对虾与鲻鱼混养中精养池的理化生物因子的研究[D]. 湛江: 广东海洋大学, 2011.
|
| [6] |
张凤翔, 陈杰, 徐美香, 等. 虾蟹混养模式的创新试验与思考[J]. 科学养鱼, 2020(2): 32-34. DOI:10.3969/j.issn.1004-843X.2020.02.019 |
| [7] |
TROELL M, JOYCE A, CHOPIN T, et al. Ecological engineering in aquaculture-Potential for integrated multi-trophic aquaculture (IMTA) in marine offshore systems[J]. Aquaculture, 2009, 297: 1-9. DOI:10.1016/j.aquaculture.2009.09.010 |
| [8] |
张爱芳, 章海鑫, 肖俊, 等. 不同池塘养殖模式下草鱼肌肉营养成分及氨基酸组成的比较[J]. 安徽农业科学, 2019, 47(6): 91-93, 96. DOI:10.3969/j.issn.0517-6611.2019.06.028 |
| [9] |
杨明, 税春, 施永海, 等. 两种养殖模式下的暗纹东方鲀肌肉营养成分比较[J]. 西北农业学报, 2022, 31(2): 138-146. DOI:10.7606/j.issn.1004-1389.2022.02.002 |
| [10] |
朱方建, 朱长波, 齐振雄, 等. 凡纳滨对虾-草鱼混养模式与对虾单养模式的池塘水质动态及产出效果对比研究[J]. 广东农业科学, 2011, 38(5): 147-152. DOI:10.3969/j.issn.1004-874X.2011.05.052 |
| [11] |
徐滨, 魏开金, 马宝珊, 等. 不同克氏原螯虾养殖模式下幼虾生长、体成分和血淋巴生化指标的比较[J]. 淡水渔业, 2021, 51(5): 84-90. DOI:10.3969/j.issn.1000-6907.2021.05.011 |
| [12] |
TOHGE T, RAMOS M S, NUNES-NESI A, et al. Toward the storage metabolome: Profiling the barley vacuole[J]. Plant Physiology, 2011, 157(3): 1469-1482. DOI:10.1104/pp.111.185710 |
| [13] |
DUNN W B, BAILEY N J C, JOHNSON H E. Measuring the metabolome: Current analytical technologies[J]. Analyst, 2005, 130(5): 606-625. DOI:10.1039/b418288j |
| [14] |
王盛青, 尤宏争, 邵蓬, 等. 温度和盐度对文蛤耗氧率、排氨率、滤食率的影响[J]. 经济动物学报, 2016, 20(2): 69-73, 77. |
| [15] |
陈素华, 吴杨平, 陈爱华, 等. 文蛤CDK1基因在选育与自然群体早期生长阶段中的表达特征[J]. 中国水产科学, 2020, 27(9): 1042-1051. |
| [16] |
白奕天, 丁天扬, 李东东, 等. 不同盐度对文蛤(Meretrix meretrix)呼吸代谢及体内酶活性的影响[J]. 海洋科学, 2018, 42(6): 123-131. |
| [17] |
WEN X Y, CHEN A H, XU Y S, et al. Comparative evaluation of volatile profiles of Asian hard clams (Meretrix meretrix) with different shell colors by electronic nose and GC-MS[J]. Journal of Aquatic Food Product Technology, 2020, 30(1): 1-15. |
| [18] |
WANT E J, MASSON P, MICHOPOULOS F, et al. Global metabolic profiling of animal and human tissues via UPLC-MS[J]. Nature Protocols, 2013, 8(1): 17-32. DOI:10.1038/nprot.2012.135 |
| [19] |
SANGSTER T, MAJOR H, PLUMB R, et al. A pragmatic and readily implemented quality control strategy for HPLC-MS and GC-MS-based metabonomic analysis[J]. Analyst, 2006, 131(10): 1075-1078. DOI:10.1039/b604498k |
| [20] |
刘瑞娟, 田相利, 董双林, 等. 蟹虾贝混养池塘生态系统微生物群落功能多样性研究[J]. 水产科学, 2014, 33(9): 535-544. DOI:10.3969/j.issn.1003-1111.2014.09.001 |
| [21] |
MARTÍNEZ-CÓRDOVA L R, EMERENCIANO M, MIRANDA-BAEZA A, et al. Microbial-based systems for aquaculture of fish and shrimp: An updated review[J]. Reviews in Aquaculture, 2014, 6: 1-18. |
| [22] |
王煜坤, 郝淑贤, 李来好, 等. 不同地区、品种及养殖模式罗非鱼营养差异分析[J]. 食品工业科技, 2018, 39(12): 231-237. |
| [23] |
WEN X Y, CHEN A H, WU Y P, et al. Comparative evaluation of proximate compositions andtaste attributes of three Asian hard clams (Meretrix meretrix) with different shell colors[J]. International Journal of Food Properties, 2020, 23(1): 400-411. |
| [24] |
温心怡. 红壳文蛤风味品质特性及传代对风味的影响[D]. 无锡: 江南大学, 2021.
|
| [25] |
沈海洋, 卢志杰, 秦真东, 等. 谷氨酰胺对斜带石斑鱼GF-1细胞中C-Myc蛋白的表达与神经坏死病毒复制的影响[J]. 水产学报, 2020, 44(9): 1385-1396. |
| [26] |
BUENTELLO J A, GATLIN D M. Effects of elevated dietary arginine on resistance of channel catfish to exposure to Edwardsiella ictaluri[J]. Journal of Aquatic Animal Health, 2001, 13(3): 194-201. |
| [27] |
吴俊光, 王连生, 王常安, 等. 饲料中精氨酸水平对杂交鲟幼鱼抗氧化能力及血清生化指标的影响[J]. 大连海洋大学学报, 2016, 31(3): 272-279. |
| [28] |
王斌. γ-氨基丁酸对栉孔扇贝免疫防御的影响[D]. 烟台: 鲁东大学, 2012.
|
| [29] |
杨创业. 马氏珠母贝人工饲料配方优化及其相关营养代谢研究[D]. 湛江: 广东海洋大学, 2019.
|
| [30] |
王楠. 谷胱甘肽相关酶的性质及其在贝类方面的研究[J]. 生命科学仪器, 2009, 8(2): 59-61. |



