2. 广西壮族自治区中国科学院广西植物研究所, 广西桂林 541006;
3. 广西雅长兰科植物国家级自然保护区管理中心, 广西百色 533209
2. Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China;
3. Guangxi Yachang Orchid National Nature Reserve Management Center, Baise, Guangxi, 533209, China
光作为植物赖以生存的能量来源,是植物生长发育过程中的重要环境因子,也是限制植物生存的主要因素。近年来,光合作用一直是研究的热点,极危植物对生态环境的敏感性与光环境对其生长发育的影响有关。目前,有较多关于濒危植物与光环境关系研究的报道,发现濒危植物在生理生态学方面存在适应性和生存力相对较弱的特点[1],如毛瓣金花茶(Camellia pubipetala)虽然属于阴生植物,但是可以承受一定的强光,此树种适合生长于相对开阔的遮阴环境,光照太强会导致其生长不良,但荫蔽度太大则会使其开花结果率低,自然生境下林下光照强度过低是导致其种群数量得不到增多的重要原因[2];水青树(Tetracentron sinense)在林窗生境下生长良好,其光合能力也相对较好,而林缘和林下生境下生长的水青树在种群竞争中处于劣势,此生境下水青树光合能力较差是其濒危原因之一[3];夏腊梅(Sinocalycanthus chinensis)光合能力较差,对光照的适应能力较弱,在种间竞争中也处于不利地位[4];长序榆(Ulmus elongata)为阳性植物,对光照的需求较高,其幼苗虽然具有一定的耐阴性,但是因光照不足使其不能正常生长而被淘汰,种群自然更新受到限制[5]。这些研究也给濒危植物迁地保护以及种群恢复提供了有价值的参考依据。
贵州地宝兰(Geodorum eulophioides)属兰科(Orchidaceae)地宝兰属多年生草本植物,冬季会有倒苗现象,具有观赏和药用等开发价值。1921年德国植物分类学家Schlechter在贵州罗甸首次发现此物种并命名。2004年在广西雅长兰科植物国家级自然保护区内再次被发现,并成为重点保护对象[6],属于中国特有的珍稀极危植物,被世界自然保护联盟(IUCN)列为极度濒危物种。经调查,贵州地宝兰只适应于海拔较低且气候稍微干旱的生境,海拔300-600 m,常生长在河边、公路边、山坡荒地、疏林灌草丛中,适合生长在pH值为4.6-6.5的微酸性土及酸性土。由于贵州地宝兰对生境条件要求严格以及自身生理条件的限制,再加上种间竞争和人为干扰破坏等因素的影响,使得贵州地宝兰野外种群数量极少[7]。目前,一些学者已经对贵州地宝兰的繁育技术[8, 9]、濒危原因[6]、遗传多样性[10]等进行了研究,但仍需要全面深入系统地研究,从而从根本上解决贵州地宝兰的濒危问题。因此,开展贵州地宝兰的光合生理特性研究,探究其对不同光照强度的适应性,以制定更有效、更合理的保护机制,为其迁地保护和种群恢复提供参考依据。
1 材料和方法 1.1 材料和处理试验于广西植物研究所内进行,试验材料为贵州地宝兰成年盆栽苗,栽种于内径21 cm、深18 cm的塑料花盆中,每盆栽植1-3株,选取生长最佳植株作为试验苗,栽培基质为林下表层土壤,pH值为5.34,有机质含量1.26%,全氮1.53 g/kg,全磷1.09 g/kg,全钾14.11 g/kg。通过黑色尼龙网遮阴,建立相对光照强度分别为8%、20%、45%、100%(不遮阴)的荫棚4个。苗木先在8%的遮荫棚中恢复生长1个月,然后随机分成4组,每组6盆,5月中旬分别放置于4个荫棚下进行处理。每天浇灌足量的水,每个月施肥1次,同时进行病虫害防治。
1.2 方法 1.2.1 光合作用日进程变化的测定光合作用日进程变化于9月中旬进行测定。在天气晴朗的条件下,采用Li-6400便携式光合作用系统(Li-Cor, Lincoln, Nebraska, USA)测定贵州地宝兰叶片的气体交换参数,并利用自然光和空气CO2浓度进行测定。从4个遮荫棚中选取长势较好的3株贵州地宝兰,于北京时间8:00-17:00每间隔1.5 h测定1次,每个叶片重复测3组数据,取平均值。测定项目包括叶片的净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,mmol·m-2·s-1)、气孔导度(Gs,mmol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1);环境因子参数包括光合有效辐射(PAR,μmol·m-2·s-1)、空气温度(Ta,℃)、空气相对湿度(RH,%)等微气象参数。
1.2.2 光合-光响应曲线的测定在10月下旬选择晴朗天气于上午9:00-12:00进行测量,采用Li-6400便携式光合作用系统测定健康叶片的光合-光响应曲线。测量前为了充分活化光合系统,叶片先在600 μmol·m-2·s-1光照强度下诱导30 min(仪器自带的红蓝光源)。使用开放气路,设空气流速为0.5 L·min-1,叶片温度设为29℃,CO2浓度为400 μmol·mol-1(用CO2钢瓶控制浓度)。设置13个不同的光照强度梯度为1 800 μmol·m-2·s-1、1 500 μmol·m-2·s-1、1 200 μmol·m-2·s-1、1 000 μmol·m-2·s-1、800 μmol·m-2·s-1、600 μmol·m-2·s-1、400 μmol·m-2·s-1、200 μmol·m-2·s-1、150 μmol·m-2·s-1、100 μmol·m-2·s-1、50 μmol·m-2·s-1、20 μmol·m-2·s-1、0 μmol·m-2·s-1,每测定一个光照强度需要3 min。以光量子通量密度(PPFD)为横轴、净光合速率(Pn)为纵轴绘制光合-光响应曲线,依照以下方程拟合Pn-PPFD曲线[11]:
| $ P_{\mathrm{n}}=P_{\max }\left(1-C_{0} e^{-\varPhi \mathrm{PPFD} / P_{\max }}\right), $ | (1) |
式中,Pmax为最大净光合速率,Φ为弱光下光化学量子效率,C0为度量弱光下净光合速率趋于0的指标。表观量子利用效率(AQY)为Pn-PPFD曲线初始部分(0-150 μmol·m-2·s-1)的曲线斜率。通过适合性检验,拟合效果良好,然后用下列公式计算光补偿点(LCP):
| $ \mathrm{LCP}=P_{\max } \ln \left(C_{0}\right) / \varPhi。$ | (2) |
Pn达到Pmax时的PPFD为光饱和点(LSP),计算公式如下:
| $ \mathrm{LSP}=P_{\max } \ln \left(100 C_{0}\right) / \varPhi。$ | (3) |
将待测的贵州地宝兰植株于前一天晚上移至室内进行暗适应,第二天黎明前用Li-6400荧光测定系统测定叶片的叶绿素a荧光参数,测定时尽量选择同一光照强度下成熟度、健康度和方位一致的叶片。主要测量参数包括初始荧光(F0)、最大荧光(Fm)、可变荧光(Fv)、PSⅡ潜在光化学效率(Fv/F0)和PSⅡ最大光化学效率(Fv/Fm)[12]。
1.2.4 光合色素含量的测定从进行光合测定的植株上采集叶片剪碎,用95%乙醇提取叶片的光合色素,24 h后分别在665 nm、649 nm和470 nm下测定提取液的吸光值,根据参考文献[13]的公式计算出叶绿素a (Chl a)、叶绿素b (Chl b)和类胡萝卜素(Car)的含量,以及叶绿素a与叶绿素b的比值(Chl a/Chl b)、类胡萝卜素与叶绿素(a+b)的比值[Car/Chl(a+b)]。
1.2.5 生长指标的测定测量不同光照处理下贵州地宝兰植株的株高、基径、最大叶长、最大叶宽等生长状况参数。
1.3 数据处理对上述测定或统计的各个指标,采用SPSS软件进行单因素方差分析,并用Duncan法进行多重比较,绘图采用Origin 9.2软件。
2 结果与分析 2.1 光合作用日进程变化特征在不同光照强度处理下贵州地宝兰光合作用日进程变化如图 1所示。不同光照强度下的光合有效辐射(PAR)、空气温度(Ta)和相对湿度(RH)的日变化均呈“单峰”型曲线。PAR最大值均出现在12:30,8%、20%光照强度下PAR最大值不超过400 μmol·m-2·s-1,100%光照强度下PAR最大值为1 496.93 μmol·m-2·s-1。100%光照强度下Ta在14:00最大,接近40℃;其他处理下Ta在15:30最大,均达到36℃以上。RH的变化趋势与Ta相反,在15:30时RH达到最低值。不同光照强度处理下的PAR和Ta表现为8%光照强度 < 20%光照强度 < 45%光照强度 < 100%光照强度,RH的变化趋势则与PAR、Ta相反。
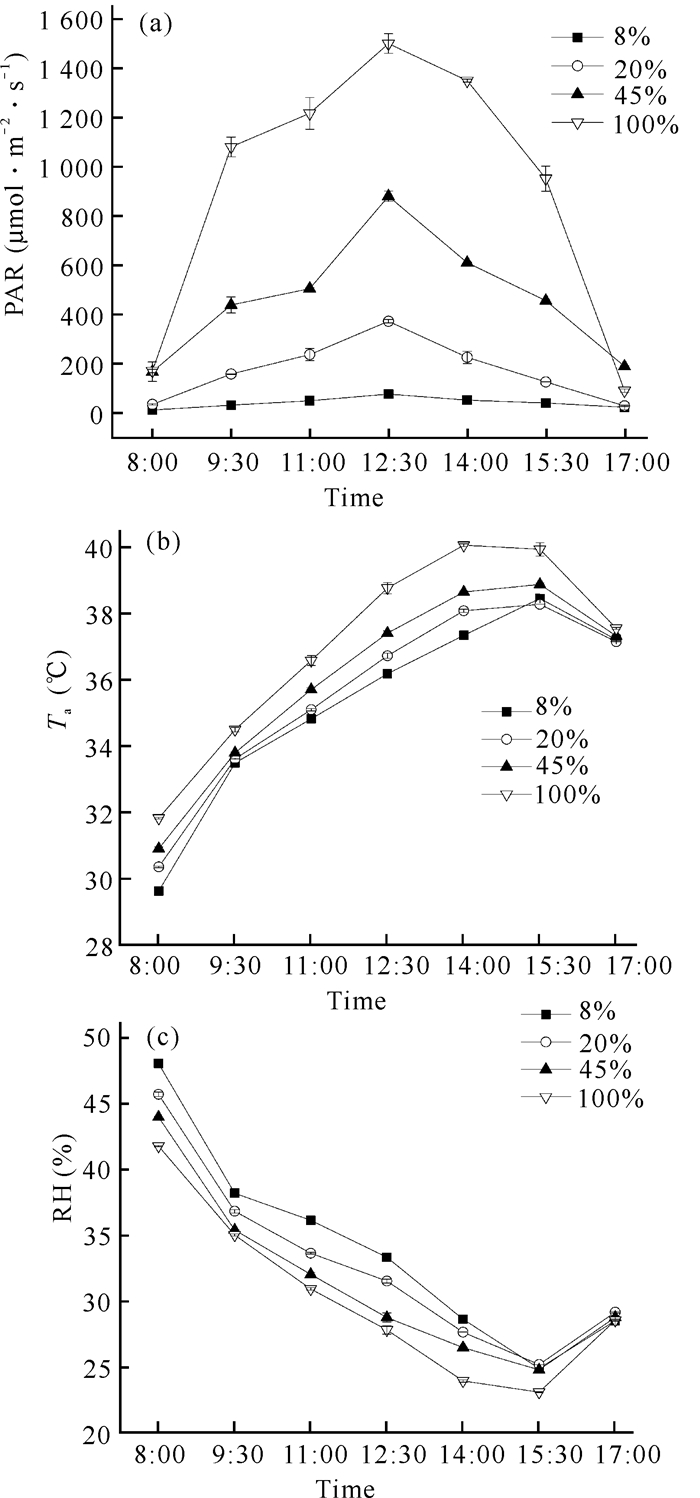
|
| 图 1 不同光照强度下光合有效辐射、空气温度和相对湿度的日变化 Fig.1 Diurnal changes of photosynthetically active radiation, air temperature and relative humidity under different light intensities |
2.2 光照强度对贵州地宝兰气体交换参数日变化的影响
不同光照强度下贵州地宝兰气体交换参数日变化如图 2、表 1所示。由图 2(a)可知,在20%、45%和100%光照强度下的Pn呈“双峰”型曲线,峰值分别出现在11:00和14:00;3种光照强度下的Pn日变化相似,均是8:00后开始上升,11:00到达峰值后开始下降,12:30达到第一个低值,有明显的“午休”现象,随后上升,14:00后又开始下降。8%光照强度下的Pn日变化呈“单峰”型曲线,变化趋势平缓,没有出现“午休”现象。4种光照强度下的日均净光合速率表现为20%光照强度>45%光照强度>100%光照强度>8%光照强度(表 1),表明20%光照强度下贵州地宝兰积累光合产物的能力更强。
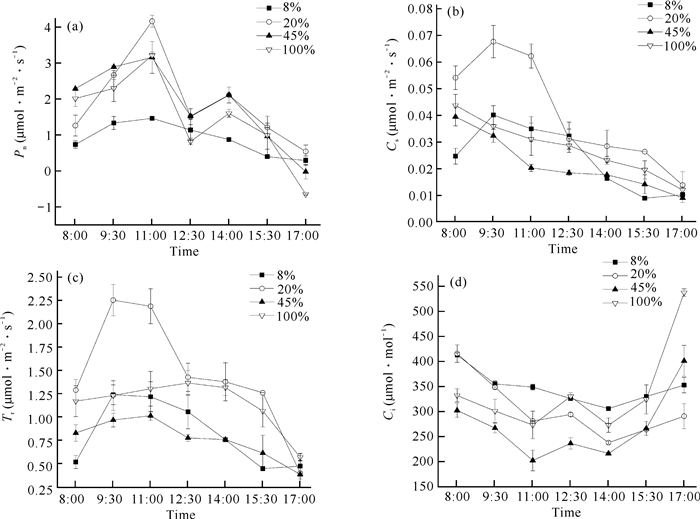
|
| 图 2 不同光照强度下贵州地宝兰气体交换参数日变化 Fig.2 Daily variation of gas exchange parameters of G.eulophioides under different light intensities |
| 光照强度 Light intensity |
日均净光合速率 (μmol·m-2·s-1) Pn(μmol·m-2·s-1) |
日均气孔导度 (mmol·m-2·s -1) Gs(mmol·m-2·s -1) |
日均胞间CO2浓度 (μmol·mol-1) Ci(μmol·mol-1) |
日均蒸腾速率 (mmol·m-2·s -1) Tr(mmol·m-2·s -1) |
| 8% | 0.905±0.163b | 0.024±0.005b | 341±13.57a | 0.844±0.143b |
| 20% | 1.922±0.453a | 0.040±0.009a | 301±24.73b | 1.454±0.234a |
| 45% | 1.760±0.393a | 0.021±0.004b | 270±25.27c | 0.765±0.081b |
| 100% | 1.483±0.553a | 0.028±0.004b | 335±36.12a | 1.145±0.103a |
| Note: Different lowercase letters in the same column indicate significant differences (P < 0.05) | ||||
由图 2(b)可知,20%和8%光照强度处理下Gs呈先升高后降低的趋势,在9:30达到最大值;45%和100%光照强度处理的Gs呈降低趋势。20%光照强度处理下日均Gs显著高于其他3个处理(表 1),说明20%光照强度处理有利于贵州地宝兰叶片气孔调节,提高其光合作用效率。Tr的日变化均呈“单峰”型变化曲线,各个光照强度处理下Tr的最高峰出现时间不尽相同,但总体上12:30前的Tr值高于12:30之后[图 2(c)];4种光照强度处理下的日均Tr大小为20%光照强度>100%光照强度>8%光照强度>45%光照强度(表 1)。20%、45%和100%光照强度下叶片的Ci变化趋势呈“W”型,从8:00开始迅速下降,到11:00达到第一个低值,随后上升后又下降,到14:00达到第二个低值[图 2(d)];而8%光照强度下Ci的变化趋势呈“V”型,与Pn的变化规律相反。
2.3 光照强度对贵州地宝兰光合-光响应曲线的影响不同光照强度下贵州地宝兰的光合-光响应曲线与光照强度的变化趋势总体上一致,但净光合速率(Pn)的大小明显存在差异(图 3)。在光量子通量密度(PPFD)小于400 μmol·m-2·s-1时,Pn随着PPFD的增加而增大;而PPFD大于400 μmol·m-2·s-1时,Pn稍有下降。不同光照强度处理下Pn的大小表现为20%光照强度>8%光照强度>45%光照强度>100%光照强度。

|
| 图 3 不同光照强度下贵州地宝兰叶片的光合-光响应曲线 Fig.3 Photosynthesis-light response curve in leaves of G.eulophioides under different light intensities |
不同光照强度下贵州地宝兰的Pmax以20%光照强度最高,其值为(2.529±0.252) μmol·m-2·s-1,且显著高于其他3个处理(P < 0.05);与20%光照强度下的Pmax相比,8%、45%、100%分别下降25.74%、36.34%和64.53%。随着光照强度的增加,贵州地宝兰的光饱和点(LSP)表现为先升高后降低的趋势,且在20%光照强度下值最大;而光补偿点(LCP)则是随着光照强度的升高而上升;表观量子效率(AQY)与LSP变化趋势一致,以20%光照强度下最高,100%光照强度下最低,且100%光照强度下的AQY显著低于其他处理(表 2)。
| 光照强度 Light intensity |
最大净光合速率 (μmol·m-2·s-1) Pmax (μmol·m-2·s-1) |
表观量子效率 AQY |
光饱和点 (μmol·m-2·s-1) LSP (μmol·m-2·s-1) |
光补偿点 (μmol·m-2·s-1) LCP (μmol·m-2·s-1) |
| 8% | 1.878±0.160b | 0.085±0.004b | 527±11.72a | 2.580±0.410c |
| 20% | 2.529±0.252a | 0.101±0.006a | 542±34.00a | 3.306±1.505b |
| 45% | 1.610±0.341b | 0.068±0.068b | 447±52.03b | 3.868±1.128b |
| 100% | 0.897±0.150c | 0.035±0.007c | 407±77.48c | 5.773±1.423a |
| Note: Different lowercase letters in the same column indicate significant differences (P < 0.05) | ||||
2.4 光照强度对贵州地宝兰叶绿素荧光参数的影响
由表 3可知,贵州地宝兰叶片PSⅡ的初始荧光(F0)随着光照强度的升高而逐渐降低,最大荧光(Fm)和可变荧光(Fv)呈先升高后降低的趋势,且均在20%光照强度下最高。PSⅡ最大光化学效率(Fv/Fm)反映了植物的反应中心内原初光能转化效率,Fv/F0则反映了PSⅡ的潜在活性,当受到光照胁迫时,Fv/Fm显著下降,光合电子传递受到影响。100%光照强度下Fv/Fm和Fv/F0显著低于8%、20%、45%光照强度处理(P < 0.05),表明100%光照强度下贵州地宝兰PSⅡ潜在活性中心受损,光合作用受到抑制。
| 光照强度 Light intensity |
初始荧光 F0 |
最大荧光 Fm |
可变荧光 Fv |
最大光化学效率 Fv/Fm |
光化学效率 Fv/F0 |
| 8% | 315.6±14.53a | 1 530.7±35.83a | 1 215.0±21.66a | 0.794±0.005a | 3.76±0.206a |
| 20% | 304.70±9.39a | 1 600.7±80.40a | 1 296.0±112.10a | 0.809±0.005a | 4.25±0.131a |
| 45% | 284.0±21.73a | 1 365.0±29.72b | 1 081.0±72.02a | 0.793±0.012a | 3.84±0.273a |
| 100% | 282.0±15.00a | 1 040.7±99.72c | 758.7±15.63b | 0.722±0.040b | 2.73±0.509b |
| Note: Different lowercase letters in the same column indicate significant differences (P < 0.05) | |||||
2.5 光照强度对贵州地宝兰叶绿素含量的影响
由图 4可知,随着光照强度的增大,贵州地宝兰叶片叶绿素a (Chl a)、叶绿素b (Chl b)、类胡萝卜素(Car)含量和叶绿素(a+b)[Chl (a+b)]含量均逐渐降低,其中20%、45%、100%光照强度相比于8%光照强度下Chl a含量分别降低11.71%、43.75%、72.59%,Chl b含量分别降低14.07%、43.07%、72.73%,Car含量分别降低6.32%、30.48%、56.88%。Car/Chl (a+b)比值随着光照强度的增大而逐渐升高,而不同光照强度处理下Chl a/Chl b无显著差异。
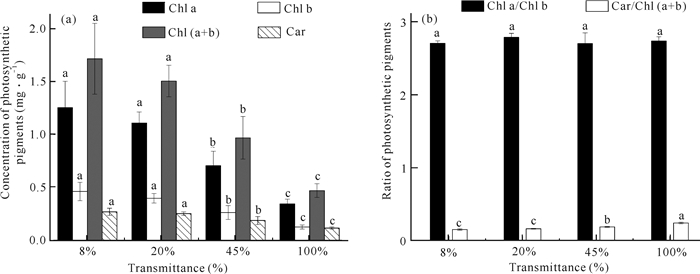
|
| Different small letters indicate that the same index has significant differences under different light intensities (P < 0.05) 图 4 不同光照强度下贵州地宝兰叶片的光合色素含量及比值 Fig.4 Photosynthetic pigment content and ratio in leaves of G.eulophioides under different light intensities |
2.6 光照强度对贵州地宝兰生长状况的影响
不同光环境对贵州地宝兰生长状况的影响如表 4所示。植株的株高、基径、最大叶长和最大叶宽均在20%光照强度下最大,8%光照强度下次之,100%光照强度下各项指标相比其他光照强度较低。通过观察发现,全光照下的植株出现纤细、矮小、灼伤、长斑等发育不良的现象,表明强光对贵州地宝兰的生长有明显的抑制作用,适度遮阴有利于贵州地宝兰的生长。
| 光照强度 Light intensity |
株高(cm) Plant height (cm) |
基径(mm) Basal diameter (mm) |
最大叶长(cm) Maximum leaf length (cm) |
最大叶宽(cm) Maximum leaf width (cm) |
| 8% | 15.00±2.16a | 2.25±0.56a | 18.33±3.68a | 2.67±0.56b |
| 20% | 15.25±2.16a | 2.73±0.24a | 18.88±1.02a | 3.30±0.31a |
| 45% | 13.67±0.47b | 2.20±0.31a | 15.17±1.65b | 2.37±0.53b |
| 100% | 12.00±0.00b | 1.77±0.15b | 15.50±2.50b | 2.35±0.15b |
| Note: Different lowercase letters in the same column indicate significant differences (P < 0.05) | ||||
3 讨论
光对于植物的光合作用主要有以下3点作用:第一,提供同化力形成所需要的能量;第二,活化光合作用的关键酶和促使气孔开放;第三,调节植物自身光合机构的发育[14]。本研究中,贵州地宝兰净光合速率日进程主要呈“双峰”型曲线,8%光照强度下的净光合速率日均值最低,其他3个处理均随着光照强度的增大而逐渐下降,说明光照不足或过剩都会对贵州地宝兰植株的光合作用产生不利的影响。贵州地宝兰自身具有的光合“午休”现象,使净光合速率Pn和光合有效辐射PAR呈非完全正比,且午间胞间CO2浓度Ci上升,表明此时净光合速率下降主要受非气孔限制因素的影响。净光合速率可以显示植物的光合能力,也就是在同等的条件下,具有较高净光合速率的植物具备更强的光合能力和对周围环境的适应能力[15]。本研究中,贵州地宝兰的日均净光合速率表现为20%光照强度>45%光照强度>100%光照强度>8%光照强度,表明20%光照强度下贵州地宝兰积累光合产物的能力更强。不同光照强度处理下贵州地宝兰的日均净光合速率Pn均小于2 μmol· m-2·s-1,表明贵州地宝兰的光合能力较弱,不利于光合作用产物积累,同时对环境的适应能力较差,使得其在群落竞争中处于劣势。
本研究中,贵州地宝兰在20%光照强度下叶片的Pmax最高,45%和100%光照强度处理下Pmax显著降低,说明其在光照强度过高的情况下光合能力下降。一般阴生植物的LSP为500-1 000 μmol·m-2·s-1或者更低,LCP小于20 μmol·m-2·s-1[16]。本研究中,贵州地宝兰植株在不同光照强度下的LSP和LCP都比较低,属于阴生植物,与生长于荫蔽的环境相吻合,说明适当的遮阴是栽培贵州地宝兰的必要条件之一。表观量子效率是光合作用中光能转化指标之一,其值越高则植物在弱光下转换利用光能的效率就越高。贵州地宝兰在8%、20%、45%光照强度下AQY显著高于100%光照强度,说明贵州地宝兰在弱光下具有较强的适应性。
经过暗适应处理后,叶片的Fv/Fm是植物是否发生光抑制的重要判断标准[17]。在没有环境胁迫的前提下,植物经过暗适应处理后的Fv/Fm通常在0.8以上[18, 19],凌晨测定的Fv/Fm可以作为是否发生长期光抑制的指标[20]。8%、20%和45%光照强度下贵州地宝兰的Fv/Fm在0.8左右,表明在此光照强度下其未发生明显光抑制现象,而全光照下Fv/Fm显著降低,出现了长期光抑制现象,表明其生长受到了强光胁迫[21]。
叶绿素是植物光合作用中最重要的色素成分,强光胁迫会影响叶绿素的合成,促使已经合成的叶绿素分解,导致其含量下降。Chl a/Chl b的数值是衡量植物耐阴性的重要指标之一,有研究人员认为阴生叶的Chl a/Chl b数值在3以下,阳生叶的Chl a/Chl b数值在3以上[22, 23]。本研究中,随着光照强度的增加,贵州地宝兰植株的Chl (a+b)、Chl a和Chl b含量不断下降,表明强光下叶片叶绿素合成受到影响,同时也会促进叶绿素的分解。强光下叶片叶绿素含量降低以及Car/Chl (a+b)升高都会减少叶片自身对光能的捕捉,从而降低光合机构遭受光氧化破坏的风险,同时也是植物对环境强光胁迫的一种光保护调节机制。
植物的生长发育与光环境有密切的联系,不同的光照强度对植物生长的影响不同,一定的遮光条件能使阴生植物的生长状态达到最佳[24]。本研究表明,株高、基径、最大叶长和最大叶宽均在20%光照强度下最大;8%光照强度下各生长指标较低,可能与光照不足有关;45%光照强度下其生长受到轻微光抑制;100%光照强度下受到严重光抑制,叶片出现灼伤现象。因此,贵州地宝兰适合在适度遮阴的环境下生长。
4 结论贵州地宝兰整体上日均净光合速率、最大净光合速率、表观量子效率均偏低,在群落竞争中处于不利地位。贵州地宝兰属于阴生植物,最适宜在20%光照强度下生长;8%光照强度对其光合作用影响较小;45%光照强度下贵州地宝兰受到轻微光抑制,可以在一定程度上通过改变自身的形态和生理特征来应对外界环境的变化;100%光照强度下贵州地宝兰发生严重光抑制,表现出植株纤细、矮小、起斑点,甚至叶片变黄或被灼伤。因此,贵州地宝兰对光合能力和适应能力较弱,适合生长在相对开阔且具有一定遮阴效果的环境。在迁地保护和种群恢复中,可以选择适当遮阴的环境进行苗木种植,同时对其生长影响较大的竞争植物进行适当砍伐,为其提供良好的生长环境,以提高贵州地宝兰的生长速度,促进其自然更新。
| [1] |
张文辉, 祖元刚, 刘国彬. 十种濒危植物的种群生态学特征及致危因素分析[J]. 生态学报, 2002, 22(9): 1512-1520. DOI:10.3321/j.issn:1000-0933.2002.09.021 |
| [2] |
柴胜丰, 庄雪影, 韦霄, 等. 光照强度对濒危植物毛瓣金花茶光合生理特性的影响[J]. 西北植物学报, 2013, 33(3): 547-554. DOI:10.3969/j.issn.1000-4025.2013.03.018 |
| [3] |
李文英. 濒危植物水青树的光合生理研究[D]. 南充: 西华师范大学, 2019.
|
| [4] |
金则新, 李钧敏, 马金娥. 濒危植物夏蜡梅光合生理生态特性[J]. 浙江大学学报(理学版), 2011, 38(6): 682-688. DOI:10.3785/j.issn.1008-9497.2011.06.015 |
| [5] |
罗光宇, 陈超, 李月灵, 等. 光照强度对濒危植物长序榆光合特性的影响[J]. 生态学杂志, 2021, 40(4): 980-988. |
| [6] |
冯昌林, 蔡树威, 邓振海. 雅长林区贵州地宝兰的濒危原因及保护对策[J]. 广西林业, 2012(9): 43-44. DOI:10.3969/j.issn.1004-0390.2012.09.041 |
| [7] |
魏海燕, 李晓芳, 安明态, 等. 贵州极危植物贵州地宝兰资源现状与濒危原因分析[J]. 山地农业生物学报, 2018, 37(3): 44-48. |
| [8] |
罗玉婷, 罗小瑜, 蓝玉甜, 等. 贵州地宝兰组培快繁生根技术研究[J]. 中国园艺文摘, 2012, 28(12): 40-41, 72. DOI:10.3969/j.issn.1672-0873.2012.12.019 |
| [9] |
蓝玉甜, 韦新莲, 黄岚, 等. 野生贵州地宝兰无菌播种及根状茎繁育技术研究[J]. 安徽农业科学, 2014, 42(2): 395-397, 418. DOI:10.3969/j.issn.0517-6611.2014.02.024 |
| [10] |
营婷. 贵州地宝兰保护遗传学研究[D]. 南京: 南京大学, 2013.
|
| [11] |
BASSMAN J H, ZWIER J C. Gas exchange characteristics of Populus trichocarpa, Populus deltoids and Populus trichocarpa×P.deltoids clone[J]. Tree Physiology, 1991, 8(2): 145-159. DOI:10.1093/treephys/8.2.145 |
| [12] |
SOUZA R P, MACHADO E C, SILVA J A B, et al. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea (Vigna unguiculata) during water stress and recovery[J]. Environmental and Experimental Botany, 2004, 51(1): 45-56. DOI:10.1016/S0098-8472(03)00059-5 |
| [13] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 134-263.
|
| [14] |
许大全. 光合作用气功限制分析中的一些问题[J]. 植物生理学通讯, 1997, 33(4): 241-244. |
| [15] |
黄娟, 吴彤, 孔国辉, 等. 油页岩废渣地12种木本植物光合作用的季节变化[J]. 植物生态学报, 2006, 30(4): 666-674. DOI:10.3321/j.issn:1005-264X.2006.04.017 |
| [16] |
蒋高明. 植物生理生态学[M]. 北京: 高等教育出版社, 2004.
|
| [17] |
张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学报, 1999, 16(4): 444-448. DOI:10.3969/j.issn.1674-3466.1999.04.021 |
| [18] |
JOHNSON G N, YOUNG A J, SCHOLES J D, et al. The dissipation of excess excitation energy in British plant species[J]. Plant, Cell & Environment, 1993, 16(6): 673-679. |
| [19] |
MAXWELL K, JOHNSON G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany, 2000, 51(345): 659-668. DOI:10.1093/jexbot/51.345.659 |
| [20] |
BJÖRKMAN O, DEMMIG B. Photon yield of O2 evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins[J]. Planta, 1987, 170(4): 489-504. DOI:10.1007/BF00402983 |
| [21] |
DEMMING-ADAMS B, ADAMS Ⅲ W W. Photoprotection and other response of plants to high light stress[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43: 599-626. DOI:10.1146/annurev.pp.43.060192.003123 |
| [22] |
LICHTENTHALER H K, BUSCHMANN C, DÖLL M, et al. Photosynthetic activity, chloroplast ultrastructure, and leaf characteristics of high-light and low-light plants and of sun and shade leaves[J]. Photosynthesis Research, 1981, 2(2): 115-141. DOI:10.1007/BF00028752 |
| [23] |
HOFLACHER H, BAUER H. Light acclimation in leaves of the juvenile and adult life phases of ivy (Hedera helix)[J]. Physiologia Plantarum, 1982, 56(2): 177-182. DOI:10.1111/j.1399-3054.1982.tb00321.x |
| [24] |
迟伟, 王荣富, 张成林. 遮荫条件下草莓的光合特性变化[J]. 应用生态学报, 2001, 12(4): 566-568. DOI:10.3321/j.issn:1001-9332.2001.04.020 |



