红树林位于陆地和海洋的交界带,其在净化海水、防风消浪、固碳储碳、维护生物多样性等方面有着不可替代的作用[1, 2]。目前红树林的生境面临破碎化,生存受到威胁,基础的生态服务价值正在急剧退化[3]。据统计,自20世纪80年代,全球红树林面积减少35%以上[4]。造成红树林生态环境恶化的原因有:极端天气或气候变化影响[5]、物种入侵[6]、有害生物如食叶类害虫[7]和蛀木性害虫[8]爆发,围填海、港口建设[9]、养殖[10]、污染[11, 12]、砍伐[13]等活动。
有害生物可造成红树植物落叶甚至死亡,它的爆发是造成红树林面积锐减的重要因素之一。国内外已有许多关于红树林有害生物的研究。例如,美国、巴西、肯尼亚、莫桑比克、塞舌尔、桑给巴尔岛、坦桑尼亚和科摩罗等国家的美洲红树(Rhizophora mangle)遭受了团水虱的危害[14]。哥伦比亚、法国、印尼等报道了杯萼海桑(Sonneratia alba)、白骨壤属(Avicennia germina)、海漆(Excoecaria agallocha)、桐花树(Aegiceras corniculatum)遭到了鳞翅目害虫的危害[15]。印度尼西亚人工红树林出现白轮蚧(Aulacaspis marina)感染红茄苳(R.mucronata)且致死的现象[16]。杨盛昌等[17]统计我国红树林害虫有128种,以鳞翅目和半翅目为主。甄文全等[18]调查广西山口红树林保护区共有451种昆虫,显著多于蒋国芳[19]调查的194种,前者的研究表明红树植物主要害虫种类有海榄雌瘤斑螟(Ptyomaxia sp.)、毛颚小卷蛾(Lasiognatha cellifera)、白囊袋蛾(Chalioides kondonis)、广翅蜡蝉(Ricania sp.)、潜叶蛾(Phyllocnistis sp.)和蛎盾蚧(Lepidosaphes sp.)[20]。近年来,引起北海红树林大面积虫害的有害生物主要有海榄雌瘤斑螟、小袋蛾(Acanthopsyche subferalbata)、柚木肖弄蝶夜蛾(Hybaea puera)、团水虱等。海榄雌瘤斑螟是危害白骨壤(Avicennia marina)的重要食叶类害虫,大爆发时其能在较短时间内吃光寄主的叶片,造成白骨壤严重枯萎[21]。小袋蛾主要危害秋茄(Kandelia obovata)、桐花树和白骨壤[22]。柚木肖弄蝶夜蛾是近年出现的新害虫,主要取食白骨壤,也可危害其他红树植物,大爆发时其危害面积达480 hm2[23]。另外,蚧壳虫作为危害人工林的主要害虫,常造成秋茄生长衰弱[24, 25]。
目前国内外关于人工围填海或港口建设造成红树林大面积消失的报道较多,但关于围填海和港口建设影响红树林内有害生物的研究鲜有报道。已有研究证实,人为活动造成红树林中昆虫种类大幅度减少,虫害频发,红树林生态系统遭受严重的破坏[26]。而互花米草因其耐高盐和耐水淹[27]的特性,可在红树林光滩或死亡斑块中迅速定殖和扩散[28]。
广西红树林研究中心研究人员于2019年观察到广西北海榄根村红树林出现大面积死亡的现象,初步判断是高岭土溢流淤积造成的,高岭土可能与虾塘或码头填埋有关。高岭土是白色、无孔、不膨胀和惰性的矿物质,可用于造纸、陶瓷、耐火材料、油漆、橡胶和塑料、化学合成、药品、农药等[29]。高岭土堆积区增加土壤酸性,产生Al3+毒性,造成植物无法正常生长[30]。另一方面,高岭土黏附在叶片上可阻碍害虫取食,在一定程度上可保护寄主植物叶片[31]。截至2020年5月,该区域红树林受损面积达到16.67 hm2以上[32]。该地位于广西北海铁山港,红树林主要种类为白骨壤,还有少量桐花树、红海榄(R.stylosa)、秋茄和海漆分布。本文以榄根村红树林为研究对象,通过调查红树林有害生物的种类和危害情况,拟为该地白骨壤死亡的原因提供数据支持,并为后期人工修复提出科学建议。
1 材料与方法 1.1 调查站位及其设置结合红树林受损情况,将调查地域分为4个区域,并布设23个食叶害虫调查站位(图 1):林地低潮区红树林样方(L区),含5个站位(L1、L2、L3、L4、L5);中高潮位的严重受损区边缘红树林样方(ED区),含7个站位(ED1、ED2、ED3、ED4、ED5、ED6、ED7);受损区正常生长的红树林样方(AL区),含7个站位(AL1、AL2、AL3、AL4、AL5、AL6、AL7);正常生长红树林对照样方(CK区),含4个站位(CK1、CK2、CK3、CK4)。其中,严重受损区边缘红树林样方(ED区)和受损区正常生长的红树林样方(AL区)的红树植物受高岭土影响较大,低潮区红树林样方(L区)受高岭土影响较小,对照样方(CK区)不受高岭土影响。
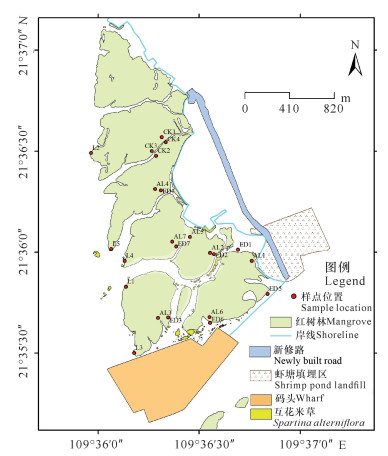
|
| 图 1 食叶害虫调查站位设置图 Fig.1 Survey stations of defoliator pests |
1.2 食叶害虫调查方法
每个站位设置1个10 m×10 m的样方。在每个样方内沿对角线随机选择15株白骨壤,然后以每株白骨壤为中心,按照东西南北4个方位,每个方位采集一枝20 cm长的枝条,每个站位/样方共采集60个枝条。统计所采集枝条的食叶害虫种类、数量、叶片数和叶片受损比率(受损叶片与总叶片的数量之比)。根据柚木肖弄蝶夜蛾食量大且可短时间内吃光叶片的特点,利用Google Earth高清图像(分辨率1 m,2019年11月至2020年4月),结合随机踏查确定害虫种类,测量危害面积[33]。
选择白骨壤叶面受害最为严重的低潮区红树林为调查区域,于2020年3月、4月采集树冠层淤泥痕迹线以上(Upper)和以下区域(Lower)的枝条,统计叶片受损率和虫口密度(虫口数量与样枝数量之比)。3月和4月的气温数据来源于北海市气象局。
1.3 蛀干害虫小蠹的种类和分布研究用锯子采集有蛀孔的白骨壤活树树干,带回室内用砍刀劈开,采集活体小蠹。在显微镜下观察小蠹的形态结构,根据《中国经济昆虫志》等资料分析鉴定小蠹的分类地位。
根据呼吸根的完整与否,将白骨壤分为4类:AAR,呼吸根正常的白骨壤;HAR,呼吸根减半的白骨壤;NAR,没有呼吸根但活着的白骨壤;DT,死亡的白骨壤。每类白骨壤均选择10株进行每木调查,统计小蠹蛀孔数。选择NAR进行调查,共调查10株,将白骨壤树干锯下带回,从地面开始每隔10 cm设置为一个区段,统计并记录每个区段的小蠹蛀孔数。
1.4 外来入侵植物互花米草调查现场调查互花米草生长情况,观察是否有互花米草的死亡现象,并在红树林死亡斑块中查看是否有互花米草入侵现象。利用2019年12月的Google Earth高清图像(分辨率1 m),根据互花米草草斑的特点、形状和纹理勾画出互花米草斑块的外形轮廓,形成kml文件后导入GIS软件进行制图和斑块面积统计。
1.5 数据处理用SPSS软件进行数据处理,使用单因素方差分析检验显著性,并采用Origin和ArcGIS作图。
2 结果与分析 2.1 食叶害虫对红树林的危害对4个区域(低潮区、严重受损区边缘、受损区正常生长和对照区)的白骨壤树冠层水痕线以上的食叶害虫进行统计分析,发现主要的食叶害虫为危害严重且分布较广的柚木肖弄蝶夜蛾(Hyblaea puera)、海榄雌瘤斑螟(Ptyomaxia sp.)和蛎盾蚧(Lepidosaphes sp.)。如图 2a所示,蛎盾蚧的虫口密度最大,其中在严重受损区边缘的虫口密度最高,为16.17头/100叶,显著高于低潮区和受损区正常生长的林地;对照区的蛎盾蚧虫口密度次之,为8.43头/100叶,但与其余3个区域均无显著差别;低潮区林地的蛎盾蚧密度最低,为0.32头/100叶。柚木肖弄蝶夜蛾在低潮区林地最多,达0.34头/100叶,与严重受损区边缘和对照区具有显著差别;受损区正常生长的红树林虫口密度次之,但与其余三区无显著差别。海榄雌瘤斑螟在受损区正常生长区的虫口密度最大,为0.06头/100叶,对照区林地未发现该虫害,但4个区域之间无显著差别。

|
| 不同小写字母代表差异显著,P<0.05。L,低潮区的红树林样方;ED,严重受损区边缘的红树林样方;AL,受损区正常生长的红树林样方;CK,对照区的红树林样方 Different lowercase letters represent significant differences (P < 0.05).L, mangroves in the low tide area.ED, mangroves at the edge of the severely damaged area.AL, mangroves that grow normally in the damaged area.CK, mangroves that grow normally in the control area 图 2 不同区域食叶害虫的虫口密度和叶片受损率的对比 Fig.2 Comparison of the population density and leaf damage rate of defoliator pests in different areas |
4个区域白骨壤叶片受损率大小为低潮区的红树林(41.8%)>严重受损区边缘的红树林(11.19%)>受损区正常生长的红树林(10.66%)>对照区的红树林(9.61%)。低潮区红树林样方的叶片受损率显著大于后三者,而后三者无显著差别(图 2b)。榄根村白骨壤叶片受损率分布如图 3所示,外滩白骨壤叶片受损率较大,靠近内滩的叶片受损率较小。
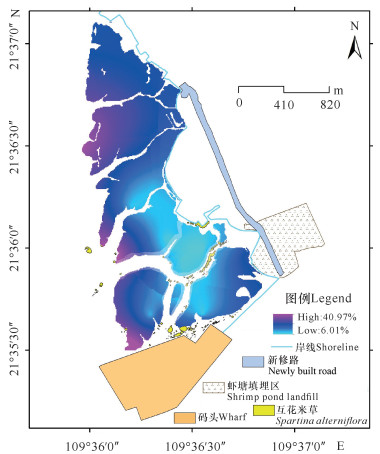
|
| 图 3 榄根村白骨壤叶片受损率分布图 Fig.3 Distribution of leaf damage rate of Avicennia marina in Lan′gen Village |
从遥感图片上判断,柚木肖弄蝶夜蛾于2019年11月入侵榄根村红树林区,分布在红树林区的外滩位置,主要有7个斑块(图 4中白色线条圈出的位置),总面积达2.87 hm2。靠近海岸线和填海区的红树林受高岭土危害较为严重,而柚木肖弄蝶夜蛾主要分布在高岭土危害较轻的低潮区。根据2020年3月份和4月份的现场调查,初步判断该地柚木肖弄蝶夜蛾的发生程度为轻度发生,在榄根村红树林区还未大面积扩散。

|
| 图 4 柚木肖弄蝶夜蛾在榄根村红树林区的分布(白色线条圈出的7个区域,标号1-7) Fig.4 Distribution of Hyblaea puera in mangrove in Lan′gen Village (The seven area circled by white line, labeled 1-7) |
对比树冠层水痕线以上和树冠层水痕线以下的叶片受损率和虫口密度。如图 5a所示,水痕线以上的叶片受损率(68.58%)极显著高于水痕线以下(18.06%)。如图 5b所示,在水痕线以上树冠层柚木肖弄蝶夜蛾的虫口密度为1.20头/100叶,水痕线以下树冠层未发现该虫,前者极显著高于后者。海榄雌瘤斑螟虫口密度较低,水痕线以上为0.30头/100叶,水痕线下为0.44头/100叶,无明显的分布趋势。在低潮区红树林样方(L区)未见蛎盾蚧,表明淹水或淤泥(包括高岭土)附着阻碍了食叶类害虫的取食和定殖。
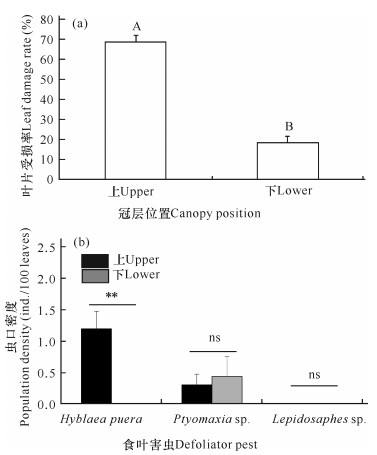
|
| 不同大写字母和“**”代表差异极显著,P<0.001;ns代表两者之间无显著性 Different capital letters and "**" represent significant differences (P < 0.001), ns represents no significance between the two columns 图 5 外滩不同冠层位置的叶片受损情况和食叶害虫虫口密度对比 Fig.5 Comparison of leaf damage and population density of defoliator pest in different canopy positions on the outer beach |
对比2020年3月份和4月份低潮区红树林水痕线以上树冠层的虫口密度和叶片受损率。如图 6a所示,4月份叶片受损率较多,为73.40%,极显著高于3月份的41.88%。柚木肖弄蝶夜蛾、海榄雌瘤斑螟和蛎盾蚧在4月份的虫口密度均高于3月份。其中4月份的柚木肖弄蝶夜蛾虫口密度(0.98头/100叶)显著高于3月份(0.36头/100叶)。在两个月份间,海榄雌瘤斑螟和蛎盾蚧的虫口密度无显著差别(图 6c)。北海4月份的气温高于3月份,且4月份平均低温与3月份平均高温相同,均为23℃,而4月份平均高温可达28℃(图 6b)。气温的升高可加剧食叶害虫的危害,造成该地4月份叶片受损率和虫口密度均显著高于3月份(图 6c)。在高岭土影响较小的低潮位林地,食叶害虫的数量会随气温的升高而增多。
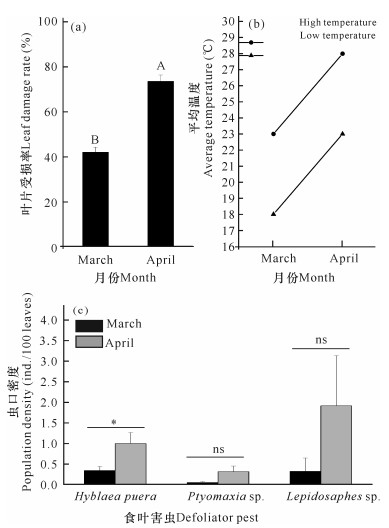
|
| 不同大写字母和*代表差异显著,P<0.05;ns代表两者之间无显著性 Different capital letters and "*"represent significant differences (P < 0.05), ns represents no significance between the two columns 图 6 不同月份低潮区叶片受损情况和食叶害虫虫口密度 Fig.6 Leaf damage and population density of defoliator pests in lower tide areas in different months |
2.2 多毛梢小蠹在白骨壤树干上的分布
经过鉴定对比,确定榄根村白骨壤树干的小蠹虫为多毛梢小蠹(Cryphalus pilosus),属鞘翅目(Coleoptera)小蠹科(Scolytidae)齿小蠹亚科(Ipinae)梢小蠹属(Cryphalus),形态如图 7a和7b所示。多毛梢小蠹为食菌性小蠹,在受害的白骨壤树干中,发现伴生真菌危害寄主树干,造成树干内部显示蓝紫色(图 7c和7d)。多毛梢小蠹主要分布在中高潮位的死亡或死亡边缘的白骨壤林,在低潮区红树植物上未发现小蠹虫的危害,且未在其他红树植物上发现小蠹虫危害的迹象。

|
| 图 7 多毛梢小蠹及半生真菌危害白骨壤 Fig.7 Cryphalus pilosus and associated fungi damage Avicennia marina |
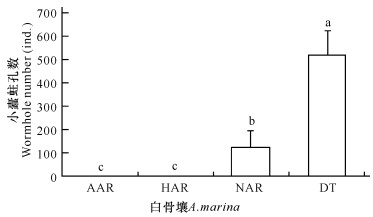
统计每类白骨壤树干上小蠹蛀孔数。如图 8所示,呼吸根正常的白骨壤(AAR)和呼吸根减半的白骨壤(HAR)均无小蠹危害,无呼吸根但存活的白骨壤(NAR)上小蠹蛀孔平均为124个,显著多于AAR和HAR组。死亡的白骨壤(DT)上蛀孔数最多,为519个,显著高于其他3个组别,表明小蠹虫只危害无呼吸根或死亡的白骨壤,即小蠹虫只危害即将死亡的白骨壤。
|
| 不同小写字母代表差异显著,P<0.05;AAR,呼吸根正常的白骨壤;HAR,呼吸根减半的白骨壤;NAR,没有呼吸根但活着的白骨壤;DT,死亡的白骨壤 Different lowercase letters represent significant differences (P < 0.05).AAR, A.marina with all aerial root; HAR, A.marina with half of aerial root; NAR, A.marina with no aerial root, but it is alive; DT, dead A.marina 图 8 不同健康状态下白骨壤上小蠹的蛀孔数 Fig.8 Wormhole number of Avicennia marina under different health conditions |
图 9展示NAR树干上10 cm区段的孔洞数量,从白骨壤基干往上,多毛梢小蠹蛀孔依次减少。多毛梢小蠹在0-10 cm危害较为严重,蛀孔数达47个,显著高于其余区段蛀孔数量。以上结果表明小蠹虫从树干基部开始蛀孔危害,危害时间越久,小蠹虫越多,蛀孔在树干上的位置越高。

|
| 不同小写字母代表差异显著,P<0.05 Different lowercase letters represent significant differences (P < 0.05) 图 9 白骨壤树干不同区段的小蠹蛀孔数 Fig.9 Wormhole number in different sections of trunk of Avicennia marina |
2.3 互花米草的面积及分布
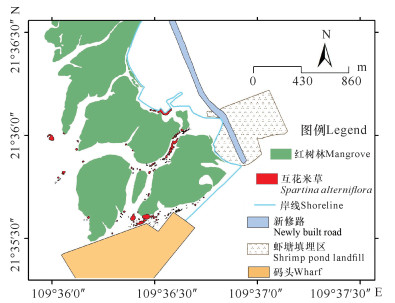
通过现场调查和卫星图相结合的方式调查互花米草的面积和分布。榄根村红树林粘土溢流影响区的互花米草斑块约180个,小斑块占绝大多数,总面积约2.82 hm2,斑块平均面积0.02 hm2(图 10)。互花米草主要分布在潮沟边缘和红树林外缘,集中在靠近码头填埋区和虾塘填埋区的潮沟内,所在区域同时也是高岭土沉积较为严重的区域。另外,在部分死亡红树林斑块中出现了互花米草,互花米草小斑块抢占了死亡红树林所在的滩涂,同时未发现互花米草死亡现象。互花米草的分布对红树林滩涂排水可能会有不利影响,特别是分布在潮沟中的互花米草。
|
| 图 10 榄根村红树林粘土溢流影响区互花米草的分布 Fig.10 Distribution of S.alterniflora in influence area of mangrove clay overflow in Lan′gen Village |
3 讨论
柚木肖弄蝶夜蛾是近年来出现的白骨壤新害虫,其1年可繁殖12代,每只雌虫最多可产800多粒虫卵,老熟幼虫的取食量大,大爆发时对白骨壤的破坏性极大[23]。目前在榄根村红树林仅局部发生,其虫口密度和叶片受损率明显多于对照区,这可能与中高潮区林地受高岭土影响较大有关。实地勘察发现近岸的高中潮带白骨壤已遭受粘土溢流的严重影响,可观察到树叶上有明显的高岭土。高岭土在树叶表面形成白色的保护层,影响害虫的产卵、移动、蛀孔和取食,也可妨碍病菌的定殖,从而防治害虫和病菌[31, 34-36]。另一个原因可能与夜蛾习性有关,该夜蛾具迁飞习性[37],成虫寻找寄主植物主要通过视觉、嗅觉和触觉来完成[38],树叶被大量粘土遮挡可能会影响昆虫的视觉和触觉[39]。粘土等细颗粒悬浮物粘附在叶片上有助于减轻柚木肖弄蝶夜蛾取食并危害白骨壤的程度。后期需要密切监视该夜蛾的虫口密度、数量和分布的变化情况。如果柚木肖弄蝶夜蛾在该地大发生,可能会导致部分红树生长衰弱。
海榄雌瘤斑螟是白骨壤林中广泛存在的害虫[40]。在研究地已发现其幼虫,但危害程度较轻。随着气温升高,该虫数量可能增多[41],后期需要密切关注斑螟种群的动态变化,必要时进行人工控制。蛎盾蚧属于刺吸性害虫,在榄根村主要危害秋茄,且在高潮带分布较广,与其他地点研究结果相符[25]。另外,由于蛎盾蚧主要危害人工林和幼树,在后期修复造林时,蛎盾蚧可能会对修复带来不利的影响。
虽然柚木肖弄蝶夜蛾、海榄雌瘤斑螟和蛎盾蚧,这3类食叶害虫在大发生时会对白骨壤和秋茄造成一定的危害,但即使达到虫灾程度也未见导致红树林死亡的文献记录。从2017-2020年的遥感影像观察,也未发现这几种食叶害虫在榄根村红树林区严重发生或爆发成灾;从食叶害虫的空间分布上分析,2019年底柚木肖弄蝶夜蛾危害较明显的几个斑块均位于外滩位置,而退化死亡的红树林斑块主要是中内滩的位置。因此,食叶害虫危害不是榄根村红树林死亡的直接或间接原因。
本研究首次记录了多毛梢小蠹对红树林的危害。多毛梢小蠹主要在白骨壤树干木质部蛀孔,上下纵横贯穿,孔道呈立体结构,造成寄主组织永久性损伤,影响寄主营养物质的传导;蠹害不仅由小蠹虫蛀洞造成,而且在其危害过程中携带病原真菌“伴生菌”的侵入[42, 43]。在进化过程中,小蠹虫已特化出“贮菌器”与真菌共生,且与其所带真菌的关系是相对稳定的,一种小蠹虫常与某一种或几种病原菌发生联系[44]。伴生真菌往往借助小蠹虫到达寄主树木组织内,完成生命周期,在侵染过程中分泌毒素对树木进行危害[45];伴生真菌对树木的危害削弱了树木的抗性,并为小蠹虫提供充足的食物来源,从而有助于小蠹虫的入侵[46]。本研究发现多毛梢小蠹主要分布在受高岭土危害较为严重的高中潮区,并主要危害生长较弱甚至将要死亡的白骨壤树干,在0-10 cm基茎的数量最多; 在高岭土危害较轻或未危害的红树林区域,未见小蠹虫在白骨壤基干蛀孔。根据不同区段树干的孔洞数量,可发现该小蠹从白骨壤树干基部开始危害,逐渐向上,使白骨壤死亡。虽然小蠹和其携带的伴生真菌可加速植株的死亡[45],但不是导致红树林大面积死亡的根本原因。
高岭土的溢流淤积造成白骨壤生长衰弱甚至死亡,进而引发蛀木害虫(多毛梢小蠹)使红树林死亡。互花米草会迅速在红树林死亡斑块内定殖和生长,互花米草强大的根系和凋落物有利于改善底质环境,也可影响水动力,促进粘土悬浮物质沉降,从而改善水质。红树林叶片上附着的高岭土,不易被雨水和潮水冲刷,或在退潮时再次附着在叶片上,干扰食叶害虫识别寄主植物,妨碍食叶害虫进行取食危害。但是,互花米草大面积扩散不利于滩涂和潮沟的排水,需要人为清除。在榄根村高岭土溢流影响区内,互花米草似乎不受粘土的影响,因此本研究未发现有明显的互花米草死亡现象,这可能与互花米草的茎干结构有关,通过其中空的茎干可以最大限度地利用空气中的氧气,从而克服土壤缺氧的问题。
铁山港榄根村红树林区的互花米草全为自然扩散[47]。本研究调查发现部分死亡白骨壤林中出现米草新生斑块,且互花米草主要以小斑块形式存在,少量以连片分布,如果不加以人工干扰,后期可能形成互花米草大面积入侵的问题。受互花米草可加速粘土等悬浮物质沉降的启发[48],后期可利用不受高岭土影响的草本植物(盐沼草)改善底质和水质。此外,该地大面积死亡的树种主要为白骨壤,在后期修复时应注重树种的搭配;同时监控食叶性害虫和小蠹虫的发生,必要时进行防治。
4 结论本研究分析表明,铁山港榄根村红树林区的主要植食性害虫为柚木肖弄蝶夜蛾(Hybaea puera)、海榄雌瘤斑螟(Ptyomaxia sp.)和蛎盾蚧(Lepidosaphes sp.),其中柚木肖弄蝶夜蛾主要分布在低潮区,蛎盾蚧主要分布在中高潮区,而斑螟虫口数量少,无明显分布趋势。在高岭土影响较小的低潮区,红树植物叶片的受损较为严重。高岭土粘附在叶片表面一定程度上减缓食叶害虫的危害,但引发了蛀干害虫的发生。本研究首次发现多毛梢小蠹(Cryphalus pilosus)危害白骨壤的树干,死亡红树林斑块内已有互花米草入侵,但导致白骨壤死亡的根本原因并非有害生物的入侵。高岭土的淤积未对互花米草造成不利影响,相反在高岭土淤积严重导致红树林死亡的区域,互花米草最先入侵定殖,需要提早及时进行防治。
| [1] |
林鹏. 中国红树林生态系[M]. 北京: 科学出版社, 1997: 1-10.
|
| [2] |
MENG Y, BAI J, GOU R, et al. Relationships between above- and below-ground carbon stocks in mangrove forests facilitate better estimation of total mangrove blue carbon[J]. Carbon Balance Management, 2021, 16(1): 1-14. DOI:10.1186/s13021-020-00160-5 |
| [3] |
DUKE N C, MEYNECKE J O, DITTMANN S, et al. A world without mangroves?[J]. Science, 2007, 317(5834): 41-42. |
| [4] |
SILLS J, CURNICK D J, PETTORELLI N, et al. The value of small mangrove patches[J]. Science, 2019, 363(6424): 239-239. DOI:10.1126/science.aaw0809 |
| [5] |
KRAUSS K W, CAHOON D R, ALLEN J A, et al. Surface elevation change and susceptibility of different mangrove zones to sea-level rise on Pacific high islands of Micronesia[J]. Ecosystems, 2010, 13(1): 129-143. DOI:10.1007/s10021-009-9307-8 |
| [6] |
XIA S, WANG W, SONG Z, et al. Spartina alterniflora invasion controls organic carbon stocks in coastal marsh and mangrove soils across tropics and subtropics[J]. Global Change Biology, 2021, 27(3): 1-18. |
| [7] |
SHEARER H. Herbicides threaten north Queensland's coastal mangroves[J]. Ecos, 2004, 119: 32-33. |
| [8] |
BROOKS R A, BELL S S. Mangrove response to attack by a root boring isopod: Root repair versus architectural modification[J]. Marine Ecology Progress, 2002, 231(1): 85-90. |
| [9] |
BOSIRE J, KAIRO J. The restoration and rehabilitation of damaged or degraded mangrove ecosystems in Kenya[J]. Philosophy, 2014, 5(5): 1197-1204. |
| [10] |
RAHMAN A F, DRAGONI D, DIDAN K, et al. Detecting large scale conversion of mangroves to aquaculture with change point and mixed-pixel analyses of high-fidelity MODIS data[J]. Remote Sensing of Environment, 2013, 130: 96-107. DOI:10.1016/j.rse.2012.11.014 |
| [11] |
SCOTT P, NENIBARINI Z. Oil and water: The Bodo spills and the destruction of traditional livelihood structures in the Niger Delta[J]. Community Development Journal, 2013, 48(3): 391-405. DOI:10.1093/cdj/bst021 |
| [12] |
SANDILYAN S, KATHIRESAN, et al. Plastics-A formidable threat to unique biodiversity of Pichavaram mangroves[J]. Current Science, 2012, 103(11): 1262-1263. |
| [13] |
WALTERS B B, ÖNNBÄCK P, KOVACS J M, et al. Ethnobiology, socio-economics and management of mangrove forests: A review[J]. Aquatic Botany, 2009, 89(2): 220-236. |
| [14] |
李云, 郑德璋, 廖宝文. 红树林主要有害生物调查初报[J]. 中国森林病虫, 1997(4): 12-14. |
| [15] |
薛云红. 厦门秋茄蛎盾蚧(Lepidosaphes sp. )生物学特性及其综合防治技术的研究[D]. 厦门: 厦门大学, 2018.
|
| [16] |
OZAKI K, KITAMURA S, SUBIANDORO E, et al. Life history of Aulacaspis marina Takagi and Williams (Hom., Coccoidea), a new pest of mangrove plantations in Indonesia, and its damage to mangrove seedlings[J]. Journal of Applied Entomology, 2010, 123(5): 281-284. |
| [17] |
杨盛昌, 彭建, 薛云红, 等. 中国红树林的害虫种类及其综合防治[J]. 中国森林病虫, 2020, 39(1): 32-41. |
| [18] |
甄文全, 薛云红, 刘文爱, 等. 广西山口红树林保护区昆虫调查[J]. 广西科学, 2019, 26(4): 430-443. DOI:10.3969/j.issn.1005-9164.2019.04.012 |
| [19] |
蒋国芳. 山口红树林区昆虫种类组成及其季节变动的初步分析[J]. 广西科学院学报, 1997, 13(2): 11-17. |
| [20] |
刘文爱, 薛云红, 甄文全, 等. 植食性昆虫的组成和波动对红树林群落演替的影响[J]. 生态学杂志, 2020, 39(6): 1795-1805. |
| [21] |
刘文爱, 李丽凤. 广州小斑螟生物学特性及其防治的研究[J]. 中国森林病虫, 2018, 37(2): 18-21. DOI:10.3969/j.issn.1671-0886.2018.02.005 |
| [22] |
范航清, 刘文爱, 曹庆先. 广西红树林害虫生物生态学特性与综合防治技术研究[M]. 北京: 科学出版社, 2012.
|
| [23] |
刘文爱, 李丽凤. 白骨壤新害虫柚木肖弄蝶夜蛾的生物特性及防治[J]. 广西科学, 2017, 24(5): 523-528. |
| [24] |
刘文爱, 范航清. 危害广西红树植物秋茄的4种主要盾蚧调查研究[J]. 安徽农学通报, 2010, 16(22): 95. DOI:10.3969/j.issn.1007-7731.2010.22.051 |
| [25] |
刘文爱, 薛云红, 范航清. 红树林蚧虫的发生和扩散规律[J]. 中国森林病虫, 2019, 38(6): 11-15. DOI:10.3969/j.issn.1671-0886.2019.06.003 |
| [26] |
徐友根, 李崧. 城市建设对深圳福田红树林生态资源的破坏及保护对策[J]. 资源·产业, 2002, 11(3): 32-35. DOI:10.3969/j.issn.1673-2464.2002.03.009 |
| [27] |
王卿, 安树青, 马志军, 等. 入侵植物互花米草——生物学、生态学及管理[J]. 植物分类学报, 2006, 44(5): 559-588. |
| [28] |
李郑杰. 漳江口红树林区互花米草入侵及扩散机制研究[D]. 厦门: 厦门大学, 2014.
|
| [29] |
BRISTOW C M, 丁雪心. 世界高岭土的开发和用途[J]. 矿产保护与利用, 1988(1): 6-14. |
| [30] |
黄义雄, 方祖光, 林皆敏, 等. 高岭土矿区植被恢复与生态效应研究[J]. 福建师大学报, 2008, 24(2): 86-91. |
| [31] |
SACKETT T E, BUDDLE C M, VINCENT C. Effect of kaolin on fitness and behavior of Choristoneura rosaceana (Lepidoptera: Tortricidae) Larvae[J]. Journal of Economic Entomology, 2005, 98(5): 1648-1653. DOI:10.1093/jee/98.5.1648 |
| [32] |
吴采倩, 刘倩. 环保督察组通报广西一国企违规施工破坏红树林, 企业已停工整改[N/OL]. 北京: 新京报, 2021-05-19. https://m.bjnews.com.cn/detail/162143887314258.html.
|
| [33] |
李新枝. 基于无人机和卫星数据的马尾松毛虫虫害监测[D]. 武汉: 华中农业大学, 2016.
|
| [34] |
SISTERSON M S, LIU Y B, KERNS D L, et al. Effects of kaolin particle film on oviposition, larval mining, and infestation of cotton by pink bollworm (Lepidoptera: Gelechiidae)[J]. Journal of Economic Entomology, 2003, 96(3): 805-810. DOI:10.1093/jee/96.3.805 |
| [35] |
KNIGHT A L, UNRUH T R, CHRISTIANSON B A, et al. Effects of a kaolin-based particle film on obliquebanded leafroller (Lepidoptera: Tortricidae)[J]. Journal of Economic Entomology, 2000, 93(3): 744-749. DOI:10.1603/0022-0493-93.3.744 |
| [36] |
KAUFMAN D, YANG W Q, KOWALSKI J, et al. Evaluation of surround kaolin clay film as a management tool for root weevils in strawberries[C]. Portland, Oregon: Pacific Northwest Insect Management Conference, 2004.
|
| [37] |
胡荣, 陈河, 杨克学, 等. 中国红树林新害虫柚木驼蛾的研究进展[J]. 中国森林病虫, 2016, 35(5): 34-37. DOI:10.3969/j.issn.1671-0886.2016.05.009 |
| [38] |
方剑锋, 于飞, 吴建波. 植食性昆虫取食行为的影响因素及植物源拒食剂的分类[J]. 广东农业科学, 2006(10): 52-55. DOI:10.3969/j.issn.1004-874X.2006.10.022 |
| [39] |
GLENN D M, PUTERKA G J, VANDERZWET T., et al. Hydrophobic particle films: A new paradigm for suppression of arthropod pests and plant diseases[J]. Journal of Economic Entomology, 1999, 92(4): 759-771. DOI:10.1093/jee/92.4.759 |
| [40] |
范航清, 邱广龙. 中国北部湾白骨壤红树林的虫害与研究对策[J]. 广西植物, 2004, 24(6): 558-562. DOI:10.3969/j.issn.1000-3142.2004.06.016 |
| [41] |
李罡, 昝启杰, 赵淑玲, 等. 海榄雌瘤斑螟的生物学特性及Bt对其幼虫的毒力和防效[J]. 应用与环境生物学报, 2007, 13(1): 50-54. DOI:10.3321/j.issn:1006-687X.2007.01.012 |
| [42] |
SIEMASZKO W. Fungi associated with bark beetles in Poland[J]. Planta Polonica, 1939, 7: 1-54. |
| [43] |
LIEUTIER F, YART A, SALLE A. Stimulation of tree defenses by ophiostomatoid fungi can explain attack success of bark beetles on conifers[J]. Annals of Forest Science, 2009, 66(8): 801-823. DOI:10.1051/forest/2009066 |
| [44] |
ZHOU X, BEER Z, WINGFIELD M J. DNA sequence comparisons of Ophiostoma spp., including Ophiostoma aurorae sp.nov., associated with pine bark beetles in South Africa[J]. Studies in Mycology, 2006, 55(55): 269-277. |
| [45] |
ALAMOUTI S M, TSUI C, BREUIL C. Multigene phylogeny of filamentous ambrosia fungi associated with ambrosia and bark beetles[J]. Mycological Research, 2009, 113(8): 822-835. DOI:10.1016/j.mycres.2009.03.003 |
| [46] |
HARRINGTON T C, AGHAYEVA D N, FRAEDRICH S W. New combinations in Raffaelea, Ambrosiella, and Hyalorhinocladiella, and four new species from the redbay ambrosia beetle, Xyleborus glabratus[J]. Mycotaxon, 2010, 111(1): 337-361. DOI:10.5248/111.337 |
| [47] |
莫竹承, 范航清, 刘亮. 广西海岸潮间带互花米草调查研究[J]. 广西科学, 2010, 17(2): 170-174. DOI:10.3969/j.issn.1005-9164.2010.02.023 |
| [48] |
王爱军, 叶翔. 福建省东北部沿海罗源湾互花米草盐沼环境下粘性沉积物的侵蚀一沉降过程[J]. 第四纪研究, 2013, 33(3): 582-593. DOI:10.3969/j.issn.1001-7410.2013.03.19 |



