红树林具有重要的生态及经济价值,尤其是在固岸护堤、抵御海啸台风等自然灾害、维持生物多样性、净化水质、固碳及发展旅游业等方面具有重要作用。白骨壤(Avicennia marina)是世界上分布最广的红树植物,在我国主要分布在广东、广西、福建、海南和台湾等省地。白骨壤为我国常见的先锋红树植物树种,分布广泛,种子可进行有性生殖,根系发达,适合生长在贫瘠的裸露沙滩上,因此被称为红树林先锋树种。
围填海对海洋生态环境产生了较大的影响,其对红树的影响主要体现在围垦、养殖污染和淹水胁迫等方面[1]。1980年以来,围填海造成全国红树林面积减少12 923.70 hm2[2],因此研究围填海导致红树林死亡的具体原因具有重要意义。叶绿素(Chlorophyll,Chl)含量是植物生长过程中一个重要的生理指标,由于其对周围环境很敏感,且与植物的光合作用密切相关,被广泛用作植物生长的常规测定指标。光照和低氧胁迫会影响叶绿素的含量。光照不足影响植物叶绿素的生物合成[3],所以光照不足是叶绿素含量降低的重要原因之一。低氧胁迫是植物生长过程中遇到的重要非生物胁迫之一[4]。低氧胁迫下,植物处于缺氧状态,其生理过程受到干扰,如水分失衡、膜结构被破坏、有害代谢产物积累等。因此,低氧胁迫下植物叶绿素含量降低[5],植物光合作用效率降低,而由于植物种类及胁迫时间、程度的差异使得叶绿素含量的变化各不相同[6-8]。低氧胁迫使植物营养物质利用效率下降、光合作用减弱[9, 10],因此植物在低氧胁迫下呼吸与能量代谢会发生变化,使得植物在低氧胁迫下能够存活。围填海时,白骨壤的低氧胁迫耐受能力与其在被高岭土覆盖条件下的能量供应状况有密切的联系。如果植物体内积累了较多的能量物质或在低氧胁迫下养分消耗缓慢,植物就有较强的低氧胁迫耐受能力。而在植物能量产生过程中,细胞色素C氧化酶(Cytochrome C Oxidase, COX, EC1.9.3.1)和乙醇脱氢酶(Alcohol Dehydrogenase, ADH, EC1.1.1.1)发挥了重要的作用,是产生ATP的关键酶。由于细胞色素C氧化酶和乙醇脱氢酶活性易受环境变化的影响,研究白骨壤中这两种酶的活性在低氧胁迫下的变化,对从呼吸与能量代谢方面阐明围填海对白骨壤的影响具有重要作用。围填海时白骨壤的指状呼吸根被高岭土覆盖,指状呼吸根缺氧,因此指状呼吸根是测定细胞色素C氧化酶和乙醇脱氢酶活性的重要部位。
铁山港榄根村陆域填土工作始于2012年左右,至2017年12月榄根村红树林区海域吹填工程已基本成型,陆域填土工程范围亦完全到达红树林海岸边缘。在海域吹填过程中,邻近海域吹填工程边缘红树林生境遭受严重威胁。红树林从这一时期开始受损,但这一时期红树林受损面积较小,暂发现4个受损红树林斑块零星分布。随着时间推移,红树林受损面积增加明显,受损区域呈连片状分布。2018年10月至2019年6月,海域吹填工程区东南和东北边缘有所调整,陆域填土工程继续开展。截至2020年4月,监测区内红树林受损面积已达17.18 hm2。围填海工程导致高岭土覆盖在白骨壤的叶片和指状呼吸根上,因此本文以围填海不同区域不同生长状态的白骨壤叶片和指状呼吸根为材料,研究围填海对白骨壤叶片叶绿素含量、NAD+/NADH比值、NADP+/NADPH比值、ATP含量和指状呼吸根活力、有氧呼吸关键酶细胞色素C氧化酶和无氧呼吸关键酶乙醇脱氢酶活性的影响,以探讨围填海对白骨壤呼吸与能量代谢的影响,深入研究围填海导致白骨壤死亡的生理机制。
1 材料与方法 1.1 材料 1.1.1 样地概况及采样铁山港是我国面积最大的天然白骨壤纯林的生长地,并零星生长有桐花树Aegiceras corniculatum、秋茄Kandelia obovata和红海榄Rhizophora stylosa。榄根村现存白骨壤林93.83 hm2,群落平均覆盖度57%、平均密度55株/100 m2、平均高度2.08 m。铁山港周边缺少河流和淡水调节,滩涂泥沙质、贫瘠,红树林生态系统脆弱。研究区域经纬度为21°35′37.14″-21°36′31.63″N,109°36′56.05″-109°35′54.51″E。以白骨壤为研究对象,采集白骨壤叶片及指状呼吸根植物材料。分别设置严重受损红树林区边缘站位6个(ED1-ED6,以下简称ED),项目监测范围内红树林大斑块中暂未显示枯亡现象仍然正常生长的红树林调查站位3个(尚存活样方AL1-AL3,以下简称AL),正常红树林对照站位3个(对照组CK1-CK3,以下简称CK),研究站位如图 1所示。ED组和AL、CK组的显著差别在于:ED组出现白骨壤植株全株死亡的现象,红树植株死亡比例为(60.5±6.3)%,死亡植株均无叶片残留(叶片残留百分比可在一定程度上反应植株存活情况),有一定比例的断顶株数;AL、CK组仅出现轻微的叶片掉落情况和少量的断顶株数。2020年3月6-7日在榄根村不同组区域取材:CK组,15个独立生物学重复;AL组,15个独立生物学重复;ED组,30个独立生物学重复,共60个样品。所有样品均放置于低温保温箱中带回实验室,-80℃保存待测。测定前将白骨壤叶片及指状呼吸根用超纯水洗净、擦干并称重。叶绿素含量、NAD+/NADH比值、NADP+/NADPH比值和ATP含量用白骨壤的第二对叶测定,根系活力、细胞色素C氧化酶活性和乙醇脱氢酶活性用白骨壤的指状呼吸根测定。

|
| 图 1 研究站位图 Fig.1 Location map of research station |
1.1.2 主要试剂和设备
辅酶ⅠNAD+/NADH含量试剂盒(批号:G0801W)、辅酶Ⅱ NADP+/NADPH含量试剂盒(批号:G0802W)、ATP含量试剂盒(磷钼酸比色法,批号:G0815W)、植物根系活力试剂盒(批号:G0124W)、线粒体复合体Ⅳ细胞色素C氧化酶试剂盒(批号:G0848W96)、乙醇脱氢酶(ADH)试剂盒(批号:G0806W)均购自苏州格锐思生物科技有限公司。主要仪器设备为多功能酶标仪(Molecular Devices;VERSA max)。
1.2 方法 1.2.1 叶绿素含量测定参照顾骏飞等[11]的方法测定叶绿素含量。
1.2.2 呼吸与能量代谢生理指标测定NAD+/NADH比值用辅酶ⅠNAD+/NADH含量试剂盒测定,NADP+/NADPH比值用辅酶Ⅱ NADP+/NADPH含量试剂盒测定,ATP含量用ATP含量试剂盒(磷钼酸比色法)测定,指状呼吸根活力用植物根系活力试剂盒测定,细胞色素C氧化酶活性用线粒体复合体Ⅳ细胞色素C氧化酶试剂盒测定, 乙醇脱氢酶活性用乙醇脱氢酶(ADH)试剂盒测定。
1.2.3 数据统计与分析数据统计及绘图使用Excel软件(Microsoft office 365, Redmond, WA, USA)。图表中的数值用平均值±SD的形式表示,显著性分析使用t检验,*P <0.05,表示差异显著,**P <0.01,表示差异极显著。
2 结果与分析 2.1 围填海对白骨壤叶片叶绿素含量的影响从图 2可以看出,与CK组相比,AL组及ED组的白骨壤叶片叶绿素总含量均显著减少。与CK组相比,ED组的白骨壤叶片叶绿素总含量极显著减少,下降53%;与AL组相比,ED组的白骨壤叶片叶绿素总含量显著减少,下降31%。说明海岸工程围填海导致的高岭土溢流淤积对白骨壤叶片产生遮光影响,使得叶绿素合成减少,进而影响白骨壤的光合作用。
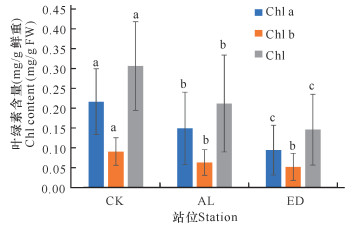
|
| 不同小写字母表示差异显著(P<0.05);FW,鲜重 Different lowercase letters indicate significant difference (P < 0.05); FW, fresh weight 图 2 白骨壤叶片叶绿素含量 Fig.2 Chlorophyll content in the leaves of A.marina |
2.2 围填海对白骨壤叶片NAD+/NADH比值及NADP+/NADPH比值的影响
从图 3可以看出,与CK组相比,AL组及ED组的白骨壤叶片NAD+/NADH比值及NADP+/NADPH比值均显著降低。与正常生长的白骨壤相比,ED组白骨壤叶片NAD+/NADH比值下降61%,NADP+/NADPH比值下降62%;与AL组相比,ED组的白骨壤叶片NAD+/NADH比值及NADP+/NADPH比值分别下降45%及48%。因此,海岸工程围填海导致的高岭土溢流淤积堵塞了白骨壤叶片和指状呼吸根的气孔,使得白骨壤可以获取的氧气量减少,从而减少NAD+及NADP+的合成,进而使NAD+/NADH比值及NADP+/NADPH比值下降。
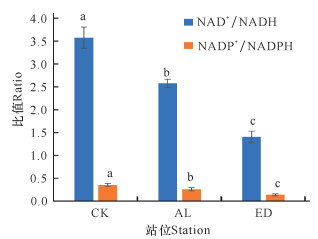
|
| 不同小写字母表示差异显著(P<0.05) Different lowercase letters indicate significant difference (P < 0.05) 图 3 白骨壤叶片NAD+/NADH比值及NADP+/NADPH比值 Fig.3 NAD+/NADH ratio and NADP+/NADPH ratio in the leaves of A.marina |
2.3 围填海对白骨壤叶片ATP含量的影响
如图 4所示,与CK组相比,AL组的白骨壤叶片ATP含量显著减少。与正常生长的白骨壤相比,ED组的白骨壤叶片ATP含量下降95%,说明海岸工程围填海导致的高岭土溢流淤积堵塞白骨壤叶片和指状呼吸根的气孔,使得白骨壤可以获取的氧气量减少,从而减少ATP的合成,进而导致ATP含量下降。
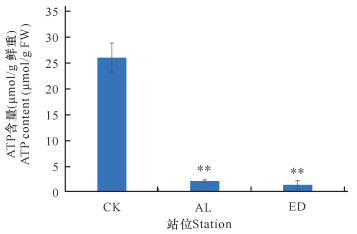
|
| **P<0.01,表示差异极显著 **P<0.01 indicates extremely significant difference 图 4 白骨壤叶片ATP含量 Fig.4 ATP content in the leaves of A.marina |
2.4 围填海对白骨壤指状呼吸根活力的影响
与CK组相比,AL组及ED组的白骨壤指状呼吸根的活力显著下降;与正常生长的白骨壤相比,ED组的白骨壤指状呼吸根活力下降62%;与AL组相比,ED组的白骨壤指状呼吸根的活力显著下降(图 5)。说明海岸工程围填海导致的高岭土溢流淤积堵塞白骨壤指状呼吸根的气孔,使得白骨壤可以获取的氧气量减少,产生低氧胁迫,进而抑制白骨壤根系活力。
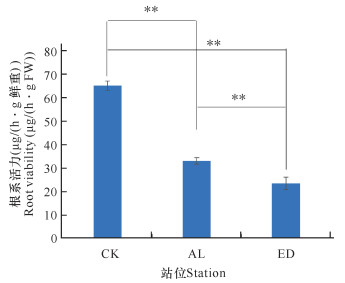
|
| **P<0.01,表示差异极显著 **P<0.01 indicates extremely significant difference 图 5 白骨壤指状呼吸根活力 Fig.5 Viability in finger-like pneumetophores of A.marina |
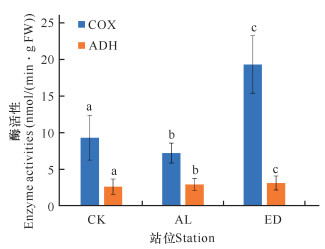
2.5 围填海对白骨壤指状呼吸根细胞色素C氧化酶和乙醇脱氢酶活性的影响
从图 6可以看出,与CK组相比,ED组的指状呼吸根细胞色素C氧化酶和乙醇脱氢酶活性明显升高,指状呼吸根细胞色素C氧化酶活性升高108%,乙醇脱氢酶活性升高20%,说明与CK组相比,ED组的有氧呼吸活性和无氧呼吸活性均升高。
|
| 不同小写字母表示差异显著(P<0.05) Different lowercase letters indicate significant difference (P<0.05) 图 6 白骨壤指状呼吸根细胞色素C氧化酶和乙醇脱氢酶活性 Fig.6 COX and ADH activity in finger-like pneumeto-phores of A.marina |
3 讨论 3.1 围填海对白骨壤叶片叶绿素含量的影响
光照不足会影响植物叶绿素的生物合成[3],黑暗中大部分植物无法合成叶绿素[12],而叶片长期遮光会导致叶绿素含量显著下降[13]。长期遮光降低植物光合碳同化能力及光合作用关键酶活性,导致叶绿素合成减少,叶片褪绿。叶绿素酸酯a加氧酶(CAO)将叶绿素酸酯a (Chlide a)转化为叶绿素酸酯b (Chlide b)。拟南芥CAO在黑暗下表达量很低,但在光照条件下表达量显著上调[14]。水稻OsCAO1在黑暗和光照条件下的表达模式与拟南芥CAO相似。叶绿素合酶(CHLG)将Chlide a和Chlide b转化为叶绿素a和叶绿素b。拟南芥CHLG在见光后表达量逐渐上调。长期遮光不利于植物转绿,光通过调控叶绿素生物合成途径中的关键基因影响叶绿素生物合成。氧气充足时植物叶绿素含量维持在一个较高的水平,低氧胁迫时叶绿素含量下降[15]。围填海导致白骨壤叶片气孔被高岭土堵塞,光照被高岭土阻断,叶绿素生物合成减少,叶绿素含量下降。
3.2 围填海对白骨壤呼吸与能量代谢的影响低氧胁迫往往造成糖酵解及三羧酸循环的代谢过程变缓甚至停滞,导致还原型辅酶Ⅰ(NADH)向氧化型辅酶Ⅰ(NAD+)的再生过程受到抑制进而阻止ATP的产生[16]。植物细胞在低氧胁迫条件下,正常有氧呼吸产生ATP的途径受阻,转而通过乙醇发酵和乳酸发酵途径产生少量的ATP。围填海导致严重受损区的白骨壤叶片ATP含量下降95%(图 4),其原因是ATP合成减少。
在逆境条件下,细胞器结构会被破坏,最终将导致细胞相关生理功能的降低乃至丧失[17]。对黄瓜的研究结果表明,低氧胁迫下根尖细胞受到伤害,线粒体内嵴减少[18]。本研究结果表明,受损白骨壤指状呼吸根活性下降(图 5),可能是随着细胞器结构的逐渐降解,化学反应效率不可避免地下降,使得同化力减弱,并最终导致根活力下降,究其原因正是由于线粒体抗氧化系统的异常所导致。
当白骨壤指状呼吸根刚被高岭土覆盖时,白骨壤指状呼吸根还可以利用胞间氧进行氧化磷酸化。随着胞间氧的消耗,氧分压下降,植物表现出通过上调细胞色素C氧化酶的活性来有效地利用不断减少的氧气进行有氧呼吸。氧作为电子传递链的最终电子受体,低氧胁迫直接影响以氧为底物的细胞色素C氧化酶。白骨壤指状呼吸根被高岭土覆盖,使得植物氧化磷酸化过程受到很大的影响,通过氧化磷酸化产生的ATP有限,必须通过无氧呼吸生成ATP,为维持能量供应,就需要提高指状呼吸根乙醇脱氢酶活性。
4 结论高岭土溢流淤积,使其附着于白骨壤叶片和指状呼吸根上,白骨壤叶片被遮光,叶片和指状呼吸根的气孔被堵塞。叶片被遮光导致叶绿素含量下降,叶片和指状呼吸根的气孔被堵塞导致白骨壤遭受低氧胁迫,因此叶片NAD+/NADH比值及NADP+/NADPH比值下降,叶片ATP含量下降,指状呼吸根活性下降,细胞色素C氧化酶和乙醇脱氢酶活性上升。
| [1] |
杨奕. 围填海风险胁迫下中国红树林空间脆弱性评估方法及应用研究[D]. 厦门: 厦门大学, 2018.
|
| [2] |
关道明, 刘长安, 左平, 等. 中国滨海湿地[M]. 北京: 海洋出版社, 2012.
|
| [3] |
何俊俊, 杨京平, 杨虎, 等. 光照及氮素水平对水稻冠层叶片SPAD值动态变化的影响[J]. 浙江大学学报: 农业与生命科学版, 2014, 40(5): 495-504. |
| [4] |
生利霞, 冯立国, 束怀瑞. 低氧胁迫下钙对樱桃砧木根系抗氧化系统及线粒体功能的影响[J]. 中国农业科学, 2008, 41(11): 3913-3919. DOI:10.3864/j.issn.0578-1752.2008.11.064 |
| [5] |
BENNICELLI R P, STPNIEWSKI W, ZAKRJZHEVSKY D A, et al. The effect of soil aeration on superoxide dismutase activity, malondialdehyde level, pigment content and stomatal diffusive resistance in maize seedlings[J]. Environmental and Experimental Botany, 1998, 39(3): 203-211. DOI:10.1016/S0098-8472(97)00044-0 |
| [6] |
赖廷和, 何斌源. 木榄幼苗对淹水胁迫的生长和生理反应[J]. 生态学杂志, 2007, 26(5): 650-656. DOI:10.3321/j.issn:1000-4890.2007.05.007 |
| [7] |
刘义玲, 李天来, 孙周平, 等. 根际低氧胁迫对网纹甜瓜光合作用、产量和品质的影响[J]. 园艺学报, 2009, 36(10): 1465-1472. DOI:10.3321/j.issn:0513-353X.2009.10.010 |
| [8] |
古志钦, 张利权, 袁琳. 互花米草与芦苇光合色素含量对淹水措施的响应[J]. 应用生态学报, 2009, 20(10): 2365-2369. |
| [9] |
BURGOS S, STAMP P, SCHMID J E. Agronomic and physiological study of cold and flooding tolerance of spelt (Triticum spelta L.) and wheat (Triticum aestivum L.)[J]. Journal of Agronomy Crop Science, 2001, 187(3): 195-202. DOI:10.1046/j.1439-037x.2001.00516.x |
| [10] |
VOESENEK L A C J, COLMER T D, PIERIK R, et al. How plants cope with complete submergence[J]. New Phytologist, 2006, 170(2): 213-226. DOI:10.1111/j.1469-8137.2006.01692.x |
| [11] |
顾骏飞, 周振翔, 李志康, 等. 水稻低叶绿素含量突变对光合作用及产量的影响[J]. 作物学报, 2016, 42(4): 551-560. |
| [12] |
DUANMU D, CASERO D, DENT R M, et al. Retrograde bilin signaling enables chlamydomonas greening and phototrophic survival[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(9): 3621-3626. |
| [13] |
华劲松, 戴红燕, 夏明忠. 不同光照强度对芸豆光合特性及产量性状的影响[J]. 西北农业学报, 2009, 18(2): 136-140. |
| [14] |
ESPINEDA C E, LINFORD A S, DEVINE D, et al. The AtCAO gene, encoding chlorophyll a oxygenase, is required for chlorophyll b synthesis in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(18): 10507-10511. DOI:10.1073/pnas.96.18.10507 |
| [15] |
赵丰云. 加气灌溉对葡萄氮素代谢及光合同化物积累分配的影响[D]. 石河子: 石河子大学, 2018.
|
| [16] |
JACKSON M B, RICARD B. Physiology, biochemistry and molecular biology of plant root systems subjected to flooding of the soil[J]. Ecological Studies, 2003(168): 193-213. |
| [17] |
SHAO H B, CHU L Y, JALEEL C A, et al. Water-deficit stress-induced anatomical changes in higher plants[J]. Comptes Rendus Biologies, 2008, 331(3): 215-225. DOI:10.1016/j.crvi.2008.01.002 |
| [18] |
陆晓民, 孙锦, 郭世荣, 等. 油菜素内酯对低氧胁迫黄瓜幼苗根系线粒体抗氧化系统及其细胞超微结构的影响[J]. 园艺学报, 2012, 39(5): 888-896. |


