中华乌塘鳢(Bostrychus sinensis)隶属于鲈形目(Perciformes)塘鳢科(Eleotridae)乌塘鳢属(Bostrychus),俗称杜鳗、虾虎、涂鱼、蟹虎、土鱼[1, 2],是近岸咸淡水暖水性小型底栖鱼类,分布于印度洋-太平洋沿海[3, 4],在我国东海沿海地区、台湾海峡和南海均有分布[5]。该鱼肉质鲜美,细嫩可口,经济价值和营养价值高,又兼具药用价值和滋补功效,在中国沿海作为名贵食用鱼类而广受人们喜爱[6]。
中华乌塘鳢的消费市场需求大,人工养殖虽可满足其部分市场需求,但人们更热衷于野生资源,这导致中华乌塘鳢天然资源量因过度捕捞出现急剧下降。通过走访调查广西防城港市和钦州市的海鲜市场发现,在20世纪90年代之前,一个海鲜市场中华乌塘鳢的每天收购量为100-150 kg;20世纪90年代至21世纪初,收购量为35-50 kg;而今收购量仅为10-15 kg,甚至更少。据此,可推断近30年来广西沿海中华乌塘鳢的天然资源量持续下降约90%。但有关中华乌塘鳢的天然资源量现存状况却未见相关研究报道。
目前有关中华乌塘鳢的研究报道多集中在养殖及繁育方面,如池塘养殖[7]、网箱养殖[8]、围网养殖[9]、人工育苗[10]以及养殖管理等[11, 12]。此外,关于中华乌塘鳢的个体特征也有相关报道,如中华乌塘鳢利用体内的微生物使其耐低氧能力增强[13, 14]、鳃和肠道的渗透机制使其耐盐范围广[3]以及对氨毒性的防御[15]等方面。有关中华乌塘鳢天然资源量的研究,仅在长江口地区开展的一项人工漂浮湿地对浮游生物的影响研究中,提及在7-10月的底拖网调查中仅在7月捕获过中华乌塘鳢[16]。中华乌塘鳢常捕食青蟹(Scylla spp.),在红树林中位于食物链的顶端,而顶端的捕食者是某些生态系统持续存在的关键[17],因此利用科学的方法对红树林区中华乌塘鳢天然资源量进行有效评估是极其重要的。
中华乌塘鳢具有穴居习性[18],退潮后躲藏于洞穴,难以完全捕获,传统围网或诱捕笼的方式均无法对中华乌塘鳢的天然资源量进行科学评估。本研究针对红树林区中华乌塘鳢天然资源量无法准确评估的难题,选取广西珍珠湾红树林区作为典型研究区域,以大围网限定调查面积,采用诱捕笼捕抓,结合标志重捕法,调查了解广西珍珠湾红树林区中华乌塘鳢天然资源量及其时空分布动态,为红树林生态系统功能和生物多样性的保护和修复提供基础数据。
1 材料与方法 1.1 研究区域概况调查区域位于广西北仑河口国家级自然保护区的珍珠港石角红树林区(21°36′N, 108°14′E,图 1),为红树林地埋管道原位生态养殖的实验地[19]。珍珠湾位于广西防城港市江山镇白龙半岛,湾口西起万尾岛的东沙头,东至江山半岛的白龙台,湾口宽约3.50 km。全湾岸线长46.00 km,海湾面积94.20 km2,其中滩涂面积53.33 km2。珍珠港海区年平均气温为22.5℃,潮汐类型属全日潮,平均潮差为2.24 m,最大潮差5.05 m[20]。2012年防城港潮高基准面在平均海平面下230 cm,本次试验区域在潮汐大于255 cm时会淹没滩涂。广西北仑河口国家级自然保护区共有红树林1 230 hm2[21],其中研究地所在的珍珠湾有红树林939.97 hm2,绝大部分为桐花树(Aegiceras corniculatum)群落和白骨壤(Avicennia marina)群落,其中木榄(Bruguiera gymnorrhiza)+秋茄(Kandelia obovata)+白骨壤是该研究区的主要群落类型,桐花树群落主要生长在潮沟和海向林缘[22]。
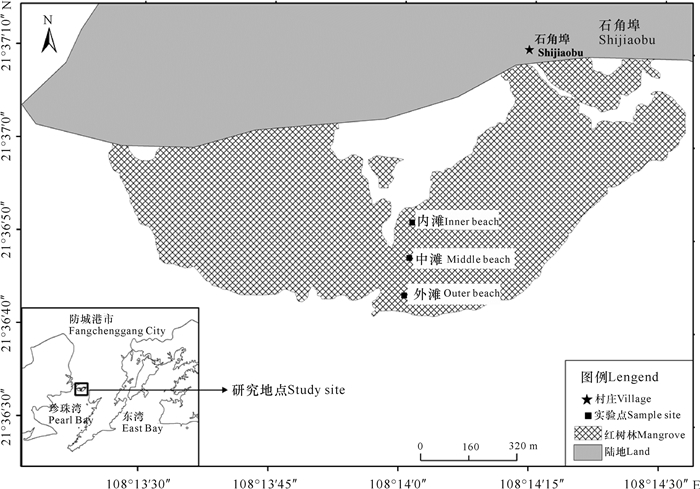
|
| 图 1 广西珍珠湾红树林林内调查点 Fig.1 Investigation sites in mangrove forests in Pearl Bay, Guangxi |
1.2 方法 1.2.1 围网及诱捕笼设置
用5 mm孔径的聚乙烯网布缝制成3条150 m长(面积约为0.18 hm2)的围网,高3 m。在垂直于海堤的直线上分别于内滩、中滩、外滩选定3个区域(中滩的高程最高,约比外滩高20 cm,比内滩高15 cm),间隔约120 m,围网底边约30 cm埋入沉积物中。在围网内放置3个20 m长的诱捕笼,3个诱捕笼中的任意两个成120°夹角从围网中心向边沿延伸(图 2)。
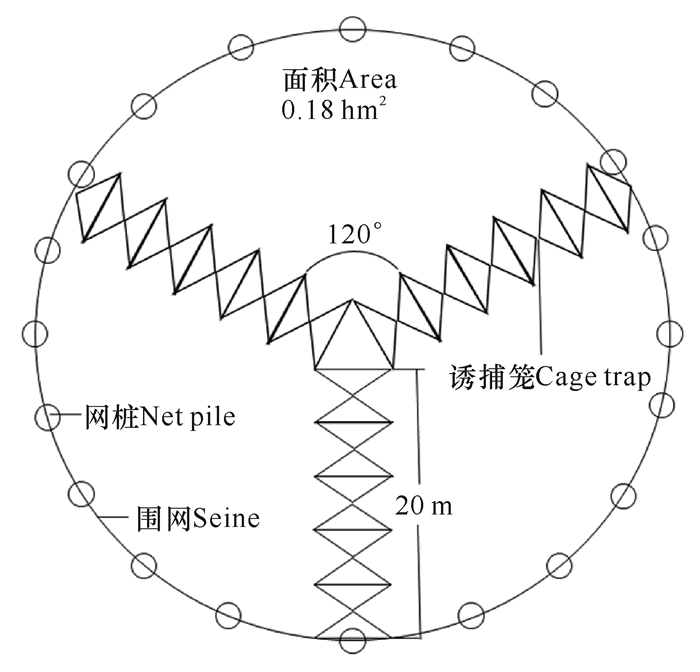
|
| 图 2 调查装置示意图 Fig.2 Schematic diagram of the survey unit |
1.2.2 标志重捕
标志重捕法是针对自由活动的生物,利用重新捕获的标志生物数占标志总数的比例等于捕获自然个体数与自然个体总数的比例,进一步对自然个体总数进行数学推断的方法,即在调查生物的环境中投放一定数量的被标志生物,经过一段时间后进行重新捕获,根据捕获的标志生物数与投放总数的比例,对应非标志生物数来估算种群资源量。该方法在国内外的鱼类调查中已被成熟使用[23, 24]。
实验前一个月将围网(含木桩)布设好,随后将网自然置于滩涂上,以此减少对野生鱼类的干扰。在每个季节代表月(1月、4月、7月、10月)的中旬开始实验,封闭滩涂4 d。第一天高潮时,利用小船将网挂置于木桩上,每个围网投放30尾预先进行尾鳍修齐的中华乌塘鳢(区别于野生个体),此后3 d每天用诱捕笼诱捕,记录诱捕到的天然鱼和标志鱼尾数,利用两栖鱼类外形特征测量装置[25]测量体长和体宽,并放置于吸水纸吸干鱼表面的水分,最后置于天平上称量湿重(精度0.01 g),随后重新放回围网滩涂。
1.2.3 水温和盐度水温采用HOBO光温记录仪(UA-002-08,温度记录范围:-20-70℃,精度:±0.53℃,Onset Computer Corporation,美国)每小时记录一次,将记录仪固定在滩涂表面,选取1月、4月、7月、10月进行分析,数据读取时去除记录仪非淹水时间的数据。
1.2.4 数学分析方法天然资源量(种群密度)计算公式:
D=(M×N/n)/S,
式中,D为该鱼类的天然资源量(ind./hm2),M为天然鱼类的捕获尾数(ind.),n为标志鱼类的捕获尾数(ind.),N为标志鱼类的投放尾数(ind.),S为围网面积(hm2)。生物量用种群密度乘以捕获个体的平均生物量来计算。
采用Excel和SPSS 21.0统计软件进行数据统计分析,多重比较采用LSD分析,文中数值均为平均值±标准误差的形式表示。利用Origin 2018进行作图。
2 结果与分析 2.1 水温由图 3可知,2013年珍珠湾红树林区涨潮时上覆水的温度呈先升后降趋势,7月的平均水温最高,达到(29.85±0.28)℃。

|
| 不同小写字母代表不同月份的水温差异显著(P<0.05) Different lowercase letters represents significant difference at P < 0.05 on water temperature at different month 图 3 2013年广西珍珠湾红树林区水体月均温度变化 Fig.3 Changes of monthly mean temperature of the water in Pearl Bay mangrove area of Guangxi in 2013 |
2.2 中华乌塘鳢资源量的时间变化
珍珠湾红树林区中华乌塘鳢的全年平均种群密度为(18.74±4.04) ind./hm2。由图 4可知,种群密度呈现中间高两边低的趋势,但各季度之间差异不显著(P>0.05)。
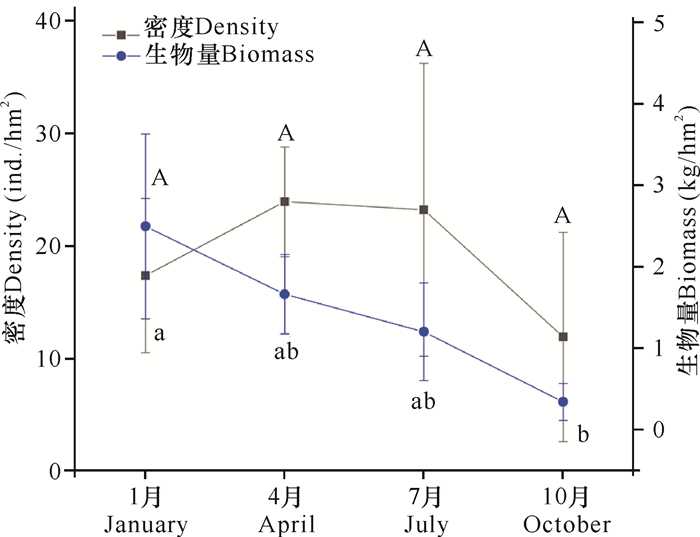
|
| 不同小写字母代表不同月份之间的生物量差异显著(P<0.05),不同大写字母代表不同月份的密度差异显著(P<0.05) Different lowercase letters represents significant difference at P < 0.05 on the biomass at different month.Different capital letters represents significant difference at P < 0.05 on the density at different month 图 4 2013年广西珍珠湾红树林区中华乌塘鳢种群密度和生物量的时间变化 Fig.4 Temporal variation of density and biomass of B.sinensis in Pearl Bay mangrove area of Guangxi in 2013 |
珍珠湾红树林区中华乌塘鳢的全年平均生物量为(1.44±0.37) kg/hm2。由图 4可知,生物量随时间依次递减,其中1月显著高于10月(P<0.05),其余季度之间差异不显著(P>0.05)。
2.3 中华乌塘鳢资源量的空间变化由图 5可知,珍珠湾红树林区中华乌塘鳢的种群密度随离陆地距离增加而增加,而生物量则为中滩最大,但种群密度和生物量在各滩位之间差异均不显著(P>0.05)。
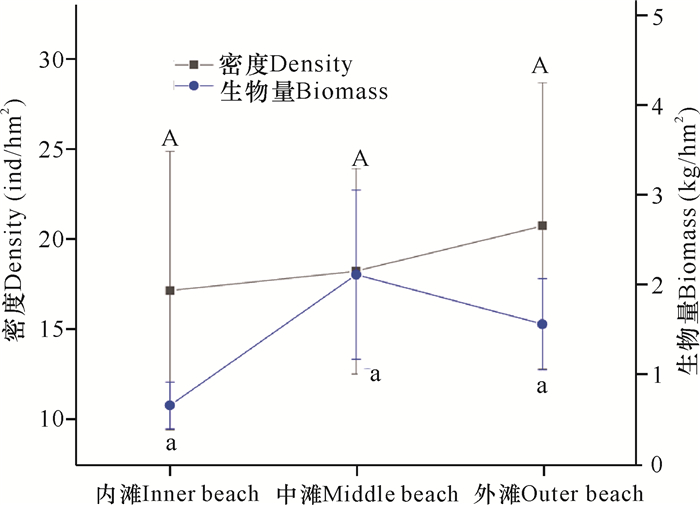
|
| 不同小写字母代表不同滩位之间的生物量差异显著(P<0.05),不同大写字母代表不同滩位的密度差异显著(P<0.05) Different lowercase letters represents significant difference at P < 0.05 on the biomass at different zonation.Different capital letters represents significant difference at P < 0.05 on the density at different zonation 图 5 2013年广西珍珠湾红树林区中华乌塘鳢种群密度和生物量的空间变化 Fig.5 Spatial variation of density and biomass of B.sinensis in Pearl Bay mangrove area of Guangxi in 2013 |
2.4 中华乌塘鳢的体长、体宽和性别
所分析的珍珠湾红树林区中华乌塘鳢的全年平均体长和平均体宽分别为(15.59±0.50) cm和(2.64±0.11) cm。由图 6可知,平均体长和平均体宽均表现为1月显著大于其他月(P<0.05),其余季度之间差异不显著(P>0.05)。

|
| 不同小写字母代表不同月份之间的平均体宽差异显著(P<0.05),不同大写字母代表不同月份的平均体长差异显著(P<0.05) Different lowercase letters represents significant difference at P < 0.05 on the average body weight at different month.Different capital letters represents significant difference at P < 0.05 on the average body length at different month body weight of B.sinensis in Pearl Bay mangrove area of Guangxi in 2013 图 6 2013年广西珍珠湾红树林区中华乌塘鳢平均体长和平均体宽的时间变化 Fig.6 Temporal variation of average body length and average |
由图 7可知,所分析的珍珠湾红树林区中华乌塘鳢的平均体长和平均体宽在各滩位的大小排序为中滩>外滩>内滩。
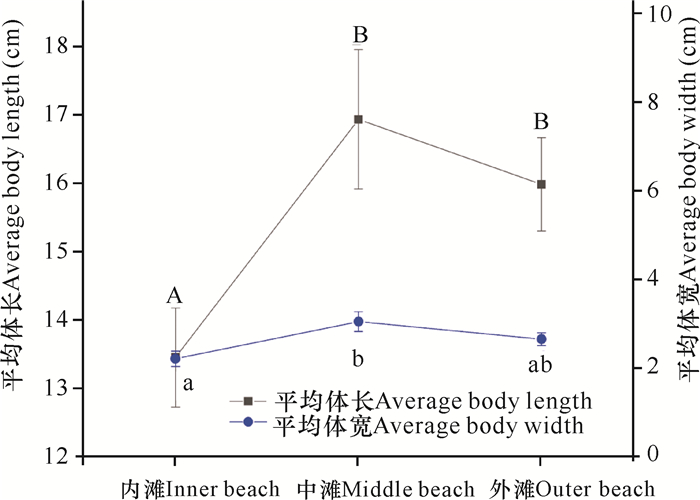
|
| 不同小写字母代表不同滩位之间的平均体宽差异显著(P<0.05),不同大写字母代表不同滩位的平均体长差异显著(P<0.05) Different lowercase letters represents significant difference at P < 0.05 in average body weight at different zonation.Different capital letters represents significant difference at P < 0.05 in average body length at different zonation 图 7 2013年广西珍珠湾红树林区中华乌塘鳢平均体长和平均体宽的空间变化 Fig.7 Spatial variation of average body length and average body weight of B.sinensis in Pearl Bay mangrove area of Guangxi in 2013 |
1月和10月捕获的野生中华乌塘鳢均为雄性,4月和7月的雌雄比分别为0.83和1.00。从滩位上看,内滩、中滩、外滩的中华乌塘鳢雌雄比分别为1.00,1.20,0.31。
3 讨论 3.1 红树林的作用本研究调查发现,广西珍珠湾红树林区中华乌塘鳢的种群密度季节差异不显著,但4月和7月的种群密度仍略高于1月和10月。季节性环境受不同季节之间水温和营养可利用性的变化影响[26]。盐度可能是影响红树林内中华乌塘鳢种群密度的主要因子,但因实验月份盐度数据的缺失无法直接阐述。根据该区域多年的盐度监测,盐度一般呈现先降(4月)后升(10月)的趋势,4月起盐度降至20‰以下,其主要原因是研究地点(广西防城港市)位于南亚热带,春季降雨量小,夏季降雨量大。尽管中华乌塘鳢的耐受盐度为0-35‰[2],但较适宜的盐度为10‰-25‰[2],另有研究表明中华乌塘鳢的苗种适宜盐度约为15‰[27],而该适宜盐度和4月盐度相近,可能该时段红树林区的盐度较适合中华乌塘鳢交配繁育后代,4月和7月的雌雄比接近1也可佐证。因此4月的种群密度增加。而1月和10月的种群密度较低也可能受温度影响,尽管中华乌塘鳢的耐温范围为6.0-35.0℃[1],但较理想的水温应在25-30.0℃[2]。由于红树林属于潮间带,退潮后滩涂裸露,冬季水温较低,中华乌塘鳢可能逃逸到海水较深的潮沟或远海躲避寒冷。
中华乌塘鳢的领域性强,常在泥浆表面打“Y”形泥洞,一进一出,非产卵季节雌雄个体均单独生活于洞中,但到了交配季节,雌性和雄性成对挖掘洞穴以躲避敌害和繁殖[2, 5, 18]。红树林滩涂的质地适合中华乌塘鳢挖掘洞穴,植物复杂的根系也为其提供躲避的空间,本研究发现中华乌塘鳢在红树林内无显著空间差异也说明了其适应性。中华乌塘鳢对硫化物的忍耐性高[28],而红树林的高硫化物含量等特性则限制很多动物的进入[29, 30],进而减少了中华乌塘鳢鱼苗被捕食的危险。另有研究表明,中华乌塘鳢的产卵季节为4-10月,在中国东南部沿海水域产卵高峰期为5-7月[31, 32]。本研究的调查结果显示,雌鱼4月开始在红树林出现,且4月和7月的中华乌塘鳢雌雄比接近1。综上所述,红树林为中华乌塘鳢提供了良好的繁育场。
3.2 资源量趋势调查结果显示,珍珠湾红树林区中华乌塘鳢的种群密度为(18.74±4.04) ind./hm2,生物量为(1.44±0.37) kg/hm2,若以亩为单位,则每亩仅有1.25尾中华乌塘鳢,生物量也仅为0.1 kg。尽管之前没有确切的研究数据,但通过走访广西沿海的渔民可知,目前野生的中华乌塘鳢极少,几乎没有渔民靠捕捞中华乌塘鳢为生。此外本研究捕捞到的个体形态较小,趋向于小型化。过度捕捞是造成该现象的重要原因之一,在广西沿海的红树林中随处可见蜈蚣网,使得原本资源量就匮乏的中华乌塘鳢更加少。另有研究表明,在北部湾沿海,中华乌塘鳢、拟穴青蟹(Scylla paramamosain)、中国鲎(Tachypleus tridentatu)等经济动物野生资源量比30年前下降85%以上,2004-2010年间,海南东寨港鱼类种类和单网渔获物数量均下降30%以上[33]。
尽管陆基海水养殖排放污染绝对量仅占入海总量的5.31%,但其排放具有明显的时空性,集中排放是最大的问题,其污染物浓度是自然海水的数十至上百倍[33],对大多数的海洋生物均造成了严重的影响。曾被誉为滨海生态产品的“红树林海鸭蛋”[34]实际上就是放养于红树林区家鸭生产的蛋,随着养殖密度和放养范围的增大,家禽的过度捕食使底栖生物的丰度和种类也随之下降[35],生活在红树林中的中华乌塘鳢也不能幸免。此外,互花米草入侵严重也是导致资源量下降的原因之一: 首先互花米草占据了红树林外围的滩涂,减少了中华乌塘鳢的栖息空间,还可能阻挡中华乌塘鳢进入红树林的通道;其次红树林周边滩涂的动物多样性和生物量往往比红树林高[29, 36-38],空间的缺失也减少了中华乌塘鳢的食物来源。综上所述,中华乌塘鳢的天然资源量处于下降趋势。
3.3 种群恢复建议过度捕捞是中华乌塘鳢天然资源量变小的主要原因,可从以下3方面进行恢复:(1)加强红树林保护区的管理,严禁在红树林保护区内布设蜈蚣网等灭绝性渔具;(2)在非保护区内实施禁渔期,如中国东南部沿海水域,鱼类产卵高峰期为5-7月,可将禁渔期设置在鱼类的产卵期;(3)提高周边渔民的保护意识,宣传捕大留小的策略。
其次是生境的保护和恢复。对被互花米草入侵的区域应加强治理,未被入侵区域严格管控,一旦发现立即清除,此外对外来物种的引种应谨慎;对周边陆基养殖塘的排放进行严格监督,严禁一次性高浓度排放,可采取低浓度排放或固体化处理;还可采用相关底栖动物保育装置进行恢复[39]。
中华乌塘鳢的野外生态位研究仍存在较多的空白,应有针对性开展相关的研究,如产卵场的位置、环境条件及范围等,还可利用特异性寄生虫、标志放流追踪、耳石微化学特征等方法研究其生活史的路线和过程,同时通过顶级捕食者平衡红树林生态系统的稳定,以此更好地促进中华乌塘鳢的资源恢复。
4 结论广西珍珠湾红树林区中华乌塘鳢天然资源量极小,其在时间序列和滩位空间分布上无明显规律,个体趋于小型化。季度间的雌性比例显示红树林是中华乌塘鳢的主要繁育场所,中华乌塘鳢在高温季节进入红树林的几率更高,但过度捕捞和生境的破坏使其天然资源量处于下降趋势。应加强捕捞管理和生境保护,平衡中华乌塘鳢顶级捕食者在红树林生态系统的作用。
致谢
感谢广西科学院广西红树林研究中心珍珠港滨海生态实验站的罗砚、钟云平对野外采样的帮助。
| [1] |
竺俊全, 李明云, 何旭强, 等. 中华乌塘鳢对有关环境因子的耐受性及其生物学特性初步观察[J]. 海洋渔业, 2000, 22(1): 10-13. DOI:10.3969/j.issn.1004-2490.2000.01.004 |
| [2] |
钟爱华, 李明云. 中华乌塘鳢的生物学特性及人工育苗研究进展[J]. 浙江海洋学院学报: 自然科学版, 2002, 21(3): 269-272. DOI:10.3969/j.issn.1008-830X.2002.03.014 |
| [3] |
PEH W Y X, CHEW S F, WILSON J M, et al. Branchial and intestinal osmoregulatory acclimation in the four-eyed sleeper, Bostrychus sinensis (LacepSde), exposed to seawater[J]. Marine Biology, 2009, 156(9): 1751-1764. DOI:10.1007/s00227-009-1210-5 |
| [4] |
KOTTELAT M, WHITTEN A J, KARTIKASARI S N, et al. Freshwater fishes of Western Indonesia and Sulawesi[M]. Hong Kong: Periplus Editions, 1993.
|
| [5] |
WANG H J, LIN H D, ZHANG L Y, et al. Development and characterization of 20 microsatellite markers for chinese black sleeper, Bostrychus sinensis[J]. International Journal of Molecular Sciences, 2011, 12(12): 9570-9575. DOI:10.3390/ijms12129570 |
| [6] |
邵广昭. 台湾鱼类资料库[EB/OL]. (2021-5-29). http://fishdb.sinica.edu.tw.
|
| [7] |
张邦杰, 毛大宁, 张邦豪, 等. 中华乌塘鳢的池养生物学与养成技术研究[J]. 海洋科学, 1997, 21(5): 15-18. |
| [8] |
任松, 李显然, 胡礼胜. 中华乌塘鳢网箱养殖技术初探[J]. 海洋科学, 1998, 22(2): 11-13. |
| [9] |
黄建华. 红树林滩涂围养中华乌塘鳢的可行性探讨[J]. 水产科技, 2001, 95(5): 5-6. DOI:10.3969/j.issn.1004-6755.2001.05.004 |
| [10] |
刘振勇. 中华乌塘鳢人工苗种的养成试验[J]. 海洋渔业, 1996, 18(3): 111-113. |
| [11] |
赵青松, 金珊. 中华乌塘鳢野生苗种的采捕与暂养技术[J]. 水利渔业, 2005, 25(5): 19-20. DOI:10.3969/j.issn.1003-1278.2005.05.009 |
| [12] |
李宽意, 谷孝鸿. 中华乌塘鳢半咸水中的养殖技术[J]. 水产养殖, 1998(2): 9-10. |
| [13] |
FAN S L, LI H D, ZHAO R. Effects of normoxic and hypoxic conditions on the immune response and gut microbiota of Bostrichthys sinensis[J]. Aquaculture, 2020, 525: 735336. DOI:10.1016/j.aquaculture.2020.735336 |
| [14] |
张健东, 陈刚. 中华乌塘鳢耗氧率和窒息点的研究[J]. 水产养殖, 2002(4): 28-31. DOI:10.3969/j.issn.1004-2091.2002.04.011 |
| [15] |
PEH W Y X, CHEW S F, CHING B Y, et al. Roles of intestinal glutamate dehydrogenase and glutamine synthetase in environmental ammonia detoxification in the euryhaline four-eyed sleeper, Bostrychus sinensis[J]. Aquatic Toxicology, 2010, 98(1): 91-98. DOI:10.1016/j.aquatox.2010.01.018 |
| [16] |
HUANG X F, ZHAO F, SONG C, et al. Effects of stereoscopic artificial floating wetlands on nekton abundance and biomass in the Yangtze Estuary[J]. Chemosphere, 2017, 183: 510-518. DOI:10.1016/j.chemosphere.2017.05.091 |
| [17] |
ESTES J A, TERBORGH J, BRASHARES J S, et al. Trophic downgrading of planet earth[J]. Science, 2011, 333(6040): 301-306. DOI:10.1126/science.1205106 |
| [18] |
HONG W S, CHEN S X, ZHANG Q Y, et al. Sex organ extracts and artificial hormonal compounds as sex pheromones to attract broodfish and to induce spawning of Chinese black sleeper (Bostrichthys sinensis Lacepede)[J]. Aquaculture Research, 2006, 37(5): 529-534. DOI:10.1111/j.1365-2109.2006.01462.x |
| [19] |
FAN H Q, HE B Y, PERNETTA J C. Mangrove ecofarming in Guangxi Province China: An innovative approach to sustainable mangrove use[J]. Ocean & Coastal Management, 2013, 85. |
| [20] |
邱广龙, 范航清, 李蕾鲜, 等. 潮间带海草床的生态恢复[M]. 北京: 中国林业出版社, 2014.
|
| [21] |
贾明明. 1973~2013年中国红树林动态变化遥感分析[D]. 长春: 中国科学院研究生院(东北地理与农业生态研究所), 2014.
|
| [22] |
陶艳成, 葛文标, 刘文爱, 等. 基于高分辨率卫星影像的广西红树林面积监测与群落调查[J]. 自然资源学报, 2017, 32(9): 1602-1614. |
| [23] |
谢松光, 李钟杰, 崔奕波. 用围网标志回捕法研究草型湖泊小型鱼类的密度[J]. 水生生物学报, 2003, 27(1): 98-99. DOI:10.3321/j.issn:1000-3207.2003.01.020 |
| [24] |
POOS M, LAWRIE D, TU C, et al. Estimating local and regional population sizes for an endangered minnow, redside dace (Clinostomus elongatus), in Canada[J]. Aquatic Conservation: Marine and Freshwater Ecosystems, 2012, 22(1): 47-57. DOI:10.1002/aqc.1235 |
| [25] |
苏治南, 钟云旭, 范航清, 等. 两栖鱼类外形特征测量装置: CN201720504633.5[P]. 2018-05-01. https://wenku.baidu.com/view/9712effca01614791711cc7931b765ce04087a4a?fr=xueshu.
|
| [26] |
COSTA-PEREIRA R, TAVARES L E R, DE CAMARGO P B, et al. Seasonal population and individual niche dynamics in a tetra fish in the Pantanal wetlands[J]. Biotropica, 2017, 49(4): 531-538. DOI:10.1111/btp.12434 |
| [27] |
ZHANG Y T, HUANG S, QIU H T, et al. Optimal salinity for rearing Chinese black sleeper (Bostrychus sinensis) fry[J]. Aquaculture, 2017, 476: 37-43. DOI:10.1016/j.aquaculture.2017.04.004 |
| [28] |
陆宇哲, 潘红平, 王帅, 等. 养殖模式及酸和硫化物胁迫对中华乌塘鳢血液生理生化指标的影响[J]. 广西科学, 2017, 24(5): 516-522. |
| [29] |
ELLIS J, NICHOLLS P, CRAGGS R, et al. Effects of terrigenous sedimentation on mangrove physiology and associated macrobenthic communities[J]. Marine Ecology Progress Series, 2004, 270: 71-82. DOI:10.3354/meps270071 |
| [30] |
LEE S Y. The effect of mangrove leaf litter enrichment on macrobenthic colonization of defaunated sandy substrates[J]. Estuarine, Coastal and Shelf Science, 1999, 49(5): 703-712. DOI:10.1006/ecss.1999.0523 |
| [31] |
HONG W S, ZHANG Q Y. Review of captive bred species and fry production of marine fish in China[J]. Aquaculture, 2003, 227(1/4): 305-318. |
| [32] |
HONG W S, CHEN S X, ZHENG W Y, et al. Hermaphroditism in cultured Chinese black sleeper (Bostrichthys sinensis L. )[J]. Journal of the World Aquaculture Society, 2006, 37(4): 363-369. DOI:10.1111/j.1749-7345.2006.00049.x |
| [33] |
范航清, 王文卿. 中国红树林保育的若干重要问题[J]. 厦门大学学报: 自然科学版, 2017, 56(3): 323-330. |
| [34] |
范航清, 苏治南, 王欣, 等. 红树林地埋管道原位生态养殖系统[M]. 北京: 科学出版社, 2020.
|
| [35] |
祝阁, 钟才荣, 李诗川, 等. 海南东寨港集约化海鸭养殖对红树林的影响[C]//中国第五届红树林学术会议. 温州: [s. n. ], 2011.
|
| [36] |
ALFARO A C. Benthic macro-invertebrate community composition within a mangrove/seagrass estuary in northern New Zealand[J]. Estuarine, Coastal and Shelf Science, 2006, 66(1/2): 97-110. |
| [37] |
SU Z N, QIU G L, FAN H Q, et al. Changes in carbon storage and macrobenthic communities in a mangrove-seagrass ecosystem after the invasion of smooth cordgrass in Southern China[J]. Marine Pollution Bulletin, 2020, 152: 110887. DOI:10.1016/j.marpolbul.2020.110887 |
| [38] |
SU Z N, QIU G L, FAN H Q, et al. Seagrass beds store less carbon but support more macrobenthos than mangrove forests[J]. Marine Environmental Research, 2020, 162: 105162. DOI:10.1016/j.marenvres.2020.105162 |
| [39] |
钟云旭, 倪孔平, 罗砚, 等. 活塞式开放插管底栖动物自然保育装置及应用: CN201210568841.3[P]. 2014-07-16.
|



