红树林是生长在热带和亚热带潮间带滩涂上的木本植物群落,其与周围的环境相互作用,共同构成独特的红树林生态系统[1]。红树林生态系统支撑着独特的动物群[2],大型底栖动物是其重要的组成部分[3],其中软体动物是红树林大型底栖动物最主要的类群之一[4, 5]。软体动物是重要的生物工程师,它们通过摄食、造穴和排泄等活动改变了红树林水体理化特性,促进物质循环和能量流动[6-8],为鸟类、鱼类等动物提供主要食物来源[9],对红树林区动物多样性的维持有重要作用。已有研究表明,软体动物活动能力弱且活动范围小,对环境变化比较敏感,可作为指示生物反映滨海湿地生态环境的变化[10-14]。
红树林底栖物种的时空分布格局是生态学研究的热点之一,不仅可以揭示物种的时空结构,而且还可以确定影响物种分布格局的生态过程机制[15-17]。这对红树林生物多样性保护和生态系统功能维持具有重要意义。近年来,有关红树林软体动物的时空分布格局已开展了广泛的研究[18-21],但大多数的研究尺度仅聚焦在潮间带尺度。目前,在景观尺度上(如海湾尺度)有关红树林软体动物时空分布格局及其机制的研究还较少。另外,在全球变化和城市化的背景下,养殖污水、生活污水和工业废水任意排放等环境压力是导致红树林湿地功能退化的主要原因之一[22-24]。例如,有研究表明海水盐度、氧化还原电位、pH值、潮汐等水文环境会影响潮间带尺度下的红树林软体动物群落结构[24, 25]。目前,水环境条件在景观尺度(如海湾尺度)上是否影响底栖软体动物群落结构仍不清楚。因此,在景观尺度(如海湾尺度)下,探究底栖软体动物的时空格局和水环境因素的关系对保护和维持红树林生态系统功能具有重要的生态学意义。
海南东寨港是海口市东北部与文昌市西北部之间的内海,形似漏斗状,是中国热带地区的一个典型溺谷型海湾,其动植物种类丰富。东寨港滩涂水域面积为5 400 hm2,其中423.5 hm2为海水养殖区[26]。另外,东寨港周边分布较多的养猪场和规模约1 333 hm2的水产养殖塘,大部分的养殖废水未经处理直接排入东寨港,导致东寨港水体受到不同程度的污染[26]。水环境的变化预计对水生生物如底栖软体动物产生影响进而改变其群落结构[10]。因此,本研究以海南东寨港湾为研究区,通过设置湾口、湾中、湾顶3个典型红树林地点对软体动物进行四季调查,并测定水环境因子,分析海湾内软体动物群落的时空分布特征,探讨影响软体动物群落结构差异的主要水环境因子,为全球变化和城市化背景下的红树林湿地功能保护和管理提供科学依据。
1 材料与方法 1.1 研究区域概况海南东寨港(110°32′-110°37′E, 19°51′-20°1′N)位于海南岛东北部,是由地震沉陷形成的溺谷型海湾,伸入内陆达15 km。东寨港北临琼州海峡,海岸线曲折,周围有演丰河、珠溪河等流入海湾内的溪流。潮汐为不规则的半日潮,平均潮差为1.29 m。因处于东南沿海地区,海湾受热带风暴侵袭较为频繁,属热带海洋性季风气候,年平均气温23.3-23.8℃,年平均降水量1 676.4 mm。东寨港面积为52.4 km2,其中红树林占1/3,主要分布于塔市、演丰镇、三江镇等地。塔市位于东寨港北侧出海口附近,优势种为红海榄(Rhizophora stylosa)和白骨壤(Avicennia marina);演丰镇位于东寨港中部,优势种为角果木(Ceriops tagal)和海莲(Bruguiera sexangula);三江镇位于东寨港南端,即“漏斗状”底部,优势种为无瓣海桑(Sonneratia apetala)和海莲。
1.2 软体动物群落和水环境因子调查2020年7月至2021年4月,通过夏(7月)、秋(10月)、冬(1月)、春(4月)四季对海湾内湾口塔市(TS)、湾中山尾头(SWT)和湾顶三江(SJ) 3个主要红树林地点软体动物多样性进行调查(图 1)。3个调查地点各设置1条垂直于海岸的断面,每条断面设置3个采样点,共9个采样点。在低潮时,采用25 cm×25 cm的定量框,在每个采样点随机设置5个重复样方(样方间距10 m以上),收集底泥表面的软体动物,挖至30 cm深,使用1 mm孔径的筛网进行筛洗,分选出底泥中的软体动物。所收集的各样方内软体动物样品用自封袋分装记录后带回实验室,按《海洋调查规范第6部分:海洋生物调查指南》(GB/T 12763.6-2007)进行处理、鉴定、计数和称重。在高潮时,利用德国WTW便携式多参数水质分析仪在每个季度现场测定水环境物理指标,包括水温、溶解氧、总溶解固体、pH值、盐度。
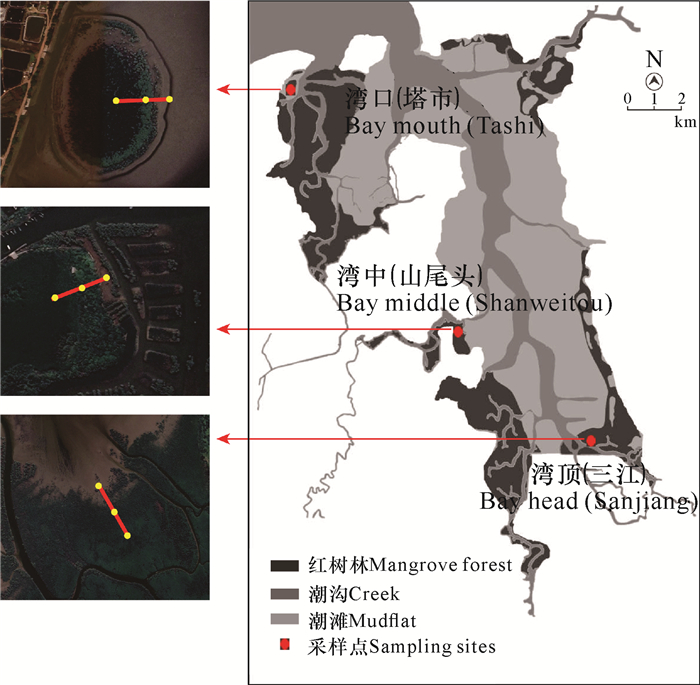
|
| 图 1 海南东寨港调查地点分布 Fig.1 Survey site map in Dongzhaigang, Hainan Island |
1.3 数据处理与分析
采用个体数计算软体动物的优势度与多样性指数,公式如下:
(1) 优势度指数[27]
| $ Y = {P_i} \times {f_i}。$ |
(2) Margalef丰富度指数[28]
| $ {d = \left( {S - 1} \right)/{\rm{lo}}{{\rm{g}}_2}N。} $ |
(3) Shannon-Wiener多样性指数[29]
| $ {H' = - \sum\limits_{i = 1}^S {{P_i}{\rm{lo}}{{\rm{g}}_2}{P_i}} 。} $ |
(4) Pielou均匀度指数[30]
| $ {J = H' /{\rm{lo}}{{\rm{g}}_2}S。} $ |
式中,Pi是第i种个体数占总个体数的比值;fi是第i种物种在各站位出现的频率;S是样方内总种类数;N是样方内总个体数。当Y≥0.02时,该种确定为优势种[30]。以上计算均在Excel 2013中进行。
使用SPSS 20.0软件进行单因素方差分析和Pearson相关性分析,比较软体动物密度、生物量及多样性指数在不同地点、不同季节间的差异及其与水环境因子的关系。图形和图表绘制由Excel 2013和Origin 2021b完成。
软体动物群落相似性分析基于Bray-Curtis距离对断面内样点的密度数据进行四次方根转化和标准化处理后,以组平均法进行等级聚类。聚类后采用Similarity Profiles (SIMPROF)分析来验证聚类所得的群落结构模式与随机空间结构是否存在差异显著,并采用Similarity Percentages(SIMPER)识别特征种及其对应的贡献率。所有的分析均使用PRIMER v6.0进行[31]。
2 结果与分析 2.1 物种组成与优势度共采集到软体动物895个个体,隶属于2纲6目18科31种(表 1),其中双壳纲3目9科18种,占总物种数的58.1%;腹足纲3目9科13种,占41.9%。帘蛤科种类最多,共4种。
| 纲 Class |
目 Order |
科 Family |
种 Species |
湾口 Bay mouth |
湾中 Bay middle |
湾顶 Bay head |
| 双壳纲 Bivalvia |
帘蛤目 Veneroida |
满月蛤科 Lucinidae |
印澳蛤 Indoaustriella plicifera |
√ | √ | √ |
| 斯氏印澳蛤 Indoaustriella scarlato |
√ | √ | √ | |||
| 中带蛤科 Mesodesmatidae |
台湾朽叶蛤 Coecella formaosae |
√ | ||||
| 樱蛤科 Tellinidae |
拟箱美丽蛤 Merisca capsoides |
√ | ||||
| 亮樱蛤未定种1 Nitidotellina sp.1 |
√ | √ | ||||
| 亮樱蛤未定种2 Nitidotellina sp.2 |
√ | |||||
| 截蛏科 Solecurtidae |
缢蛏 Sinonovacula constricta |
√ | ||||
| 蚬科 Corbiculidae |
红树蚬 Geloina coaxans |
√ | √ | |||
| 凹线仙女蚬 Cyrenobatissa subsulcata |
√ | |||||
| 帘蛤科 Veneridae |
鳞杓拿蛤 Anomalodiscus squamosus |
√ | ||||
| 伊萨伯雪蛤 Clausinella isabellina |
√ | |||||
| 青蛤 Cyclina sinensis |
√ | |||||
| 日本镜蛤 Dosinia japonica |
√ | |||||
| 绿螂科 Glauconomidae |
中国绿螂 Glauconome chinensis |
√ | ||||
| 皱纹绿螂 Glauconome corrugata |
√ | √ | ||||
| 海螂目 Myoida |
蓝蛤科 Corbulidae |
光滑蓝蛤 Potamocorbula laevis |
√ | |||
| 河蓝蛤未定种 Potamocorbula sp. |
√ | |||||
| 笋螂目 Pholadomyoida |
鸭嘴蛤科 Laternulidae |
截形鸭嘴蛤 Laternula truncata |
√ | √ | ||
| 腹足纲 Gastropoda |
中腹足目 Mesogastropoda |
拟沼螺科 Assimineidae |
短拟沼螺 Assiminea brevicula |
√ | √ | √ |
| 绯拟沼螺 Assiminea latericea |
√ | √ | √ | |||
| 滩栖螺科 Batillariidae |
纵带滩栖螺 Batillaria zonalis |
√ | ||||
| 汇螺科 Potamididae |
珠带拟蟹守螺 Cerithidea cingulata |
√ | √ | √ | ||
| 查加拟蟹守螺 Cerithidea djadjariensis |
√ | √ | √ | |||
| 小翼拟蟹守螺 Cerithidea microptera |
√ | √ | √ | |||
| 狭口螺科 Stenothyridae |
日本狭口螺 Stenothyra japonica |
√ | √ | |||
| 麂眼螺科 Rissoidae |
方形埃列螺 Iravadia quadrasi |
√ | √ | |||
| 河口螺科 Iravadiidae |
河口螺未定种1 Ceratia sp.1 |
√ | √ | |||
| 河口螺未定种2 Ceratia sp.2 |
√ | |||||
| 新腹足目 Neogastropoda |
织纹螺科 Nassariidae |
秀丽织纹螺 Nassarius festiva |
√ | |||
| 基眼目 Basommatophora |
两栖螺科 Amphibolidae |
泷岩两栖螺 Salinator takii |
√ | |||
| 耳螺科 Ellobiidae |
环带异耳螺 Allochroa layardi |
√ |
湾口的软体动物物种数最多(26种),湾中、湾顶的较少,分别为12种、14种(图 2a)。从季节上来看,冬季物种数最多,为22种,春季次之(21种),夏、秋季较少,分别为13种、14种(图 2b)。
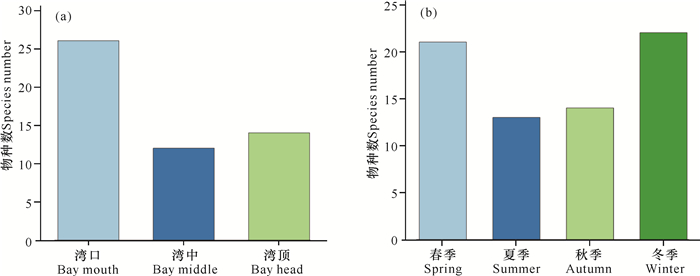
|
| 图 2 海南东寨港不同地点(a)、不同季节(b)红树林软体动物的物种数 Fig.2 Species number of mangrove mollusk at different sites (a) and seasons (b) in Dongzhaigang, Hainan Island |
总体来看,海湾内红树林软体动物的优势种为珠带拟蟹守螺(Cerithidea cingulata)、小翼拟蟹守螺(Cerithidea microptera)、绯拟沼螺(Assiminea latericea)、短拟沼螺(Assiminea brevicula)、印澳蛤(Indoaustriella plicifera)、斯氏印澳蛤(Indoaustriella scarlatoi)等(表 2),其中汇螺科个体数最多,为557个,占总个体数的62.2%。海湾内红树林软体动物优势种在不同地点间存在差异(表 2)。湾口优势种种类较多,河口螺未定种2(Iravadia sp.2)、印澳蛤、凹线仙女蚬(Cyrenobatissa subsulcata)、台湾朽叶蛤(Coecella formaosae)、亮樱蛤未定种1(Nitidotellina sp.1)为其独有的优势种。湾中红树蚬(Geloina coaxans)生物量大,是其主要优势种之一。光滑蓝蛤(Potamocorbula laevis)仅在湾顶为主要优势种。从季节上来看,红树林软体动物优势种差异显著。河口螺未定种2、印澳蛤、凹线仙女蚬为春季独有的优势种。红树蚬、台湾朽叶蛤分别为夏季、冬季的主要优势种。秋季的独有优势种为光滑蓝蛤和亮樱蛤未定种1。
| 种类 Species |
湾口Bay mouth | 湾中Bay middle | 湾顶Bay head | |||||||||||
| 春季 Spring |
夏季 Summer |
秋季 Autumn |
冬季 Winter |
春季 Spring |
夏季 Summer |
秋季 Autumn |
冬季 Winter |
春季 Spring |
夏季 Summer |
秋季 Autumn |
冬季 Winter |
|||
| 珠带拟蟹守螺 Cerithidea cingulata |
0.001 | 0.237 | 0.003 | 0.130 | 0.005 | 0.107 | 0.300 | 0.330 | 0.342 | 0.218 | - | 0.109 | ||
| 小翼拟蟹守螺 Cerithidea microptera |
- | - | 0.026 | 0.075 | 0.051 | - | - | 0.003 | 0.013 | - | - | 0.053 | ||
| 短拟沼螺 Assiminea brevicula |
0.043 | - | 0.003 | 0.000 | 0.010 | 0.014 | - | 0.009 | 0.014 | 0.007 | - | 0.103 | ||
| 绯拟沼螺 Assiminea latericea |
- | - | 0.012 | 0.025 | 0.010 | 0.057 | - | - | - | 0.005 | - | 0.010 | ||
| 河口螺未定种2 Iravadia sp.2 |
0.030 | - | - | - | - | - | - | - | - | - | - | - | ||
| 印澳蛤 Indoaustriella plicifera |
0.053 | 0.000 | 0.017 | 0.000 | - | - | 0.003 | - | - | 0.002 | - | - | ||
| 斯氏印澳蛤 Indoaustriella scarlatoi |
0.010 | 0.010 | 0.070 | 0.007 | 0.046 | - | - | 0.017 | 0.001 | - | - | - | ||
| 凹线仙女蚬 Cyrenobatissa subsulcata |
0.038 | - | - | - | - | - | - | - | - | - | - | - | ||
| 红树蚬 Geloina coaxans |
- | - | - | - | 0.003 | 0.029 | 0.006 | - | 0.001 | 0.001 | - | 0.005 | ||
| 光滑蓝蛤 Potamocorbula laevis |
0.008 | - | - | - | - | - | - | - | - | - | 0.067 | - | ||
| 台湾朽叶蛤 Coecella formaosae |
- | 0.008 | 0.006 | 0.031 | - | - | - | - | - | - | - | - | ||
| 亮樱蛤未定种1 Nitidotellina sp.1 |
- | 0.004 | 0.035 | 0.007 | 0.003 | - | - | - | - | - | - | - | ||
| 注:加粗斜体数字对应的种类为优势种, -表示未出现 Note: Dominant species marked with bold italic number, - means not present |
||||||||||||||
2.2 密度和生物量
软体动物年平均密度和平均生物量分别为79.6 ind./m2、78.7 g/m2。单因素方差分析结果表明,海湾内软体动物密度和生物量在不同地点间差异显著(P < 0.05)(图 3a、c)。湾口软体动物的密度显著高于湾中、湾顶,但湾口生物量却低于湾中,而高于湾顶。从季节上看,软体动物的密度在不同季节间存在显著差异(P < 0.05),秋季密度显著低于其他三季,但生物量不存在显著差异(P>0.05)(图 3b、d)。
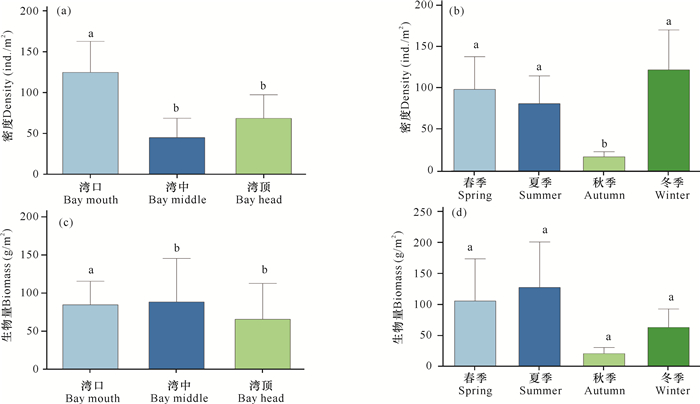
|
| 不同的小写字母表示差异显著 Different lowercase letters mean significant difference 图 3 海南东寨港不同地点(a)(c)、不同季节(b)(d)红树林软体动物密度和生物量 Fig.3 Density and biomass of mangrove mollusk at different sites (a)(c) and seasons (b)(d) in Dongzhaigang, Hainan Island |
2.3 物种多样性
Margalef丰富度指数(d)、Pielou均匀度指数(J)和Shannon-Wiener多样性指数(H′)平均值分别为1.220±0.188,0.591±0.078,1.815±0.275。Margalef丰富度指数为0-2.498,Pielou均匀度指数为0-0.919,Shannon-Wiener多样性指数为0-3.384。海湾内软体动物的Margalef丰富度指数、Pielou均匀度指数和Shannon-Wiener多样性指数变化趋势均是湾口>湾中>湾顶(图 4a、c、e),湾口物种多样性高,而湾顶物种多样性最低。软体动物在不同季节的Margalef丰富度指数、Pielou均匀度指数和Shannon-Wiener多样性指数呈现相同变化趋势,即春季>冬季>夏季>秋季(图 4b、d、f)。
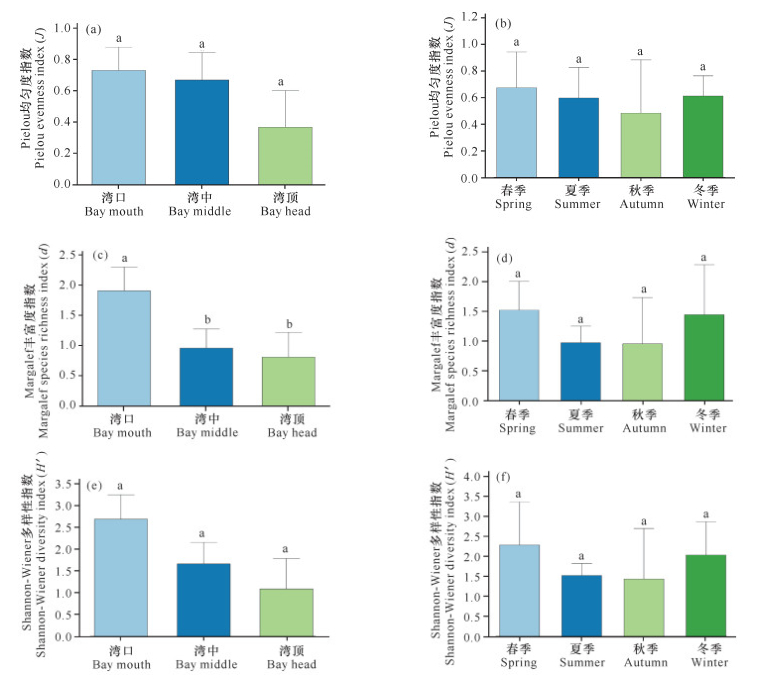
|
| 不同小写字母表示差异显著 Different lowercase letters mean significant difference 图 4 海南东寨港不同地点(a)(c)(e)、不同季节(b)(d)(f)红树林软体动物群落多样性指数 Fig.4 Diversity index of mangrove mollusk communities at different sites (a)(c)(e) and seasons (b)(d)(f) in Dongzhaigang, Hainan Island |
2.4 聚类分析
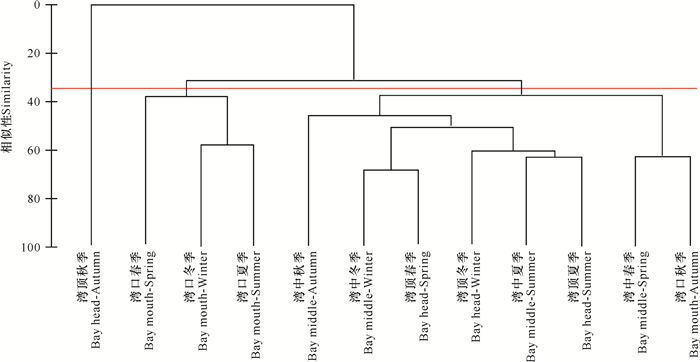
Cluster聚类结果表明,在群落相似度为35%的水平上,海湾内存在3组不同的软体动物群落(图 5),SIMPROF检验进一步证明其存在显著差异(P < 0.05)。湾顶秋季单独成为一组,湾口的春季、夏季、冬季为第二组,其余的共同组合为第三组。SIMPER分析表明湾口的一阶贡献种为斯氏印澳蛤,贡献率为21.13%;湾中和湾顶的一阶贡献种均为珠带拟蟹守螺,其贡献率分别为51.59%、45.68%。
|
| 图 5 海南东寨港红树林软体动物群落聚类图 Fig.5 Cluster dendromgram of mangrove mollusk communities in Dongzhaigang, Hainan Island |
2.5 软体动物群落参数与环境因子的Pearson相关分析
将3个地点的密度、生物量和多样性指数与环境因子进行Pearson相关性分析,结果表明,盐度和总溶解固体与底栖软体动物群落的相关性系数大于0.7,表明盐度和总溶解固体与底栖软体动物达到极显著的高度相关水平(R>0.7, P≤0.01)(表 3)。
| 参数 Parameters |
密度 Density (ind./m2) |
生物量 Biomass (g/m2) |
Margalef丰富度指数 Margalef species richness index (d) |
Pielou均匀度指数 Pielou evenness index (J) |
Shannon-Wiener多样性指数 Shannon-Wiener diversity index (H′) |
| 总溶解固体 Total dissolved solids (g/L) |
0.834** | 0.775** | 0.404 | 0.383 | 0.375 |
| 溶解氧 Dissolved oxygen (mg/L) |
0.337 | -0.013 | 0.122 | -0.047 | 0.039 |
| 温度 Temperature (℃) |
-0.155 | 0.146 | -0.215 | -0.015 | -0.155 |
| 盐度 Salinity |
0.830** | 0.772** | 0.401 | 0.389 | 0.380 |
| pH | 0.381 | 0.266 | 0.219 | 0.294 | 0.261 |
| Note: **P≤0.01 | |||||
3 讨论 3.1 红树林软体动物群落季节变化
软体动物群落的季节变化是反映其群落结构的重要特征,但不同红树林区的季节变化规律并不相同。泉州湾洛阳红树林自然保护区底栖软体动物物种数、密度、生物量及物种多样性指数均呈现为春季>秋季[21];香港红树林区树栖和底栖软体动物冬季物种数、密度、生物量均大于夏季[32];广东珠海淇澳岛红树林区底栖软体动物物种数则为秋、冬季较多,春、夏季较少[33];九龙江口红树林区软体动物密度呈现的规律为冬季最高,夏季最低,其季节变化与梯拟沼螺(Assiminea scalaris)有直接关系[34];海南东寨港底栖软体动物物种数、密度、生物量为春季较多,夏季最少[35]。本研究中海湾内软体动物物种数、密度、多样性指数均表现为春、冬季较多,夏、秋季较少,与章慧[35]的研究结果一致。软体动物群落的季节差异主要与其生活史有关[3],大多数软体动物的繁殖期在春季,且在发育完成时,由于软体动物活动能力弱,活动范围有限,只能在固定的场所栖息[8, 36]。本次调查在冬季时,由于遇上寒潮,人为捕捞活动减少,因此冬季软体动物密度和多样性高。夏季软体动物生物量高于其他三季,一方面是因为在湾中夏季采集到的优势种红树蚬个体较大;另一方面可能是因为软体动物在春季繁殖,随着幼体的生长,生物量在夏季达到最高。
3.2 水环境压力驱动红树林软体动物群落空间分布格局研究结果发现东寨港软体动物物种数、密度、多样性指数均为湾口>湾中>湾顶,表明东寨港红树林底栖软体动物群落具有明显的空间梯度特征。而盐度和总溶解固体与群落结构特征的显著正相关关系表明东寨港的水环境变化显著影响红树林底栖软体动物群落。水体中总溶解固体一般包括有机物、无机物、溶解性盐和重金属。有机物和无机物为大多底栖动物的主要食物来源[37, 38]。湾口处有养殖塘且靠近居住区,养殖废水和生活污水的排放使总溶解固体含量增加,进而丰富软体动物的食物来源,使软体动物丰度增加。有研究表明,重金属浓度与软体动物丰度呈现负相关关系[39, 40]。总溶解固体与群落组成的强正相关性关系的初步分析显示,东寨港排放的废水中重金属含量并没有对红树林底栖软体动物群落组成产生显著的负效应。这表明东寨港红树林软体动物群落受水体重金属胁迫的可能性较小。水体重金属的来源主要是工业废水,而初步分析发现东寨港的污水源主要是养殖废水和生活污水[26]。无机物和溶解性盐的排放会影响水体的化学特征,比如氧化还原电位、电导率和水体盐度。本研究结果显示水体盐度显著影响底栖软体动物群落。盐度的降低和波动通常伴随着物种数的减少[41]。马维等[36]对海南岛西海岸软体动物研究发现,马袅湾和花场湾因淡水流入而盐度较低,导致软体动物物种数和多样性也随之降低。湾口处于入海口,平均海水盐度最高,为25.6,湾中平均海水盐度次之,为22.6,而湾顶因处于咸淡水交汇处,平均海水盐度最低,为19.0,因此湾顶软体动物物种数、多样性低于湾口和湾中。而水体盐度的变化通常会伴随电导率的变化[42],因此,电导率预计会影响底栖软体动物群落结构[24]。本研究初步分析认为,东寨港总溶解固体的主要成分可能是有机物、无机物和溶解性盐,进而影响红树林底栖动物的群落结构。
另外,环境胁迫会改变群落的空间格局[43, 44]。有研究表明低盐度胁迫会降低群落多样性[45],进而导致群落发生同质化。盐度分析结果显示,湾口的水体盐度较高,而湾中和湾顶水体盐度较低。另外,聚类分析结果表明,湾中和湾顶的软体动物群落同质化程度较高,因为这两个区域的群落相似性较高,一阶贡献种均为珠带拟蟹守螺。而湾口与湾中、湾顶的底栖软体动物群落则出现较高的异质性,因为湾口与其他两个区域群落相似性较低,其一阶贡献种为斯氏印澳蛤。这些结果表明,水体环境胁迫会显著影响底栖软体动物的群落组成和空间周转[24]。因此,水体环境变化会引发一系列综合效应而影响红树林底栖软体动物的群落结构。
4 结论对海湾尺度下软体动物群落结构时空分布特征进行研究,结果表明,海湾内软体动物物种丰富,共采集895个个体,隶属于18科31种,优势种为珠带拟蟹守螺、小翼拟蟹守螺、绯拟沼螺、短拟沼螺、印澳蛤、斯氏印澳蛤等;海湾内软体动物存在明显的时空分布格局:空间上呈现湾口到湾顶递减趋势;从季节上来看,软体动物物种数、密度及多样性表现为春季、冬季高于夏季和秋季,盐度和总溶解固体是其时空分布特征差异的主要水环境因子。因此,要加强东寨港红树林湿地水环境管理,对养殖污水、生活污水等进行控制,注重生态环境保护,为软体动物等海洋生物提供适宜的栖息场所。
| [1] |
王文卿, 王瑁. 中国红树林[M]. 北京: 科学出版社, 2007.
|
| [2] |
NAGELKERKEN I, BLABER S J M, BOUILLON S, et al. The habitat function of mangroves for terrestrial and marine fauna: A review[J]. Aquatic Botany, 2008, 89(2): 155-185. DOI:10.1016/j.aquabot.2007.12.007 |
| [3] |
陈光程, 余丹, 叶勇, 等. 红树林植被对大型底栖动物群落的影响[J]. 生态学报, 2013, 33(2): 327-336. |
| [4] |
KATHIRESAN K, BINGHAM B L. Biology of mangroves and mangrove ecosystems[J]. Advances in Marine Biology, 2001, 40: 81-251. |
| [5] |
MACINTOSH D J, ASHTON E C, HAVANON S. Mangrove rehabilitation and intertidal biodiversity: A study in the Ranong mangrove ecosystem, Thailand[J]. Estuarine, Coastal and Shelf Science, 2002, 55(3): 331-345. DOI:10.1006/ecss.2001.0896 |
| [6] |
ASHTON E C, MACINTOSH D J, HOGARTH P J. A baseline study of the diversity and community ecology of crab and molluscan macrofauna in the Sematan mangrove forest, Sarawak, Malaysia[J]. Journal of Tropical Ecology, 2003, 19(2): 127-142. DOI:10.1017/S0266467403003158 |
| [7] |
CANNICCI S, BURROWS D, FRATINI S, et al. Faunal impact on vegetation structure and ecosystem function in mangrove forests: A review[J]. Aquatic Botany, 2008, 89(2): 186-200. DOI:10.1016/j.aquabot.2008.01.009 |
| [8] |
CANNICCI S, LEE S Y, BRAVO H, et al. A functional analysis reveals extremely low redundancy in global mangrove invertebrate fauna[J]. Proceedings of the National Academy of Sciences, 2021, 118(32): e2016913118. DOI:10.1073/pnas.2016913118 |
| [9] |
ZOU F S, ZHANG H H, DAHMER T, et al. The effects of benthos and wetland area on shorebird abundance and species richness in coastal mangrove wetlands of Leizhou Peninsula, China[J]. Forest Ecology and Management, 2008, 255(11): 3813-3818. DOI:10.1016/j.foreco.2008.03.020 |
| [10] |
管强, 刘吉平, 武海涛, 等. 中国自然湿地螺类生态学研究进展[J]. 生态学报, 2016, 36(9): 2471-2481. |
| [11] |
王瑁, 刘毅, 丁弈朋, 等. 海南东寨港红树林软体动物[M]. 厦门: 厦门大学出版社, 2013.
|
| [12] |
Al-KHAYAT J A, VETHAMONY P, NANAJKAR M. Molluscan diversity influenced by mangrove habitat in the Khors of Qatar[J]. Wetlands, 2021, 41(4): 45. DOI:10.1007/S13157-021-01441-6 |
| [13] |
LIU Y, WANG M, WANG W Q, et al. Chilling damage to mangrove mollusk species by the 2008 cold event in Southern China[J]. Ecosphere, 2016, 7(6): e01312. DOI:10.1002/ecs2.1312 |
| [14] |
CHEN G G, WANG W Q, ZHANG Y M, et al. Abundant and rare species may invoke different assembly processes in response to climate extremes: Implications for biodiversity conservation[J]. Ecological Indicators, 2020, 117: 106716. DOI:10.1016/j.ecolind.2020.106716 |
| [15] |
傅伯杰. 景观生态学原理及应用[M]. 北京: 科学出版社, 2001.
|
| [16] |
WILLIS K J, WHITTAKER R J. Species diversity-scale matters[J]. Science, 2002, 295(5558): 1245-1248. DOI:10.1126/science.1067335 |
| [17] |
舒凤月, 王海军, 崔永德, 等. 长江流域淡水软体动物物种多样性及其分布格局[J]. 水生生物学报, 2014, 38(1): 19-26. |
| [18] |
郑梓琼, 唐以杰, 戚诗婷, 等. 深圳福田红树林大型底栖动物多样性研究[J]. 湿地科学与管理, 2020, 16(3): 69-73. DOI:10.3969/j.issn.1673-3290.2020.03.16 |
| [19] |
KON K, KUROKURA H, TONGNUNUI P. Influence of a microhabitat on the structuring of the benthic macrofaunal community in a mangrove forest[J]. Hydrobiologia, 2011, 671(1): 205. DOI:10.1007/s10750-011-0718-0 |
| [20] |
卓异, 蔡立哲, 郭涛, 等. 泉州湾蟳埔潮间带大型底栖动物群落的时空分布[J]. 生态学报, 2014, 34(5): 1244-1252. |
| [21] |
黄雅琴, 李荣冠, 江锦祥. 泉州湾洛阳江红树林自然保护区潮间带软体动物多样性及分布[J]. 海洋科学, 2011, 35(10): 110-116. |
| [22] |
WANG W Q, FU H F, LEE S Y, et al. Can strict protection stop the decline of mangrove ecosystems in China? From rapid destruction to rampant degradation[J]. Forests, 2020, 11(1): 55. DOI:10.3390/f11010055 |
| [23] |
DUKE N C, MEYNECKE J O, DITTMANN S, et al. A world without mangroves?[J]. Science, 2007, 317(5834): 41-42. |
| [24] |
陈国贵, 王文卿, 谷宣, 等. 漳江口红树植物群落周转对大型底栖动物群落结构的影响[J]. 生态学报, 2021, 41(11): 4310-4317. |
| [25] |
吴瑞. 红树林区大型底栖动物研究进展[J]. 热带农业科学, 2016, 36(10): 109-113. |
| [26] |
李仕平, 李仙, 张光磊, 等. 东寨港海水增养殖区水质状况及变化趋势研究[J]. 海南师范大学学报: 自然科学版, 2017, 30(4): 430-435. |
| [27] |
徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15, 19. |
| [28] |
GLEASON H A. On the relation between species and area[J]. Ecology, 1922, 3(2): 158-162. DOI:10.2307/1929150 |
| [29] |
马克平, 刘玉明. 生物群落多样性的测度方法Ⅰ α多样性的测度方法(下)[J]. 生物多样性, 1994, 2(4): 231-239. DOI:10.3321/j.issn:1005-0094.1994.04.009 |
| [30] |
PIELOU E C. The measurement of diversity in different types of biological collections[J]. Journal of Theoretical Biology, 1966, 13: 131-144. DOI:10.1016/0022-5193(66)90013-0 |
| [31] |
周红, 张志南. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用[J]. 青岛海洋大学学报, 2003, 33(1): 58-64. DOI:10.3969/j.issn.1672-5174.2003.01.023 |
| [32] |
蔡立哲, 黄玉山, 谭凤仪. 香港红树林区软体动物生态研究[J]. 海洋科学集刊, 1997(2): 103-114. |
| [33] |
李亚芳. 珠江口淇澳岛3类湿地软体动物群落生态学及分类学研究[D]. 广州: 中山大学, 2013.
|
| [34] |
高世和, 李复雪. 九龙江口红树区底相大型底栖动物的群落生态[J]. 台湾海峡, 1985, 4(2): 179-191. |
| [35] |
章慧. 海南东寨港红树林生境异质性对软体动物多样性的影响[D]. 厦门: 厦门大学, 2016.
|
| [36] |
马维, 王瑁, 王文卿, 等. 海南岛西海岸红树林软体动物多样性[J]. 生物多样性, 2018, 26(7): 707-716. |
| [37] |
PEETERS E T H M, GYLSTRA R, VOS J H. Benthic macroinvertebrate community structure in relation to food and environmental variables[J]. Hydrobiologia, 2004, 519(1): 103-115. |
| [38] |
何斌源, 赖廷和, 王欣, 等. 廉州湾滨海湿地潮间带大型底栖动物群落次级生产力[J]. 生态学杂志, 2013, 32(8): 2104-2112. |
| [39] |
张琦, 王方鸣, 罗岳平, 等. 湘江流域大型底栖动物群落结构及其与环境因子的关系[J]. 水生态学杂志, 2018, 39(2): 48-57. |
| [40] |
迟国梁, 赵颖, 官昭瑛, 等. 广东横石水河大型底栖动物群落与环境因子的关系[J]. 生态学报, 2010, 30(11): 2836-2845. |
| [41] |
刘劲科, 韩维栋, 何秀玲, 等. 雷州半岛红树林海区底栖动物多样性的研究[J]. 海洋科学, 2006, 30(10): 65-69, 74. DOI:10.3969/j.issn.1000-3096.2006.10.014 |
| [42] |
吴葆仁, 陈国华. 海水的电导及其与盐度、温度和压力的关系[J]. 海洋科学, 1979(3): 25-29. |
| [43] |
APE F, SARA G, AIROLDI L, et al. Influence of environmental factors and biogenic habitats on intertidal meiofauna[J]. Hydrobiologia, 2018, 807(1): 349-366. DOI:10.1007/s10750-017-3410-1 |
| [44] |
YASUHARA M, HUNT G, DIJKEN G V, et al. Patterns and controlling factors of species diversity in the Arctic Ocean[J]. Journal of Biogeography, 2012, 39(11): 2081-2088. DOI:10.1111/j.1365-2699.2012.02758.x |
| [45] |
GIBERTO D A, BREMEC C S, ACHA E M, et al. Large-scale spatial patterns of benthic assemblages in the SW Atlantic: The Rio de la Plata estuary and adjacent shelf waters[J]. Estuarine, Coastal and Shelf Science, 2004, 61(1): 1-13. DOI:10.1016/j.ecss.2004.03.015 |



