2. 广西科学院广西红树林研究中心, 广西红树林保护与利用重点实验室, 广西北海 536000;
3. 复旦大学生物多样性科学研究所, 生物多样性和生态工程教育部重点实验室, 上海 200438
2. Guangxi Key Lab of Mangrove Conservation and Utilization, Guangxi Mangrove Research Center, Guangxi Academy of Sciences, Beihai, Guangxi, 536000, China;
3. Ministry of Education Key Laboratory for Biodiversity Science and Ecological Engineering, Institute of Biodiversity Science, Fudan University, Shanghai, 200438, China
2020年9月以来,习近平总书记在多次重要讲话中提出:中国力争在2060年前实现碳中和。2018年,《IPCC全球升温1.5℃特别报告》提出碳中和(Carbon Neutrality),即在规定时期内人为二氧化碳(CO2)移除在全球范围抵消人为CO2排放时,可实现CO2净零排放,等同于“CO2净零排放”(Net zero CO2 emissions)[1]。碳中和战略不仅是全球气候治理和构建人类命运共同体的重大需求,也是生态文明建设的内在需求。增汇,即增加自然生态系统的碳汇功能,是实现碳中和的两条根本路径之一。工业革命的两百多年来,由于化石燃料的燃烧,温室气体大量排放,使大气CO2浓度由工业革命前的280 μmol·mol-1(百万分之一)上升到目前的将近420 μmol·mol-1[2],并引起全球气候变暖。滨海湿地(Coastal Wetlands)是地球上高效的碳汇,可以吸收和捕获大气中的CO2并在沉积物中长时间埋藏,有效缓解全球气候变暖。以往的研究陆续对我国滨海湿地的碳储量进行了估算,其碳汇和空间分布格局的研究也在不断更新。本文将对近年来我国滨海湿地生态系统的碳储量、碳汇能力及其空间格局进行综述,拟揭示滨海蓝碳储量和碳汇能力面临的环境变化,探讨我国滨海蓝碳对减缓气候变暖的贡献。
1 蓝碳定义和应用2009年,联合国环境规划署(UNEP)、联合国粮农组织(FAO)和联合国教科文组织-政府间海洋学委员会(IOC-UNESCO)联合发布《蓝碳:健康海洋的固碳作用——快速反应评估报告》,提出“蓝碳”(Blue Carbon)的定义,即由海洋生物捕获的碳[3],其特指那些由海洋和滨海生态系统从大气中捕获并永久埋藏在海洋沉积物中的碳。在狭义上,蓝碳指储存在红树林、潮间带盐沼和海草床的土壤、地上活生物质(叶、枝、干)、地下活生物质(根)和非活体生物质(如凋落物和枯死木)中的碳[3, 4],这部分碳也被称为滨海蓝碳(Coastal Blue Carbon)。
在全球领域,一般将陆地森林固定的碳称为“绿碳”,用于评估陆地森林的固碳能力。与陆地生态系统中“绿碳”一样,滨海蓝碳是在几年到几十年的时间内被植物活体固定下来的碳。不同于陆地生态系统,滨海湿地沉积物中的碳可长时间封存(几十年到千年尺度),是巨大的碳库[5]。由于潮汐淹水使滨海湿地的沉积物长期处于厌氧(甚至无氧)状态,沉积物中好氧性微生物的分解速率远低于陆地生态系统,因此,死亡的地下根系在厌氧环境中缓慢分解,成为储存在沉积物中的有机质。这部分碳被称为内源性碳。其次,海陆交错带的潮汐和地表径流从临近生态系统带来的沉积物和有机碎屑,被滨海湿地植被的根系或冠层捕获并固定下来,成为外源性的碳输入,从而增加了滨海湿地的有机质埋藏。这两个过程使滨海湿地比陆地生态系统具有更高的碳储量和固碳效率[6]。因此,滨海湿地成为地球上的高密度碳汇之一,其在固定CO2和减缓大气温室气体排放方面的功能已得到广泛认识。虽然滨海湿地仅占地球表面积的0.1%,但是其单位面积固碳能力是陆地生态系统的6-10倍,其沉积物中埋藏的碳可能占海洋沉积物碳储量的50%[7],贡献了全球1%-10%的海洋初级生产力[4]。若滨海湿地遭受破坏,其沉积物将释放大量CO2到大气中。
蓝碳概念提出的十几年来,滨海湿地的固碳功能已经得到广泛认识,并从科学认识、政策制定到管理实践,极大推动了国际和国家层面的蓝碳行动计划。目前,红树林、潮间带盐沼和海草床已纳入《2006年IPCC国家温室气体清单指南的2013年补充版:湿地》[8],并被美国和澳大利亚等国家采用。红树林也成为联合国气候变化框架公约(UNFCCC) 认可的、参与清洁发展机制(CDM) 碳证贸易的碳汇林[9]。2011年《海洋和海岸带可持续发展蓝图报告》[10]提出了保护海洋生态系统、建立全球性蓝碳市场的目标;通过保护和恢复滨海湿地来增加碳汇,并用于交易。未来,可通过发展蓝碳基金、探索蓝碳信用认证和鼓励自愿碳市场等措施,使蓝碳成为经济杠杆,有效整合生态系统功能和减缓气候变化的目标和需求,服务于我国2060年的碳中和战略。
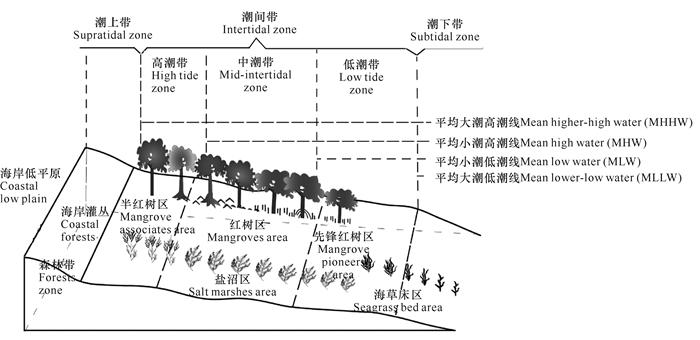
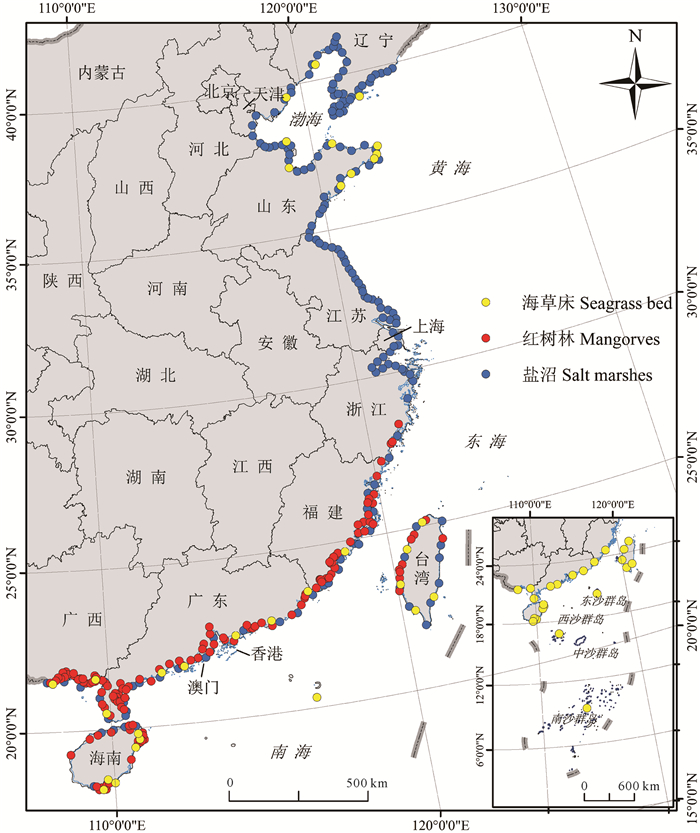
2 我国滨海湿地的分布现状我国大陆海岸线曲折漫长,北起鸭绿江口,南至北仑河口,长约1.8×104 km,经辽宁、河北、天津、山东、江苏、上海、浙江、福建、广东、广西、海南等11个省(自治区、直辖市)。滨海湿地的总面积约为5.796×106 hm2,包括浅海水域、淤泥质海滩、潮间带盐沼、红树林、潮下水生层、珊瑚礁等湿地类型,占全国湿地总面积的10.9%[11]。在狭义的蓝碳定义中,蓝碳生态系统包含红树林、滨海盐沼和海草床等3种滨海湿地生态系统。我国同时拥有这3种滨海湿地生态系统,其中红树林主要分布在南方的亚热带和热带沿海;滨海盐沼分布在温带到亚热带海域;海草床分布在温带到热带海域。3种滨海湿地类型在潮间带的分布区和潮汐特征如图 1所示:红树林生长于平均海平面以上的潮间带上[12];海草床主要分布在低潮带和潮下带区域,分布的潮位相对红树林和盐沼更低。在我国,3种滨海湿地在纬度上的分布格局如图 2所示[13-18]。
2.1 红树林
中国的红树林主要分布在南方沿海各省、自治区(海南、广东、广西、福建和浙江)及港澳台地区,南起海南三亚的榆林港(18°19′N),北至福建福鼎的沙埕港(27°20′N);1957年秋茄被成功引种到浙江乐清(28°25′N)。福建福鼎是我国红树林天然分布的北界,浙江乐清是人工引种的北界。群落类型包括秋茄(Kandelia obovata)群落、白骨壤(Avicennia marina)群落、秋茄-白骨壤混生群落、木榄(Bruguiera gymnoihiza)群落、海莲(Bruguiera sexangula)群落、红海榄(Rhizophora stylosa)群落、海桑(Sonneratia caseolares)群落、正红树(Rhizophora apiculata)群落等[13]。
根据国家林业和草原局的最新数据,我国红树林在过去10多年得到快速恢复。赵传朋和秦承志[15]基于谷歌地球提供的优于1 m分辨率的图像,估算认为2019年我国红树林的总面积为21 148-24 801 hm2。
2.2 滨海盐沼中国的滨海盐沼主要分布在沿海的辽宁到广西各省区[17, 18],总面积为10.2-3 434.0 km2[11]。我国的滨海盐沼类型最多、面积最大、分布最广,包括灌丛和草丛盐沼[如柽柳(Tamarix chinensis)群系,碱蓬(Suaeda spp.)群系]、草丛沼泽[如藨草(Scirpus spp.)群系]、禾草沼泽[如芦苇(Phragmites australis)群系、外来入侵植物互花米草(Spartina alterniflora)群系],以及灯芯草(Juncus effusus)群系、香蒲(Typha orientalis)群系等[18]。其中,芦苇沼泽的分布最广,仅辽河三角洲的芦苇沼泽就达6.06×104 hm2,且最南可以分布到香港米铺湿地。碱蓬沼泽是我国北方典型的滨海湿地类型,在辽河三角洲面积达2 000 hm2,被誉为“红地毯”。海三棱藨草沼泽广泛分布于江苏、浙江等地。外来植物互花米草已全面入侵我国的红树林和滨海盐沼,形成单一优势群落,其植被面积已扩展到5.52×104 hm2[19]。
2.3 海草床海草是生长在海洋中的显花植物。大面积的连片海草被称为海草床。我国主要有6个海草群系:鳗草(Zostera marina)群系、海菖蒲(Enhalus acodoides)群系、泰来草(Thalassia hemprichii)群系、卵叶喜盐草(Halophila ovalis)群系、日本鳗草(Zostera japonica)群系、贝克喜盐草(Halophila beccarii)群系。我国海草面积约1.68×104 hm2[16, 20-28],其中南海和黄渤海是我国海草的主要分布区[16]。在温带海域,例如河北曹妃甸、山东黄河口、天鹅湖等地,主要的海草群系为鳗草群系和日本鳗草群系[18]。在热带海域,例如海南沿岸及附属岛屿,常见的海草群系为海菖蒲群系、泰来草群系和卵叶喜盐草群系[16]。在亚热带海域,例如广西、广东和福建沿岸的潮间带,常见的海草群系为卵叶喜盐草群系、贝克喜盐草群系和日本鳗草群系[16]。由于海草在潮间带的分布潮位较低、淹水时间长,现代遥感技术对其空间分布的遥感数据判读还不清晰,对其分布区域估算还存在差异。
3 滨海湿地的储碳和固碳特征蓝碳生态系统是高效的碳汇。地球上每年捕获的碳有55%是由海洋生物捕获的,而滨海湿地植被的作用显著[3]。受限于研究手段,以及缺乏地面长期监测、实测站点稀疏等原因,现有滨海湿地储碳和固碳能力评估的误差很大。近十年来,我国学者整合历史数据和部分实测数据(1-50年不等),初步估算了我国滨海湿地蓝碳的碳储量和碳汇能力[29-33],为蓝碳储量和碳汇估算提供了基础。
3.1 红树林碳储量和固碳能力红树林是热带、亚热带海岸带一种高生产力的生态系统,也是热带地区碳储量最丰富的森林[34]。林鹏教授[13]在《中国红树林生态系》一书中指出了我国红树林的“三高”特性,说明红树林储碳和固碳的高效性。
从碳储量来看,全球尺度红树林地上生物量碳密度达6.6-250.8 Mg·C·hm-2(生物量为16.6-627.0 Mg·hm-2,1 Mg=106 g),沉积物碳密度达283 Mg·C·hm-2 [35, 36]。其生物量固碳具有明显的纬向特征:东南亚等热带区域生物量高,而亚热带区域生物量相对较低[37];在我国大陆地区和台湾地区都表现出类似的特征[38, 39]。红树林沉积物有别于热带和亚热带陆地森林,潮间带的低氧生境减缓了有机质的分解速率,使大量细根或枯枝落叶还未分解就形成泥炭被埋藏下来。因此,红树林沉积物是富碳的有机土,其有机质含量可超过20%,有机质的保存率高,矿化速率低[38, 40-42]。在一些人为扰动小的地区,沉积物甚至可达3 m深,有机碳储量远高于陆地森林(陆地森林土壤碳累积通常不超过30 cm)。红树林总碳的50%-90%存储于地下的沉积物中[34, 43]。据粗略估算,我国大陆地区红树林总碳储量约为5.5 Tg·C (1 Tg=1012 g),其中,仅27%的碳源自植物生物量,而73%的碳存在于表层1 m土壤中[44]。土壤对红树林碳储量的贡献巨大。
从固碳能力看,红树林面积仅占全球陆地面积的0.1%,但其固碳量占全球总固碳量的5%[45]。红树林的植被和沉积物的固碳量大约是热带雨林的3-4倍[3]。在1997年出版的《中国红树林生态系》[13]一书中,基于海南东寨港、广西英罗湾山口和福建九龙江口等为期6,5和11年的观测,林鹏教授计算海莲林、红海榄林和秋茄林的初级生产力分别为29.5,15.4,23.5 Mg·hm-2·a-1,凋落物量分别为12.6,6.3,9.2 Mg·hm-2·a-1。综合现有面积数据,我国红树林固碳速率约为0.22 Tg·C·a-1,生态系统碳埋藏速率为0.28 Tg·C·a-1[44]。
3.2 滨海盐沼碳储量和固碳能力滨海盐沼在我国的分布最广,其储碳和固碳能力在3类滨海湿地植被类型中也最强[32]。在低潮带和中潮带盐沼中,地下储碳是碳储量的主要部分,地下储碳通常占整个滨海盐沼生态系统碳库的65%-95%[46]。在高潮带盐沼中,地上生物量占总碳库的比重更大。
Hu等[47]基于哨兵一号的时间序列数据和知识的自动决策树分类器,绘制了10 m精度的2019年全国滨海盐沼分布图,面积为127 477.27 hm2。根据联合国环境规划署认可的全球盐沼湿地遥感数据,我国盐沼湿地的面积为544 800 hm2[48]。全球盐沼湿地沉积物的碳埋藏速率平均约为168 g·C·m-2·a-1[31]。初步估算,我国滨海盐沼的碳汇量为0.21-0.91 Tg·C·a-1。
3.3 海草床碳储量和固碳能力海草床分布于除了南极洲以外的各大洲[49],具有很高的初级生产力,在碳循环中具有重要的作用[5, 50, 51]。海草床能减少沉积物的再悬浮,不仅能够储存植物体固定的有机碳,还能捕获和埋藏外源碳[52]。一般而言,海草床沉积物中的碳有50%是外源碳[53]。Fourqurean等[51]通过数据整合计算出全球海草生物量碳密度为0.61-7.29 Mg·C·hm-2,沉积物碳密度为23.6-372.4 Mg·C·hm-2(均值为194.2 Mg·C·hm-2,中值为139.7 Mg·C·hm-2)。在我国,海草床的碳密度要小得多,沉积物碳密度为(91.0 ± 28.9) Mg·C·hm-2(均值±95%置信区间,中值为43.6 Mg·C·hm-2)[32]。目前,对海草床碳埋藏速率的研究很有限(表 1),在全国尺度开展监测十分有必要。
| 生态系统 Ecosystems |
面积 Aera (×104 hm2) |
固碳速率 Carbon sequestration (Tg·C·a-1) |
| 红树林 Mangorves |
2.56 | 0.22 |
| 盐沼 Salt marshes |
12.75-54.48 | 0.21-0.91 |
| 海草床 Seagrass bed |
1.68 | 缺数据 No data |
然而,现有研究对我国滨海湿地的植被和沉积物碳储量和碳汇能力缺乏系统观测,区域的数据间缺乏一致性。未来的研究还需通过建立统一的监测体系,获得准确的全域尺度的碳储量和固碳能力评估。
4 人类活动对滨海湿地固碳能力的影响由于工业的发展和人口的增长,频繁的人类活动使得世界上很多国家沿海地区的植被遭到严重破坏[54, 55]。自1980年至2011年,全球已丧失约35%的红树林、29%的海草床和50%的滨海盐沼[56]。近年来,全球许多地区的滨海湿地仍在持续性减少[57]。在我国,自20世纪50年代以来的围海造田、围塘养殖、毁林修建海岸工程和城市化的过程,造成盐沼和红树林面积锐减;沿海地区历次围填海工程已严重挤压滨海湿地的分布区[18]。海岸挤迫使现存红树林成为狭窄而破碎化的堤前红树林[58]。虽然2000年以来大规模的红树林恢复行动补偿了丧失的红树林面积,然而,生物入侵、养殖污染等人为干扰依然导致红树林的严重退化[58]。
4.1 城市化和富营养化随着经济发展和人口向沿海迁移,海滨城市成为全球经济发展最迅速的区域。城市的发展促使一些区域的红树林成为“城市森林”或者“郊野公园”,例如深圳福田红树林和香港米铺湿地,均可发挥生态系统服务功能。然而,城市化进程引起的富营养化、噪音污染、病虫害等问题使红树林面临退化。富营养化的水体一方面加速植物的生长固碳,另一方面又增加了土壤温室气体排放,对滨海湿地的碳汇功能的总体效应极为复杂[38]。富营养化还严重影响海草的生存现状,造成海南文昌大片海草床退化[59]。养殖塘含氮磷有机物的排入,将改变沉积物的碳氮循环特征,增加甲烷(CH4)和氧化亚氮(N2O)等温室气体的排放[60]。因此,城市化进程和富营养化对滨海湿地带来的影响极为显著,两者主要是通过改变生态系统的结构和功能,进而影响碳氮循环,改变滨海湿地的碳汇功能。
4.2 海堤和养殖塘的物理屏障20世纪80年代开始的围塘养殖大大侵占了最适宜红树林生长的中、高潮位区域,导致现有红树林成为林带窄小、背靠海堤和养殖塘的堤前红树林。海堤限制了红树林的陆向演替,成为碳汇林恢复造林和退塘还林的物理屏障;并使得红树林生境片段化和退化。从20世纪80年代到2010年,我国盐沼范围总体损失59%,填海造陆(填海)是盐沼损失最主要的驱动因素[61]。海平面上升使得滨海湿地受到海岸挤迫的强度不断增加。在福建和广东一带,水产养殖业占当地经济收入的比重很大,养殖塘成为滨海湿地修复的屏障。海堤和养殖塘等物理屏障通过影响和挤迫滨海湿地生态系统,改变其健康的生态系统物质循环和能量流动,进而改变其储碳和固碳特征。
4.3 生物入侵原产于大西洋沿岸的互花米草自1979年引进我国以来,严重威胁从辽宁到广东徐闻的广大区域,占据了大量可供红树林后代繁育和利用的光滩,甚至产生剧烈种间竞争,改变乡土盐沼和红树林的演替格局[17, 62]。互花米草的入侵对于光滩土壤碳库累积有积极的促进作用,但其土壤固碳量低于红树林[63]。互花米草入侵海草床还显著改变了大型底栖动物的群落结构[64]。被认为是“生态系统工程师”的互花米草还具有生物地貌作用,将改变潮滩的地表高程、潮沟形态等地貌特征[65]。GIS和数学模拟证据表明:米草属植物的入侵,可加速斑块内部沉积和斑块外部土壤侵蚀,改变区域地貌特征[66]。在福建漳江口,互花米草的入侵迅速提升红树林区的高程,并可能加速光滩的陆地化[67]。因此,入侵物种对地貌的影响也将导致生态系统碳库的时空变化,改变原生滨海湿地生态系统的碳源-汇关系。虽然互花米草是我国盐沼的主要类型,其扩张会增加蓝碳生态系统的面积,然而互花米草排放的非CO2温室气体,如甲烷或N2O的排放速率均高于被入侵的红树林区[68],其缓解气候变暖的功能还有待斟酌。
5 展望综上,我国滨海湿地蓝碳的自然增汇潜力很大。虽然滨海湿地蓝碳的潜力受限于生态修复的宜林地面积,但是滨海湿地蓝碳的优势表现在单位面积的固碳效率上。而且,滨海湿地沉积物储碳巨大,一旦受到破坏,储存的碳将被释放到大气中。然而,我国滨海湿地的碳汇潜力缺乏系统观测,观测手段不足,观测站位的较少,观测的系统性不足,更缺乏统一的标准,这些问题都导致现有数据库不全面。我国沿海地区是快速城市化的区域,这决定了该区域滨海湿地面临更多元而复杂的人为干扰,例如来自城市化、富营养化、海岸挤迫和生物入侵的共同影响。以往研究虽提供了滨海湿地萎缩、功能退化、病害甚至死亡的证据;但生态系统固碳功能及其机制的还需进一步研究。特别是将人为干扰作为全球变化的主导因素,对滨海湿地生态系统碳汇功能的演变开展系统性研究,将有助于预估未来蓝碳生态系统效率。近年来,随着蓝碳不断参与到碳交易、碳金融等领域,通过经济杠杆带动蓝碳生态系统的保护和发展,蓝碳碳汇的议题也从科学研究扩展到全球经济领域。因此,从我国滨海湿地保护和修复的国家需求,以及碳中和的战略出发,厘清我国滨海湿地储碳和碳汇能力,了解其时空演变的规律,深入探讨全球变化对滨海湿地碳汇能力的影响极为重要。
| [1] |
IPCC, MATTHEWS J B R, BABIKER M, et al. 2018: Annex I: Glossary[R]//MASSON-DELMOTTE V, ZHAI P, PÖRTNER H-O, et al (eds. ). Global Warming of 1.5℃. An IPCC Special Report: [s. n. ], 2018.
|
| [2] |
DLUGOKENCKY E J, LANG P M, MASARIE K A, et al. Atmospheric carbon dioxide dry air mole fractions from the NOAA GML Carbon cycle cooperative global air sampling network, 1968-2013, Version: 2014-06-27[Z]. 2014.
|
| [3] |
NELLEMANN C, CORCORAN E, DUARTE C, et al. Blue carbon: The role of healthy oceans in binding carbon[M]. GRID-Arendal: United Nations Environment Programme, 2009.
|
| [4] |
MCLEOD E, CHMURA G L, BOUILLON S, et al. A blueprint for blue carbon: Toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Frontiers in Ecology and the Environment, 2011, 9(10): 552-560. DOI:10.1890/110004 |
| [5] |
DUARTE C M, MIDDELBURG J J, CARACO N. Major role of marine vegetation on the oceanic carbon cycle[J]. Biogeosciences, 2005, 2(1): 1-8. DOI:10.5194/bg-2-1-2005 |
| [6] |
HOWARD J, HOYT S, ISENSEE K, et al. Coastal blue carbon: Methods for assessing carbon stocks and emissions factors in mangroves, tidal salt marshes, and seagrasses[M]. Arlington: International Union for Conservation of Nature, 2014.
|
| [7] |
DUARTE C M, LOSADA I J, HENDRIKS I E, et al. The role of coastal plant communities for climate change mitigation and adaptation[J]. Nature Climate Change, 2013, 3(11): 961-968. DOI:10.1038/nclimate1970 |
| [8] |
BLAIN D, BOER R, EGGLESTON S, et al. 2013 Supplement to the 2006 IPCC guidelines for national greenhouse gas inventories: Wetlands[J]. Wetlands Supplement, 2013. |
| [9] |
YEE S M. REDD and blue carbon: Carbon payments for mangrove conservation[M]. Athens: University of Georgia, 2010.
|
| [10] |
IOC/UNESCO, I MO, F AO, et al. A blueprint for ocean and coastal sustainability[M]. Paris: IOC/UNESCO, 2011.
|
| [11] |
国家林业局. 中国湿地资源·总卷[M]. 北京: 中国林业出版, 2015.
|
| [12] |
张乔民, 于红兵, 陈欣树, 等. 红树林生长带与潮汐水位关系的研究[J]. 生态学报, 1997, 17(3): 258-265. DOI:10.3321/j.issn:1000-0933.1997.03.006 |
| [13] |
林鹏. 中国红树林生态系[M]. 北京: 科学出版社, 1997.
|
| [14] |
周晨昊, 毛覃愉, 徐晓, 等. 中国海岸带蓝碳生态系统碳汇潜力的初步分析[J]. 中国科学: 生命科学, 2016, 46(4): 475-486. |
| [15] |
ZHAO C, QIN C Z. 10-m-resolution mangrove maps of China derived from multi-source and multi-temporal satellite observations[J]. Isprs Journal of Photogrammetry and Remote Sensing, 2020, 169: 389-405. DOI:10.1016/j.isprsjprs.2020.10.001 |
| [16] |
郑凤英, 邱广龙, 范航清, 等. 中国海草的多样性、分布及保护[J]. 生物多样性, 2013, 21(5): 517-526. |
| [17] |
关道明. 中国滨海湿地米草盐沼生态系统与管理[M]. 北京: 海洋出版社, 2009.
|
| [18] |
关道明. 中国滨海湿地[M]. 北京: 海洋出版社, 2012.
|
| [19] |
MAO D H, LIU M Y, WANG Z M, et al. Rapid invasion of Spartina alterniflora in the coastal zone of mainland china: Spatiotemporal patterns and human prevention[J]. Sensors, 2019, 19(10): 2308. DOI:10.3390/s19102308 |
| [20] |
邱广龙, 苏治南, 钟才荣, 等. 濒危海草贝克喜盐草在海南东寨港的分布及其群落基本特征[J]. 广西植物, 2016, 36(7): 882-889. |
| [21] |
JIANG Z J, LIU S L, ZHANG J P, et al. Newly discovered seagrass beds and their potential for blue carbon in the coastal seas of Hainan Island, South China Sea[J]. Marine Pollution Bulletin, 2017, 125(1/2): 513-521. |
| [22] |
陈石泉, 林国尧, 蔡泽富, 等. 海南东寨港海草资源分布特征及影响因素[J]. 湿地科学与管理, 2019, 15(4): 53-56. DOI:10.3969/j.issn.1673-3290.2019.04.13 |
| [23] |
李洪辰, 张沛东, 李文涛, 等. 黄海镆铘岛海域海草床数量分布及其生态特征[J]. 海洋科学, 2019, 43(4): 46-51. |
| [24] |
ZHANG X M, LIN H Y, SONG X Y, et al. A unique meadow of the marine angiosperm Zostera japonica, covering a large area in the turbid intertidal Yellow River Delta, China[J]. Science of the Total Environment, 2019, 686: 118-130. DOI:10.1016/j.scitotenv.2019.05.320 |
| [25] |
李政, 李文涛, 杨晓龙, 等. 威海双岛湾海域海草分布及其生态特征[J]. 渔业科学进展, 2021, 42(2): 176-183. |
| [26] |
XU S C, XU S, ZHOU Y, et al. Sonar and in situ surveys of eelgrass distribution, reproductive effort, and sexual recruitment contribution in a eutrophic bay with intensive human activities: Implication for seagrass conservation[J]. Marine Pollution Bulletin, 2020, 161(PartA): 111706. DOI:10.1016/J.MARPOLBUL.2020.111706 |
| [27] |
XU S C, XU S, ZHOU Y, et al. Long-term changes in the unique and largest seagrass meadows in the Bohai Sea (China) using satellite (1974-2019) and sonar data: Implication for conservation and restoration[J]. Remote Sensing, 2021, 13(5): 856. DOI:10.3390/RS13050856 |
| [28] |
XU S C, QIAO Y L, XU S, et al. Diversity, distribution and conservation of seagrass in coastal waters of the Liaodong Peninsula, North Yellow Sea, northern China: Implications for seagrass conservation[J]. Marine Pollution Bulletin, 2021, 167: 112261. DOI:10.1016/J.MARPOLBUL.2021.112261 |
| [29] |
LIU H X, REN H, HUI D F, et al. Carbon stocks and potential carbon storage in the mangrove forests of China[J]. Journal of Environmental Management, 2014, 133: 86-93. |
| [30] |
王法明, 唐剑武, 叶思源, 等. 中国滨海湿地的蓝色碳汇功能及碳中和对策[J]. 中国科学院院刊, 2021, 36(3): 241-250. |
| [31] |
WANG F M, SANDERS C J, SANTOS I R, et al. Global blue carbon accumulation in tidal wetlands increases with climate change[J]. National Science Review, 2021, 8(9): nwaa296. DOI:10.1093/NSR/NWAA296 |
| [32] |
FU C C, LI Y, ZENG L, et al. Stocks and losses of soil organic carbon from Chinese vegetated coastal habitats[J]. Global Change Biology, 2020, 27(1): 202-214. |
| [33] |
焦念志, 梁彦韬, 张永雨, 等. 中国海及邻近区域碳库与通量综合分析[J]. 中国科学: 地球科学, 2018, 48(11): 1393-1421. |
| [34] |
DONATO D C, KAUFFMAN J B, MURDIYARSO D, et al. Mangroves among the most carbon-rich forests in the tropics[J]. Nature Geosci, 2011, 4(5): 293-297. DOI:10.1038/ngeo1123 |
| [35] |
ROVAI A S, TWILLEY R R, CASTAÑEDA-MOYA E, et al. Global controls on carbon storage in mangrove soils[J]. Nature Climate Change, 2018, 8(6): 534-538. DOI:10.1038/s41558-018-0162-5 |
| [36] |
ROVAI A S, RIUL P, TWILLEY R R, et al. Scaling mangrove aboveground biomass from site-level to continental-scale[J]. Global Ecology and Biogeography, 2016, 25(3): 286-298. DOI:10.1111/geb.12409 |
| [37] |
HUTCHISON J, MANICA A, SWETNAM R, et al. Predicting global patterns in mangrove forest biomass[J]. Conservation Letters, 2014, 7(3): 233-240. DOI:10.1111/conl.12060 |
| [38] |
GAO Y, ZHOU J, WANG L M, et al. Distribution patterns and controlling factors for the soil organic carbon in four mangrove forests of China[J]. Global Ecology and Conservation, 2019, 17: e00575. DOI:10.1016/j.gecco.2019.e00575 |
| [39] |
LI S B, CHEN P H, HUANG J S, et al. Factors regulating carbon sinks in mangrove ecosystems[J]. Global Change Biology, 2018, 24(9): 4195-4210. DOI:10.1111/gcb.14322 |
| [40] |
范航清, 林鹏. 秋茄红树植物落叶分解的碎屑能量研究[J]. 植物学报, 1994, 36(4): 305-311. |
| [41] |
毛子龙, 杨小毛, 赵振业, 等. 深圳福田秋茄红树林生态系统碳循环的初步研究[J]. 生态环境学报, 2012, 21(7): 1189-1199. |
| [42] |
LUNSTRUM A, CHEN L Z. Soil carbon stocks and accumulation in young mangrove forests[J]. Soil Biology & Biochemistry, 2014, 75: 223-232. |
| [43] |
KHAN M, SUWA R, HAGIHARA A. Carbon and nitrogen pools in a mangrove stand of Kandelia obovata (S., L.) Yong: Vertical distribution in the soil-vegetation system[J]. Wetlands Ecology and Management, 2007, 15(2): 141-153. DOI:10.1007/s11273-006-9020-8 |
| [44] |
陈鹭真, 杨盛昌, 林光辉. 全球变化下的中国红树林[M]. 厦门: 厦门大学出版社, 2021.
|
| [45] |
BOUILLON S, BORGES A V, CASTANEDA-MOYA E, et al. Mangrove production and carbon sinks: A revision of global budget estimates[J]. Global Biogeochemical Cycles, 2008, 22(2): 3052. DOI:10.1029/2007GB003052 |
| [46] |
ELSEY-QUIRK T, SELISKAR D M, SOMMERFIELD C K, et al. Salt marsh carbon pool distribution in a mid-atlantic lagoon, USA: Sea level rise implications[J]. Wetlands, 2011, 31(1): 87-99. DOI:10.1007/s13157-010-0139-2 |
| [47] |
HU Y K, TIAN B, YUAN L, et al. Mapping coastal salt marshes in China using time series of Sentinel-1 SAR[J]. ISPRS Journal of Photogrammetry Remote Sensing, 2021, 173: 122-134. DOI:10.1016/j.isprsjprs.2021.01.003 |
| [48] |
MCOWEN C, WEATHERDON L, BOCHOVE J W, et al. A global map of saltmarshes[J]. Biodiversity Data Journal, 2017, 5(5): e11764. |
| [49] |
SPALDING M, TAYLOR M, RAVILIOUS C, et al. Global overview: The distribution and status of seagrasses[M]//GREEN E P, FREDERICK T. World atlas of seagrasses. California: Univ of California, 2003.
|
| [50] |
DUARTE C M, MARBÁ N, GACIA E, et al. Seagrass community metabolism: Assessing the carbon sink capacity of seagrass meadows[J]. Global Biogeochemical Cycles, 2010, 24(4). DOI:10.1029/2010GB003793 |
| [51] |
FOURQUREAN J W, DUARTE C M, KENNEDY H, et al. Seagrass ecosystems as a globally significant carbon stock[J]. Nature Geoscience, 2012, 5(7): 505-509. DOI:10.1038/ngeo1477 |
| [52] |
HENDRIKS I E, SINTES T, BOUMA T J, et al. Experimental assessment and modeling evaluation of the effects of the seagrass Posidonia oceanica on flow and particle trapping[J]. Marine Ecology Progress Series, 2008, 356: 163-173. DOI:10.3354/meps07316 |
| [53] |
KENNEDY H, BEGGINS J, DUARTE C M, et al. Seagrass sediments as a global carbon sink: Isotopic constraints[J]. Global Biogeochemical Cycles, 2010, 24(4). DOI:10.1029/2010GB003848 |
| [54] |
DUKE N C, MEYNECKE J O, DITTMANN S, et al. A world without mangroves?[J]. Science, 2007, 317(5834): 41-42. |
| [55] |
WAYCOTT M, DUARTE C M, CARRUTHERS T J, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381. DOI:10.1073/pnas.0905620106 |
| [56] |
BARBIER E B, HACKER S D, KENNEDY C, et al. The value of estuarine and coastal ecosystem services[J]. Ecological Monographs, 2011, 81(2): 169-193. DOI:10.1890/10-1510.1 |
| [57] |
CHOWDHURY R R, UCHIDA E, CHEN L, et al. Anthropogenic drivers of mangrove loss: Geographic patterns and implications for livelihoods[M]//RIVERA-MONROY V H, LEE S Y, KRISTENSEN E, et al, Mangrove ecosystems: A global biogeographic perspective. Springer, 2017: 275-300.
|
| [58] |
范航清, 王文卿. 中国红树林保育的若干重要问题[J]. 厦门大学学报: 自然科学版, 2017, 56(3): 323-330. |
| [59] |
HERBECK L, KRUMME U, NORDHAUS I, et al. Pond aquaculture effluents feed an anthropogenic nitrogen loop in a SE Asian estuary[J]. Science of the Total Enivronmen, 2021, 756: 144083. DOI:10.1016/j.scitotenv.2020.144083 |
| [60] |
CHEN G C, CHEN J H, OU D Y, et al. Increased nitrous oxide emissions from intertidal soil receiving wastewater from dredging shrimp pond sediments[J]. Environmental Research Letters, 2020, 15(9). DOI:10.1088/1748-9326/ab93fb |
| [61] |
GU J L, LUO M, ZHANG X J, et al. Losses of salt marsh in China: Trends, threats and management[J]. Estuarine, Coastal and Shelf Science, 2018, 214: 98-109. DOI:10.1016/j.ecss.2018.09.015 |
| [62] |
ZHANG Y, HUANG G, WANG W, et al. Interactions between mangroves and exotic Spartina in an anthropogenically disturbed estuary in southern China[J]. Ecology, 2012, 93(3): 588-597. DOI:10.1890/11-1302.1 |
| [63] |
CHEN Y, LI Y, THOMPSON C, et al. Differential sediment trapping abilities of mangrove and saltmarsh vegetation in a subtropical estuary[J]. Geomorphology, 2018, 318(10): 270-282. |
| [64] |
SU Z N, QIU G L, FAN H Q, et al. Changes in carbon storage and macrobenthic communities in a mangrove-seagrass ecosystem after the invasion of smooth cordgrass in southern China[J]. Marine Pollution Bulletin, 2020, 152: 1-9. |
| [65] |
邱冬冬, 路峰, 闫家国, 等. 滨海湿地生态系统工程师对潮间带土壤环境的影响机制[J]. 北京师范大学学报: 自然科学版, 2018, 54(1): 9-16. |
| [66] |
SCHWARZ C, YE Q H, WAL D, et al. Impacts of salt marsh plants on tidal channel initiation and inheritance[J]. Journal of Geophysical Research: Earth Surface, 2014, 119(2): 385-400. DOI:10.1002/2013JF002900 |
| [67] |
CHEN L Z, CHEN Y N, ZHANG Y H, et al. Mangrove carbon sequestration and sediment deposition changes under cordgrass invasion[M]//SIDIK F, FRIESS D A. Dynamic sedimentary environments of mangrove coasts. Elsevier, 2021: 473-509.
|
| [68] |
GAO G F, LI P F, SHEN Z J, et al. Exotic Spartina alterniflora invasion increases CH4 while reduces CO2 emissions from mangrove wetland soils in southeastern China[J]. Scientific Reports, 2018, 8: 9243. DOI:10.1038/s41598-018-27625-5 |