2. 桂林理工大学旅游与风景园林学院, 广西桂林 541006;
3. 百色学院农业与食品工程学院, 广西百色 533000
2. College of Tourism and Landscape Architecture, Guilin University of Technology, Guilin, Guangxi, 541006, China;
3. College of Agriculture and Food Engineering, Baise University, Baise, Guangxi, 533000, China
现代社会重金属污染愈发严重,其来源主要有金属冶炼及化工企业生产、污灌、固体废弃物、农药及化学残留等。铜(Cu)是动植物生长的微量必需元素,含量过高时会产生毒害作用,镉(Cd)是比较常见且污染严重的一种重金属,铜和镉是重金属污染中两个主要的环境污染物,其中Cd污染较普遍,其次是Cu、Pb、Zn等。国内许多地方从粮食、蔬菜中已检测出含量超标的重金属有砷、铅、镉、铜等[1-3]。铜和镉等重金属的污染已经成为影响我国农业和生态环境可持续发展的重要因素。
过量的Cd容易被植物吸收并积累,影响农作物产量[4, 5]。Cd不仅影响植物细胞生长,而且会抑制叶绿素的合成,对植物光合作用产生复杂的影响。目前关于Cu对植物毒害的相关研究大都集中在对高等植物细胞结构和光合作用的影响等方面[6, 7]。总的来说铜毒害作用和镉毒害机理相似,两者均对植物细胞生长发育、细胞膜结构、细胞器以及各种酶类产生广泛的毒害作用,影响光合作用并对植物生长起抑制作用[8, 9]。
目前,有关汞胁迫对玉米、小麦、水稻、辣椒等种子萌发和幼苗生长的影响研究较多,但有关于镉、铜及其复合胁迫条件下麻疯树(Jatropha curcas Linn.)幼苗生理生化特性的研究报道较少。麻疯树也被称为小桐子、木花生、老胖果、膏桐、黑皂树等,属大戟科(Euphorbiaceae Juss)麻疯树属(Jatropha),原产于巴西,适合生长在热带和亚热带地区,其中美洲和亚洲的热带地区占绝大多数。麻疯树是全球已发现并受到公认的林业生物柴油物种,是当今最有开发潜力和优势的树种之一,得到国际组织、政府和企业的高度重视。经广西检测中心测定,麻疯树种子含油率为53.6%;当年种植,次年开花结果,5年进入盛产期,正常结果期长达50年;具有较强的抗旱能力,适宜种植在贫瘠干热地区,同时具有绿化作用和经济价值。
本研究以麻疯树种子为材料,研究受镉、铜及其复合胁迫后,麻疯树幼苗叶片叶绿素a、叶绿素b、丙二醛(MDA)、可溶性蛋白质和可溶性糖含量,以及过氧化物酶(POD)活性、根系活力、细胞膜透性、脯氨酸积累等生理生化特性,以揭示铜和镉对麻疯树生理生化特性的影响和作用机制,为铜、镉对麻疯树伤害机理的研究提供科学依据,并为麻疯树及其他受铜、镉等重金属元素危害的植物的保护和利用提供有效的数据支撑。
1 材料与方法 1.1 材料麻疯树种子为云南壮大科技有限公司提供,编号为TB2。
仪器:电子天平、离心机、微量移液器、恒温水浴锅、可见光分光光度计、漩涡仪、DDS-307型数显电导率仪、研钵、烧杯、容量瓶、量筒、移液管等。
试剂:标准脯氨酸溶液、酸性茚三酮、甲苯、脯氨酸、冰醋酸、磺基水杨酸、丙酮、乙酸乙酯、硫代硫酸钠、碳酸钙均为分析纯级;1 mol/L硫酸、66 mmol/L磷酸缓冲液、10%三氯乙酸(TCA)、磷酸缓冲液、pH值为6.0的反应混合液、1%氯化三苯四氮唑(TTC)等。
1.2 方法 1.2.1 种子催芽用清水浸泡种子12 h,随后用高锰酸钾消毒液按照1∶5000的比例消毒10 min,将湿润的棉花和两层滤纸在培养皿中垫上一层,将实验种子平铺在滤纸上,放入培养皿中恒温培养,温度为25℃,并且按时喷洒蒸馏水,确保种子所需水分。
1.2.2 盆栽沙培处理(1) 播种育苗
提前准备好塑料杯作为栽培器具,器皿直径为8 cm。将培育所需基质定为珍珠岩,种子露白后,将种子进行播种。每日用1/2的霍格兰培养液体保持实验基质的湿润。
(2) 胁迫处理
实验共设铜离子、镉离子、铜和镉复合离子3个因子,每个因子设6个处理,分别为6种不同的浓度,各处理浓度如表 1所示,其中T1为对照组。每个处理包含10株长势匀称、体态一致的麻疯树幼苗,使用含有不同金属浓度的培养液分别用于浇洒栽培基质。实验进行7 d后检测各项生理指标。
| 处理编号Treatment number | 处理浓度Treatment concentration (mg/L) | ||
| 铜离子Copper ion | 镉离子Cadmium ion | 铜和镉复合离子Cu and Cd complex ion | |
| T1 | 0 | 0 | 0+0 |
| T2 | 25 | 5 | 25+5 |
| T3 | 50 | 10 | 50+10 |
| T4 | 100 | 50 | 100+50 |
| T5 | 200 | 100 | 200+100 |
| T6 | 400 | 200 | 400+200 |
1.2.3 测定方法
以王小菁等[10]和张志良等[11]的实验研究为依据,无水丙酮提取并采用可见光光度法测定叶绿素含量;采用硫代巴比妥酸加热显色法测定丙二醛含量;采用考马斯亮蓝法测定可溶性蛋白质含量;使用愈创木酚法测定过氧化物酶的活性;使用TTC显色法测定根系活力;通过测定外渗液电导率来测定植物细胞质膜的透性;使用酸性茚三酮法测定脯氨酸含量。
1.3 数据分析采用Excel 2016软件整理数据及绘制图表。
2 结果与分析 2.1 铜、镉及其复合胁迫对麻疯树幼苗丙二醛含量的影响丙二醛作为膜脂过氧化物的主要产物,能够和核酸、蛋白质、氨基酸等活性物质交换联结,沉积为脂褐素(不溶化合物),对细胞生命活动产生干扰,其膜脂过氧化程度通过内部含量呈现[12, 13]。丙二醛会抑制蛋白质的合成,植物在衰老和逆境伤害的情况下,会发生膜脂过氧化生成丙二醛,通过丙二醛含量可了解植物组织的破坏程度。由图 1可知,Cd胁迫下丙二醛含量随着Cd2+浓度的升高先升高后下降,当浓度升高至10 mg/L时丙二醛含量降至最低,之后随着Cd2+浓度的继续增加丙二醛含量又再次升高,当Cd2+浓度为100 mg/L时达到峰值,Cd2+浓度超过100 mg/L后丙二醛含量再次下降。Cu胁迫下,其浓度为100 mg/L时,麻疯树幼苗丙二醛含量最低,是对照组的82.92%;当浓度增大至200 mg/L时,其MDA含量最高。在Cd、Cu复合胁迫下,当Cu+Cd复合离子浓度为(25+5) mg/L时MDA含量最高,浓度加大至(100+50) mg/L时MDA含量降至最低。丙二醛含量低时对麻疯树幼苗生长有促进作用;含量高时对麻疯树幼苗生长有毒害作用。
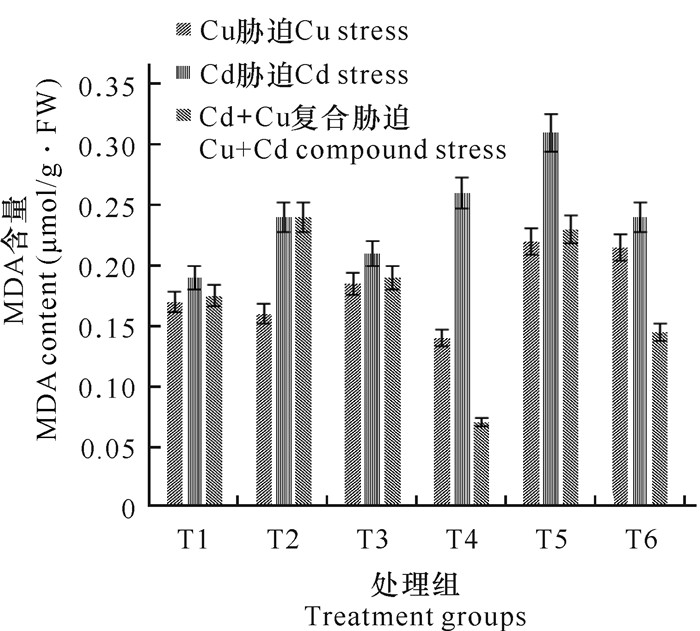
|
| 图 1 铜、镉及其复合胁迫对麻疯树幼苗丙二醛含量的影响 Fig.1 Effects of Cu, Cd and their combined stress on the content of malondialdehyde in J.curcas seedlings |
2.2 铜、镉及其复合胁迫对麻疯树幼苗根系活力的影响
根系为植物提供生长所需的营养物质,根系代谢强度与其活力有直接关系,活力高则代谢旺盛,对植株生长有好处。由图 2可知,Cd胁迫下麻疯树幼苗的根系活力先降低后升高,当Cd2+浓度为100 mg/L时根系活力达到最高值,之后随着浓度的继续升高再次下降。但是可以看到,不管何种Cd2+浓度下的胁迫,根系活力都处在较高的水平,说明Cd2+胁迫对麻疯树根系活力影响不明显。在Cu胁迫下,麻疯树幼苗根系活力随着Cu2+浓度的增加先逐渐升高再迅速下降至几乎接近零,表明根系基本死亡。Cu+Cd复合胁迫下,根系活力也是升高再降低,当Cu+Cd复合浓度为(50+10) mg/L时,麻疯树幼苗根系活力最强,说明一定Cu+Cd复合离子浓度有利于幼苗的生长,而高浓度Cu+Cd复合离子则会毒害幼苗的生长。
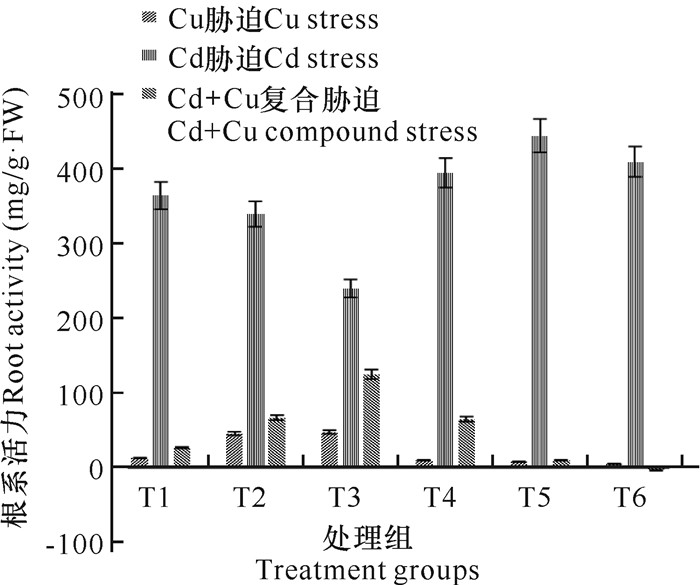
|
| 图 2 铜、镉及其复合胁迫对麻疯树幼苗根系活力的影响 Fig.2 Effects of Cu, Cd and their combined stress on root activity of J.curcas seedlings |
2.3 铜、镉及其复合胁迫对麻疯树叶绿素含量的影响
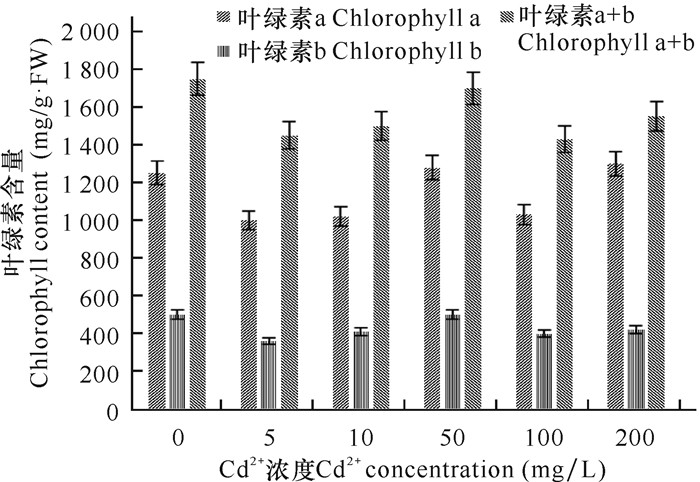
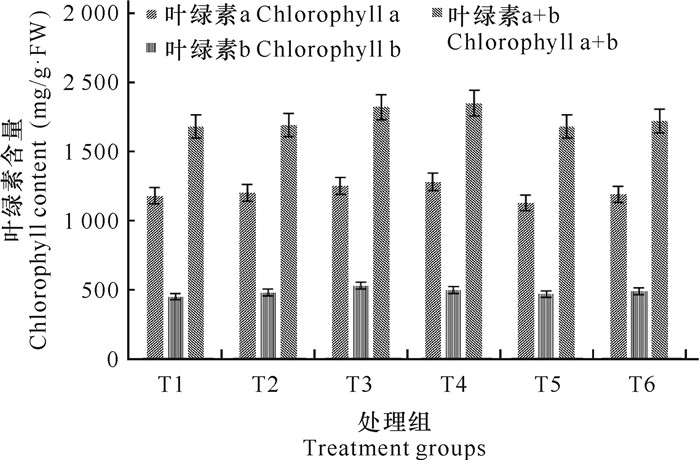
由图 3-5可知,随着Cu2+浓度增加,叶绿素a、叶绿素b和叶绿素a+b含量总体呈现上升趋势,Cu2+胁迫组麻疯树幼苗的叶绿素含量均比对照组的叶绿素含量有所增加,说明Cu2+浓度对麻疯树幼苗生长有促进作用。Cu2+浓度为25 mg/L时,麻疯树幼苗叶绿素含量上升幅度较大,可能是麻疯树幼苗在Cu2+浓度为25 mg/L时表现出应激作用,加快其光合作用(图 3)。Cd2+处理后的叶绿素含量相对于参照组的叶绿素含量普遍稍低,当Cd2+浓度为5 mg/L时,叶绿素的含量降到最低;在50 mg/L及以上的Cd2+浓度时,叶绿素含量先降低后上升(图 4),表明其浓度的增加不能说明对叶绿素积累有促进或者抑制作用。在Cd、Cu复合胁迫下,其叶绿素总体呈小幅度起伏,说明Cd、Cu复合胁迫对麻疯树幼苗光合作用的影响不大(图 5)。

|
| 图 3 不同铜离子浓度胁迫对麻疯树幼苗叶绿素含量的影响 Fig.3 Effects of different concentrations of copper ions on the chlorophyll content in J.curcas seedlings |
|
| 图 4 不同镉离子浓度胁迫对麻疯树幼苗叶绿素含量的影响 Fig.4 Effects of different cadmium concentration stress on the chlorophyll content of J.curcas seedlings |
|
| 图 5 铜、镉复合胁迫对麻疯树幼苗叶绿素含量的影响 Fig.5 Effects of Cu and Cd on the chlorophyll content in J.curcas seedlings |
2.4 铜、镉及其复合胁迫对麻疯树幼苗电导率的影响
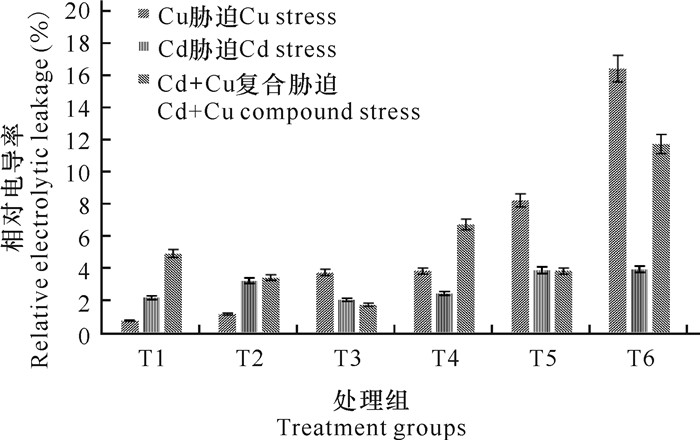
Cu2+胁迫下,麻风树幼苗外渗液电导率随Cu2+浓度增加而增加,呈显著正相关关系(图 6)。Cd2+胁迫下,相对电导率总体是先升高再下降后上升的变化趋势,浓度为10 mg/L时,其相对电导率为对照组的78.24%。Cu+Cd复合胁迫浓度逐渐上升到(50+10) mg/L时,相对电导率缓慢下降。当Cu+Cd复合胁迫浓度为(100+50) mg/L时相对电导率急剧上升, 当复合浓度为(400+200) mg/L时相对电导率达到最高,为对照组的238.38%。
|
| 图 6 铜、镉及其复合胁迫对麻疯树幼苗相对电导率的影响 Fig.6 Effect of Cu, Cd and their combined stress on the electrical conductivity of J.curcas seedlings |
2.5 铜、镉及其复合胁迫对麻疯树幼苗可溶性蛋白质含量的影响
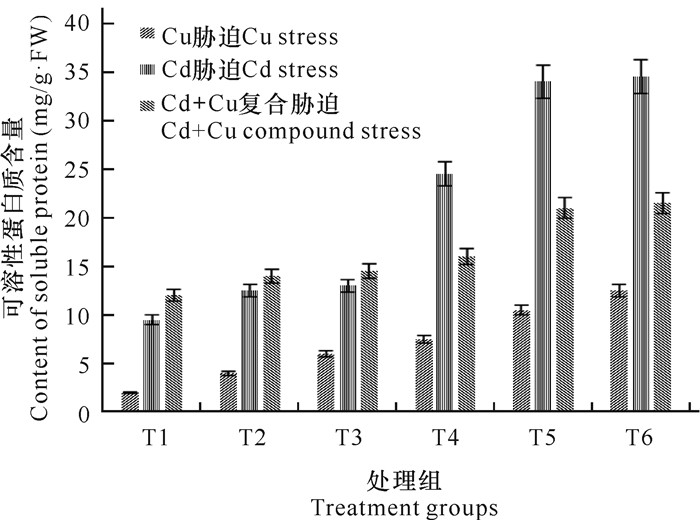
由图 7可知,麻疯树幼苗叶片中含有的可溶性蛋白质含量随Cd2+和Cu2+胁迫浓度升高而升高,Cd浓度为200 mg/L或Cu浓度为400 mg/L时,可溶性蛋白质含量达到顶峰,分别为对照组的352.87%和575.06%。Cd、Cu复合胁迫时,可溶性蛋白质含量也随着处理浓度的增加而增加,但当Cu+Cd复合胁迫浓度分别为(25+5)、(50+10) mg/L时,可溶性蛋白质含量与对照组差异不明显; 当Cu+Cd复合胁迫浓度分别达到(200+100)、(400+200) mg/L时,可溶性蛋白质含量显著提高,分别为对照组的190.87%和193.94%。可溶性蛋白质作为重要的渗透调节物质和营养物质,其增加可提高细胞的保水能力,同时对细胞的生命物质、生物膜起保护作用。从图 7中可以明显看出,Cd2+浓度为200 mg/L时可溶性蛋白质含量变化最明显,含量最高。
|
| 图 7 铜、镉及其复合胁迫对麻疯树幼苗可溶性蛋白质含量的影响 Fig.7 Effects of Cu, Cd and their combined stress on the protein content of J.curcas seedlings |
2.6 铜、镉及其复合胁迫对麻疯树幼苗可溶性糖含量的影响
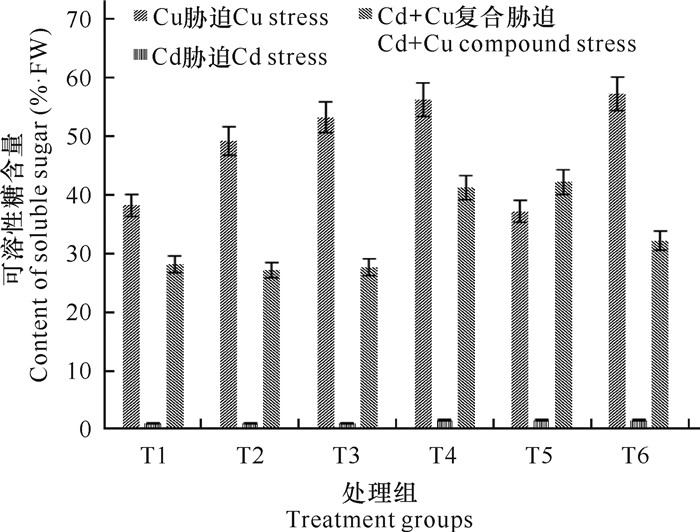
如图 8可示,单一金属Cd处理下,麻疯树幼苗的可溶性糖含量先降低然后升高达到最大值(浓度为50 mg/L时),但与对照组间的差异不明显,说明Cd胁迫对麻风树可溶性糖含量影响不显著。在Cu处理下,随着其浓度增加,可溶性糖含量也随之增加,当Cu2+浓度达到400 mg/L时,可溶性糖含量达到峰值,为对照组151.58%。复合胁迫时,麻疯树幼苗中可溶性糖含量随胁迫浓度的升高而增加,当Cu+Cd复合胁迫浓度为(200+100) mg/L时,含量达到最高值,为对照组的143.52%。可溶性糖含量的增加,能减少重金属胁迫对植物产生的伤害,增强植物的抗逆性。
|
| 图 8 铜、镉及其复合胁迫对麻疯树幼苗可溶性糖含量的影响 Fig.8 Effects of Cu, Cd and their combined stress on the content of soluble sugar in J.curcas seedlings |
2.7 铜、镉及其复合胁迫对麻疯树幼苗过氧化物酶活性的影响
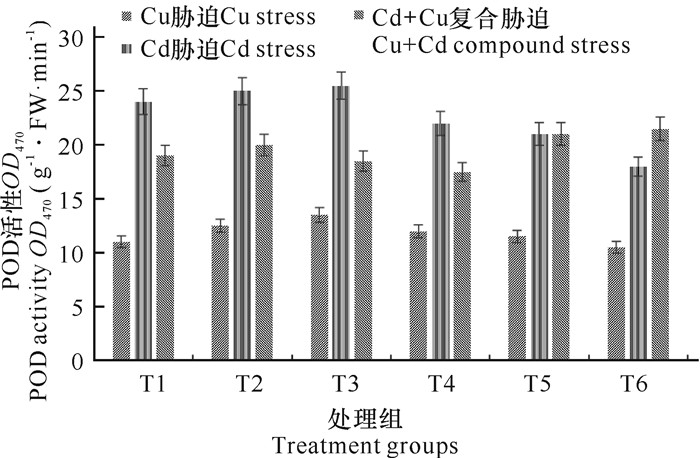
过氧化物酶是一种含铁的酶,能促进H2O2氧化酶类反应,进而促进植物的生长,在植物体的呼吸代谢中起着重要的作用。由图 9可知,单一Cu、Cd胁迫下,POD活性均随Cu2+、Cd2+的浓度升高先缓慢上升后缓慢下降。当Cu2+和Cd2+浓度分别为50,10 mg/L时,POD活性达到最高值,分别为对照组的116.14%和107.63%。当Cu2+和Cd2+浓度分别为400,200 mg/L时,POD活性达到最小值,分别为对照组的96.38%和78.25%。表明Cu2+或Cd2+浓度较低时,能诱导过氧化物酶表达并消除胁迫下产生的活性氧。
|
| 图 9 铜、镉及其复合胁迫对麻疯树幼苗过氧化物酶(POD)活性的影响 Fig.9 Effects of Cu, Cd and their combined stress on the peroxidase (POD) activity of J.curcas seedlings |
Cu+Cd复合胁迫对POD活性的影响不显著,当Cu+Cd复合胁迫处理浓度为(400+200) mg/L时,活性达到最大值,为对照组的1.027倍;当Cu+Cd复合胁迫浓度为(100+50) mg/L时,POD活性达到最小值,为对照组的0.956倍。
2.8 铜、镉及其复合胁迫对麻疯树幼苗脯氨酸含量的影响由图 10可知,随着Cu2+浓度增加,麻疯树幼苗脯氨酸含量呈增大趋势,低浓度(25,50 mg/L)处理对脯氨酸含量影响不显著,高浓度(200,400 mg/L)处理能够促进麻疯树游离脯氨酸含量的显著提高。同样单一Cd胁迫时,当浓度为200 mg/L时,脯氨酸含量增大;当浓度为10 mg/L时,脯氨酸含量变少,为对照组的68.32%,说明10 mg/L的Cd2+阻碍了麻疯树幼苗体内脯氨酸的合成。当Cu+Cd复合胁迫浓度达到(100+50)、(200+100)、(400+200) mg/L时,脯氨酸含量加速上升,分别为对照组的114.68%、165.66%、208.92%。复合胁迫时,麻疯树幼苗中脯氨酸含量随着处理浓度的升高呈上升趋势(图 10),当Cu+Cd复合胁迫浓度为(25+5) mg/L时,幼苗中的脯氨酸含量与对照组间差异不显著,当复合浓度大于等于(100+50) mg/L时,其含量与对照组间差距显著。且随复合胁迫浓度增加,脯氨酸含量高于单一金属胁迫,说明复合胁迫增加了脯氨酸积累,加剧对细胞膜的破坏。
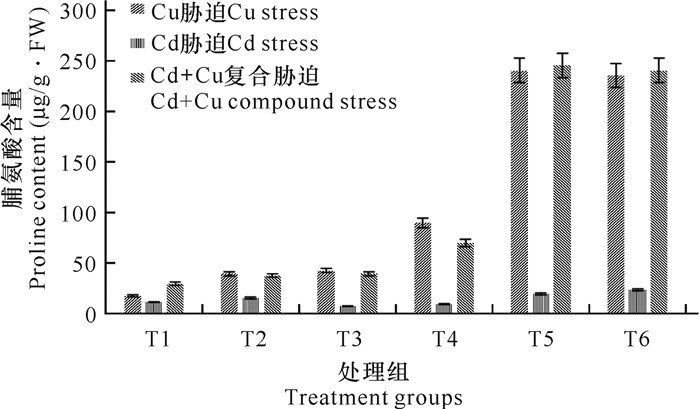
|
| 图 10 铜、镉及其复合胁迫对麻疯树幼苗脯氨酸含量的影响 Fig.10 Influence of Cu, Cd and their combined stress on the proline content of J.curcas seedlings |
3 讨论 3.1 镉胁迫对麻疯树幼苗生理生化特性的影响
重金属对植物生理生化特征的影响会因为外界环境的变化而变化,重金属污染严重会导致植物生长不良、产生病害,甚至早衰死亡。Cd对所有植物都具有毒性,Cd2+在低浓度(0.1-1.0 mg/kg)时抑制植物的生长、发育和繁殖,高浓度时可导致植物死亡[14]。本研究结果表明,Cd胁迫下麻疯树幼苗的MDA含量均较对照组增加,说明Cd2+在麻疯树幼苗体内的积累可以破坏活性氧代谢平衡,同时随着Cd2+浓度的增高,可溶性蛋白质含量增加,且游离脯氨酸含量在5, 100, 200 mg/L时增加,使Cd2+对麻疯树幼苗的毒害作用减弱,从而使Cd2+对叶绿素的合成和根系活力的毒害作用降至最低,同时对植物细胞组织起到保护作用。当Cd2+浓度> 50 mg/L时,实验显示POD活性有明显的下降趋势,而可溶性糖和电导率明显增高。以上结果表明,当Cd2+浓度>50 mg/L时,Cd对麻疯树幼苗表现出毒害现象,这与徐玲玲等[15]、彭昌琴等[16]的试验结果一致。
3.2 铜胁迫对麻疯树幼苗生理生化特性的影响铜是植物生长的必需微量元素之一,也是叶绿素的重要组成部分,参与植物光合作用等,但Cu过量也会对植物产生毒害作用。本研究结果表明,在Cu胁迫下,浓度分别为25,100,50,400,400,400,50,200 mg/L时,相对应的丙二醛、根系活力、叶绿素含量、可溶性蛋白质含量、可溶性糖含量、POD活性、脯氨酸含量等指标相对于参照组均处于对植物组织具有积极利好阶段。
由实验结果可以看出,当Cu2+浓度为100 mg/L时其MDA含量最低,当浓度增大至200 mg/L时,其MDA含量最高。这是因为高浓度的Cu2+会破坏麻疯树幼苗叶片膜结构和功能,导致细胞膜透性增大和大量的MDA积累。麻疯树幼苗根系活力和过氧化物酶(POD)活性随Cu2+浓度的增大先缓慢上升后缓慢下降。这是因为低浓度的Cu2+不仅能诱导过氧化物酶活性,还能对其胁迫下产生的活性氧有一定的消除作用,从而使过氧化物酶(POD)的活性升高,但其维持系统稳定的能力有限,当胁迫达到一定强度时,这种能力会渐渐丧失,随之酶的活性降低。酶活性的高低,在影响麻风树幼苗根系的生长的同时对其根系活力也有影响。而当Cu2+浓度到达200 mg/L时,麻疯树根系活力值已经很小,根系基本死亡。
麻疯树幼苗外渗液电导率、可溶性蛋白质含量、可溶性糖含量、脯氨酸含量都随Cu2+浓度增加而增加,其中高浓度Cu (200,400 mg/L)能促进麻疯树游离脯氨酸含量的显著提高。当Cu2+浓度到达一定程度后,可溶性糖和和可溶性蛋白质的含量达到最大值,Cu2+浓度为400 mg/L时可溶性蛋白质和可溶性糖含量均最大。
综上所述,低浓度Cu2+不仅对麻疯树幼苗的毒害作用表现不明显,还对相关生理指标表现出促进作用,符合低浓度Cu2+会促进麻疯树幼苗生长这一科学理论,也表明当Cu2+浓度达到一定程度时才会抑制、毒害麻疯树幼苗生长发育。
3.3 铜、镉复合胁迫对麻疯树幼苗生理生化特性的影响叶绿体是光合作用的主要场所,其结构的完整性会影响植物光合作用。本研究结果显示,与对照组相比,随着Cd+Cu复合胁迫浓度的提高,麻疯树幼苗叶片叶绿素虽有变化但是变化幅度不大,也就是说Cd+Cu复合胁迫不影响麻疯树幼苗叶片叶绿素的合成;但麻疯树幼苗POD活性有不同程度影响,即Cd+Cu复合胁迫致使幼苗体内活性氧代谢失衡;麻疯树幼苗活性氧积累增多,导致膜脂过氧化,从而产生丙二醛等膜脂过氧化物。
本实验研究Cd2+、Cu2+复合胁迫时,当Cd+Cu复合胁迫浓度为Cd2+ < 50 mg/L、Cu2+ < 100 mg/L时,麻风树幼苗中的脯氨酸含量与对照组没有明显变化;当复合胁迫浓度中Cd2+达到100 mg/L及以上、Cu2+达到200 mg/L及以上时,其含量与对照组间差距显著。脯氨酸作为渗透调节物质,可在逆境条件下大量合成,这就说明在高浓度复合胁迫逆境下,植物会为了保护自身的代谢功能而产生大量的脯氨酸。
| [1] |
赵纪新, 尹鹏程, 岳荣, 等. 我国农田土壤重金属污染现状·来源及修复技术研究综述[J]. 安徽农业科学, 2018, 46(4): 19-21, 26. DOI:10.3969/j.issn.0517-6611.2018.04.005 |
| [2] |
袁林, 赖星, 杨刚, 等. 钝化材料对镉污染农田原位钝化修复效果研究[J]. 环境科学与技术, 2019, 42(3): 90-97. |
| [3] |
黄燕华, 张娜, 刘丽, 等. 我国耕地土壤重金属污染现状及防治对策探析[J]. 化工设计通讯, 2017, 43(9): 192-193. DOI:10.3969/j.issn.1003-6490.2017.09.168 |
| [4] |
CARGNELUTTI D, TABALDI L A, SPANEVELLO R M, et a1. Mercury toxicity induces oxidative stress in growing cucumber seedlings[J]. Chemosphere, 2006, 65(6): 999-1006. DOI:10.1016/j.chemosphere.2006.03.037 |
| [5] |
覃勇荣, 汤丰瑜, 严海杰, 等. 重金属胁迫对任豆种子萌发及幼苗抗氧化酶活性的影响[J]. 种子, 2017, 36(10): 31-36. |
| [6] |
王友保, 刘登义. Cu、As及其复合污染对小麦生理生态指标的影响[J]. 应用生态学报, 2001, 12(5): 773-776. DOI:10.3321/j.issn:1001-9332.2001.05.030 |
| [7] |
郝晓华, 任美艳. Cu2+单独污染对藜麦种子萌发及部分生理指标的影响[J]. 安徽农学通报, 2018, 24(11): 16-20. DOI:10.3969/j.issn.1007-7731.2018.11.007 |
| [8] |
林义章, 徐磊. 铜污染对高等植物的生理毒害作用研究[J]. 中国生态农业学报, 2007, 15(1): 201-204. |
| [9] |
公勤, 康群, 王玲, 等. 重金属铜对植物毒害机理的研究现状及展望[J]. 南方农业学报, 2018, 49(3): 469-475. DOI:10.3969/j.issn.2095-1191.2018.03.09 |
| [10] |
王小菁, 李玲, 张盛春, 等. 植物生理学[M]. 北京: 高等教育出版社, 2019.
|
| [11] |
张志良, 李小方. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2016.
|
| [12] |
OUZOUNIDOU G. Copper-induced changes on growth, methal content and photosynthetic function of Alyssum montanum plants[J]. Environ Experi Botan, 1994, 34(2): 165-172. DOI:10.1016/0098-8472(94)90035-3 |
| [13] |
董袁媛, 孙竹, 杨洋, 等. 镉胁迫对黄麻光合作用及镉积累的影响[J]. 核农学报, 2017, 31(8): 1640-1646. |
| [14] |
尹国丽, 师尚礼, 寇江涛, 等. Cd胁迫对紫花苜蓿种子发芽及幼苗生理生化特性的影响[J]. 西北植物学报, 2013, 33(8): 1638-1644. |
| [15] |
徐玲玲, 李巧玉, 张红莲, 等. 3种草本植物种子萌发及幼苗初期对镉胁迫的生理影响[J]. 种子, 2016, 35(3): 37-41. |
| [16] |
彭昌琴, 陈兴银, 杨鹏, 等. 镉胁迫对尾穗苋种子萌发及幼苗生理特性的影响[J]. 种子, 2018, 37(7): 43-48. |



