2. 中国海洋大学, 山东青岛 266100;
3. 山东省滨州市无棣县海洋发展和渔业局, 山东滨州 251900
2. Ocean University of China, Qingdao, Shandong, 266100, China;
3. Binzhou Municipal Marine Development Bureau, Binzhou, Shandong, 251900, China
非洲斑节对虾(Penaeus monodon),又称金刚斑节对虾、斑节王,分类学上隶属于节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)对虾科(Penaeidae)对虾属(Peneus),是对虾属中的大型种。非洲斑节对虾原产于非洲莫桑比克等地,相对于目前国内养殖的斑节对虾而言,其体表特征表现为体色较深、头胸甲较为厚实、体长侧扁、略呈梭形、体色鲜亮等。非洲斑节对虾养殖的适合水温为25-32℃,适应盐度在30左右,适宜环境为沙底质,对饲料蛋白含量要求相对较低,属于杂食性动物,抗病能力强,适宜工厂集约化、池塘等多种养殖模式[1]。
养殖环境因子中的盐度是影响水产养殖动物生长最直接、最重要的生态因子之一[2],自然环境(如雨天、旱天)的变化可直接或间接地影响养殖水体的盐度,进而对动物机体生理状态产生影响[3-8]。目前,关于盐度对对虾养殖的影响报道较多,且集中表现在凡纳滨对虾方面。李娜等[9]研究发现随着盐度升高,凡纳滨对虾的存活率、相对增重率、特定生长率、饵料转化率等指标皆表现出降低趋势,而摄食率、血浆渗透压及Na+-K+-ATPase活力逐渐升高。董甜甜等[10]从生长、代谢和抗氧化酶活力方面研究高盐胁迫对凡纳滨对虾的影响,结果表明高盐度不适宜对虾的生长和存活,但可以激活其抗氧化能力和脂类代谢。赵玉超等[11]研究发现,随着盐度增加,凡纳滨对虾仔虾生长日增率和存活率显著降低,而酸性磷酸酶ACP、碱性磷酸酶AKP、超氧化物歧化酶SOD和过氧化氢酶CAT等部分非特异性免疫酶活性被激发,机体渗透调节能力增强。Gao等[12]研究表明,低盐度环境下凡纳滨对虾生长性能和存活率显著降低,激活了对虾鳃Na+-K+-ATPase α亚基、碳酸酐酶转录水平,但抑制了肝胰脏糜蛋白酶、胰蛋白酶的转录水平。李华等[13]研究显示,低盐可激活凡纳滨对虾血淋巴超氧化物歧化酶SOD活性。目前,关于盐度胁迫(包括高盐度和低盐度)对非洲斑节对虾的研究报道较少,因此,本实验以非洲斑节对虾为研究对象,分析低、高盐度胁迫对非洲斑节对虾生长、代谢、抗氧化及消化指标的影响,拟丰富对虾生物学基础知识,同时为非洲斑节对虾健康养殖及抗环境胁迫预警提供理论参考。
1 材料与方法 1.1 实验动物及其管理实验用非洲斑节对虾初始体质量为(1.5±0.2) g,暂养于玻璃钢桶(500 L)中。暂养期间所用海水盐度为30,pH值为8.0±0.5,温度为(28±0.5)℃,24 h充气泵充氧,溶氧量为(7.5±0.5) mg/L,水体总氨氮低于0.5 mg/L。每天饲料投喂量为体质量的8%-10%,每天5次投喂(6:00、10:00、14:00、18:00、22:00),根据当日天气、残饵和饲养条件调整具体投喂量。养殖过程中每天上午10:00换水1次,换水量为总水体的30%。暂养7 d后,每天以5个盐度的速度由盐度30驯化至实验设计盐度梯度。海水盐度由淡水、天然海水与卤水(滨州友发有限公司)调配而成。
1.2 实验设计2020-04-17-2020-5-30,在山东省滨州市北海经济开发区友发水产有限公司工厂化车间进行为期35 d的对虾养殖试验。实验设置20,30,40,50共4个盐度梯度,其中30盐度组作为对照。每个盐度组设3个平行,每个平行放入大小均匀、健康的非洲斑节对虾400尾。日常投喂、管理同暂养期。每隔7 d,从每个平行组随机取30尾对虾取血、鳃和肝胰腺组织样品。
1.3 样品收集试验过程的第3,7,14,35天,采用1.0 mL一次性无菌注射器从对虾心脏采集血液,与抗凝剂按照1∶1比例混合置于Eppendorf管中(每个平行取30尾虾,混合成一个样品),4℃过夜后于4 000 r/min离心10 min,取上清,-80℃保存, 备测。
试验过程的第3,7,14,35天,采用无菌镊子及剪刀获取鳃丝样品(每个平行取30尾虾,混合成一个样品),经剪刀剪碎,称取一定质量后置于匀浆管中,加入9倍体积的生理盐水,匀浆后经冷冻离心机4℃条件下3 000 r/min离心15 min,取上清液备测。
试验过程的第3,7,14,35天,在冰盘中获取肝胰腺组织置于Eppendorf离心管中(每个平行取30尾虾,混合成一个样品),混合后迅速投入液氮中,再转移到-80℃保存备用。称取一定质量肝胰腺组织置于匀浆管中,加入9倍体积的生理盐水,匀浆后经冷冻离心机4℃条件下3 000 r/min离心15 min,取上清液备测。
1.4 指标的检测 1.4.1 生长指标35 d的投喂试验结束后,停食1 d,称量每个平行组非洲斑节对虾的体质量,计算增重率(Weight Gain Rate,WGR)、特定生长率(Specific Growth Rate,SGR),统计成活率(Survival Rate,SR)。计算公式: WGR =(末均重-初均重) /初均重×100%,SGR=(ln末均重-ln初均重) /试验天数×100%,SR=(终末活对虾尾数/初始活对虾尾数) ×100%。
1.4.2 渗透调节指标测定采用南京建成生物工程研究所的试剂盒测定非洲斑节对虾鳃丝组织中总ATPase及Na+-K+-ATPase活力。总ATPase酶活定义为每小时每毫克组织蛋白中的ATP酶分解ATP产生1 μmol无机磷的量为一个酶活力单位。Na+-K+-ATPase酶活定义为每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为一个酶活力单位。
1.4.3 抗氧化相关酶活性测定采用南京建成生物工程研究所的试剂盒测定非洲斑节对虾血清样品总抗氧化能力(T-AOC)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量、谷胱甘肽过氧化物酶(GSH-Px)活性。其中,T-AOC定义为在37℃时,每分钟每毫升血清使反应体系的吸光度(OD)值增加0.01为一个总抗氧化能力单位;CAT酶活定义为每毫升血清每秒钟分解1 μmol H2O2的量为一个活力单位;SOD酶活定义为在本反应体系中SOD抑制率达50%时所对应的酶量为一个活力单位(U);MDA含量定义为每毫升血清在95℃及酸性环境中与硫代巴比妥酸(Thiobarbituric Acid,TBA)缩合,形成红色MDA-TBA加合物的量;GSH-Px酶活定义为每0.1 mL血清在37℃反应5 min,扣除非酶促反应作用,使反应体系中GSH浓度降低1 μmol/L为一个酶活力单位。
1.4.4 消化酶活性测定采用南京建成生物工程研究所的试剂盒测定非洲斑节对虾肝胰腺组织样品胃蛋白酶(Pepsin)、脂肪酶(Lipase)和淀粉酶(Amylase) 活性。胃蛋白酶活力定义为在37℃条件下每毫克组织蛋白每分钟分解蛋白生成1 μg氨基酸相当于一个酶活力单位。脂肪酶活力定义为在37℃条件下每毫克组织蛋白每分钟水解生成1 μmol脂肪酸为一个酶活力单位。淀粉酶活力定义为组织中每毫克蛋白在37℃与底物作用30 min,水解10 mg淀粉为一个酶活力单位。
1.5 数据统计分析试验所得数据均表示为平均值±标准误(n=3);对数据进行SPSS 19.0单因素方差分析(one-way ANOVA)和Duncan比较分析,以P<0.05作为差异的显著性水平。
2 结果与分析 2.1 盐度胁迫对非洲斑节对虾生长的影响由表 1可知,实验期间各盐度组非洲斑节对虾的成活率不同,其中20,30盐度组成活率均为100%,40盐度组成活率为97.67%,50盐度组成活率仅为72.00%。投喂实验结束后,盐度胁迫组对虾终末体质量均低于对照组,50盐度组差异最显著(P<0.05),增重率仅为30.23% (P < 0.05);其次是20盐度组。特定生长率所受影响同步于终末体质量和增重率,盐度胁迫组SGR均显著低于对照组(P<0.05)。
| 盐度组别Salinity groups | 初始体质量Initial body weight (IBW,g·tail -1) | 终末体质量Final body weight (FBW,g·tail -1) | 增重率Weight gain rate(WGR,%) | 特定生长率Specific growth rate(SGR,%·d -1) | 成活率Survival rate(SR,%) |
| 20 | 1.49±0.05 a | 2.21±0.06 a | 48.55±1.54 a | 1.15±0.10 a | 100±0.00 a |
| 30 | 1.51±0.06 a | 3.01±0.06 b | 95.49±5.01 b | 1.96±0.03 b | 100±0.00 a |
| 40 | 1.60±0.03 a | 2.83±0.10 b | 76.59±0.68 c | 1.64±0.09 c | 97.67±0.88 a |
| 50 | 1.40±0.05 a | 1.84±0.05 c | 30.23±0.96 d | 0.75±0.03 d | 72.00±1.15 b |
| 注:同列数据后不同小写字母表示差异显著(P<0.05) Note:Different lowercase letters after the same column of data indicate significant differences (P<0.05) | |||||
2.2 盐度胁迫对非洲斑节对虾渗透调节的影响
由图 1可知,盐度胁迫对非洲斑节对虾鳃丝ATPase和Na+-K+-ATPase活性影响显著(P<0.05)。如图 1a所示,实验第3天,20盐度组ATPase活性显著下降,而40,50盐度组相反,活性显著升高;随着时间的延长,各盐度组ATPase活性均表现出适应盐度胁迫环境;第35天,与对照组比较,20,40,50盐度组均无显著差异(P>0.05)。图 1b显示,实验第3,7天,20,40,50盐度组Na+-K+-ATPase活性均比对照组升高,且差异显著(P<0.05),其中40盐度组尤为突出;第35天,20盐度组与对照组无显著差异(P>0.05),而40,50盐度组较对照组高,差异显著(P<0.05)。
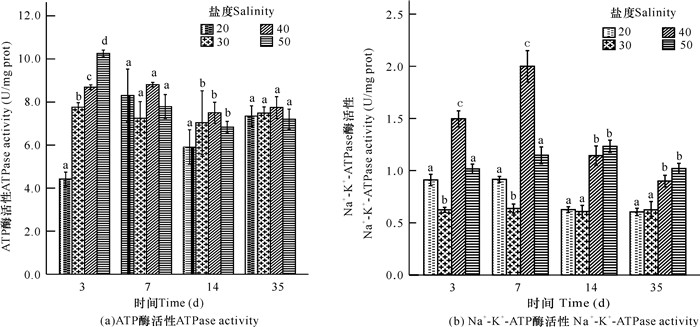
|
| 图中不同小写字母表示同一时间各组之间存在显著性差异(P < 0.05) Different small letter superscripts in the figures are significantly different (P < 0.05) 图 1 盐度胁迫对非洲斑节对虾渗透调节的影响 Fig.1 Effects of salinity stress on osmoregulation of P.monodon |
2.3 盐度胁迫对非洲斑节对虾抗氧化酶活性的影响
由图 2可知,盐度胁迫对非洲斑节对虾抗氧化应激系统产生明显的影响。图 2a结果显示,实验第3天,20,40,50盐度组T-AOC活性均比对照组显著提高(P<0.05),但胁迫组间无显著差异(P>0.05);第7,14,35天,20盐度组T-AOC活性较对照组低,但无显著差异(P>0.05);第7,14天,40,50盐度组较对照组高(P>0.05),而第35天,40,50盐度组较对照组低(P>0.05)。图 2b结果显示,整个实验过程中,各盐度组CAT活性均比对照组低,且第35天呈现适应状态,胁迫组与对照组间以及各胁迫组间均无显著差异(P>0.05);实验过程中,20盐度组与50盐度组间无显著差异(P>0.05)。图 2c结果显示,实验第3天,50盐度组SOD活性显著低于对照组及其他盐度组(P<0.05);随着时间延长,50盐度组SOD活性有所提升,且第14,35天与对照组之间差异显著(P<0.05)。图 2d结果显示,20盐度组MDA含量较对照组稍低,但无显著差异(P>0.05);实验第3天,40,50盐度组MDA含量较对照组显著提高(P<0.05),第7天仍比对照组高但无显著差异(P>0.05);随时间延长,第35天MDA含量比对照组稍低(P>0.05)。图 2e结果显示,实验第3天,20,40,50盐度组GSH-Px活性均显著高于对照组(P<0.05);随着时间延长,20盐度组GSH-Px活性有所降低,第14天与对照组之间存在显著差异(P < 0.05);第7天,40盐度组GSH-Px活性显著高于对照组(P<0.05),第14天,50盐度组活性最高(P>0.05);第35天,各胁迫组间以及胁迫组与对照组之间均无显著差异(P>0.05)。
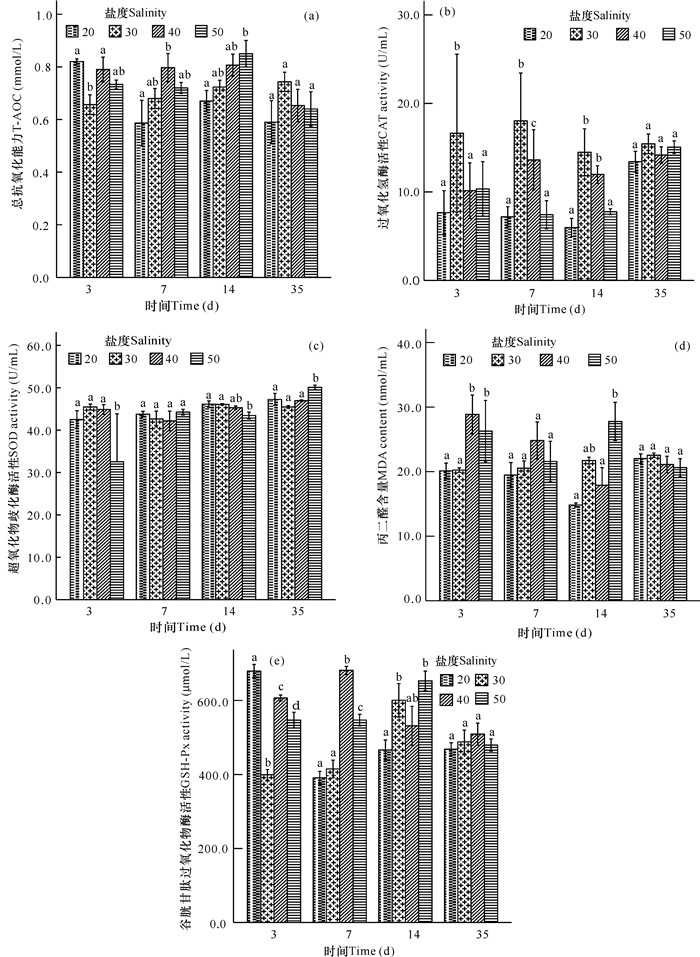
|
| 图中不同小写字母表示同一时间各组之间存在显著性差异(P < 0.05) Different small letter superscripts in the figures are significantly different (P < 0.05) 图 2 盐度胁迫对非洲斑节对虾抗氧化酶活性的影响 Fig.2 Effects of salinity stress on antioxidant of P.monodon |
2.4 盐度胁迫对非洲斑节对虾消化酶活性的影响
由图 3可知,盐度胁迫对非洲斑节对虾消化酶活性产生了不同程度的影响。如3a所示,实验期间各盐度组胃蛋白酶活性均比对照组降低,20盐度组第7天胃蛋白酶活性有所提升,仍比对照组低,但无显著差异(P>0.05);而40,50盐度组在整个实验期间一直与对照组存在显著差异(P<0.05)。图 3b结果显示,实验第3,14天,各盐度组脂肪酶活性均显著低于对照组显著(P<0.05),各盐度胁迫组之间差异不显著(P>0.05);第7天,20盐度组脂肪酶活性升高,与对照组无显著差异(P>0.05),但40,50盐度组仍显著降低(P<0.05);第35天,20,40盐度组脂肪酶活性较前期有所提升,与对照组间无显著差异(P>0.05),但50盐度组仍显著低于对照组(P < 0.05)。图 3c结果显示,实验第3天,20盐度组淀粉酶活性显著高于对照组(P<0.05),40,50盐度组与对照组无显著差异(P>0.05);第7,35天,各盐度组与对照组之间均无显著差异(P>0.05);第14天,40,50盐度组显著高于对照组(P<0.05),20盐度组与对照组无显著差异(P>0.05)。

|
| 图中不同小写字母表示同一时间各组之间存在显著性差异(P < 0.05) Different small letter superscripts in the figures are significantly different (P < 0.05) 图 3 盐度胁迫对非洲斑节对虾消化酶活性的影响 Fig.3 Effects of salinity stress on digestive enzymes activity of P.monodon |
3 讨论 3.1 盐度胁迫对非洲斑节对虾生长的影响
本研究结果发现,低盐度、高盐度胁迫均对非洲斑节对虾生长产生了抑制,增重率、特定生长率和成活率均呈现降低的趋势,尤其是50盐度组,说明盐度胁迫导致对虾生长环境远离其等渗点,从而在生长过程中需要更多的能量来维持机体渗透平衡,这就导致其代谢加快,物质积累不足,因此生长缓慢,成活率甚至仅有72.0%。非洲斑节对虾与凡纳滨对虾可能会因为品种差异、个体差异、饵料种类、水中理化因子及其他生态环境等多种因素导致盐度适应性存在差异,但基本原理一致。如研究报道,凡纳滨对虾具有广盐性,其最适盐度范围是18-35[14, 15],然而对虾的等渗点一般处于24-26。当环境盐度不适应自身渗透压时,凡纳滨对虾会自我调节渗透压平衡,其同化率在适宜的盐度环境下会随盐度降低而降低,从而抑制生长代谢。Bary等[16]研究发现,当盐度从25上升到35时,凡纳滨对虾的生长特征趋于缓慢,当盐度再升高至49时,对虾的生长明显受到抑制。李二超等[17]研究结果表明,盐度从25到35时,凡纳滨对虾生长缓慢,且成活率降低。Panikkar[18]研究渗透调节和环境盐度之间的适应性时发现,高盐度环境中,对虾需要将体内多余盐分排除,保持机体内正常水分;而低盐度环境中,对虾即需要获取更多盐分,排除机体内多余水分,在这调控过程中,机体需要消耗能量,因而降低了其他必需的能量代谢,降低了生长效能。
3.2 盐度胁迫对非洲斑节对虾渗透调节的影响盐度通过调节渗透压来影响对虾的生理功能。为适应不同生长环境,对虾在渗透调节和离子调节时又伴随着能量代谢,ATPase、Na+-K+-ATPase活性可反映机体渗透调节甚至生长代谢等状况[11, 19-22]。众多研究已探讨盐度和ATPase、Na+-K+-ATPase之间的调节或维持效应。Liu等[23]对中华绒螯蟹进行盐度适应性研究,结果显示随着盐度的升高,中华绒螯蟹血浆渗透压升高,Na+-K+-ATPase活力也逐渐升高。Wilder等[24]在对罗氏沼虾的研究中也发现,盐度的提高刺激了虾鳃中Na+-K+-ATPase酶活力。潘鲁青等[25]研究发现,养殖环境中盐度变化时, 凡纳滨对虾鳃丝中Na+-K+-ATPase活力逐渐升高,且盐度越低酶活力越大。然而,甲壳动物对虾主要依靠鳃上皮细胞膜上的Na+-K+-ATPase参与主动运输Na+和K+,维持机体的Na+、K+离子平衡和调节血淋巴渗透压[26],高盐胁迫条件下,鳃丝Na+-K+-ATPase活力有所增强[11]。本研究也呈现相似结果,急性盐度胁迫时Na+-K+-ATPase活力升高,40盐度组尤为显著,且随时间延长,与对照组仍呈现显著差异。这可能是因为在高盐度环境下,非洲斑节对虾体内渗透压增高,细胞内外极性也增加,为提供转运、吸收动力导致鳃上皮细胞活跃,机体为维持渗透平衡需消耗大量能量;但Na+-K+-ATPase转运Na+的能力有限,需要在适宜盐度下才达到最大转运能力。也有研究认为,由于渗透压的长期调节,基因表达量随刺激情况发生变化,进而调节Na+-K+-ATPase位点数量,从而影响酶活力,表现为升高现象[27]。本研究中,ATPase活力在急性盐度胁迫第3天表现出显著差异,50盐度组差异最显著;随时间延长,各盐度胁迫组活力有所回复,第35天与对照组无显著差异,趋于稳定,推测认为ATPase酶活力变化可能与Ca2+、Mg2+转运有关,具体原因还需进一步研究证实。
3.3 盐度胁迫对非洲斑节对虾抗氧化酶活性的影响在盐度胁迫环境中,对虾体内自由基会不断积累,若未能及时清除,积累到一定程度会对对虾机体产生胁迫,引起机体氧化应激反应,相关抗氧化酶活力随之发生变化[28]。不同指标其功能不同,对盐度胁迫的敏感度也不同[28, 29]。T-AOC是反映机体总抗氧化水平的重要指标之一;SOD是最重要的活性氧消除酶,在平衡氧化和抗氧化过程中通过2O2-+2H+→H2O2+O2反应清除体内过量氧自由基;CAT与SOD协同作用,在活性氧消除系统中将过氧化氢转变为水,保护机体免受氧自由基损伤而发生正常代谢;GSH-Px是一种重要的过氧化物分解酶,保护机体细胞膜不受过氧化物的损害;当机体内氧自由基过量发生损伤时会促进脂质过氧化反应,脂质过氧化物丙二醛MDA含量通过过氧化程度间接反映机体抗氧化能力[30-33]。本研究中,高盐胁迫下T-AOC活力升高,CAT活力发生不同程度的降低,SOD活力变化与对照组差异不显著,而MDA含量明显增加,GSH-Px活力显著提高。低盐胁迫影响效应则不同:急性胁迫第3天T-AOC活性显著提升,随着时间延长,酶活力比对照组稍低,且GSH-Px活力变化相同;SOD活力和MDA含量与对照组无显著差异;CAT活力较对照组显著降低,随时间延长呈现适应状态。推测产生这些结果的原因可能是,急性盐度胁迫使非洲斑节对虾体内氧自由基变化未发生急剧积累,抗氧化酶协同作用维持了机体的正常水平,但脂质过氧化物的增加对机体产生了一定的损伤,为保护体内细胞不受严重伤害而诱导了GSH-Px活力,分解过量的过氧化物质,从而实现对环境改变的适应性。
3.4 盐度胁迫对非洲斑节对虾消化酶活性的影响当环境盐度发生变化时,机体为克服负面影响改变其生理功能,调控能量代谢,渗透压平衡所需能量多,消化代谢能量便被消耗,因此抑制生长[34, 35]。本研究中,高盐、低盐胁迫均降低了肝胰腺消化酶活性,50盐度组尤为显著;20盐度组淀粉酶在第3天急剧提升,随后与对照组无显著差异,推测可能是因为不同盐度环境中不同消化酶底物的含量不同,因此诱导酶活性产生了差异,具体原因需要更深层次的研究。胃蛋白酶、脂肪酶和淀粉酶活性变化趋势不同,推测可能是非洲斑节对虾应对盐度胁迫时,糖类代谢不是主要的功能调节来源,故淀粉酶活性随时间延长未发生显著改变,而蛋白质和脂类代谢在生长过程中参与较多,因此盐度改变时严重抑制了肝胰腺中胃蛋白酶及脂肪酶活性,从而降低了对蛋白质及脂类的消化能力。Babkin等[36]研究发现,消化酶具有一定的整体效应,即其中一种酶活性提高时,其他消化酶的活性也同时提高;而当其中一种酶活性减弱时,其他消化酶的活性也随之减弱,本研究中胃蛋白酶和脂肪酶活性变化也呈现出这一现象。另外,消化酶活性与生长具有一定的相关性,盐度胁迫下非洲斑节对虾生理状况不佳,代谢水平降低,呈现较低消化酶活力,吸收转化迟钝,从而抑制机体生长,陈晓瑛等[37]、荆冰妍等[38]的研究也体现了这一相关性。
4 结论综上所述,盐度胁迫(高盐、低盐)会影响非洲斑节对虾的生长指标,盐度越高,对虾的渗透调节酶活性被激发,同时调节其抗氧化能力,降低消化酶活性,其生长越缓慢,存活率越低。盐度胁迫时,渗透压调节需要更多能量,非洲斑节对虾会释放消化及代谢能量以维持自身生理需求。本研究为后续研发盐度调控技术提供数据支撑,为进一步探讨非洲斑节对虾生理机制提供基础。
| [1] |
杨纪忠, 谢林荣, 何家才, 等. 南非斑节对虾低盐度养殖试验[J]. 水产养殖, 2018, 39(5): 41-42. DOI:10.3969/j.issn.1004-2091.2018.05.019 |
| [2] |
王克行. 虾蟹类增养殖学[M]. 北京: 中国农业出版社, 1997: 182-183.
|
| [3] |
ZHAO Q, PAN L Q, REN Q, et al. Effect of salinity on regulation mechanism of neuroendocrine-immunoregulatory network in Litopenaeus vannamei[J]. Fish and Shellfish Immunology, 2016, 49: 396-406. DOI:10.1016/j.fsi.2015.12.045 |
| [4] |
MOHAMED N A, SAAD M F, SHUKRY M, et al. Physiological and ion changes of Nile tilapia (Oreochromis niloticus) under the effect of salinity stress[J]. Aquaculture Reports, 2021, 19: 100567. DOI:10.1016/J.AQREP.2020.100567 |
| [5] |
LI C, LI N, DONG T T, et al. Analysis of differential gene expression in Litopenaeus vannamei under high salinity stress[J]. Aquaculture Reports, 2020, 18: 100423. DOI:10.1016/j.aqrep.2020.100423 |
| [6] |
何竺柳. 低盐度胁迫对罗氏沼虾生长和肉质的影响[D]. 舟山: 浙江海洋大学, 2018.
|
| [7] |
李娜. 高盐胁迫对凡纳滨对虾生长性能, 理化因子及基因表达的影响[D]. 青岛: 青岛农业大学, 2017.
|
| [8] |
马金武. 三疣梭子蟹不同盐度下血淋巴理化指标分析及Na+/H+-exchanger和V-ATPase基因的克隆和功能研究[D]. 上海: 上海海洋大学, 2016.
|
| [9] |
李娜, 王仁杰, 赵玉超, 等. 高盐胁迫对凡纳滨对虾生长指标、血浆渗透压及Na+-K+-ATP酶活力的影响[J]. 浙江海洋学院学报: 自然科学版, 2017, 36(3): 196-201. DOI:10.3969/j.issn.1008-830X.2017.03.002 |
| [10] |
董甜甜, 崔彦婷, 王忠凯, 等. 高盐胁迫对凡纳滨对虾(Litopenaeus vannamei)生长, 代谢和抗氧化酶活力的影响[J]. 海洋与湖沼, 2020, 51(5): 1239-1245. |
| [11] |
赵玉超, 王仁杰, 沈敏, 等. 高盐对凡纳滨对虾仔虾生长、渗透调节及免疫相关酶活性的影响[J]. 水产学报, 2019, 43(4): 833-840. |
| [12] |
GAO W H, TIAN L, HUANG T H, et al. Effect of salinity on the growth performance, osmolarity and metabolism-related gene expression in white shrimp Litopenaeus vannamei[J]. Aquaculture Reports, 2016, 4: 125-129. DOI:10.1016/j.aqrep.2016.09.001 |
| [13] |
李华, 李强, 曲健凤, 等. 不同盐度下凡纳滨对虾血淋巴免疫生理指标比较[J][J]. 中国海洋大学学报: 自然科学版, 2007, 37(6): 927-930. |
| [14] |
LARAMORE S, LARAMORE C R, SCARPA J. Eff-ect of low salinity on growth and survival of post larvae and juvenile Litopenaeus vannamei[J]. Journal of the World Aquaculture Society, 2001, 32(4): 385-392. DOI:10.1111/j.1749-7345.2001.tb00464.x |
| [15] |
王兴强, 曹梅, 马甡, 等. 盐度对凡纳滨对虾存活、生长和能量收支的影响[J]. 海洋水产研究, 2006, 27(1): 8-13. |
| [16] |
BRAY W A, LAWRENCE A L, LEUNG-TRUJILLO J R. The effect of salinity on growth and survival of Penaeus varmamei, with observations on the interaction of IHHN virus and salinity[J]. Aquaculture, 1994, 122(2/3): 133-146. |
| [17] |
李二超, 陈立侨, 曾嶒, 等. 盐度对凡纳滨对虾体组织蛋白质积累、氨基酸组成和转氨酶活性的影响[J]. 水生生物学报, 2009, 33(3): 532-538. |
| [18] |
PANIKKAR N K. Osmotic behavior of shrimps and prawns in relation to their biology and culture[J]. FAO Fisheries Report, 1968, 57(2): 527-538. |
| [19] |
江山, 许强华. 盐度胁迫对三疣梭子蟹鳃Na+/K+-ATPase酶活的影响[J]. 水产学报, 2011, 35(10): 1475-1480. |
| [20] |
HURTADO M A, RACOTTA I S, CIVERA R, et al. Effect of hypo- and hypersaline conditions on osmolality and Na+/K+-ATPase activity in juvenile shrimp (Litopenaeus vannamei) fed low and high-HUFA diets[J]. Comparative Biochemistry and Physiology A: Molecular & Integrative Physiology, 2007, 147(3): 703-710. |
| [21] |
陈垂坤, 郜卫华, 田罗. 盐度和营养素对甲壳动物营养生理的影响研究进展[J]. 长江大学学报: 自然科学版, 2015, 12(3): 47-51. |
| [22] |
MASUI D C, MANTELATTO F L M, MCNAMARA J C, et al. Na+, K+-ATPase activity in gill microsomes from the blue crab, Callinectes danae, acclimated to low salinity: Novel perspectives on ammonia excretion[J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 2009, 153(2): 141-148. |
| [23] |
LIU H Y, PAN L Q, LÜ F. Effect of salinity on hemolymph osmotic pressure, sodium concentration and Na+-K+-ATPase activity of gill of Chinese crab, Eriocheir sinensis[J]. Journal of Ocean University of China, 2008, 7(1): 77-82. DOI:10.1007/s11802-008-0077-2 |
| [24] |
WILDER M N, HUONG D T T, ATMOMARSONO M. Characterization of Na/K-ATPase in Macrobrachium rosenbergii and the effects of changing salinity on enzymatic activity[J]. Comparative Biochemistry and Physiology A: Molecular & Integrative Physiology, 2000, 125(3): 377-388. |
| [25] |
潘鲁青, 刘志, 姜令绪. 盐度、pH变化对凡纳滨对虾鳃丝Na+-K+-ATPase活力的影响[J]. 中国海洋大学学报: 自然科学版, 2004, 34(5): 787-790. |
| [26] |
WILDER M N, IKUTA K, ATMOMARSONO M, et al. Changes in osmotic and ionic concentrations in the hemolymph of Macrobrachium rosenbergii exposed to varying salinities and correlation to ionic and crystalline composition of the cuticle[J]. Comparative Biochemistry and Physiology-Part A: Molecular & Integrative Physiology, 1998, 119(4): 941-950. |
| [27] |
MENDONCA N N, MASUI D C, MCNAMARA J C, et al. Long-term exposure of the freshwater shrimp Macrobrachium olfersii to elevated salinity: Effects on gill (Na+, K+) ATPase α-subunit expression and K+-phosphatase activity[J]. Comparative Biochemistry and Physiology, 2007, 146(4): 534-543. DOI:10.1016/j.cbpa.2006.01.019 |
| [28] |
王芸, 李正, 段亚飞, 等. 红景天提取物对凡纳滨对虾抗氧化系统及抗低盐度胁迫的影响[J]. 南方水产科学, 2018, 14(1): 9-19. |
| [29] |
TOMANEK L, ZUZOW M J, IVANINA A V, et al. Proteomic response to elevated PCO2 level in eastern oysters, Crassostrea virginica: Evidence for oxidative stress[J]. Journal of Experimental Biology, 2011, 214(11): 1836-1844. DOI:10.1242/jeb.055475 |
| [30] |
王庚申, 谢建军, 施慧, 等. 不同盐度对脊尾白虾非特异性免疫及抗氧化酶活性的影响[J]. 浙江海洋学院学报: 自然科学版, 2013, 32(6): 499-502. DOI:10.3969/j.issn.1008-830X.2013.06.006 |
| [31] |
徐靖. 超氧化物歧化酶及其应用的研究进展[J]. 食品工业科技, 2013, 34(12): 387-391. |
| [32] |
CAVALETTO M, GHEZZI A, BURLANDO B, et al. Effect of hydrogen peroxide on antioxidant enzymes and metallothionein level in the digestive gland of Mytilus galloprovincialis[J]. Comparative Biochemistry and Physiology-Part C: Toxicology & Pharmacology, 2002, 131(4): 447-455. |
| [33] |
李国明, 孙育平, 王国霞, 等. 饲料中添加谷胱甘肽对花鲈幼鱼生长性能、血清生化指标和抗氧化能力的影响[J]. 动物营养学报, 2019, 31(7): 3207-3217. DOI:10.3969/j.issn.1006-267x.2019.07.032 |
| [34] |
董兰芳, 张琴, 许明珠, 等. 不同糖源对卵形鲳鲹(Trac-hinotus ovatus)日增重、饲料利用和消化酶活性的影响[J]. 渔业科学进展, 2016, 37(3): 42-48. |
| [35] |
谢一荣, 吴锐全. 鱼类消化酶研究及其在水产养殖中的应用[J]. 广东饲料, 2005, 14(2): 15-18. DOI:10.3969/j.issn.1005-8613.2005.02.008 |
| [36] |
BABKIN B P. Secretory mechanism of the digestive glands[M]. New York: Paul B Hoeber, Inc, 1950.
|
| [37] |
陈晓瑛, 王国霞, 孙育平, 等. 饲料中添加低聚木糖对凡纳滨对虾幼虾消化酶活力、肠道形态及细菌数量的影响[J]. 动物营养学报, 2018, 30(4): 1522-1529. DOI:10.3969/j.issn.1006-267x.2018.04.037 |
| [38] |
荆冰妍, 杨超, 郭冉, 等. 四种糖作为碳源对凡纳滨对虾生长、肠道消化酶及肠道菌群的影响[J]. 水产学报, 2021, 45(6): 920-928. |



