2. 河南师范大学生命科学学院, 河南新乡 453007;
3. 北部湾大学海洋学院, 广西北部湾海洋生物多样性养护重点实验室, 广西钦州 535011;
4. 广西科学院, 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
3. Guangxi Key Laboratory of Beibu Gulf Marine Biodiversity Conservation, College of Marine Sciences, Beibu Gulf University, Qinzhou, Guangxi, 535011, China;
4. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthetic Chemistry, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
卵形鲳鲹(Trachinotus ovatus)具有肉质鲜美、生长迅速等优点,主要分布于热带及亚热带地区,在我国主要分布在粤、琼、闽等省的沿海城市,是一种重要的经济型养殖鱼类[1-4]。近年来由于过渡捕捞导致自然水体鱼类减少,为解决日益增长的需求量,养殖人员通过各种方式进行大规模饲养,其中以集约化网箱养殖最为流行。集约化网箱养殖具有产量高、养殖时间短等优势,但这种养殖方式易引发各种病害,对卵形鲳鲹养殖业的发展造成了极大影响[5-9]。
溶藻弧菌(Vibrio alginolyticus)是一种嗜盐、嗜温菌,广泛分布在热带及亚热带沿海地区[10-11]。溶藻弧菌为海洋生物土著菌之一,属条件致病菌,可以人畜共患[12-14];一旦暴发具有发病迅速、死亡率高、流行面广等特点,造成社会经济损失的同时也严重威胁着人类的生命安全[3]。抗生素的使用一度减少了水产动物疾病的暴发,但是近些年抗生素滥用的潜在危害也相继出现,例如抗生素耐药及残留,不仅导致环境不断恶化,而且其通过食物链的传递对人类食品安全产生了巨大危害[15, 16]。在当前禁抗限抗背景下,水产养殖行业更加偏向于中草药的使用,不仅由于其绿色无污染,更是由于其具有显著的抗菌抗病毒功效[17-19]。深入开展中草药在水产动物防治中的运用研究,是实现水产养殖业绿色环保、高效生态的重要发展方向。
本研究以前期发病卵形鲳鲹上分离的溶藻弧菌为实验对象。首先,通过在多种中草药中逐个筛选,确定抑菌效果较好的中草药做进一步深入研究;然后,探究其不同浓度水提物的抑菌效果,确定其杀菌浓度及最小抑菌浓度;最后,通过胞内乳酸脱氢酶(Lactate dehydrogenase,LDH)含量的测定来分析其潜在的杀菌机制。分析该中草药水提物对溶藻弧菌的抑制作用,确定其水提物导致溶藻弧菌的死亡机制,可为今后研发抗病渔用中草药制剂提供理论依据。
1 材料与方法 1.1 材料溶藻弧菌(编号为TOQZ01)分离自广西钦州湾网箱养殖中发病的卵形鲳鲹,并超低温保存于广西海洋天然产物与组合生物合成化学重点实验室。白茅根、薄荷、鹅不食草、威灵仙、鸡骨草、青蒿、栀子、桑叶、田基黄,均购自广西南宁一心大药房;0.22 μm微孔滤柱购自Millipore;LB培养基、LB琼脂平板和TCBS培养基等购自广州环凯微生物有限公司;BCA蛋白浓度测定试剂盒和乳酸脱氢酶测定试剂盒购自上海碧云天生物技术有限公司。生化培养箱购自上海博迅医疗生物仪器股份有限公司;酶标仪购自Thermo公司,超净工作台为AIRTECH。
1.2 方法 1.2.1 溶藻弧菌菌液的制备将保存的溶藻弧菌划线接种于琼脂平板,28℃培养24 h后,挑取单菌落接入LB培养基中振荡培养6 h,采用平板计数法计数;将菌液稀释至1×106 cfu/mL,并置于4℃冰箱中保存备用。
1.2.2 中草药水提物的制备将白茅根、薄荷、鹅不食草、威灵仙、鸡骨草、青蒿、栀子、桑叶、田基黄9种中草药分别用A、B、C、D、E、F、G、H、I表示。
将各中草药分别烘干至恒质量,于干燥器中冷却后粉碎,过100目筛滤网。分别称取50 g中草药粉末,超纯水中4℃浸泡过夜;中草药经文火煎煮浓缩后,武火收汁,用4层灭菌纱布过滤药液;将药液稀释至中草药含量为500 mg/mL,4℃冰箱中避光保存备用。使用前经13 400 g离心3 min,上清液即为中草药水提物。
1.2.3 中草药的初筛将溶藻弧菌37℃摇床180 r/m培养19 h,3 000 g离心5 min,弃上清,用已灭菌的生理盐水洗2次,再用生理盐水重悬至OD600等于0.03,即为溶藻弧菌的初始工作浓度。将溶藻弧菌接入无菌的96孔板中,每孔10 μL,实验组加入100 μL中草药水提物原液,对照组加入100 μL灭菌生理盐水,空白组为110 μL灭菌生理盐水,4℃放置2 h、28℃孵育6 h,测OD600。抑制率=[1-(OD600实验组-OD600空白组)/(OD600对照组-OD600空白组)]×100%。
1.2.4 半致死浓度的测定半致死浓度(即抑制率达到50%以上)测定采用二倍稀释法。首先,用二倍稀释法将中草药水提物在LB培养基中逐级稀释至500.00,250.00,125.00,62.50,31.25,15.625,7.80,0 mg/mL;接着,将溶藻弧菌菌液接入8个浓度梯度的药液中(保证菌液初始菌浓度为1×107 CFU/mL),以中草药水提物浓度0 mg/mL组作为对照组(P-Con),4℃放置2 h、28℃孵育6 h,3 000 g离心10 min,用500 μL灭菌的生理盐水清洗2次后,重悬于200 μL灭菌生理盐水中;然后,以灭菌生理盐水作为孔板对照,用分光光度计分别测定600 nm处波长;最后,计算中草药水提物对溶藻弧菌的抑制率,其计算公式见1.2.3节。每个实验重复3次。
1.2.5 细菌内乳酸脱氢酶(LDH)含量的测定将过夜培养的溶藻弧菌3 000 g离心5 min,经灭菌生理盐水洗2次后,生理盐水重悬;分别取900 μL LB (Con组)和中草药水提物(Test组),同时加入100 μL溶藻弧菌,保证每管的初始菌浓度为1×109 CFU/mL,每组3个重复;4℃放置2 h,然后28℃摇床培养,分别在2,4,6,8 h取样,测定细菌内的LDH含量。具体方法如下:
(1) LDH工作液的配制:20 μL乳酸溶液+20 μL 2-p-iodophenyl-3-nitrophenyl tetrazolium chloride (INT)溶液+20 μL酶溶液;
(2) 将处理好的样品3 000 g离心5 min,生理盐水洗2次;
(3) 加入200 μL 20%的LDH释放剂,室温静置1 h;
(4) 8 000 g离心5 min后,取120 μL上清液加入60 μL LDH工作液,室温避光孵育30 min,测定OD490。
1.2.6 数据统计用Excel 2010及SPSS 26软件进行数据处理及统计,采用非参数T检验及卡方检验。P<0.05为差异有统计学意义。
2 结果与分析 2.1 中草药水提物抑菌效果的初筛图 1为9种中草药水提物对溶藻弧菌存活率的影响。从图 1a中可以看出白茅根(A)、薄荷(B)、鸡骨草(E)、桑叶(H)对细菌的存活率没有影响,和对照组相比无显著性差异;鹅不食草(C)、威灵仙(D)、青蒿(F)、栀子(G)、田基黄(I)对细菌的存活率都有一定的抑制作用,与对照组相比具有极显著性的差异。图 1b为5种中草药水提物对细菌生长的抑制作用,其中鹅不食草(C)、威灵仙(D)、青蒿(F)、栀子(G)、田基黄(I)对溶藻弧菌抑制率分别为48.02%,97.43%,80.97%,56.50%,69.64%,但是只有D组威灵仙水提物抑菌浓度超过90%,故后续实验选用威灵仙水提物进行致死机制研究。
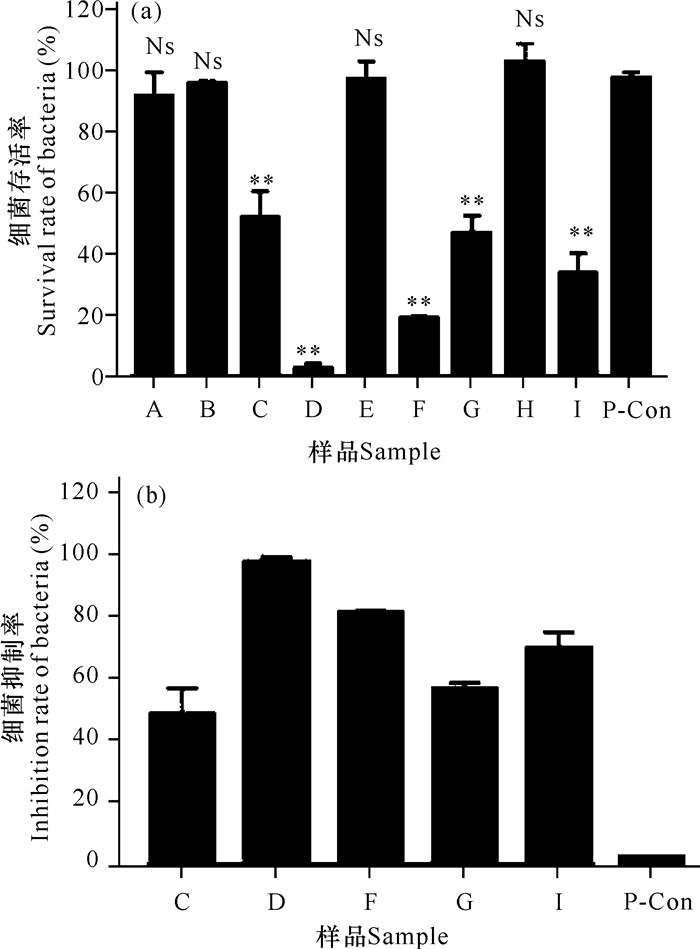
|
| A: 白茅根; B: 薄荷; C: 鹅不食草; D: 威灵仙; E: 鸡骨草; F: 青蒿; G: 栀子; H: 桑叶; I: 田基黄; **:表示与对照组相比差异极显著(P < 0.01);Ns:表示与对照组相比差异不显著 A: Imperatacylindrica, B: Menthae haplocalycis Herba, C: Herba centipedae, D: Clematis chinensis Osbeck, E: Abrus cantoniensis Hance, F: Artemisiae annuae Herba, G: Gardenia jasminoides Ellis, H: Morus alba L., I: Hypericum japonicum Thunb.Ex Murray; **: Indicates extremely different (P < 0.01);Ns: Indicates no significant 图 1 中草药水提物对溶藻弧菌存活率和抑制率的影响 Fig.1 Effects of traditional Chinese medicines water extracts on the survival rate and inhibitor rate of V.alginoly- ticus |
2.2 威灵仙水提物对溶藻弧菌的抑制作用
如图 2所示,当威灵仙水提物浓度大于125 mg/mL时,威灵仙水提物对溶藻弧菌的抑制作用随着浓度的降低而下降;当浓度为125 mg/mL时,对溶藻弧菌的抑制效果最弱,与对照组无显著性差异,其抑制率见图 3a;当浓度为500,250和125 mg/mL时,对溶藻弧菌的抑制率分别为90.09%,37.00%,4.85%;当浓度小于125 mg/mL时,对溶藻弧菌的生长具有促进作用,且在一定范围内随着浓度的升高而降低,在62.5 mg/mL达到最大值,是对照组的2.03倍,见图 3b。

|
| **:表示与对照组相比差异极显著(P < 0.01);Ns:表示与对照组相比差异不显著 **: Indicates extremely different(P < 0.01);Ns: Indicates no significant 图 2 不同浓度威灵仙水提物对溶藻弧菌的抑制效果 Fig.2 Inhibition of different concentrations of C.chinensis Osbeck water extracts on V.alginolysis |
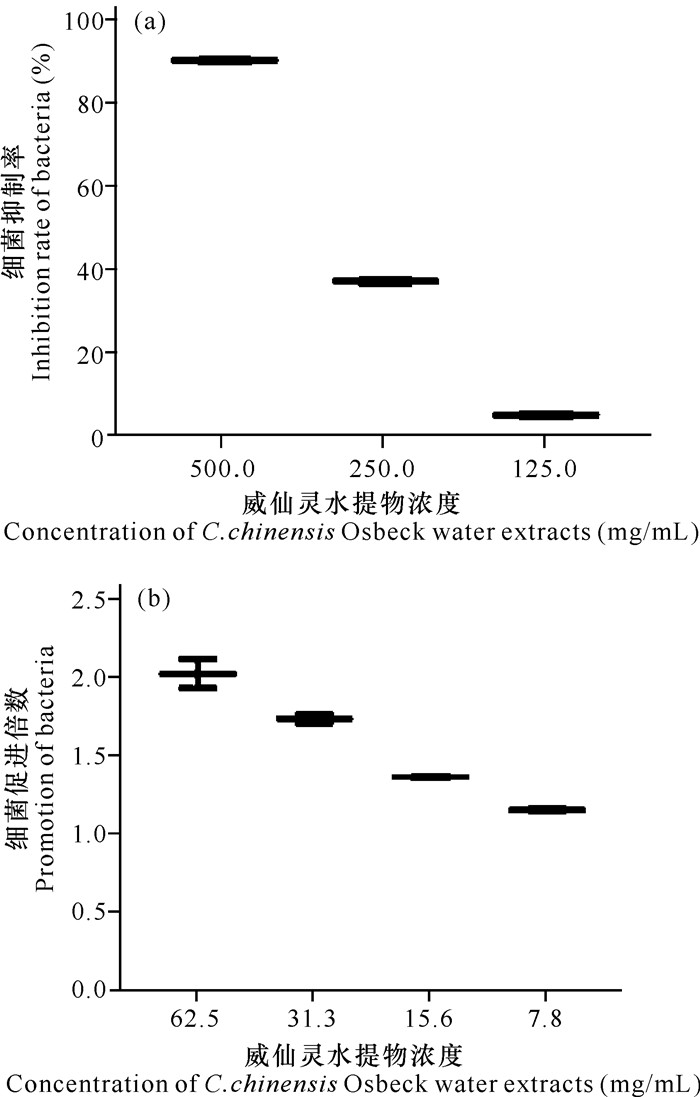
|
| 图 3 威灵仙水提物对溶藻弧菌的作用效果 Fig.3 Effection of C.chinensis Osbeck water extracts on V.alginolysis |
2.3 威灵仙水提物抑菌机制的研究
图 4为溶藻弧菌的生长曲线。由图 4可以看到:在4 h内,溶藻弧菌生长处于对数期,OD600值随着时间的推移逐渐增大;在4 h时,OD600值达到最大,而4 h以后,OD600值达到稳定,且到达了平稳期。

|
| 图 4 溶藻弧菌生长曲线 Fig.4 Growth curve of V.alginolyticus |
图 5为威灵仙水提物对溶藻弧菌胞内LDH释放量的影响。图 5a为不同时间OD490的变化,可以看出对照组OD490随着时间延长而增加,在6 h达到最大值,随后在8 h时出现下降趋势,但各实验组OD490均低于对照组,且随着时间的推移释放量逐渐减弱。图 5b为各实验组胞内LDH的释放量,其中2, 4, 6, 8 h的LDH释放量分别为24.11, 9.21, 7.43, 7.44 mU/mL。

|
| 图 5 威灵仙水提物对溶藻弧菌胞内LDH的影响 Fig.5 Effects of intracellular LDH in V.alginolysis by C.chinensis Osbeck water extracts |
3 讨论
中草药是我国文化的瑰宝,临床使用从古至今已有几千年的历史。冯锐基等[20]研究发现:五倍子对溶藻弧菌的抑菌圈直径为(16.37±0.14) mm,MIC和MBC均为6.25 mg/mL;石榴皮对溶藻弧菌的抑菌圈直径为(12.37±0.06) mm,MIC和MBC分别为12.50, 25.00 mg/mL。李赫等[21]研究发现:茯苓对嗜水气单胞菌的MIC为15.63 mg/mL,小茴香、昆布和姜黄对嗜水汽单胞菌的MIC均为31.25 mg/mL;丁香和黄芪对类志贺邻单胞菌的MIC分别为31.25和62.5 mg/mL。这些研究结果均表明中草药对溶藻弧菌有很好的抑制效果。本研究结果显示,9种中草药对溶藻弧菌均有一定的抑制效果,其中鹅不食草、威灵仙、青蒿、栀子、田基黄均有抑制溶藻弧菌的作用,而且威灵仙、青蒿、栀子、田基黄可以达到半致死浓度(抑制率大于50%),尤以威灵仙的抑菌效果最好。结果与前人研究报道一致,说明有很多中草药对溶藻弧菌均可以产生很好的抑制作用。
在不同浓度威灵仙水提物对溶藻弧菌的抑制作用研究中,当水提物浓度为500 mg/mL时,其对溶藻弧菌的抑制率可达到90.09%(当抑制率大于90%时即达到细菌致死浓度),故500 mg/mL为威灵仙水提物对溶藻弧菌的致死浓度。在一定浓度范围内,威灵仙水提物对溶藻弧菌的抑制率随着浓度降低而降低,当浓度为125 mg/mL时抑制率最低,仅为5.29%,与对照组无显著性差异;在本实验中,威灵仙水提物浓度小于125 mg/mL时,其对溶藻弧菌的生长起促进作用(在62.5 mg/mL时促进效果最明显,是对照组的2倍),且在一定浓度范围内,随着浓度的降低其促进效果逐渐降低,在7.8 mg/mL时达到最低值,仅为对照组的1.15倍。也就是说,在250-500 mg/mL时,威灵仙水提物对溶藻弧菌具有很好的抑制作用;当浓度低于125 mg/mL时,威灵仙水提物具有促进溶藻弧菌生长的作用,且当浓度低于62.5 mg/mL时,随着浓度的降低促进效果逐渐减弱。Liu等[22]使用金银花水提物及其单体对石斑鱼虹彩病毒进行抑制作用研究,结果发现也存在浓度依赖性——随着浓度的降低抗病毒效果逐渐减弱。徐晓津等[23]研究发现,复方中草药对溶藻弧菌有较好的抑制作用,且具有浓度依赖性。以上结果均与本实验结果一致, 可见威灵仙具有潜在的抑制溶藻弧菌的作用,且具有一定的浓度依赖性。
中草药对细菌的抑制作用机制有很多种[24],本研究通过对乳酸脱氢酶的释放量来判定其作用方式。LDH是糖代谢通路中重要的限速酶之一,是连接各种细胞代谢的枢纽,直接和间接地激活信号传导途径和调控免疫应答[25],所以胞内LDH的含量可以直接反映细胞的存活状态,被看作是细胞膜完整性的重要指标。从图 5a可以看出,在不同时间点,对照组OD490值一直保持一个平稳上升的趋势,在6 h达到最大值,而8 h则出现一定的下降趋势,说明在前6 h细菌一直在稳定地生长,所以胞内LDH含量逐渐上升,但在8 h细菌生长已经达到稳定期,细菌生存环境下降,导致部分细菌死亡,故而胞内LDH含量降低,这与其生长曲线结果(图 4)一致。图 5b是加入威灵仙水提物的实验组,可以看到胞内LDH含量明显低于对照组,这可能是由于威灵仙水提物对细菌的细胞膜产生了一定的破坏,导致胞内LDH流失,LDH含量降低,并且在4, 6, 8 h胞内LDH的含量基本达到一个稳定的状态,可见随着时间的推移细菌已被部分杀死,或者已经没有细菌继续生长,故LDH的释放量逐渐减弱或趋于平稳。这就说明威灵仙水提物对溶藻弧菌的抑制作用体现在细胞膜的破坏上,这种破坏效应导致了胞内的LDH大量释放。综上,威灵仙是一种发展绿色高效抗致病性溶藻弧菌制剂的潜在药物,未来我们将进一步系统研究威灵仙对水产动物其他致病菌的作用,同时致力于活体水平研究威灵仙对机体免疫力的调控作用。
4 结论本研究证实了威灵仙水提物对致病性溶藻弧菌具有抑制作用,并对其抗菌机制进行了研究。通过二倍稀释法,确定了威灵仙水提物对溶藻弧菌的致死浓度为500 mg/mL,最小抑菌浓度为250 mg/mL;通过检测胞内LDH含量,确定威灵仙水提物对溶藻弧菌的致死机制可能是通过破坏其细胞膜,使细胞内容物释放从而引起菌体裂解。因此,威灵仙有望发展成为一种高效抗水产病原菌的中草药制剂。
| [1] |
FOUZ B, AMARO C. Isolation of a new serovar of Vibrio vulnificus pathogenic for eels cultured in freshwater farms[J]. Aquaculture, 2003, 217: 677-682. DOI:10.1016/S0044-8486(02)00200-4 |
| [2] |
LI P F, ZHOU L L, NI S W, et al. Establishment and characterization of a novel cell line from the brain of golden pompano (Trachinotus ovatus)[J]. Vitro Cellular & Developmental Biology Animal, 2016, 52(4): 410-418. DOI:10.1007/s11626-015-9988-6 |
| [3] |
余庆, 李菲, 王一兵, 等. 广西北部湾大宗海水养殖鱼类卵形鲳鲹感染溶藻弧菌及其致病性研究[J]. 广西科学, 2018, 25(1): 68-73. |
| [4] |
李远友, 李孟孟, 汪萌, 等. 卵形鲳鲹营养需求与饲料研究进展[J]. 渔业科学进展, 2019, 40(1): 167-177. |
| [5] |
YU Q, LIU M Z, WEI S N, et al. Research progress and prospects for the use of aptamers in aquaculture biosecurity[J]. Aquaculture, 2021, 534(10): 736257. |
| [6] |
LI P, YU Q, LI F, et al. First identification of the nervous necrosis virus isolated from cultured golden pompano (Trachinotus ovatus) in Guangxi, China[J]. Journal of Fish Diseases, 2018, 41(7): 1177-1180. DOI:10.1111/jfd.12805 |
| [7] |
YU Q, LIU M, WEI S, et al. Research progress and prospects for the use of aptamers in aquaculture biosecurity[J]. Aquaculture, 2021, 534: 736257. DOI:10.1016/J.AQUACULTURE.2020.736257 |
| [8] |
NASCIMENTO S, VIEIRA R, THEOPHILO G, et al. Vibrio vulnificus as a health hazard for shrimp consumers[J]. Revista do Instituto de Medicina Tropical de São Paulo, 2001, 43(5): 263-266. DOI:10.1590/S0036-46652001000500005 |
| [9] |
YU Q, LI F, WANG Y B, et al. Isolation, identification and pathogenicity of Vibrio alginolyticus from marine cultured Trachinotus ovatus in Beibu Gulf, Guangxi[J]. Guangxi Sciences, 2018, 25(1): 68-73. |
| [10] |
陈强, 鄢庆枇, 马甡. 溶藻弧菌致病性研究进展[J]. 水产科学, 2006, 30(8): 83-89. |
| [11] |
HÖRMANSDORFER S, WENTGES H, NEUGEBA-UR-BVCHLER K, et al. Isolation of Vibrio alginolyticus from seawater aquaria[J]. International Journal of Hygiene and Environmental Health, 2000, 203(2): 169-175. DOI:10.1078/S1438-4639(04)70024-3 |
| [12] |
SCHMIDT U, CHMEL H, COBBS C. Vibrio alginolyticus infections in humans[J]. Journal of Clinical Microbiology, 1979, 10(5): 666-668. DOI:10.1128/jcm.10.5.666-668.1979 |
| [13] |
LEE K K. Pathogenesis studies on Vibrio alginolyticus in the grouper, Epinephelus malabaricus, Bloch et Schneider[J]. Microbial Pathogenesis, 1995, 19(1): 39-48. DOI:10.1016/S0882-4010(85)90000-2 |
| [14] |
GÓMEZ-LEÓN J, VILLAMIL L, LEMOS M L, et al. Isolation of Vibrio alginolyticus and Vibrio splendidus from aquacultured carpet shell clam (Ruditapes decussatus) larvae associated with mass mortalities[J]. Appl Environ Microbiol, 2005, 71(1): 98-104. DOI:10.1128/AEM.71.1.98-104.2005 |
| [15] |
陈昌福. 我国水产养殖动物病害防治研究的主要成就与当前存在的问题[J]. 饲料工业, 2007(10): 1-3. |
| [16] |
HAI N. The use of probiotics in aquaculture[J]. Journal of Applied Microbiology, 2015, 119(4): 917-935. |
| [17] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [18] |
SONG S K, BECK B R, KIM D, et al. Prebiotics as immunostimulants in aquaculture: A review[J]. Fish Shellfish Immunol, 2014, 40(1): 40-48. DOI:10.1016/j.fsi.2014.06.016 |
| [19] |
CARBONE D, FAGGIO C. Importance of prebiotics in aquaculture as immunostimulants.Effects on immune system of Sparus aurata and Dicentrarchus labrax[J]. Fish Shellfish Immunol, 2016, 54: 172-178. DOI:10.1016/j.fsi.2016.04.011 |
| [20] |
冯锐基, 庞欢瑛, 黄郁葱, 等. 五倍子和石榴皮对溶藻弧菌及其生物膜的体外抑制作用[J]. 安徽农业科学, 2016, 44(11): 1-3, 11. DOI:10.3969/j.issn.0517-6611.2016.11.001 |
| [21] |
李赫, 胡宗云, 张健, 等. 16种中草药提取物对2株草鱼致病菌的体外抑杀菌作用[J]. 水产学杂志, 2018, 31(2): 41-45. DOI:10.3969/j.issn.1005-3832.2018.02.008 |
| [22] |
LIU M Z, YU Q, YI Y, et al. Antiviral activities of Lonicera japonica Thunb.Components against grouper iridovirus in vitro and in vivo[J]. Aquaculture, 2020, 519: 734882. DOI:10.1016/j.aquaculture.2019.734882 |
| [23] |
徐晓津, 李秀华, 马一帆, 等. 49味中药及其复方与抗生素对溶藻弧菌的体外抑菌作用[J]. 广东海洋大学学报, 2019, 39(6): 30-38. DOI:10.3969/j.issn.1673-9159.2019.06.005 |
| [24] |
李鹏飞, 余庆, 罗永巨, 等. 广西水产疫病防控技术体系建设与水产养殖业高质化生态发展展望[J]. 广西科学院学报, 2019, 35(3): 161-165. |
| [25] |
周文丽, 缪明永. 乳酸脱氢酶与肿瘤免疫代谢研究进展[J]. 肿瘤代谢与营养电子杂志, 2020, 7(4): 396-401. |



