甘蔗渣由纤维素、半纤维素和木质素组成,所占比例依次约为45%,26%和23%。目前蔗渣这一丰富资源主要用于造纸,现有的蔗渣制浆造纸技术仅能利用其中的纤维素,因此需要预处理去除蔗渣中的半纤维素和木质素。而蔗渣预处理过程会产生大量难处理的黑液废水,对环境造成重大污染,制约着企业的发展。蔗渣是广西资源丰富且集中的生物炼制原料,如能实现蔗渣资源的价值最大化,则有助于制糖企业的有效升级。
木糖醇是一种五碳糖醇,在食品、医药和化工等领域具有广泛应用。酵母发酵半纤维素水解物生产功能性甜味剂木糖醇[1, 2],是有效利用半纤维素资源生产高附加值产品的重要途径。20世纪70年代工业上即开始使用生物合成法生产木糖醇,该方法具有环境污染小、反应条件温和、反应底物糖浆不需纯品等优点。蔗渣中的木糖含量约为24%,将含多缩戊糖的蔗渣经稀酸水解后获得木糖水解物,利用微生物可将水解物中的木糖直接转化为木糖醇[3]。
稀酸目前仍然是制备半纤维素水解物最重要的催化剂,但在稀酸水解过程会生成一系列的微生物代谢抑制物[4, 5],这些抑制物不但会抑制细胞生长,而且还是产醇效率限速因子。要使木糖醇发酵工艺具备商业竞争力,必须去除半纤维素水解物中的抑制物,改善发酵性能。半纤维素水解物中的酵母代谢抑制物主要包括小分子酸(如甲酸、乙酸、阿魏酸等)、呋喃衍生物(如糠醛、5-羟甲基糠醛等)、酚类(如香草醛、愈创木酚等)[4-13]。理化脱毒是改善水解物木糖醇发酵性能的方法之一。张厚瑞等[3]在pH值为2的条件下,使用大孔树脂对蔗渣稀硫酸水解物进行处理,处理后的水解物木糖浓度为200 g·L-1时,酵母菌株Candida tropicalis AS2.1776发酵110 h后耗完基质中的木糖,生成木糖醇127 g·L-1,产物转化率为0.64(木糖醇g/木糖g),产物生成速率为1.15 g·L-1·h-1。虽然通过理化方法可去除这些有毒物质,但是理化方法普遍存在产生新的污染物的缺点,如吸附抑制物的大孔树脂需要使用酸或碱再生,会产生酸碱废水等。另外,单一的理化方法并不能有效去除化学性质不同的抑制物,而同时结合多种理化方法进行水解物脱毒又会产生过高的成本,降低木糖醇发酵工艺的优势。蔗渣半纤维素稀酸水解物生物脱毒,是利用特定活性的微生物选择性降解去除蔗渣半纤维素稀酸水解物中的抑制物,保留其中主要木糖类物质的脱毒方法,因简捷、环保,该方法已经引起学者的普遍关注。笔者[13]曾报道筛选出木质纤维水解物生物脱毒活性微生物东方伊萨酵母Issatchenkia orientalis S-7,对三大代表性毒物——醋酸、糠醛及酚类化合物均具有降解活性,该菌株对含有三大代表性毒物的木糖糖液进行脱毒后,与对照组比较,其木糖醇发酵性能显著改善。
蔗渣半纤维素稀酸水解物中单一代谢抑制物组分毒性并不高,但组合于水解物中可显著抑制生物脱毒微生物和木糖醇发酵微生物的生长。糠醛、羟甲基糠醛及酚类抑制物的最大吸收波长均位于280 nm附近[12],对比测定东方伊萨酵母S-7生物脱毒前后的水解物在280 nm处的吸光值,以及脱毒水解物的木糖醇发酵性能,根据这些指标的变化即可评价生物脱毒过程这些抑制物的降解情况。因此,本文以细胞干重、紫外吸收光谱特征和木糖醇的产量为指标,系统研究不同条件下利用东方伊萨酵母S-7脱毒后蔗渣半纤维素稀酸水解物的产醇性能变化规律,为蔗渣资源生物定向高值化利用和制糖企业产业升级提供基础资料。
1 材料与方法 1.1 菌种与试剂所用菌株均为本实验室筛选,并保藏于中国典型培养物保藏中心,包括用于生物脱毒的东方伊萨酵母S-7 (Issatchenkia orientalis,CCTCC NO:M 206098)以及用于木糖醇发酵的热带假丝酵母1-18 (Candida troplicalis,CCTCC NO:M 205067)。实验菌株用普通麦芽汁培养基斜面4℃保存。
实验所用试剂、糖类购自中国上海国药化学试剂公司,分析纯;L-550型离心机,湖南湘仪离心机仪器有限公司生产; T6型紫外可见分光光度计, 北京普析通用仪器有限责任公司生产。
1.2 蔗渣半纤维素稀酸水解物的制备参照文献[3]的方法对甘蔗渣进行水解。稀硫酸(浓度为2.4 g·L-1):甘蔗渣=6.2,两者混合浸泡12 h,在蒸汽压力2.5× 104 Pa的条件下水解2.5 h,离心过滤去除残渣。液体部分用Ca(OH)2溶液中和,调整pH值为3.0,然后于85℃水浴保温30 min,离心过滤去除CaSO4沉淀,澄清液即为蔗渣半纤维素水解物。
1.3 培养方法 1.3.1 种子培养种子培养基:葡萄糖50 g·L-1,MgSO4·7H2O 0.2 g·L-1,KH2PO4 5 g·L-1,酵母膏10 g·L-1,自然pH值,121℃灭菌20 min。250 mL三角瓶装入种子培养基50 mL,接入一环菌种,30℃、200 r·min-1条件下培养15 h。
1.3.2 细胞干重曲线种子液转接入木糖醇发酵培养基或蔗渣半纤维素脱毒培养基,待发酵或脱毒结束。取100 mL发酵液,4 000 r·min-1离心10 min,去上清液。沉淀用无菌去离子水洗3次后,添加20 mL无菌去离子水,混匀,依次取1,2,3,4,5 mL加水定容至11 mL;然后分别取1 mL稀释100倍,利用比浊法,使用紫外可见分光光度计于600 nm处测定吸光值OD600。剩余的10 mL菌液于4 000 r·min-1离心10 min,弃上清液,沉淀菌体于100℃烘箱中干燥至恒重。以菌体干重为横坐标,吸光值OD600为纵坐标,绘出细胞干重标准曲线。其中,热带假丝酵母1-18细胞干重标准曲线为Y=X/0.017,东方伊萨酵母S-7细胞干重标准曲线为Y=X/0.013,发酵样品则根据测定的OD600代入标准曲线计算细胞干重。
1.3.3 木糖醇发酵木糖醇发酵培养基:经生物脱毒的蔗渣半纤维素稀酸水解物,在70℃减压条件下真空浓缩至木糖170 g·L-1(或者220 g·L-1),离心除去浓缩过程生成的沉淀。使用前经80℃灭菌30 min,加入已灭菌的尿素5 g·L-1,酵母膏5 g·L-1,补充适量水将培养基木糖稀释至要求浓度。
培养条件:500 mL三角瓶装脱毒水解物100 mL,接入热带假丝酵母1-18种子液10 mL,30℃、200 r·min-1摇床发酵60 h。如果重复利用细胞发酵,则在木糖醇发酵结束后离心分离出热带假丝酵母细胞,并投入到下一批新鲜的浓缩水解物脱毒液中,继续下一轮木糖醇发酵。
1.3.4 蔗渣半纤维素稀酸水解物生物脱毒条件优化 1.3.4.1 尿素用量对生物脱毒微生物细胞生长的影响按照1.2节方法制备蔗渣半纤维素稀酸水解物,用Ca(OH)2调节至pH值为6.0,4 000 r·min-1条件下离心10 min,保留上清液。取上清液100 mL,80℃灭菌30 min,添加100 g·L-1尿素溶液(121℃灭菌15 min)至发酵液中, 使其尿素含量分别为0.0,0.5,1.0,1.5,2.0,2.5,3.0 g·L-1,补充灭菌的去离子水至110 mL,接入东方伊萨酵母S-7种子液10 mL,30℃、200 r·min-1脱毒发酵24 h,使用分光光度比浊法测定细胞密度,根据1.3.2节的细胞干重标准曲线计算细胞干重。
1.3.4.2 初始pH对生物脱毒水解物产醇性能的影响按照1.2节方法制备蔗渣半纤维素稀酸水解物,用Ca(OH)2分别调节初始pH值为4,5,6,7,于4 000 r·min-1条件下离心10 min,留上清液备用。取上清液100 mL,80℃灭菌30 min,添加尿素(按照1.3.4.1节最优用量),接入东方伊萨酵母S-7种子液10 mL,30℃、200 r·min-1脱毒发酵60 h。脱毒结束,4 000 r·min-1离心10 min,取上清液,将上清液浓缩至木糖浓度150 g·L-1,然后进行木糖醇发酵,发酵过程按照1.3.3节操作步骤进行。根据发酵效果,以筛选获得的最优pH条件进行后续试验。
1.3.4.3 浓缩比例对东方伊萨酵母S-7细胞生长的影响在1.3.4.2节优化pH条件下,将蔗渣半纤维素稀酸水解物真空浓缩不同比例之后,分别接种东方伊萨酵母S-7,进行生物脱毒发酵,发酵60 h,取1 mL发酵液用去离子水定容至100 mL混匀后于600 nm处测定吸光值,按照1.3.2节的细胞干重标准曲线计算细胞干重。
1.3.4.4 生物脱毒时间对蔗渣半纤维素稀酸水解物产醇性能的影响在1.3.4.3节优化浓缩比例条件下进行蔗渣半纤维素稀酸水解物生物脱毒,500 mL三角瓶装量蔗渣水解物100 mL,接入东方伊萨酵母S-7种子液10 mL,共13份,30℃、200 r·min-1摇床脱毒发酵,每5 h取出1份样本,于4 000 r·min-1离心10 min,移取1 mL上清液于280 nm测定吸光值A280[12],用K表示蔗渣半纤维素稀酸水解物总的紫外吸收物的去除比例,其计算公式如下:
| $ K(\%)=\left(1-\frac{A_{280}(\text { 生物脱毒后的样本 })}{A_{280}(\text { 生物脱毒前的样本 })} ~~~~~~~~~~\times\right.\\ ×100\%。$ |
脱毒水解物按照1.3.3节方法进行木糖醇发酵,其中木糖发酵起点浓度为150 g·L-1。
1.3.4.5 循环利用细胞对东方伊萨酵母S-7脱毒发酵的影响在1.3.4.4节优化生物脱毒时间条件下进行蔗渣半纤维素稀酸水解物生物脱毒,连续6次循环利用细胞进行脱毒发酵,检测发酵耗时和细胞干重的变化情况。
1.4 热带假丝酵母1-18连续发酵生产木糖醇按照1.3.4.4节优化的条件用东方伊萨酵母S-7将蔗渣半纤维素水解物脱毒40 h,然后适当浓缩脱毒水解物后,调节至水解物木糖的发酵起点浓度为150 g·L-1或200 g·L-1,按照1.3.3节培养条件进行木糖醇发酵,循环利用热带假丝酵母1-18连续发酵4代。
1.5 检测方法参照文献[14]方法制备高效液相检测样本。
木糖和木糖醇检测方法。仪器:Waters 510高效液相色谱仪和示差折光检测器,色谱柱:BC-100碳水化合物Ca2+柱,流动相:超纯水,流速:1 mL·min-1,色谱柱保温温度:85℃,进样量:20 μL。
紫外吸收物检测:蔗渣半纤维素稀酸水解物的紫外吸收物含量,是评价有毒成分含量的一个重要指标[15]。糠醛[16]、芳香醛和酚类[17]在280 nm处有最大吸收值,因而在280 nm处测定吸光值。甘蔗渣半纤维素稀酸水解物生物脱毒结束,脱毒水解物离心并经滤纸过滤去除菌体,上清液用分光光度计于280 nm处测定吸光值。
2 结果与分析 2.1 尿素用量对东方伊萨酵母S-7生长的影响将蔗糖半纤维素稀酸水解物进行预处理脱毒发酵,结果表明当尿素用量达到2 g·L-1后,东方伊萨酵母S-7的细胞干重达到最大值,再增加尿素用量,细胞干重基本不再增加(图 1)。因而后续试验选择2 g·L-1作为水解物脱毒时的尿素添加量。
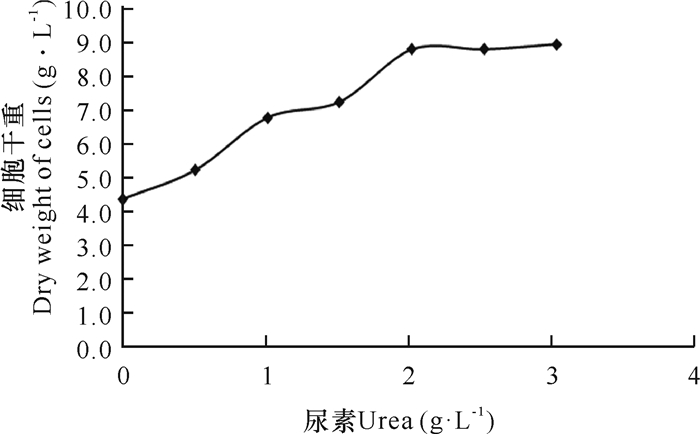
|
| 图 1 尿素添加量对东方伊萨酵母S-7细胞生长的影响 Fig.1 Effect of urea add amout on the growth of I.orientalis S-7 cells |
2.2 初始pH值对生物脱毒水解物产醇性能的影响
在不同初始pH条件下脱毒60 h后,对脱毒的蔗渣半纤维素稀酸水解物进行木糖醇试验,结果如表 1所示。在pH值为5.0条件下,生物脱毒处理的蔗渣半纤维素稀酸水解物产醇性能最佳,热带假丝酵母1-18发酵木糖醇产量最高达129.8 g·L-1,比pH值为3.0条件下生物脱毒的水解物木糖醇产量增加24.6 g·L-1。
| 生物脱毒初始pH值 Initial pH in bio- detoxification |
木糖利用率 Xylose utilization (%) |
木糖醇产量 Xylitol yield (g·L-1) |
细胞干重 Dry weight of cells (g·L-1) |
| 3 | 78.3 | 105.2 | 12.70 |
| 4 | 82.3 | 117.0 | 20.57 |
| 5 | 90.2 | 129.8 | 21.17 |
| 6 | 87.3 | 120.5 | 21.17 |
| 7 | 83.2 | 112.5 | 21.18 |
2.3 浓缩比例对东方伊萨酵母S-7细胞生长的影响
随着浓缩比例增加,东方伊萨酵母S-7细胞生长生物量先增加后降低,可知真空浓缩过程能逐步去除挥发性毒物组分。当水解物浓缩至原体积50%时,脱毒细胞生长最旺盛,细胞干重最大,细胞繁殖速度增加1倍;后续继续浓缩,东方伊萨酵母S-7细胞数量减少,可知不挥发毒物浓度增加,限制脱毒菌的生长(图 2)。

|
| 图 2 浓缩比例对东方伊萨酵母S-7细胞生长的影响 Fig.2 Effects of concentration ratio on the growth of I.orientails S-7 cells |
2.4 生物脱毒时间对蔗渣半纤维素稀酸水解物产醇性能的影响
在东方伊萨酵母S-7脱毒发酵过程中,连续检测水解物280 nm处的吸光值(用A280表示),结果显示初期的A280随脱毒时间延长而不断下降(图 3);当脱毒发酵至40 h,蔗渣半纤维素水解物A280由初始的3.121降至1.616。此后继续延长发酵时间,A280不再明显下降。
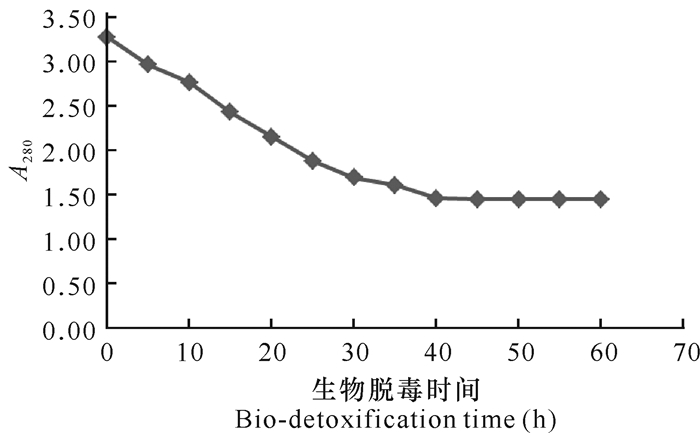
|
| 图 3 不同脱毒时间下东方伊萨酵母S-7降解蔗渣水解物中的280 nm紫外吸收物的变化趋势 Fig.3 Variation trend of 280 nm ultraviolet absorber in bagasse hydrolysate degraded by I.orientails S-7 under different detoxification time |
结合图 3水解物的280 nm处紫外吸收值,可知当东方伊萨酵母对蔗渣半纤维素稀酸水解物脱毒40 h时, 280 nm紫外吸收值降至最低,此时的紫外吸收物去除比例最大,用Kmax表示。根据1.3.4.4节公式计算Kmax≈55.4%,即280 nm处的紫外吸收物总量的55.4%可以被东方伊萨酵母S-7降解,剩余45.6%是东方伊萨酵母S-7不能降解或不易降解的。经过40 h的脱毒发酵,蔗渣半纤维素稀酸水解物的K值已经达到Kmax(55.4%),继续延长脱毒发酵时间并测定其A280已不必要。
收集经东方伊萨酵母S-7不同脱毒时间处理的蔗渣半纤维素稀酸水解物,用热带假丝酵母1-18进行木糖醇发酵。结果表明,蔗渣半纤维素稀酸水解物的木糖醇发酵性能随生物脱毒时间的延长而提高(表 2),当脱毒发酵超过40 h,其K值达到Kmax后,热带假丝酵母木糖醇发酵产量最高达134.5 g·L-1,继续延长脱毒发酵时间并不能增加热带假丝酵母1-18的木糖醇发酵产量。
| 生物脱毒时间 Bio-deto- xification time (h) |
木糖利用率 Xylose utilization (%) |
木糖醇产量 Xylitol yield (g·L-1) |
细胞干重 Dry weight of cells (g·L-1) |
| 0(对照Contrast) | 68.1 | 64.5 | 12.70 |
| 5 | 75.0 | 73.5 | 14.30 |
| 10 | 82.3 | 89.7 | 17.80 |
| 15 | 93.3 | 107.0 | 20.57 |
| 20 | 94.2 | 109.8 | 21.17 |
| 25 | 94.8 | 110.5 | 21.17 |
| 30 | 95.0 | 112.5 | 21.18 |
| 35 | 95.1 | 112.5 | 21.77 |
| 40 | 95.3 | 134.5 | 22.98 |
| 45 | 95.3 | 125.7 | 22.30 |
| 50 | 95.4 | 125.5 | 22.34 |
| 55 | 97.2 | 123.2 | 22.20 |
| 60 | 97.5 | 123.0 | 22.20 |
2.5 循环利用细胞对脱毒发酵的影响
如图 4所示,随着循环利用细胞的次数增加,细胞密度增加,所需要的脱毒时间缩短。因此,只要所用的酵母细胞没有丧失降解毒物的活性,循环利用细胞不仅节约了细胞增殖时间,而且高的初始细胞密度也降低了单位细胞接触毒物的量。这种效应的累加大幅度缩短脱毒所需要的时间。
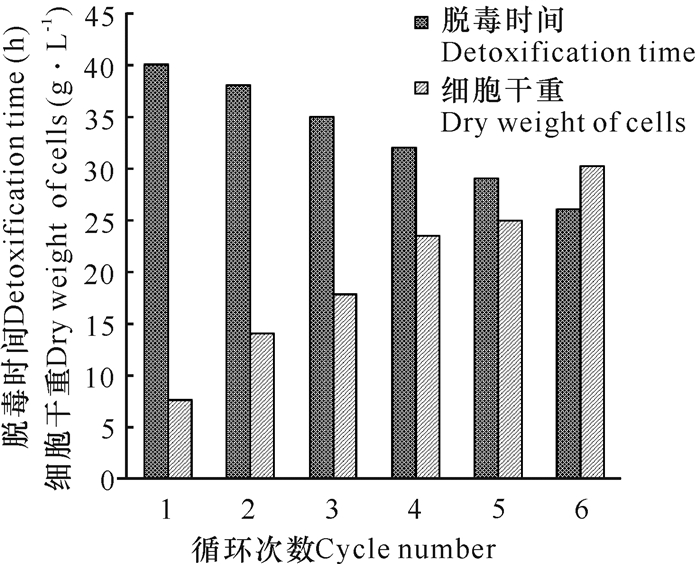
|
| 图 4 循环利用细胞对东方伊萨酵母S-7脱毒耗时和细胞干重的影响 Fig.4 Effect of recycling cells on bio-detoxification time and cell dry weight of I.orientails S-7 |
2.6 热带假丝酵母1-18连续发酵生物脱毒水解物生产木糖醇
如表 3所示,低密度接种热带假丝酵母1-18,起点木糖浓度150 g·L-1,耗时66 h,木糖醇生成速率达到1.95 g·L-1·h-1;循环利用细胞,从第3代起木糖浓度增加至200 g·L-1,木糖醇生成速率提高2倍,到第4代时木糖醇产量达163.8 g·L-1。
| 发酵代数 Fermentation algebra |
木糖浓度 Xylose concentration (g·L-1) |
木糖利用率 Xylose utilization (%) |
木糖醇产量 Xylitol yield (g·L-1) |
木糖醇 生成速率 Xylitol production rate (g·L-1·h-1) |
细胞干重 Dry weight of cells (g·L-1) |
发酵耗时 Fermentation time (h) |
| 第1代 1st Generation |
150 | 92.1 | 128.7 | 1.95 | 20.1 | 66 |
| 第2代 2st Generation |
150 | 93.3 | 134.4 | 2.40 | 24.2 | 56 |
| 第3代 3st Generation |
200 | 94.2 | 153.4 | 3.56 | 29.0 | 43 |
| 第4代 4st Generation |
200 | 94.8 | 163.8 | 5.85 | 30.2 | 28 |
3 讨论
木质纤维稀酸水解物中存在复杂的代谢毒物。卫力等[4]证明半纤维素水解物中的微生物代谢毒物(甲酸、乙酸、糠醛、苯甲醛、香草醛、愈创木酚、对羟基苯甲酸等)对木糖醇发酵菌热带假丝酵母1-18存在毒害作用,使得木糖醇产量显著降低,水解物毒物含量越高,木糖醇产量越低。Bruno等[18]研究证实西伊萨酵母可降解蔗渣水解物中的毒物,脱毒24 h后,毒物降低的浓度分别为丁香醛66.67%、阿魏酸73.33%、糠醛62%以及5-羟甲基糠醛85%。笔者[13]前期研究证实东方伊萨酵母S-7能同时降解半纤维素水解物中的乙酸、糠醛、香草醛、酚性物(没食子酸,苯酚),抑制物降解后的木糖醇发酵性能显著改善。邹韫智[19]研究发现季氏毕赤酵母Pichia guilliermondii对抑制物有较好的耐受性,并能迅速降解水解液中的糠醛、羟甲基糠醛。酿酒酵母 Saccharomyces cerensiae、构巢曲霉菌Aspergillus nidulans、煤油霉菌Amorphotheca resinae、木生锥毛壳菌Coniochaeta ligniaria等微生物均具备降解木质纤维水解物中的甲酸、糠醛、羟甲基糠醛的性能,并改善水解物乙醇或木糖醇发酵性能[20-27]。可见利用微生物进行生物脱毒是可行的,不会产生二次污染,可提高木质纤维水解物中糖分利用率。
生物脱毒改善水解物发酵性能尽管取得不错效果,但现有的单一或组合微生物,不能将水解物中的抑制物组分彻底降解或转化为无毒物质,而且生物脱毒过程耗时长,水解物中的有效糖分含量低。因此生物脱毒技术有待进一步优化,建议从以下3个方面展开研究:(1)继续筛选耐更高浓度毒物、降解毒物效率更高的活性微生物,以减少生物脱毒过程的发酵能耗;(2)筛选耐高浓度非挥发性抑制物的脱毒微生物或乙醇、木糖醇发酵菌种,减少脱毒的发酵体积,同时减少乙醇或木糖醇发酵的体积,提高产物浓度,降低能耗;(3)利用现有的乙醇或木糖醇发酵菌与脱毒微生物基因进行重新组装,构建同时具备脱毒和产乙醇或木糖醇的基因工程菌,减少发酵步骤, 降低能耗。
4 结论本研究进一步证实东方伊萨酵母S-7可有效降解蔗渣半纤维素稀酸水解物中的抑制物。将蔗渣半纤维素稀酸水机物初始pH值调节至5.0,添加2 g·L-1尿素,脱毒40 h,水解物木糖醇(134.5 g·L-1)发酵性能显著改善(空白对照组64.5 g·L-1)。循环利用细胞进行生物脱毒,起到驯化细胞的目的,脱毒细胞浓度增加,脱毒时间由原来的40 h减至27 h。热带假丝酵母1-18连续发酵脱毒水解物生产木糖醇的速率提高2倍。
| [1] |
石志海. 甘蔗渣生产木糖醇工艺的探讨[J]. 轻工科技, 2012(3): 12-13. |
| [2] |
DE ALBUQUERQUE T L, DA SILVA I J, DE MACEDO G R, et al. Biotechnological production of xylitol from lignocellulosic wastes:A review[J]. Process Biochemistry, 2014, 49(11): 1779-1789. DOI:10.1016/j.procbio.2014.07.010 |
| [3] |
张厚瑞, 曾健智, 何成新, 等. 酵母发酵蔗渣半纤维素水解物生产木糖醇[J]. 生物工程学报, 2006, 18(6): 723-728. |
| [4] |
卫力, 经艳, 林卫军, 等. 7种抑制物对热带假丝酵母木糖醇发酵性能的影响[J]. 广西科学, 2008, 15(4): 424-430. |
| [5] |
经艳, 周玉恒, 覃香香, 等. 甘蔗叶汽爆液中挥发性微生物生长抑制物的鉴定[J]. 食品与发酵工业, 2008, 34(11): 29-32. |
| [6] |
LUO C, BRINK D L, BLANCH H W. Identification of potential fermentation inhibitors in conversion of hybrid poplar hydroly-sate to ethanol[J]. Biomass and Bioenerg, 2001, 22(2): 125-138. |
| [7] |
庄军平, 林鹿, 庞春生, 等. 木质纤维素稀水解液脱毒研究进展[J]. 现代化工, 2009, 29(2): 19-23. |
| [8] |
TAHERZADEH M J, NIKLASSON C, LIDÉN G. Acetic acid-friend or foe in anaerobic batch conversion of glucose to ethanol by Saccharomyces cerevisiae?[J]. Chemical Engineering Science, 1997, 52(15): 2653-2659. DOI:10.1016/S0009-2509(97)00080-8 |
| [9] |
TAHERZADEH M J, NIKLASSON C, LIDÉN G. On-line control of fed-batch fermentation of dilute-acid hydrolyzates[J]. Biotechnology and Bioengineering, 2000, 69(3): 330-338. DOI:10.1002/1097-0290(20000805)69:3<330::AID-BIT11>3.0.CO;2-Q |
| [10] |
LARSSON S, PALMQVIST E, HAHN-HÄGERDAL B, et al. The generation of fermentation inhibitors during dilute acid hydrolysis of softwood[J]. Enzyme and Microbial Technology, 1999, 24(3/4): 151-159. |
| [11] |
ZHUNG J P, LIU Y, WU Z, et al. Hydrolysis of wheat straw hemicelllose and detoxification of hydrolysate for xylitol production[J]. BioResources, 2009, 4(2): 674-686. |
| [12] |
CANILHA L, ALMEIDA E SILVA J B, SOLENZAL A I N, et al. Eucalyptus hydrolysate detoxification with activated charcoal adsorption or ion-exchange resins for xylitol production[J]. Process Biochemistry, 2004, 39(12): 1909-1912. DOI:10.1016/j.procbio.2003.09.009 |
| [13] |
覃香香, 张厚瑞, 蔡爱华, 等. 东方伊萨酵母降解木糖醇发酵抑制物的研究[J]. 广西科学, 2010, 17(4): 358-362. |
| [14] |
苗露, 周玉恒, 张厚瑞, 等. 蔗渣木聚糖含量检测方法的比较[J]. 食品科学, 2016, 37(16): 162-168. |
| [15] |
DOMINGUEZ J M, CAO N J, GONG C S, et al. Diluteacid hemicellulos hydrolysates from corn cobs for xylitol production by yeast[J]. Bioresource Technology, 1997, 61(1): 85-90. DOI:10.1016/S0960-8524(97)84703-7 |
| [16] |
CARVALHEIRO F, DUARTE L C, LOPES S, et al. Evaluation of the detoxification of brewery's spent grain hydrolystae for xylitol production by Debaryomyces hansenii CCMI941[J]. Process Biochemistry, 2005, 40(3/4): 1215-1233. |
| [17] |
CARVALHO G B M, MUSSATTO S I, CÂNDIDO E J, et al. Comparison of different procedures for the detoxification of eucalyptus hemicellulosic hydrolysate for use in fermentative processes[J]. Journal of Chemical Technology & Biotechnology, 2006, 81(2): 152-157. |
| [18] |
BRUNO G F, RONDINELE DE O M, FLAVIO DE O F, et al. Biological detoxification of different hemicellulosic hydrolysates using Issatchenkia occidentalis CCTCC M 206097 yeast[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38: 199-207. |
| [19] |
邹韫智.木质纤维素水解液抑制物耐受菌发酵生产木糖醇的研究及产乙醇基因工程探索[D].上海: 上海交通大学, 2009.
|
| [20] |
李丰田, 田沈, 于泳, 等. 酵母菌复合培养物对木质纤维素稀酸水解液原位脱毒乙醇发酵[J]. 太阳能学报, 2009, 30(11): 1582-1586. |
| [21] |
KEATING J D, PANGANIBAN C, MANSFIELD S D. Tolerance and adaptation of ethanologenic yeasts to lignocellulosic inhibitory compounds[J]. Biotechnology and Bioengineering, 2006, 93(6): 1196-206. DOI:10.1002/bit.20838 |
| [22] |
YU Y L, FENG Y J, XU C, et al. Onsite bio-detoxification of steam-exploded corn stover for cellulosic ethanol production[J]. Bioresource Technology, 2011, 102(8): 5123-5128. DOI:10.1016/j.biortech.2011.01.067 |
| [23] |
张建, 楚德强, 于占春, 等. 低水用量约束条件下的高固体含量纤维乙醇生物加工技术策略[J]. 生物工程学报, 2010, 26(7): 950-959. |
| [24] |
朱智楠.木质纤维素来源发酵抑制物的生物降解以及光合发酵制氢[D].上海: 华东理工大学, 2010.
|
| [25] |
ZHANG J, ZHU Z N, WANG X F, et al. Biodetoxification of toxins generated from lignocellulose pretreatment using a newly isolated fungus, Amorphotheca resinae ZN1 and the consequent ethanol fermentation[J]. Biotechnology for Biofuels, 2010, 3: 1-26. DOI:10.1186/1754-6834-3-1 |
| [26] |
LÓPEZ M J, NICHOLS N N, DIEN B S, et al. Isolation of microorganisms for biological detoxification of lignocellulosec hydrolysates[J]. Applied Microbiology and Biotechnology, 2004, 64(1): 125-131. |
| [27] |
NICHOLS N N, SHARMA L N, MOWERY R A, et al. Fungal metabolism of fermentation inhibitors present in corn stover dilute acid hydrolysate[J]. Enzyme and Microbial Technology, 2008, 42(7): 624-630. DOI:10.1016/j.enzmictec.2008.02.008 |



