2. 广西大学轻工与食品工程学院, 广西南宁 530004
2. College of Light Industry and Food Engineering, Guangxi University, Nanning, Guangxi, 530004, China
药用植物是中药材的主要来源,其植株的全部或特定组织中含有特殊药效成分,可作为保健食材或药物,预防和治疗疾病。中国地域辽阔,气候多样,已知植物品种约25.7万种。中国是药用植物资源最丰富的国家之一,第四次全国中药资源普查结果显示,我国有野生药用资源1.3万余种,特有药用植物3 150种[1]。广西具有中药资源7 088种,其中药用植物5 996种,中药资源和药用植物数量目前居全国第一。药用植物产生的特殊(或次生)代谢物,具有丰富的结构和独特的生物活性,是现代药物发现和开发的天然产物库[2]。根据生物合成类型,药用成分可分为萜类、生物碱、苯丙类及其衍生物三大类。
萜类化合物是大部分药用植物的有效成分,是已知最古老、结构最多样化、分子种类最多的次级代谢产物,目前已发现鉴定的萜类化合物超过7万种[3]。萜类化合物在药用植物组织中分布广泛,而且骨架庞杂,结构多样。从化学结构来看,萜类化合物以异戊二烯单元(C5单元)分子骨架为基本结构单元。从生物合成源来看,甲戊二羟酸(Mevalonic Acid,MVA)是其生物合成的关键前体,其分子式符合(C5Hx)n通式。根据异戊二烯单元的数目,萜类化合物可分为半萜、单萜、倍半萜、二萜、二倍半萜、三萜、四萜、多聚萜,如单萜香叶醇(Geraniol)[4]、倍半萜青蒿素(Artemisinin)[5]、二萜雷公藤甲素(Triptolide)[6]、三萜皂苷(Triterpenoid saponins)[7]、四萜类胡萝卜素(Carotenoids)[8]等。萜类化合物药理活性和生物学功能也不尽相同,如青蒿素是抗疟疾药物[9]、紫杉醇是抗癌药物[10]、穿心莲内酯是抗菌消炎药[11]、四环三萜类皂苷(人参皂苷、田七皂苷、绞股蓝皂苷)可提高机体免疫力[12]、罗汉果苷是功能性甜味剂[13]、胡萝卜素类化合物是抗氧化剂[14]。其中,四环三萜类皂苷是人参、西洋参和田七等名贵中药材的主要药效成分,具有抗癌、抗衰老、抗疲劳、抗心律失常、改善记忆力、保护神经和治疗心血管疾病等多种作用。素有“南方人参”“不老长寿药草”美誉的绞股蓝也含有大量的四环三萜类皂苷,具有抗肿瘤、调节血脂和血糖、保护肝脏、抗衰老等多种药理活性。
四环三萜皂苷作为三萜类化合物的重要次生代谢物之一,由6个异戊二烯单元(C5H8)组成其骨架结构。目前,四环三萜类化合物主要从自然生物资源中直接提取纯化获得,该法严重依赖大量生物资源的获取和消耗,面临野生资源匮乏、地域分布窄、人工种植周期长等诸多限制,且提取和纯化过程复杂、成本高昂[15]。例如,7年生人参根部总皂苷含量仅占根部干重的2%左右,一些具有重要药用活性的稀有皂苷含量更是低于十万分之一[16, 17]。四环三萜类化合物结构复杂,含有多个手性中心,化学合成过程中容易形成难以分离的非活性甚至是有毒的光学异构体。此外,其化学合成过程复杂、转化率低、能耗高,所使用的有机溶剂容易对生态环境造成严重污染,难以满足未来可持续绿色工业化的需要[18]。植物组织细胞培养法可以大幅降低植物生长周期、有效避免使用重金属和有机溶剂。然而该方法与常规微生物发酵相比,步骤烦琐、操作复杂、转化率低、细胞生长周期长、成本高昂,难以实现大规模工业化生产[19]。随着高通量测序技术和分子生物学基因编辑技术的逐渐成熟,一条可持续发展的替代途径受到生物科学家们的关注:合成生物学通过整合基因组学、转录组学、代谢组学等多组学研究,利用生物信息学技术挖掘和鉴定传统药用植物活性成分合成途径中涉及的关键基因,阐明天然产物的合成机理;在微生物中模拟药用植物代谢调控网络,设计人工合成途径,构建微生物“人造细胞工厂”;利用廉价的碳源和氮源定向合成高附加值、稀有、特殊用途的天然化合物。随着研究不断深入,合成生物学技术极大地提高了微生物“细胞工厂”生产目标天然产物的能力[20]。因此合理利用合成生物学设计思维,在微生物宿主中重构底盘细胞前体合成途径、引入天然产物关键修饰基因、改造全局代谢网络和产物运输等模块,可实现目标天然产物的高产、稳产[21, 22]。
近年来,药用植物四环三萜类化合物的研究主要集中在提取工艺、成分分析及药理活性方面。随着分子生物学研究的不断深入,药用植物四环三萜皂苷的生物合成途径中的功能基因成为药用植物学研究领域的热点。本文对常见的药用植物四环三萜皂苷的生物合成学研究现状展开论述,重点介绍了以达玛烷型、葫芦烷型、环阿屯烷型为代表的几类化合物的生物合成研究进展,在高效合成四环三萜皂苷,推动药用植物资源可持续利用等方面具有参考意义。
1 药用植物中四环三萜皂苷的生物合成途径三萜类化合物的合成途径有两种:一是细胞质体中的2-甲基赤藓糖-4-磷酸途径(Methylerythritol Phosphate Pathway,MEP),主要参与二萜、单萜、类胡萝卜素、异戊二烯等的生物合成;二是胞浆中的甲羟戊酸途径(Mevalonate Pathway,MVA),主要参与单萜、半倍萜和三萜等次生代谢产物的生物合成。至今,三萜类化合物的生物合成途径逐渐明晰,其生物合成途径可分为3个阶段。
首先,异戊二烯焦磷酸(Cisopentenyl Pyrophosphate,IPP)和二甲基烯丙基焦磷酸(Dimethylallyl Diphosphate,DMAPP)均可通过MVA途径和MEP途径形成,两种途径可以通过交换IPP和DMAPP调节生物体萜类化合物的合成。
其次,牻牛儿基焦磷酸合酶(Geranyl Diphosphate Synthase,GPS)催化IPP和DMAPP,合成牻牛儿基焦磷酸(Geranyl Diphosphate,GPP),IPP与GPP在法呢烯焦磷酸合酶(Farnesyl Pyrophosphate Synthase,FPS)的催化下形成法呢烯焦磷酸酯(Farnesyl Diphosphate,FPP)。随后角鲨烯合酶(Squalene Synthase,SQS)催化FPP头尾结合成角鲨烯(Squalene,SQ),并在鲨烯环氧化酶(Squalene Epoxidase,SQE)的作用下进一步催化形成2, 3-环氧鲨烯(2, 3-Oxidosqualene)。2, 3-环氧鲨烯在不同种类的氧化鲨烯环化酶(Oxidosqualene Cyclases,OSC)的催化下,经环化、重排得到结构多样化的三萜骨架。
最后,经过一系列修饰酶,如细胞色素P450酶(Cytochrome P450 Monooxygenase,CYP450)、糖基转移酶(UDP-Glycosyltransferases,UGT)等进行三萜骨架修饰[23],从而合成结构多样和功能各异的三萜类化合物,具有代表性的药用植物四环三萜皂苷主要包括达玛烷型、葫芦烷型、环阿屯烷型和羊毛脂烷型。
2 常见四环三萜类化合物及其研究现状 2.1 达玛烷型人参、西洋参、田七是传统名贵中药,需要在特定地域条件下生长3—6年才能收获。其主要活性成分是四环三萜皂苷[24],具有抗肿瘤、抗癌、抗心律失常、保护神经、治疗心血管疾病、提高机体免疫力等多种药理活性[25]。素有“南方人参”美誉的绞股蓝中也含有大量四环三萜皂苷[26]。目前已从人参中鉴定出皂苷150多种,从田七中鉴定出70多种,从绞股蓝中鉴定出200多种,这些皂苷以达玛烷型三萜皂苷为主。达玛烷型四环三萜皂苷的共同前体2, 3-环氧鲨烯,首先通过达玛烯二醇合酶(Dammarenediol-Ⅱ Synthase,DS)催化生成达玛烯二醇(Damanediol,DM);其次在细胞色素P450酶(CYP450)的作用下,生成原人参二醇(Protopanaxadiol,PPD)和原人参三醇(Protopanaxatriol,PPT);最后通过糖基转移酶(UGT)进行糖基化修饰,分别在原人参二醇的C3和/或C20位点,原人参三醇的C6和/或C20位点,以及其他位点进行糖基化修饰,进一步分化为不同的人参/田七/绞股蓝皂苷(图 1)。
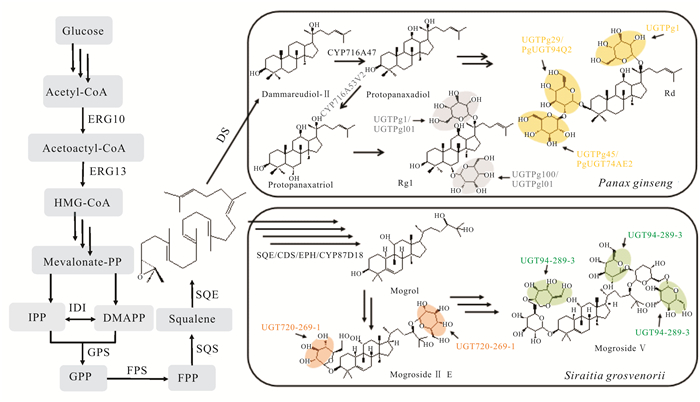
|
| 图 1 人参皂苷及罗汉果苷生物合成途径 Fig.1 Biosynthesis pathway of ginsenoside and mogroside |
王冬等[27]在构建酿酒酵母细胞工厂、优化MVA途径工程菌的基础上,综合运用途径的模块化及组合优化、基因元件筛选、密码子优化、反义RNA技术、发酵工艺等技术策略,通过基因模块组合优化的方法获得由丹参法尼基焦磷酸合酶(SmFPS)和拟南芥鲨烯合酶(AtSQS2)组成的功能模块,显著提高三萜类化合物前体的含量。该课题组首次将三萜合成通量提高到10 g·L-1级别,构建出产量高达15 g·L-1达玛烯二醇的酵母细胞工厂。Jung等[28]对人参转录组进行了测序和组装,鉴定了2个参与人参皂苷生物合成的糖基转移酶(PgUGT74AE2和PgUGT94Q2),随后将这2个糖基转移酶基因与达玛烯二醇合酶(PgDS)和原人参二醇合酶(PgPPDS)基因一起导入酵母细胞,从头合成人参皂苷Rg3。结果表明2个糖基转移酶是人参皂苷Rg3合成的关键酶。
同期,Wang等[29]在人参中克隆并鉴定2个糖基转移酶(UGTPg29和UGTPg45),通过建立2个酵母细胞工厂,以葡萄糖为原料,实现了稀有人参皂苷Rg3和Rh2的人工生物合成。随后该课题组系统地优化了酵母底盘细胞,为前体合成提供充足碳通量,提高C3-OH位点糖基转移酶的表达水平和效率,通过10 L发酵罐补料发酵,人参皂苷Rh2产量达到2.25 g·L-1[30]。
2.2 葫芦烷型罗汉果甜苷是在罗汉果果实中发现的葫芦烷型四环三萜皂苷,近年来在世界各地被广泛用作天然食品甜味剂[31],其本身具有抗炎抗菌、抗肿瘤、降血糖、增强免疫力等多种药理活性。葫芦烷型四环三萜皂苷的共同前体2, 3-环氧鲨烯在葫芦二烯醇合酶(Cucurbitadienol Synthase,CDS)的作用下生成葫芦二烯醇(Cucurbitadienol)。随后,葫芦二烯醇在细胞色素P450酶和糖基转移酶的作用下,依次形成罗汉果醇(Mogrol)和罗汉果苷(Mogroside)(图 1)。研究发现,在罗汉果苷的生物合成途径中,关键酶葫芦二烯醇合酶(SgCDS)是导致其皂苷类合成的第一个限速酶,该酶也是合成途径唯一的环化酶。
Dai等[32]运用RNA测序结合基因表达谱分析,首次鉴定了罗汉果中葫芦二烯醇合酶SgCDS和糖基转移酶UGT74AC1的基因功能。体外活性测定表明,UGT74AC1将UDP-葡萄糖醛酸中的葡萄糖基转移至葫芦烷二烯醇的C3—OH位点,催化葫芦烷二烯醇形成罗汉果苷Ⅰ E (Mogroside Ⅰ E)。随后该课题组成功鉴定与葫芦二烯醇C11位点氧化有关的细胞色素P450酶CYP87D18[33]。体外实验结果证实,CYP87D18可氧化葫芦烷二烯醇C11位,生成11-氧化葫芦二烯醇(11-oxo cucurbitadienol)和11-羟基葫芦二烯醇(11-hydroxy cucurbitadienol)。将SgCDS与CYP87D18在酵母宿主中共表达,得到11-氧化-24, 25-环氧葫芦二烯醇(11-oxo-24, 25-epoxy cucurbitadienol)、11-氧化葫芦二烯醇(11-oxo cucurbitadienol)和11-羟基葫芦二烯醇(11-hydroxy cucurbitadienol),其结构经液相色谱-固相萃取-核磁共振-质谱联用(LC/SPENMR/MS)确证。
Itkin等[34]确定了罗汉果成熟果实中主要甜苷罗汉果苷Ⅴ(Mogroside Ⅴ)的生物合成途径,鉴定了参与罗汉果苷Ⅴ合成途径的5个关键酶家族成员:鲨烯环氧酶(Squalene Epoxidases,SE)、葫芦二烯醇合酶(SgCDS)、环氧化物水解酶(Epoxide Hydrolases,EPH)、细胞色素P450酶(CYP450)和糖基转移酶(UGT)。2, 3-环氧鲨烯(2, 3-oxidosqualene)通过鲨烯环氧酶转化为2, 3-22, 23-二环氧鲨烯(2, 3-22, 23-diepoxysqualene),再经过葫芦二烯醇合酶、环氧化物水解酶及CYP87D18合成葫芦素(Mogrol)。葫芦素再经UGT720-269-1和UGT94-289-3两个糖基转移酶的催化,最后形成罗汉果苷Ⅴ。
Zhao等[35]进一步研究罗汉果皂苷的生物合成途径,采用cDNA末端快速扩增聚合酶链反应(RACE-PCR)的方法,克隆罗汉果鲨烯合酶SgSQS和环阿糖醇合成酶(Cycloartenol Synthase,CAS)的全长cDNA链,推导出的SgSQS蛋白在C末端有两个跨膜区。通过对罗汉果的角鲨烯合成酶SgSQS和环阿糖醇合成酶SgCAS的克隆与鉴定,为进一步研究罗汉果SgSQS蛋白和SgCAS蛋白的基因功能奠定基础。随后,该课题组鉴定罗汉果细胞色素P450酶(CYP450)的基因功能[36]。研究结果表明,罗汉果转录组数据库中有两个全长细胞色素P450还原酶亚型,且SgCPR1和SgCPR2转录结果在罗汉果的所有组织中均可检测到。该表达模式与几种关键酶相似,而且SgCPR1和SgCPR2对NADPH、FAD和FMN都具有一定的活性功能。因此,SgCPR1和SgCPR2都可能参与罗汉果次生代谢,尤其是罗汉果皂苷的生物合成。
葫芦二烯醇作为葫芦烷型四环三萜皂苷合成的关键中间体,其含量在相关药用植物组织中极低。Chiu等[37]利用灵芝菌丝体对罗汉果提取物进行生物转化来富集罗汉果苷Ⅲ E (Mogroside Ⅲ E),通过高效液相色谱-质谱-核磁共振联用技术对灵芝菌丝体的代谢产物进行分析,确定罗汉果苷Ⅲ E为灵芝菌丝体的主要代谢物。该菌通过脱糖反应将罗汉果提取物中丰富的罗汉果苷Ⅴ转化为罗汉果苷Ⅲ E,并检测到高水平的β-葡萄糖苷酶(β-glucosidase)活性。通过动力学模型拟合、动态吸附研究和解吸实验,优化HP-20大孔吸附树脂纯化,获得17.38 g罗汉果苷Ⅲ E,纯度55.14%,回收率74.71%。因此,罗汉果苷生物合成途径的阐明,一定程度上为工程菌的构建及后续的工业化生产奠定了理论和实验基础。
2.3 环阿屯烷型黄芪作为一种重要的药用植物,分布范围广且种类多,主要用于治疗肾炎、糖尿病和癌症,其药理活性包括免疫调节[38]、降血糖[39]、抗氧化[40]和抗病毒[41]等。黄芪具有补气强壮之功效,所含的皂苷、黄酮和多糖被认为是其临床疗效的主要成分。黄芪中分离鉴定出的皂苷大约20种,多数皂苷元为环黄芪醇(Cycloastragenol)[42]。在已知的黄芪生物合成途径中,环阿屯醇是合成黄芪皂苷的主要前体,由2, 3-氧化鲨烯通过环阿屯烷合酶(Cycolartenol Synthase,CS)催化生成。目前,黄芪皂苷的结构和药理特性得到归类,但其应用基础研究尚很薄弱,特别是其药用成分黄芪皂苷类化合物的生物合成途径的解析基础甚少。
黄芪皂苷的结构根据四环三萜骨架的C-17延伸侧链分类。迄今为止,已有文献报道了3种主要的皂苷元结构(Cycloastragenol、Cyclocanthagenol和Cyclocerebrotol)(图 2),它们分别衍生自20, 24-环氧基和20, 25-环氧基侧链[43-45]。李振秋等[46]通过总RNA的提取及逆转录PCR方法,从黄芪中克隆了鲨烯合酶基因cDNA序列。研究发现黄芪鲨烯合酶的氨基酸序列与大豆鲨烯合酶(BAA22559.1)序列相似性达88%。刘玥辉等[47]运用二维核磁共振技术(2D NMR),对黄芪中环阿屯烷型四环三萜皂苷所有核磁共振信号进行准确归属,通过ROESY实验结果确认环阿屯烷型皂苷的相对构型。
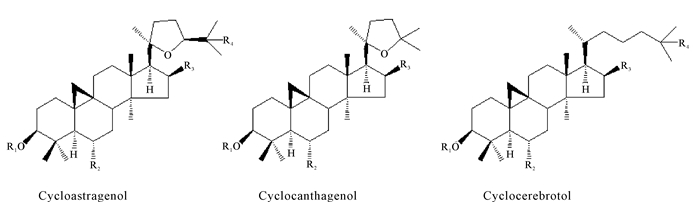
|
| 图 2 黄芪中环阿屯烷型皂苷元结构示意图 Fig.2 Schematic diagram structures of cycloartane sapogenin from Astragalus |
Guo等[48]从黄芪根部分离并鉴定出一个新的环阿屯烷化合物(3β-acetoxy-9β-19-cyclolanost-24E-ene-1α, 16β-diol-27-O-β-d-glucopyranoside),通过质谱分析确定了该化合物结构。Jiao等[49]通过茉莉酸甲酯诱导提高黄芪毛状根培养物中黄芪甲苷(Astragaloside)的产量,并增强其生物合成基因的转录反应。黄芪毛状根培养物在茉莉酸甲酯、水杨酸和乙酰水杨酸诱导下,黄芪甲苷的生物合成增加。通过对所选的诱导条件进行优化,黄芪甲苷最大产量(5.5±0.13) mg/g。此外,该课题组还分析了黄芪甲苷含量与基因表达水平之间的关系,阐明了黄芪甲苷生物合成途径的关键调控点。然而,黄芪皂苷的生物合成途径机制尚未得到完整解析,研究人员需要不断努力,如确定细胞色素P450酶和糖基转移酶下游装饰基因,最终阐明不同个体黄芪皂苷的生物合成机制。
3 展望迄今为止,研究人员已经在药用植物活性代谢产物(如人参皂苷、三七皂苷、绞股蓝皂苷及罗汉果甜苷等)的分子合成机制研究方面取得一定进展,特别是对多基因家族氧化鲨烯环化酶(OSCs)关键酶的基因克隆研究。虽然药用植物四环三萜类化合物的类型众多且结构复杂,但是各成分的提取与结构鉴定都有所突破。同时新型四环三萜类化合物及其衍生物也不断被科学家发现。另外,在四环三萜化类合物的骨架修饰阶段,由于涉及修饰关键酶基因种类数量庞大,官能团反应机制复杂,其具体合成路径的阐明进展缓慢,对特定活性物质的生物合成途径的解析还不够具体,如药用植物黄芪的次级代谢产物黄芪甲苷的生物合成途径解析,尤其是关键修饰酶如细胞色素P450酶、糖基转移酶等的挖掘和鉴定。
因此,未来的研究重点应该是进一步解析更多珍稀四环三萜皂苷的生物合成途径,挖掘与表征系列生物元件,利用酶工程手段提高关键酶的催化效率,优化细胞工厂及发酵条件来提高目标产物的产量和转化率,最终实现药用植物四环三萜类化合物的工业化高效生产。
| [1] |
HUANG L Q.Chinese government in push for sustainable traditional medicine resources[EB/OL].[2020-06-20].https://www.nature.com/articles/d42473-020-00004-3#menu.
|
| [2] |
YANG L, YANG C, LI C, et al. Recent advances in biosynthesis of bioactive compounds in traditional Chinese medicinal plants[J]. Chinese Science Bulletin, 2016, 61(1): 3-17. |
| [3] |
SANDAR M, HARALD P. Identifying and Engineering the Ideal Microbial Terpenoid Production Host[J]. Applied Microbiology and Biotechnology, 2019, 103(14): 5501-5516. DOI:10.1007/s00253-019-09892-y |
| [4] |
BERGMAN M E, CHAVEZ A, FERRER A, et al. Distinct metabolic pathways drive monoterpenoid biosynthesis in a natural population of Pelargonium graveolens[J]. Journal of Experimental Botany, 2020, 71(1): 258-271. |
| [5] |
HASSANI D, FU X, SHEN Q, et al. Parallel transcriptional regulation of artemisinin and flavonoid biosynthesis[J]. Trends in Plant Science, 2020, 25(5): 466-476. DOI:10.1016/j.tplants.2020.01.001 |
| [6] |
NOEL P, VON H, HAN H Y, et al. Triptolide and its derivatives as cancer therapies[J]. Trends in Pharmacological Sciences, 2019, 40(5): 327-341. DOI:10.1016/j.tips.2019.03.002 |
| [7] |
KIM Y J, ZHANG D, YANG D C. Biosynthesis and biotechnological production of ginsenosides[J]. Biotechnology Advances, 2015, 33(6): 717-735. DOI:10.1016/j.biotechadv.2015.03.001 |
| [8] |
MA X, ZHENG B, MA Y, et al. Carotenoid accumulation and expression of carotenoid biosynthesis genes in mango flesh during fruit development and ripening[J]. Scientia Horticulturae, 2018, 237: 201-206. DOI:10.1016/j.scienta.2018.04.009 |
| [9] |
KUMARI A, KARNATAK M, SINGH D, et al. Current scenario of artemisinin and its analogues for antimalarial activity[J]. European Journal of Medicinal Chemistry, 2019, 163: 804-829. DOI:10.1016/j.ejmech.2018.12.007 |
| [10] |
JEONG G W, HONG W G, ANH J H, et al. Anticancer effect of intracellular-delivered paclitaxel using novel pH-sensitive LMWSC-PCL di-block copolymer micelles[J]. Journal of Industrial and Engineering Chemistry, 2019, 70: 136-144. DOI:10.1016/j.jiec.2018.09.049 |
| [11] |
TOREQUL I M, JAMAL U S, SUBRATA S, et al. Andrographolide, a diterpene lactone from Andrographis paniculata and its therapeutic promises in cancer[J]. Cancer Letters, 2018, 420: 129-145. DOI:10.1016/j.canlet.2018.01.074 |
| [12] |
WANG Z C, WANG Z, HUANG W H, et al. Antioxidant and anti-inflammatory activities of an anti-diabetic polysaccharide extracted from Gynostemma pentaphyllum herb[J]. International Journal of Biological Macromolecules, 2020, 145: 484-491. DOI:10.1016/j.ijbiomac.2019.12.213 |
| [13] |
MIDORI T, MURATA Y, SUGIURA M, et al. Anticarcinogenic activity of natural sweeteners, cucurbitane glycosides, from Momordica grosvenorii[J]. Cancer Letters, 2003, 198(1): 37-42. DOI:10.1016/S0304-3835(03)00285-4 |
| [14] |
CARLA M, FRANCISCO J, ISABEL M, et al. Multivariate analyses of a wide selection of orange varieties based on carotenoid contents, color and in vitro antioxidant capacity[J]. Food Research International, 2016, 90: 194-204. DOI:10.1016/j.foodres.2016.11.005 |
| [15] |
王勇. 新本草计划——基于合成生物学的药用植物活性代谢物研究[J]. 生物工程学报, 2017, 33(3): 478-485. |
| [16] |
SHOJI S. Chemistry and cancer preventing activities of ginseng saponins and some related triterpenoid compounds[J]. Journal of Korean Medical Science, 2001, 16: S28-37. DOI:10.3346/jkms.2001.16.S.S28 |
| [17] |
ZAI Q L. Chemical insights into ginseng as a resource for natural antioxidants[J]. Chemical Reviews, 2012, 112(6): 3329-3355. DOI:10.1021/cr100174k |
| [18] |
王冬, 戴住波, 张学礼. 酵母人工合成细胞生产植物源天然产物[J]. 微生物学报, 2016, 56(3): 516-529. |
| [19] |
EXPOSITO O, BONFILL M, MOYANO E, et al. Biotechnological production of taxol and related taxoids:Current state and prospects[J]. Anti-cancer Agents in Medicinal Chemistry, 2009, 9(1): 109-121. DOI:10.2174/187152009787047761 |
| [20] |
杨玲, 范伟, 孟珍贵, 等. 药用植物四环三萜皂苷生物合成及代谢研究进展[J]. 世界科学技术——中医药现代化, 2018, 20(6): 1018-1025. |
| [21] |
庄成乐, 黄卫人, 蔡志明. 合成生物学在医学及肿瘤治疗应用的研究前景[J]. 医学综述, 2015, 21(7): 1203-1205. |
| [22] |
WANG J, XIONG Z, MENG H, et al. Synthetic biology triggers new era of antibiotics development[J]. Sub-cellular Biochemistry, 2012, 64: 95-114. |
| [23] |
罗祖良, 张凯伦, 马小军, 等. 三萜皂苷的合成生物学研究进展[J]. 中草药, 2016, 47(10): 1806-1814. |
| [24] |
徐洁森, 魏建和, 陶韵文, 等. 植物细胞色素P450在三萜皂苷生物合成中的功能研究进展[J]. 中草药, 2012, 43(8): 1635-1640. |
| [25] |
YU L, CHEN Y, SHI J, et al. Biosynthesis of rare 20(R)-protopanaxadiol/protopanaxatriol type ginsenosides through Escherichia coli engineered with uridine diphosphate glycosyltransferase genes[J]. Journal of Ginseng Research, 2019, 43(1): 116-124. DOI:10.1016/j.jgr.2017.09.005 |
| [26] |
范冬冬, 匡艳辉, 向世勰, 等. 绞股蓝化学成分及其药理活性研究进展[J]. 中国药学杂志, 2017, 52(5): 342-352. |
| [27] |
王冬, 刘怡, 许骄阳, 等. 创建酿酒酵母细胞工厂高效生产人参皂苷前体达玛烯二醇Ⅱ[J]. 药学学报, 2018, 53(8): 1233-1241. |
| [28] |
JUNG S C, KIM W, PARK S C, et al. Two ginseng UDP-glycosyltransferases synthesize ginsenoside Rg3 and Rd[J]. Plant and Cell Physiology, 2014, 55(12): 2177-2188. DOI:10.1093/pcp/pcu147 |
| [29] |
WANG P P, WEI Y, FAN Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts[J]. Metabolic Engineering, 2015, 29: 97-105. DOI:10.1016/j.ymben.2015.03.003 |
| [30] |
WANG P P, WEI W, YE W, et al. Synthesizing ginsenoside Rh2 in Saccharomyces cerevisiae cell factory at high-efficiency[J]. Cell Discovery, 2019, 5(5): 1-14. |
| [31] |
SOEJARTO D D, ADDO E M, KINGHOM A D. Highly sweet compounds of plant origin:From ethnobotanical observations to wide utilization[J]. Journal of Ethnopharmacology, 2019, 243: 1120-1156. |
| [32] |
DAI L, LIU C, ZHU Y, et al. Functional characterization of cucurbitadienol synthase and triterpene glycosyltransferase involved in biosynthesis of mogrosides from Siraitia grosvenorii[J]. Plant and Cell Physiology, 2015, 56(6): 1172-1182. DOI:10.1093/pcp/pcv043 |
| [33] |
ZHANG J, DAI L, YANG J, et al. Oxidation of cucurbitadienol catalyzed by CYP87D18 in the biosynthesis of mogrosides from Siraitia grosvenorii[J]. Plant and Cell Physiology, 2016, 57(5): 1000-1007. DOI:10.1093/pcp/pcw038 |
| [34] |
ITKIN M, DAVIEOVICH R R, COHEN S, et al. The biosynthetic pathway of the nonsugar, high-intensity sweetener mogroside Ⅴ from Siraitia grosvenorii[J]. Proceedings of the National Academy of Sciences, 2016, 113(47): E7619-E7628. DOI:10.1073/pnas.1604828113 |
| [35] |
ZHAO H, TANG Q, MO C, et al. Cloning and characterization of squalene synthase and cycloartenol synthase from Siraitia grosvenorii[J]. Acta Pharmaceutica Sinica B, 2017, 7(2): 215-222. DOI:10.1016/j.apsb.2016.06.012 |
| [36] |
ZHAO H, WANG J, CHEN T, et al. Functional ex-pression of two NADPH-cytochrome P450 reductases from Siraitia grosvenorii[J]. International Journal of Biological Macromolecules, 2018, 120: 1515-1524. DOI:10.1016/j.ijbiomac.2018.09.128 |
| [37] |
CHIU C H, WANG R, ZHUANG S, et al. Biotransformation of mogrosides from Siraitia grosvenorii by Ganoderma lucidum mycelium and the purification of mogroside Ⅲ E by macroporous resins[J]. Journal of Food and Drug Analysis, 2020, 28(1): 74-83. |
| [38] |
ZHANG J, WU C, GAO L, et al. Astragaloside Ⅳ derived from Astragalus membranaceus:A research review on the pharmacological effects[J]. Advances in Pharmacology, 2020, 87: 89-112. DOI:10.1016/bs.apha.2019.08.002 |
| [39] |
LABED A, FERHAT M, LABED Z I, et al. Compoun-ds from the pods of Astragalus armatus with antioxidant, anticholinesterase, antibacterial and phagocytic activities[J]. Pharmaceutical Biology, 2016, 54(12): 3026-3032. DOI:10.1080/13880209.2016.1200632 |
| [40] |
UN R, HORO I, MASULLO M, et al. Cycloartane and oleanane-type glycosides from Astragalus pennatulus[J]. Fitoterapia, 2016, 109: 254-260. DOI:10.1016/j.fitote.2016.01.015 |
| [41] |
LEE D Y, NOH H J, CHOI J, et al. Anti-inflammatory cycloartane-type saponins of Astragalus membranaceus[J]. Molecules, 2013, 18(4): 3725-3732. DOI:10.3390/molecules18043725 |
| [42] |
LI Y, GUO S, ZHU Y, et al. Comparative analysis of twenty-five compounds in different parts of Astragalus membranaceus var.mongholicus and Astragalus membranaceus by UPLC-MS/MS[J]. Journal of Pharmaceutical Analysis, 2019, 9(6): 392-399. DOI:10.1016/j.jpha.2019.06.002 |
| [43] |
ABIR S L, LACAILLE D, NABIL S, et al. Structural organization of cycloartane-based saponins in the genus Astragalus (Fabaceae)[J]. Phytochemistry Reviews, 2018, 17(2): 431-452. DOI:10.1007/s11101-017-9541-1 |
| [44] |
VITTORIA G, MONICA S, ASSUNTA E, et al. Chemical diversity and biological activities of the saponins isolated from Astragalus genus:Focus on astragaloside Ⅳ[J]. Phytochemistry Reviews, 2019, 18(4): 1133-1166. DOI:10.1007/s11101-019-09626-y |
| [45] |
CHEN C X, DAI L, FENG H Y, et al. A new strategy for the preparation of antibody against natural glycoside:With astragaloside Ⅳ as an example[J]. Fitoterapia, 2020, 142: 1044-1088. |
| [46] |
李振秋, 王晓明, 金亚明, 等. 黄芪鲨烯合酶基因的克隆和序列分析[J]. 河北林果研究, 2011, 26(1): 16-19. |
| [47] |
刘玥辉, 孙视, 张涵庆, 等. 黄芪中环阿屯烷型三萜皂苷的二维核磁共振研究[J]. 中国药科大学学报, 2008, 39(1): 15-19. |
| [48] |
GUO K, HE X, LU D, et al. Cycloartane-type triterpenoids from Astragalus hoantchy French[J]. Natural Product Research, 2017, 31(3): 314-319. DOI:10.1080/14786419.2016.1236100 |
| [49] |
JIAO J, GAI Q Y, WANG W, et al. Enhanced astragaloside production and transcriptional responses of biosynthetic genes in Astragalus membranaceus hairy root cultures by elicitation with methyl jasmonate[J]. Biochemical Engineering Journal, 2016, 105: 339-346. DOI:10.1016/j.bej.2015.10.010 |



