2. 广西科学院高性能新材料产业研究院, 广西南宁 530007;
3. 广西大学, 广西南宁 530004;
4. 广西北投环保水务集团有限公司, 广西南宁 530029
2. Advanced Materials Industry Institute of Guangxi Academy of Sciences, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. Guangxi University, Nanning, Guangxi, 530004, China;
4. Guangxi Beitou Environment&Water Group Co., Ltd., Nanning, Guangxi, 530029
人类对碳酸钙的使用有着悠久的历史,尤其是在建筑方面,从中国的万里长城到罗马的圆形大剧场,从建筑普通用砖到精美艺术雕像,均大量使用碳酸钙。而纳米碳酸钙是碳酸钙存在的一种形式,是20世纪80年代逐渐发展起来的一种新型超细化固体材料[1],以粒径大小1-100 nm为特征,还可以分成超细碳酸钙和超微细碳酸,其原料来源多种多样。近20年来,随着碳酸钙生产设备的不断提升,超细化技术水平也得到大幅度的提升,通过结构复杂化设计和表面改性技术的开发,碳酸钙的应用潜力得到显著提高。因为不同形貌纳米碳酸钙均具有不同的补强作用和界面行为特点,所以多种形貌可控的纳米碳酸钙制备技术也成为诸多发达国家研究的热点[2]。Fang等[3]研究纳米碳酸钙在天然橡胶硫化胶中的动态特性,发现链型纳米碳酸钙橡胶复合材料的莫林斯效应很高,与大颗粒(80 nm)立方型纳米碳酸钙相当。童张法等[4]研究间歇鼓泡碳化法制备立方形纳米碳酸钙,并优化制备工艺条件,发现采用改进的间歇鼓泡碳化法优化制备得到40 nm且粒度分布均匀的立方形纳米碳酸钙,该法操作简单,无需二次碳化且重复性好。在实际应用中,主要是根据用途所限定的力学性能和表面特性对碳酸钙晶体进行调控,其形貌的不同影响应用的优越性,比如:立方形或球形更适合油墨、牙膏等行业的需求;针形或链状则适合橡胶行业;而像电子、陶瓷行业则很注重于球形,因此,研究不同晶型和形态的纳米碳酸钙制备技术成为研究人员竞相开发的热点[5]。在碳酸钙产业获得蓬勃发展的同时,重钙固废资源的综合利用成为焦点问题。目前天然大理石和人造大理石每年产生的重钙边角料和固体废弃物达到300万t,如何充分利用重钙固体废弃物资源已成为“十四五”发展计划的重要议题,也成为碳酸钙产业绿色循环经济发展的重要产业技术需求[6-7]。纳米碳酸钙的制备方法主要有物理法、化学法两类[8-20]。其中化学法从生产连续性上可分为间歇碳化法和连续喷雾碳化法;从制备技术上又可分为鼓泡碳化法、超重力法、膜分散微结构法、非冷冻法等,上述方法各有优劣。物理法以机械力为主动力实现粒径细化,其产品晶型可控,跟原料一致,但颗粒形状不规则,粒径分布较宽,并且相同的超细尺度要求能耗相对较高,对设备要求也高。化学法是利用气液固进行非均相反应,受多相传质扩散影响较大,需要消耗试剂,有外源性杂质掺入影响产品品质的问题,原料需要精制纯化,晶型与原料并非一致,优点是可以根据要求订制化调控制备纳米碳酸钙产品。缺点是工艺过程相对较长,单元操作相对较多,部分化学法还会产生二次废水问题。电化学改进的复分解法原理是利用电化学反应控制钙、氯离子迁移,利用晶型控制剂,可原位创造碱性环境并促进CO2在溶液中的吸收, 然后解离成碳酸根,使得碳酸根与钙离子可控反应,得到纳米尺寸的碳酸钙。其特点是减少酸碱消耗量,属于Ca2+-H2O-CO32-…CO2型反应体系,可规模生产,平均粒径可按需调控;缺点是对反应设备设计要求高,要求电极和反应器材料耐电腐蚀,固定投资相对较高。
碳化反应合成纳米碳酸钙是一个极其复杂的过程,其中涉及气-液-固三相的质量传递、界面离子的吸附和晶体的成核、生长与凝并等过程,而晶体的生长分为晶核形成和晶核长大两个阶段。晶核的形成、生长与系统自由能有直接关系。控制条件的不同,所得到的晶型可有很多种,表现出来的力学性能也大为不同,因此如何控制碳化和结晶过程成为研究热点[21-26]。通过控制工艺条件得到具有现实应用意义的纳米碳酸钙产品,是当前解决钙资源综合开发的重要举措。
本文以贺州市天然大理石加工废浆重质碳酸钙为原料,利用湿法冶金纯化处理获得氯化钙原液,通过电化学法+原位碳化反应相耦合的技术路线将氯化钙与CO2气体进行反应,拟制备获得性能优良、附加值更高的纳米碳酸钙产品,进一步为贺州市实施碳酸钙产业绿色循环发展提供重要思路和技术参考。
1 材料与方法 1.1 材料从废弃大理石浆液湿法冶金工艺提纯得到的2—6 mol/L氯化钙溶液(广西金源稀土有限公司)。
1.2 主要仪器与试剂氯化钙(AR级,美国Sigma-Aldrich公司),钙标准溶液(北京环标科创环境科技发展有限责任公司),柠檬酸(AR级,国药集团化学试剂有限公司),氢氧化钠(AR级,国药集团化学试剂有限公司);无水乙醇(AR级,成都市科隆化学品有限公司),CO2气体(纯度99.99%,广西瑞达化工科技有限公司),JM10阳离子膜(北京环宇利达)。
电化学法原位碳化反应装置、钌铱钛电极及纯钛电极(设计订制);IT6953A直流电源(艾德克斯电子有限公司);Horiba D219-SCT气体质量流量控制器(上海加惠仪器仪表有限公司);MIK-pH4.0在线工业pH计(杭州米科传感技术有限公司);BT100-2J多通道蠕动泵(河北保定迪创电子科技有限公司);DC-2006恒温水槽循环器(江苏天翎仪器有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);DHG-9025A电热鼓风干燥箱(上海一恒科学仪器有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);ICS-3000离子色谱(美国戴安公司);UltimaⅣ组合型X射线衍射光谱仪,入射光源为CuK α辐射(λ=0.154 nm)(日本理学);JSM-7610F场发射扫描电镜(日本电子);TECNAI G2F30场发射透射电镜(FEI公司)。
1.3 样品制备按图 1所示安装反应系统,并连接好其他配套仪器仪表,先启动恒温装置使反应系统处于恒温状态,再开启循环泵和气体钢瓶减压阀,待稳定。阳极室的电极为钌铱钛电极,阴极室的电极为纯钛电极,中间放置阳离子交换膜。阳极液是恒定摩尔浓度的CaCl2循环液,阴极液是初始浓度为0.05 mol/L的NaOH液体,并添加一定浓度的柠檬酸,调节控温系统使得阴极液维持在恒定温度作为初始反应温度。调节直流电压为一定值,待阴极室pH值大于13时,打开CO2气体流量计并设定气体流速为某恒定值,当阴极液pH值达到低于8时,反应终止,分离取样获得纳米碳酸钙样品,经真空干燥后分析测试表征。
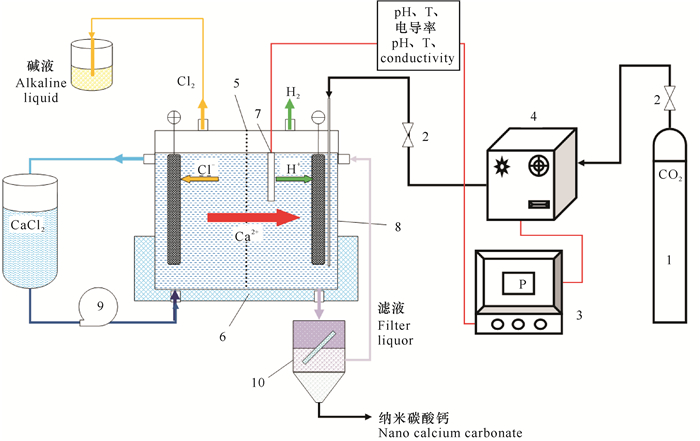
|
| 1:CO2气体钢瓶, 2:控制阀, 3:微机电脑监控系统, 4:气体流量控制系统, 5:离子交换膜, 6:恒温系统, 7:pH值、温度、电导率探测仪, 8:电化学法原位碳化反应装置, 9:循环泵, 10:分离器 1:CO2 gas cylinder; 2:Control valve; 3:Microcomputer monitoring system; 4:Gas flow control system; 5:Ion exchange membrane; 6:Constant temperature system; 7:pH value, temperature, conductivity detector; 8:Electrochemical in-situ carbonization reaction device; 9:Circulating pump; 10:Separator 图 1 电化学法原位碳化制备纳米碳酸钙的反应装置示意图 Fig.1 Schematic diagram of reaction device for electrochemical assisted in-situ carbonization of nano calcium carbonate |
1.4 纳米碳酸钙的形成原理
采用阳离子交换膜为隔膜的两室电解方法,控制阴极的电流密度,首先在阴极上发生水的电解反应生成氢气,消耗溶液中的H+,阴极室溶液中pH升高,在一定条件下与溶液中Ca2+反应生成Ca(OH)2过饱和液,反应方程式如下:
阳极反应:2Cl--2e→Cl2↑;
阴极反应:2H2O+2e→H2↑+2OH-;
碳化反应:Ca2++CO2+2OH-→CaCO3+H2O;
总反应式:Ca2++CO2+2Cl-+H2O→CaCO3↓+Cl2↑+H2↑。
在电化学反应过程中,只要控制适当的电解条件,就能保证电化学稳定生成Ca(OH)2过饱和液。电化学反应开始时阴极室溶液的pH值为12.5左右,溶液为无色溶液;保持一段时间后,Ca2+迁移至阴极室形成Ca(OH)2过饱和液,且pH值上升,超过13时开始通入CO2气体,发生原位碳化反应使得CaCO3胶体快速形成并结晶析出,随着电化学反应不断提供OH-并被碳化反应,将获得大量CaCO3沉淀物。
在阴极周围快速形成碱性环境,有助于CO2的吸收和解离,尽快形成碳酸根离子,并与钙离子结合形成碳酸钙,而消耗的钙离子则可以由经电化学作用从阳极迁移过来的钙离子进行补充,如此协同营造可持续的原位碳化反应过程,并快速生成CaCO3晶核,为获得颗粒均匀的超微CaCO3晶体创造定向结晶条件。
1.5 电化学法原位碳化反应实验(1) 恒定初始阴极液温度为(20±1)℃、柠檬酸浓度为5 mmol/L、直流电压为12 V的条件下,反应时间5 h,考察不同CO2气体流速对所制备的碳酸钙样品结晶度、粒径和形貌的影响。
(2) 恒定初始阴极液温度为(20±1)℃、直流电压为12 V的条件下,反应时间5 h,CO2通气速率30 mL/min,考察不同柠檬酸添加量对所制备碳酸钙样品结晶度、粒径和形貌的影响。
(3) 恒定初始阴极液温度为(20±1)℃、CO2通气速率30 mL/min、柠檬酸添加量为5 mmol/L、直流电压为12 V的条件下,考察反应时间、陈化方式、气体类型等制备条件对碳酸钙样品结晶度、粒径和形貌的影响。
1.6 样品分析测试表征XRD分析表征:将碳酸钙粉末放置于2 cm×2 cm大小的装样片上,铺平压实后插入装样台。使用日本理学UltimaⅣ组合型X射线衍射光谱仪,入射光源为CuK α辐射(λ=0.154 nm)。检测条件为电压40 kV,电流40 mA,角度为5—80°,扫描速度为5°/min。
FESEM分析表征:将碳酸钙样品在乙醇溶液中超声分散,用0.5 mm毛细管点滴在导电胶上,测试前样品经过表面喷金处理。使用日本电子JSM-7610F扫描电镜扫描电子显微镜观察样品形貌与结构并拍照。
TEM分析表征:将碳酸钙样品在乙醇溶液中超声分散,用5 μL移液枪吸取分散液滴于超薄碳膜上,并用红外灯烘干,送样检测,重点观测100 nm和10 nm尺度的晶体结构。
2 结果与分析 2.1 不同CO2气体流速对碳酸钙晶型的影响对不同CO2气体流速条件下制备得到的碳酸钙沉淀样品进行XRD分析表征,其结果如图 2所示。通过Jade 9.0软件数据分析,比对XRD数据库PDF卡,拟合统计处理可得晶型分析情况如表 1所示。从XRD谱图分析发现:在20,30,40,50,60 mL/min的气速条件下能得到晶体衍射峰,且随着气速的提高,晶体衍射峰强度逐渐增强。在CO2气体流速高于20 mL/min时,均获得碳酸钙晶体结构,分别有球霰石、方解石或这两种的混晶结构;当CO2气体速率高于40 mL/min时,则以混晶为主,方解石占多数。导致上述原因有可能是当气体流速过低时,受体系反应环境的影响,碳酸钙晶核数量过少而不能结晶,或者因晶体数量少而造成多余添加剂掩盖了晶体的结构特征;而当气体流速过高时,体系快速形成结晶并生长,但晶型控制剂的控制能力有限,不能很好地控制形成单一的晶型。因此对于本反应体系而言,尤其是在考虑到其他固定因素的条件下,控制气体流速在20-30 mL/min可以保证得到球霰石型的碳酸钙。

|
| 图 2 不同CO2气体流速制备得到的碳酸钙样品X衍射谱图 Fig.2 X-ray diffraction patterns of calcium carbonate samples prepared at different CO2 gas flow rates |
| 流速 Flow rate (mL/min) |
晶型 Crystal form |
晶系 Crystallographic system |
平均晶粒尺寸 Average grain size (nm) |
| 15 | 非晶 Amorphous |
- | - |
| 20 | 球霰石 Vaterite |
六方晶系 Hexagonal |
10.9 |
| 30 | 球霰石 Vaterite |
六方晶系 Hexagonal |
6.5 |
| 40 | 混晶,方解石与球霰石型 Mixed crystal,calcite and vaterite |
六方晶系 Hexagonal |
21.2 |
| 50 | 方解石型 Calcite |
六方晶系 Hexagonal |
26.3 |
| 60 | 混晶,方解石与球霰石型 Mixed crystal,calcite and vaterite |
六方晶系 Hexagonal |
19.0 |
2.2 不同柠檬酸添加量对碳酸钙晶型的影响
不同柠檬酸添加量对碳酸钙晶型的影响主要是通过XRD分析表征进行剖析(图 3)。通过Jade 9.0软件数据分析,比对XRD数据库PDF卡,拟合统计处理可知,随着柠檬酸添加的减小,碳酸钙样品在2θ=29.5°的峰衍射值最强,其方解石型特征明显,且结晶度越高,但在柠檬酸添加量达到5 mmol/L时则表现出球霰石。
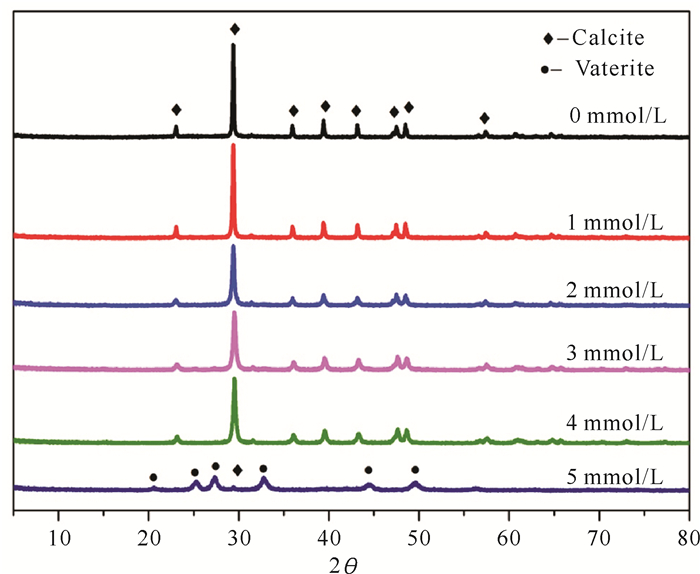
|
| 图 3 不同柠檬酸添加量制备得到的碳酸钙样品X衍射谱图 Fig.3 X-ray diffraction patterns of calcium carbonate samples prepared with different citric acid content |
2.3 制备条件对碳酸钙XRD平均粒径的影响
改变反应时间、柠檬酸添加量、陈化方式、气体类型等条件制备的碳酸钙样品,其XRD晶粒尺寸通过利用Jade 9.0软件数据分析,比对XRD数据库PDF卡,拟合统计处理可得如表 2所示结果。从结果可知,CO2浓度、碳化反应时间、晶型控制剂柠檬酸添加量以及陈化体系、干燥方式都会影响样品的XTD平均粒径。经探索发现二氧化碳浓度高有利于缩短碳化时间;陈化体系选择乙醇时,可以快速干燥且不需要强制加热烘干;在选择纯CO2、乙醇陈化体系、柠檬酸添加量为5 mmol/L条件下,缩短碳化时间可以制备得到晶粒小的样品。
| 制备条件Preparation condition | 样品XRD 平均粒径Average XRD size of sample (nm) |
||||
| 通气方式 Gas entry mode |
碳化反应时间 Carbonation time (h) |
柠檬酸添加量 Added amount of citric acid (mmol/L) |
陈化体系 Aging system |
干燥方式 Drying method |
|
| 常压空气 Atmospheric air |
24 | 0 | 无 Non |
烘干 Dry |
50.5 |
| 纯CO2 Pure CO2 |
1 | 0 | 无 Non |
烘干 Dry |
87.6 |
| 纯CO2 Pure CO2 |
3 | 0 | 无 Non |
烘干 Dry |
108.8 |
| 纯CO2 Pure CO2 |
3 | 5 | 无 Non |
烘干 Dry |
73.6 |
| 纯CO2 Pure CO2 |
1 | 5 | 乙醇 Ethanol |
烘干 Dry |
26.2 |
| 纯CO2 Pure CO2 |
3 | 5 | 乙醇 Ethanol |
自然干燥 Natural drying |
24.9 |
| 纯CO2 Pure CO2 |
3 | 5 | 乙醇 Ethanol |
烘干 Dry |
34.0 |
| 纯CO2 Pure CO2 |
6 | 5 | 乙醇 Ethanol |
自然干燥 Natural drying |
44.2 |
| 纯CO2 Pure CO2 |
6 | 5 | 乙醇 Ethanol |
烘干 Dry |
43.3 |
2.4 纳米碳酸钙样品FESEM形貌表征
在初始阴极液温度为(20±1)℃、CO2通气速率30 mL/min、柠檬酸添加量为5 mmol/L、直流电压为12 V、反应时间3 h的条件下,乙醇陈化烘干得到碳酸钙样品,其FESEM形貌如图 4所示。所获得的纳米碳酸钙样品为直链状,直径30—50 nm,长300—500 nm,长径比约为10。

|
| 图 4 纳米碳酸钙样品FESEM形貌图 Fig.4 FESEM morphology of nano calcium carbonate sample |
经过实验探索,发现反应3 h后在阴极表面形成大量附着物,引起电阻增大,造成电流值显著下降,同时因OH-供应不足造成阴极液pH值下降至8以下,反应只能终止。所以按照目前探索的情况发现仅能在3 h内正常制备出纳米碳酸钙样品,如何优化装置设计获得稳定制备纳米碳酸钙将是下一步研究的重点。
2.5 直链状纳米碳酸钙样品TEM结构表征为进一步验证碳酸钙样品的微观结构是否达到纳米级,本研究对样品(制备条件同2.4)进行TEM结构表征,结果如图 5所示。由图分析可知该纳米碳酸钙样品微观结构为链状,其直径30 nm,长250 nm,长径比(L/D)为8。

|
| 图 5 直链状纳米碳酸钙样品TEM图(CO2速率30 mL/min,直流电压12 V) Fig.5 TEM morphology of the straight chain nano calcium carbonate sample (CO2 rate 30 mL/min, DC voltage 12 V) |
同时,研究过程中还发现通过协同调节CO2通气速率为50 mL/min、直流电压为16 V,而其他条件与2.4节样品制备条件相同时,也能获得直链状纳米碳酸钙样品,该条件下样品的TEM结构表征结果如图 6所示。

|
| 图 6 直链状纳米碳酸钙样品TEM图(CO2速率50 mL/min,直流电压16 V) Fig.6 TEM morphology of the straight chain nano calcium carbonate sample (CO2 rate 50 mL/min, DC voltage 16 V) |
对比图 5和6,两种制备条件获得类似的纳米碳酸钙结构,可能是由于传质速率和反应速率综合体现的结果:CO2的吸附传质速率受通气速率的影响,单位时间内可以为反应体系提供更多的碳酸根离子,而直流电压超高则会加速钙离子的电迁移,从而为阴极区提供更多的钙离子,当碳酸根离子与钙离子达到一定平衡点时,即一定的通气速率对应一定的直流电压时,可以获得直链状纳米碳酸钙。
3 结论利用电化学法原位碳化氯化钙可制备获得直链状纳米碳酸钙。在不需要外加碱的条件下完成电化学复分解反应实现碳化过程,通过电解创造碱性条件促进CO2吸收再解离形成碳酸根,再与钙离子发生碳化反应。探索研究还发现电化学原位碳化反应的较佳工艺条件为直流电压12 V、反应温度20℃、反应时间3 h、柠檬酸添加量5 mmol/L、CO2通气速率30 mL/min。所得到链状纳米碳酸钙,直径30 nm,长径比(L/D)约为8。将电压改为16 V,同时将CO2通气速率改为50 mL/min,也获得相似结果。本研究将氯化钙电化学反应和原位碳化反应进行耦合,通过电场控制钙、氯离子迁移,快速创造碱性环境,提高CO2气体吸收并解离出碳酸根,在晶型控制剂引导下,使得碳酸根与钙离子可控反应,获得形貌可控的碳酸钙产品。同时还可以利用副产生成的氢和氯制备盐酸,为反萃工艺制备氯化钙提供原料,实现氯的循环使用,避免卤素的污染。这不仅可以实现纳米碳酸钙的按需调控,还可以实现绿色清洁生产。
通过探索性研究实验,本文获得直链状纳米碳酸钙产品,但是制备过程中也发现一些急需解决的问题,比如电阻剧增、电极附着物消除、通气速率与直流电压最佳匹配,以及纳米粒子团聚等问题。下一步研究工作将首先重点围绕解决这4个突出问题,以便获得可连续电化学法原位碳化反应制备直链状纳米碳酸钙的工艺,其次是对直链状纳米碳酸钙进行性能测试分析(如测试比表面积、沉降体积、吸油值、白度、力学性能等),最后是将其开发应用于高分子复合材料,深入开展其应用研究。
| [1] |
杨小红, 陈建兵, 盛敏钢. 纳米碳酸钙的生产和用途[J]. 化学教育, 2007(10): 5-7. |
| [2] |
王洪亮, 王少青, 贾慧. 碳酸钙工业的现状与发展[J]. 内蒙古石油化工, 2009(17): 39-40. |
| [3] |
FANG Q H, SONG B, TEE T T, et al. Investigation of dynamic characteristics of nano-size calcium carbonate added in natural rubber vulcanizate[J]. Composites Part B:Engineering, 2014(60): 561-567. |
| [4] |
童张法, 胡超, 李立硕, 等. 间歇鼓泡碳化法制备立方形纳米碳酸钙工艺条件优化[J]. 广西科学, 2015, 22(1): 53-59. |
| [5] |
肖品东. 纳米碳酸钙生产与应用关键技术解密[M]. 北京: 化学工业出版, 2009.
|
| [6] |
黄志民, 黎贞崇, 王尧, 等.广西(贺州)东融石材碳酸钙产业研究院发展规划研究报告[R].南宁: 2019.
|
| [7] |
中国科学院成都文献情报中心.碳酸钙产业技术发展研究报告[R].成都: 2015.
|
| [8] |
刘小风, 钟宏. 不同形态纳米碳酸钙的研究进展[J]. 上海涂料, 2009, 47(4): 22-25. |
| [9] |
马洁, 李春忠, 陈雪花. 焦磷酸钠对液相碳化法制备纳米碳酸钙形貌的影响[J]. 无机化学学报, 2005, 21(10): 1465-1470. |
| [10] |
赵东清, 刘家祥. 碳酸化工艺参数对纳米碳酸钙形貌和颗粒尺寸的影响[J]. 非金属矿, 2007, 30(2): 5-7. DOI:10.3969/j.issn.1000-8098.2007.02.002 |
| [11] |
胡庆福, 刘洪杰, 刘润静, 等. 针状纳米级碳酸钙的工业生产和应用[J]. 化工进展, 2006, 25(3): 337-339. |
| [12] |
MELDRUM F C, HYDE S T. Morphological influence of magnesium and organic additives on the precipitation of calcite[J]. Journal of Crystal Growth, 2001, 231(4): 544-558. |
| [13] |
XIANG L, XIANG Y, WANG Z G, et al. Influence of chemical additives on the formation of super-fine calcium carbonate[J]. Powder Technology, 2002, 126(2): 129-133. |
| [14] |
GIUSEPPE F, SIMONA F, ALBERTO R. Crystallization of calcium carbonate salts into beta-chitin scaffold[J]. Journal of Inorganic Biochemistry, 2002, 91(3): 475-480. |
| [15] |
HIROAKI I, TOMOHIRO T, TAKASHI M, et al. Self-organized formation of porous aragonite with silicate[J]. Journal of Crystal Growth, 2002, 244(2): 200-205. |
| [16] |
CHEONG S C, YONG W K. A study of the correlation between organic matrices and nanocomposite materials in oyster shell formation[J]. Biomaterials, 2000, 21(3): 213-222. |
| [17] |
FENG Q L, CUI F Z, PU G, et al. Crystal orientation, toughening mechanisms and a mimic of nacre[J]. Materials Science and Engineering C, 2000, 11(1): 19-25. |
| [18] |
黄木清.一种非冷冻法纳米碳酸钙的生产方法: CN02149667.6[P].2003-05-14.
|
| [19] |
林积梁, 谢文清, 黄文德, 等.利用低品位石灰石湿法活化制备超细活性纳米碳酸钙的方法: CN200810071290.3[P].2008-12-10.
|
| [20] |
DICKINSON S R, MCGRATH K M. Aqueous Precipitation of calcium carbonate modified by hydroxyl-containing compounds[J]. Crystal Growth & Design, 2004, 4(6): 1411-1418. |
| [21] |
林荣毅, 张家芸, 张培新. 纳米碳酸钙的生长和控制机理[J]. 中国有色金属学报, 2002, 12(2): 358-362. DOI:10.3321/j.issn:1004-0609.2002.02.033 |
| [22] |
YAO C L, XU W H, DING A M, et al. Biomimetic synthesis of calcium carbonate in the sucrose solution[J]. Asian Journal of Chemistry, 2010, 22(1): 733-737. |
| [23] |
蒋惠亮, 殷福珊, 吉捷, 等. 表面活性剂对纳米碳酸钙结晶过程的影响[J]. 日用化学工业, 2005, 35(2): 69-71. |
| [24] |
KAZUNORI K, RYOICHI F, YOSHIYUKI S, et al. Effect of surface properties of calcium carbonate on aggregation process investigated by molecular dynamics simulation[J]. Journal of Materials Science, 2014, 49(4): 1724-1733. |
| [25] |
KAZUNORI K, TAKENOBU Y, Atsuko S. Aggregation modeling of calcium carbonate particles by Monte Carlo simulation[J]. Journal of Nanoparticle Research, 2011, 13(12): 7209-7218. |
| [26] |
颜鑫. 纳米碳酸钙关键技术[M]. 北京: 化学工业出版社, 2007.
|



