2. 广西中医药大学药学院, 广西南宁 530200;
3. 广西广泽健康产业股份有限公司, 广西南宁 530205;
4. 广西壮族自治区中国科学院广西植物研究所, 广西桂林 541000
2. Traditional Chinese Medicine, Guangxi University of Traditional Chinese Medicine, Nanning, Guangxi, 530200, China;
3. Guangze Health Industry Co., Ltd., of Guangxi, Nanning, Guangxi, 530205, China;
4. Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541000, China
植物内生菌一般指那些在其生活史的一定阶段或全部阶段存活于健康植物各种组织内,不会对宿主植物产生明显病害的微生物[1]。经过长期的共同进化,植物内生菌与宿主植物已经建立了一种稳定的互利共生关系,可以在植物体内独立繁殖[2]。许多研究表明,植物内生菌可以通过溶磷、合成植物激素、固氮、合成铁载体等方式产生各种生理活性物质,直接或间接地促进植物生长,为宿主植物提供必要的营养物质,也可以通过诱导植物防御机制,提高宿主植物对干旱、重金属、高盐碱、病害等物胁迫的抗逆性。
牛大力是豆科鸡血藤属植物美丽鸡血藤Callerya speciosa,主产于长江流域以南各地,是岭南地区著名的药食两用中药材。牛大力味甘、性平[3],可润肺补虚、强筋活络,在临床上常用于治疗跌打损伤、腰肌劳损、肺虚咳嗽、慢性肝炎、遗精、白带等症[4]。近年来,广东、广西、香港、澳门等地民间普遍使用牛大力熬制靓汤药食两用,需求有逐年增长之势[5]。由于目前市场需求与日俱增,牛大力野生资源被过度采挖,原材料极度短缺,生态环境也被严重破坏[6]。内生菌是一类具有极大潜力的微生物资源,具备促进植物生长及对环境友好等特性,还能产生与宿主植物相同或类似药用价值的活性成分,这可缓解因市场需求造成的野生资源被过度采挖的压力,为保护濒危野生药用植物带来新思路。目前,学者主要针对牛大力的化学成分、药理作用以及组织培养等研究进行了大量的工作,而牛大力内生菌的研究鲜有报道。本研究对采自广西天等县、资源县、南丹县以及那坡县4地的野生牛大力进行内生细菌的分离,研究其促生特性,旨在为开发利用牛大力有益内生菌株资源提供基础理论依据和数据支持。
1 材料与方法 1.1 供试材料野生牛大力植株采自广西天等县、资源县、南丹县以及那坡县,将生长状况良好的健康植株用塑封袋带回实验室, 置4℃冰箱保存备用,24 h内进行内生细菌的分离。采集的植物样品经广西大学农学院黄荣韶教授鉴定,为豆科鸡血藤属植物美丽鸡血藤Callerya speciosa。
1.2 供试培养基营养琼脂(NA)培养基(1 L):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂18 g,pH值为7.0—7.2;用于分离、培养细菌。
营养肉汤(NB)培养基(1 L):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,pH值为7.0—7.2;用于培养细菌。
阿须贝氏(Ashby)培养基(1 L):CaCO3 5 g,CaSO4·2H2O 0.1 g,KH2PO4 0.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,甘露醇10 g,琼脂13 g,pH值为7.0-7.2;用于固氮菌培养。
IAA检测培养基(1 L):L-色氨酸0.5 g,酪蛋白氨基酸0.5 g,酵母浸粉0.5 g,无水葡萄糖0.5 g,可溶性淀粉0.5 g,胰蛋白胨0.5 g,丙酮酸钠0.3 g,K2HPO4 0.3 g,MgSO4·7H2O 0.05 g,pH值为7.0—7.2;用于产IAA能力的定性与定量测定。
CAS检测培养基(1 L):CAS染液50 mL,10%酪蛋白氨基酸30 mL,0.1 mol/L磷酸盐缓冲液5 mL,20%蔗糖溶液10 mL,1 mmol/L CaCl2 1 mL,琼脂18 g;用于产铁载体能力的定性检测。
MKB培养基(1 L):K2HPO4 2.5 g,MgSO4·7H2O 0.2 g,甘油15 mL,酪蛋白氨基酸5.0 g,pH值为7.2;用于产铁载体能力的定量测定。
NBRIP培养基(1 L):KCl 0.2 g,MgCl2·6H2O 0.3 g,Ca3(PO4)2 5 g,MgSO4·7H2O 0.25 g,葡萄糖10 g,(NH4)2SO4 0.1 g,琼脂13 g,pH值为7.0—7.2;用于溶磷能力的定性与定量测定。
1.3 方法 1.3.1 牛大力内生细菌的分离、纯化采用组织块分离法进行牛大力内生细菌分离。取野生牛大力植株的根、茎组织用流水洗净表面的泥土等杂物,用滤纸吸干表面水分,随后将植物组织切块,用无菌水冲洗3次备用。牛大力组织消毒方法:分别用75%乙醇和1%次氯酸钠表面消毒浸泡4—5 min,多次摇晃瓶身使组织块与消毒液充分接触,无菌水冲洗4次以洗净残余的消毒液;最后用无菌滤纸吸去表面水分。取最后冲洗液涂布于NA培养基平板,28℃倒置培养3 d,若无菌落出现,则表明植物组织表面消毒彻底。将消毒合格的根、茎组织分别用无菌刀片切去表皮及边缘部分,剪碎后转移至无菌研钵中研磨成匀浆,将研磨液适当进行梯度稀释,各取100 μL至NA培养平板上,均匀涂布,28℃下黑暗培养2—3 d。挑选菌落形态不同的单菌落纯化3次,将菌落表面形态特征及镜检形态都相同的菌落合并为同一类。将纯化的菌株保存备用。
1.3.2 内生细菌的分子生物学鉴定参考Terefework等[7]的方法采用改良的CTAB法提取所有菌株的DNA,选用细菌16S rDNA通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行基因扩增。30 μL PCR反应体系包括Premix Taq 15 μL,Template DNA 1.2 μL,上下游引物各0.6 μL,ddH2O 12.6 μL;PCR反应条件:94℃、3 min,94℃、30 s,55℃、30 s,72℃、30 s,30个循环后,再72℃、10 min。产物经电泳检测,扩增序列条带在1 500 pb左右,PCR扩增产物序列测定委托上海生工生物工程有限公司完成。测序结果提交NCBI进行在线同源比对,根据相似性下载相关菌株序列,用MEGA 7.0构建系统发育树。
1.3.3 内生细菌的促生特性固氮能力检测:参照李骜[8]的方法将活化的待测菌株接种于Ashby液体培养基中,28℃、180 r/min摇床恒温震荡培养,每个处理重复3次。分别在第3 d和第7 d目测对比处理组与对照组的浑浊度,若明显浑浊即为阳性;将阳性菌株活化并接种到Ashby平板上,28℃黑暗培养,连续继代培养3次,若菌株能正常生长,即为有固氮活性。
溶磷能力测定:参照钟传青等[9]的方法,将各菌株接种于NBRIP培养基平板上,28℃暗培养6 d后,观察菌落周围有无透明圈出现。若有透明圈出现说明细菌能解磷。将初筛的具有溶磷性菌株在NB液体培养基中培养至对数期,按1%的接种量接种于NBRIP液体培养基中,28℃、150 r/min振荡培养6 d后,用钼锑抗比色法,根据标准曲线计算上清液有效磷含量。
产铁载体能力测定:参照Schwyn和Neilands[10]的CAS平板法,将活化后的待测菌株点接于CAS蓝色固体平板上,28℃黑暗培养5 d,观察检测培养基的颜色变化,若菌落周围有橙黄色晕圈产生则为阳性。将阳性菌株活化接种于MKB培养基中,在28℃、150 r/min条件下培养5 d,培养液离心后取2 mL上清液与等体积CAS检测液充分混合,反应60 min后,观察颜色变化,根据公式计算各菌株分泌铁载体活性。
产IAA能力测定:参照Sarwar和Kremer[11]的比色法,将待测菌株接种于添加有L-色氨酸(0.5 g/L)的IAA检测培养基中,28℃、180 r/min的摇床中培养2 d;菌液8 000 r/min离心10 min后取500 μL上清液,与Sackowki显色剂1:1混合,室温避光放置30 min后观察颜色变化,若混合液出现红色或粉红色,则表示菌株具有合成IAA能力,根据标准曲线计算菌液中IAA的浓度。
2 结果与分析 2.1 内生细菌分离纯化通过平板划线、革兰氏染色、菌落形态观察等手段,从广西4地采集到的野生牛大力根、茎两部分组织中一共分离到可培养内生细菌59株,其中从根中分离得到48株(占总分离菌株的81.36%),茎中分得11株(占总分离菌株的18.64%)。通过单菌落形态、颜色、大小、湿度等菌落特征及显微镜镜检特征,将59株内生细菌进行同类合并,初步鉴定为34组。
2.2 内生细菌的16S rDNA基因系统发育分析对34组内生细菌的16S rDNA基因片段进全序列测定,测定结果提交NCBI与已知序列进行同源性比对,Blast分析结果如表 1所示。对内生菌和相似性最高的相关模式菌株的16S rDNA基因序列分析,利用MEGA 7.0构建系统发育树(图 1)。由结果可知,34组内生细菌分属于4门16属20种。系统发育树显示,牛大力内生细菌主要有Bacillus、Kosakonia、Myroide、Leclercia、Providencia、Pantoea、Proteus等。其中芽孢杆菌属Bacillus数量最多,有12株,占总分离菌株的20.34%,为优势菌属。根据优势菌种的分类原则,牛大力的优势菌种有Kosakonia pseudosacchari (11.86%)、Myroides odoratimimus(11.86%)以及Leclercia sp.(10.17%)。
| 菌株编号 No.of strains |
相似性最高的菌株 The most similar model strain |
相似性 Similarity (%) |
分离数量 Quantity of separation |
相对频率 Relative frequency (%) |
| ST1-5 | Proteus mirabilis (KC456539) | 98 | 4 | 6.78 |
| RT7-1 | Alcaligenes faecalis subsp.(KC790302) | 99 | 2 | 3.38 |
| RH17-1 | Burkholderia sp.(KF788025) | 99 | 1 | 1.69 |
| RH17-2 | Rhizobium sp.(JQ697681) | 99 | 1 | 1.69 |
| RH17-5 | Leclercia sp.(KP265974) | 99 | 6 | 10.17 |
| GR1-1 | Pseudomonas koreensis (KF424274) | 98 | 1 | 1.69 |
| GR2-1 | Pantoea dispersa (GQ200831) | 98 | 1 | 1.69 |
| GR4-1 | Providencia vermicola (KX098543) | 98 | 5 | 8.47 |
| XDR0-1 | Stenotrophomonas maltophilia (KY078806) | 98 | 2 | 3.38 |
| XDR1-2 | Acinetobacter johnsonii (KY767512) | 98 | 1 | 1.69 |
| XDR3-4 | Bacillus sp.(KC857472) | 98 | 3 | 5.08 |
| DR1-3 | Bacillus oryzaecorticis (KU877673) | 97 | 3 | 5.08 |
| DR5-1 | Bacillus safensis (KR708899) | 99 | 3 | 5.08 |
| TBR0 | Micrococcus luteus (KT003279) | 99 | 2 | 3.38 |
| TBR7 | Pantoea sp.(KR029327) | 98 | 3 | 5.08 |
| TBR10 | Kosakonia pseudosacchari (NR135211) | 99 | 7 | 11.86 |
| NR5-3 | Paenibacillus castaneae (NR044403) | 99 | 3 | 5.08 |
| NR7-2 | Bacillus sp.(KP126830) | 98 | 3 | 5.08 |
| RH1-4 | Brevibacillus sp.(GU471747) | 99 | 1 | 1.69 |
| SH2-6 | Myroides odoratimimus (JF775418) | 99 | 7 | 11.86 |
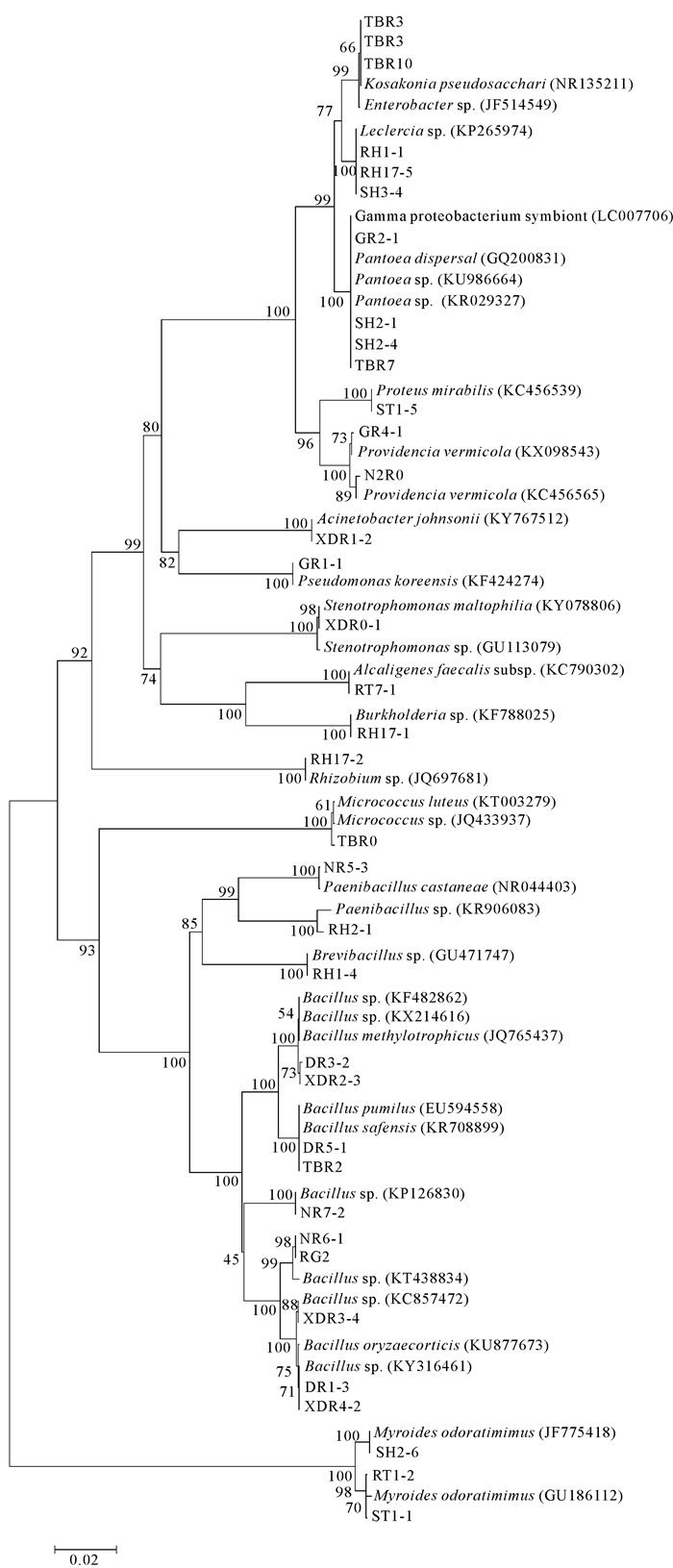
|
| 图 1 内生细菌16S rDNA系统进化树 Fig.1 16S rDNA phylogenetic tree of endophytic bacteria |
2.3 牛大力内生细菌促生特性分析 2.3.1 不同菌株的固氮能力
本试验分析了20株代表性牛大力内生细菌的促生特性,促生结果见表 2。根据20株内生细菌在Ashby培养基上的生长结果显示,共11株菌继代3次仍能在Ashby培养基正常生长,说明这些牛大力内生细菌具有潜在的固氮潜力,占测定菌株总数的35%。
| 菌株编号 No.of strains |
固氮 Nitrogen-fixing |
溶磷 Soluble phoaphate (mg/L) |
产铁载体 Siderophore detection(%) |
产IAA IAA production(mg/L) |
| RH17-2 | + | 9.10 | 49.76 | 6.17 |
| RT7-1 | - | - | - | - |
| RH17-1 | + | 8.67 | - | - |
| TBR10 | + | 1.60 | - | 12.68 |
| RH17-5 | + | 3.33 | 65.29 | 1.75 |
| TBR7 | + | 17.44 | - | - |
| GR2-1 | + | 2.44 | 65.97 | 12.68 |
| GR4-1 | + | 4.90 | - | 16.30 |
| ST1-5 | + | 3.84 | - | 29.48 |
| XDR1-2 | - | 4.28 | 70.19 | 43.10 |
| GR1-1 | - | 4.62 | 61.12 | - |
| XDR3-4 | + | - | - | 20.40 |
| DR5-1 | - | 10.44 | - | - |
| XDR0-1 | + | - | - | - |
| NR7-2 | + | 14.78 | - | 13.02 |
| DR1-3 | - | 9.50 | 69.39 | 21.48 |
| NR5-3 | - | 7.52 | - | 35.48 |
| RH1-4 | - | 7.94 | - | 1.11 |
| SH2-6 | - | 15.12 | 73.12 | - |
| TBR0 | - | 14.81 | - | 31.35 |
| 注:“+”表示阳性,“-”表示阴性 Note:"+" indicates positive result,"-" indicates negative result |
||||
2.3.2 不同菌株的溶磷能力
经过溶解磷酸钙能力的定性初筛,共有17株菌可以在NBRIP培养基上形成溶磷圈,占测定菌株总数的85%。通过定量测定,不同内生细菌的难溶性磷酸盐溶解量不同,有效磷增量为1.60—14.71 mg/L,菌株TBR7、RH1-4、TBR0及NR7-2的难溶性磷酸盐溶解能力相对较强(表 2)。
2.3.3 不同菌株的产铁载体能力通过CAS平板测定内生细菌的产铁载体能力,结果显示(表 2),7株内生细菌可以产铁载体,占待测菌株总数的35%。定量结果表明,有6株内生细菌为高产铁载体菌株,产铁载体活性均>50%,其中菌株XDR1-2分泌铁载体活性高达70.19%。
2.3.4 不同菌株的产IAA能力通过显色反应分析牛大力内生细菌产IAA的能力,发现共有13株内生细菌出现不同程度的显色,占待测菌株总数的65%。通过定量测定,不同内生细菌的IAA产生量存在明显区别(1.11—43.10 mg/L),其中XDR1-2、NR5-3、TBR0、ST1-5菌株产IAA的能力相对较强(表 2)。
3 讨论内生细菌几乎存在于所有已研究的植物中,具有丰富的物种多样性。内生细菌的16S rDNA序列含有的可变序列是每个微生物特有的特征序列,可以作为鉴定细菌种属的分子基础,广泛应用于细菌的分类鉴定[12]。如朱艳蕾[13]从银砂槐根、叶组织中分离出45株内生细菌,经16S rDNA序列分析鉴定为芽孢杆菌属等13个属; 张晓波等[14]从药用植物骆驼刺中分离出的50株内生菌经16S rDNA序列分析属于15个菌属。本研究从健康野生牛大力植株根、茎中分离的59株可培养内生细菌经16S rDNA序列分析鉴定为16属20种,反映了牛大力内生细菌的菌群较为丰富。牛大力的优势菌属为芽孢杆菌属,这与前文及已报道的许多论文结果一致[13-16]。在牛大力不同部位分布的内生细菌种类和数量有较大差异,内生细菌主要存在于根部,可能是因为根系营养物质丰富,有利于内生细菌的生长繁殖。
内生细菌生存于植物组织里,在植物组织中占据有利的生态位,在受到植物保护的同时,也比外界环境微生物更易于发挥其生物学功能[17]。植物内生菌可通过多种途径产生促进作用,如促进宿主植物生长、拮抗病原菌以及提高宿主植物抗逆能力等[18-20]。本研究分离的牛大力内生细菌具有溶磷、固氮、产IAA、产铁载体等多种促生功能,在实际的农业生产中具有一定的应用潜力。
4 结论本试验从野生牛大力植株根茎组织中分离得到59株内生细菌,通过对内生细菌的16S rDNA基因进行序列分析,鉴定为16属20种,说明牛大力内生细菌具有丰富的物种多样性。对鉴定的内生细菌进行促生活性评估,结果表明有11株具有潜在的固氮能力,17株具有溶磷能力,7株具有产铁载体的能力,有13株具有产IAA的能力。菌株RH17-2、RH17-5、GR2-1兼具固氮、溶磷性、产铁载体、产IAA能力。这些菌具有作为促生菌应用于促进植物生长等方面的潜力。
| [1] |
HALLMANN J, QUADT-HALLMANN A, MAHAFF-EE W F, et al. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Microbiology, 1997, 43(10): 895-914. DOI:10.1139/m97-131 |
| [2] |
王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. DOI:10.13344/j.microbiol.china.130815 |
| [3] |
何克谏. 生草药性备要:影印本[M]. 广州: 广东科技出版社, 2009.
|
| [4] |
王国强. 全国中草药汇编[M]. 北京: 人民卫生出版社, 2014.
|
| [5] |
邓栩雯. 浅谈几种药食两用南药及其产业发展潜力[J]. 南方农业, 2018, 12(21): 121-122. |
| [6] |
马帅鹏. 广东省牛大力产业发展潜力分析[J]. 热带农业科学, 2014, 34(4): 87-90. DOI:10.3969/j.issn.1009-2196.2014.04.019 |
| [7] |
TEREFEWORK Z, KAIJALAINEN S, LINDSTRÖM K. AFLP fingerprinting as a tool to study the genetic diversity of rhizobium galegae isolated from Galega orientalis and Galega officinalis[J]. Journal of Biotechnology, 2001, 91(2/3): 169-180. DOI:10.1016/S0168-1656(01)00338-8 |
| [8] |
李骜.华石斛根部可培养内生细菌分离鉴定及其促生研究[D].海口: 海南大学, 2015.
|
| [9] |
钟传青, 黄为一. 不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J]. 土壤学报, 2005, 42(2): 286-294. DOI:10.3321/j.issn:0564-3929.2005.02.017 |
| [10] |
SCHWYN B, NEILANDS J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56. DOI:10.1016/0003-2697(87)90612-9 |
| [11] |
SARWAR M, KREMER R J. Enhanced suppression of plant growth through production of L-tryptophan-derived compounds by deleterious rhizobacteria[J]. Plant & Soil, 1994, 172(2): 261-269. DOI:10.1007/BF00011328 |
| [12] |
FELESTRINO ÉRICA B, SANTIAGO I, SILVA FREITAS L D, et al. Plant growth promoting bacteria associated with Langsdorffia hypogaea-rhizosphere-host biological interface:A neglected model of bacterial prospection[J]. Frontiers in Microbiology, 2017, 8(66): 113-122. DOI:10.3389/fmicb.2017.00172 |
| [13] |
朱艳蕾.银砂槐内生细菌分离、生理特性及促生抗逆作用研究[D].西安: 陕西师范大学, 2018.
|
| [14] |
张晓波, 马燕, 熊文娟, 等. 盐碱戈壁药用植物骆驼刺内生菌的分离、培养与鉴定[J]. 生物资源, 2019, 41(1): 53-60. DOI:10.14188/j.ajsh.2019.01.008 |
| [15] |
顾晓洁, 解卓学, 吕嘉东, 等. 白首乌内生细菌分离鉴定及系统发育树分析[J]. 辽宁中医药大学学报, 2018, 20(6): 52-56. DOI:10.13194/j.issn.1673-842x.2018.06.014 |
| [16] |
周先治, 高晖, 李敏, 等. 基于16S rRNA序列研究华重楼植株可培养内生细菌的多样性[J]. 中草药, 2017, 48(18): 3807-3814. DOI:10.7501/j.issn.0253-2670.2017.18.022 |
| [17] |
PALUS J A, BORNEMAN J, LUDDEN P W, et al. A diazotrophic bacterial endophyte isolated from stems of Zea mays L.and Zea luxurians Iltis and Doebley[J]. Plant and Soil, 1996, 186(1): 135-142. DOI:10.1007/bf00035067 |
| [18] |
武利勤, 顾海科, 王青, 等. 石斛内生甲基营养芽胞杆菌的拮抗和促生作用研究[J]. 生物技术通报, 2016, 32(8): 200-206. DOI:10.13560/j.cnki.biotech.bull.1985.2016.08.029 |
| [19] |
唐玉娟.山豆根内生细菌的促生活性菌株筛选及其促生作用研究[D].南宁: 广西大学, 2017.
|
| [20] |
陈建桦, 姚裕群, 李良波, 等. 广西道地药材山豆根的内生菌研究与应用[J]. 广西科学院学报, 2019, 35(1): 6-12. DOI:10.13657/j.cnki.gxkxyxb.20190123.007 |



