2. 桂林医学院药学院, 广西桂林 541004
2. College of Pharmacy, Guilin Medical University, Guilin, Guangxi, 541004, China
喙核桃(Annamocarya sinensis)为胡桃科(Juglandaceae)喙核桃属(Annamocarya)植物,为第三纪古热带孑遗植物[1]。喙核桃果实为核果,球形或卵球形,顶端具鸟喙状尖头,该种仅分布于贵州、广西、云南等少数几个省区[2],其木材结构均匀,花纹美观,是制作军工设备、家具等的优良木材。喙核桃仅有极低比例的种子可萌发成苗。此外,喙核桃的分布区域多年来破坏严重,植株数量日趋减少,已被列为国家二级保护植物[3]。目前,对喙核桃的研究仅有群落调查[4]、木材解剖及其分类位置[5]、保育遗传[6]等方面。为准确揭示喙核桃的遗传多样性,以便于进行后续资源评价、良种选育及种苗繁育等工作,亟需建立其特定的多样性检测体系。
Inter-simple Sequence Repeat (ISSR)分子标记技术由Zietkiewicz等于1994年提出,具有操作简易、成本低、灵敏度高等特点,推出后即被广泛应用于植物遗传多样性研究中[7]。ISSR-PCR扩增反应条件对检测结果至关重要,将该技术用于物种遗传多样性检测时需建立其对应的扩增反应体系。本文将正交和单因素试验相结合,开展dNTPs、Mg2+、引物、Taq DNA聚合酶、模板DNA、循环次数及退火温度对喙核桃ISSR-PCR扩增效果影响的研究,以期建立喙核桃ISSR-PCR最佳反应体系,为其种质资源评价等奠定基础。
1 材料与方法 1.1 材料试验材料2019年8月采于广西壮族自治区中国科学院广西植物研究所的种质资源圃,采集生长良好植株的幼嫩叶片2-3片,冰盒(4℃)带回实验室后用液氮(-80℃)冷冻。样品经广西植物研究所韦霄研究员鉴定。
1.2 试剂与仪器PCR扩增反应体系中所用dNTPs、引物、10×PCR Buffer、Taq DNA聚合酶等试剂全部购自上海生工生物工程技术服务有限公司。
DNA质量检测所用分光光度计为TU-1901型双光束紫外可见分光光度计;PCR扩增采用美国BIO-RAD伯乐公司的PCR仪;DYCP-34型电泳槽和CDYY-6C型电泳仪为北京市六一仪器厂生产。
1.3 方法 1.3.1 喙核桃基因组DNA提取采用CTAB法提取喙核桃叶片总DNA。DNA质量检测采用1%琼脂糖凝胶电泳法和紫外分光光度计检测法。
1.3.2 ISSR-PCR反应体系正交试验用2×uniqueTMTaq Plus Master Mix (with Dye)试剂盒对100条通用引物进行初步筛选,选用引物826 (5′-ACA CAC ACA CAC ACA CC-3′)进行正交试验(L16(45)),设置的因素为Mg2+、Taq DNA聚合酶、dNTPs、引物、DNA模板,每因素设置4个梯度(表 1和表 2)。此外,每个体系中添加2.0 μL的10×PCR Buffer,最后用ddH2O补至20 μL,每个组合重复3次。
| 水平 Levels |
因素Factors | ||||
| dNTPs (mmol/L) |
引物 Primer (μmol/L) |
Mg2+ (mmol/L) |
Taq DNA聚合酶 Taq DNA polymerase (U/20 μL) |
DNA (ng) |
|
| 1 | 0.1 | 0.2 | 1.0 | 0.5 | 30 |
| 2 | 0.2 | 0.4 | 1.5 | 1.0 | 45 |
| 3 | 0.4 | 0.6 | 2.0 | 1.5 | 60 |
| 4 | 0.5 | 0.8 | 2.5 | 2.0 | 75 |
| 编号 Number |
因素Factors | ||||
| dNTPs (mmol/L) |
引物 Primer (μmol/L) |
Mg2+ (mmol/L) |
Taq DNA聚合酶 Taq DNA polymerase (U/20 μL) |
DNA (ng) |
|
| 1 | 0.1 | 0.2 | 1.0 | 0.5 | 30 |
| 2 | 0.1 | 0.4 | 1.5 | 1.0 | 45 |
| 3 | 0.1 | 0.6 | 2.0 | 1.5 | 60 |
| 4 | 0.1 | 0.8 | 2.5 | 2.0 | 75 |
| 5 | 0.2 | 0.2 | 1.5 | 1.5 | 75 |
| 6 | 0.2 | 0.4 | 1.0 | 2.0 | 60 |
| 7 | 0.2 | 0.6 | 2.5 | 0.5 | 45 |
| 8 | 0.2 | 0.8 | 2.0 | 1.0 | 30 |
| 9 | 0.4 | 0.2 | 2.0 | 2.0 | 45 |
| 10 | 0.4 | 0.4 | 2.5 | 1.5 | 30 |
| 11 | 0.4 | 0.6 | 1.0 | 1.0 | 75 |
| 12 | 0.4 | 0.8 | 1.5 | 0.5 | 60 |
| 13 | 0.5 | 0.2 | 2.5 | 1.0 | 60 |
| 14 | 0.5 | 0.4 | 2.0 | 0.5 | 75 |
| 15 | 0.5 | 0.6 | 1.5 | 2.0 | 30 |
| 16 | 0.5 | 0.8 | 1.0 | 1.5 | 45 |
预扩增程序:首先94℃预变性5 min;94℃变性30 s,52.9℃退火30 s,72℃延伸30 s,循环40次; 以上循环结束后72℃延伸10 min。扩增产物采用1.5%的琼脂糖电泳1.5 h左右,然后置EB液(0.5 μg/mL)中染色20 min,最后置UVP凝胶成像系统中拍照。
1.3.3 喙核桃ISSR-PCR扩增单因素试验以优选出的正交组合为基础进行单因素试验,设置水平分别为Mg2+浓度0.5, 1.0,1.5,2.0,2.5,3.0 mmol/L;Taq DNA聚合酶浓度0.25,0.5,1.0,1.5,2.0,2.5 U/20 μL;引物浓度0.1,0.2,0.4,0.6,0.8,1.0 μmol/L;模板DNA 15,30,45,60,75,90 ng;dNTPs浓度0.1,0.2,0.3,0.4,0.5,0.6 mmol/L。
1.3.4 ISSR-PCR反应程序优化退火温度设置为理论退火温度Tm±5℃,共12个梯度。循环次数设20,25,30,35,40,45次。
2 结果与分析 2.1 正交试验结果5因素4水平正交试验的结果如图 1所示,组合1,7,14,15,16的扩增效果最差,基本无条带扩出。组合2,4,5条带强度弱且背景模糊。组合3,8,9,10,11,12,13扩增效果虽稍好,但仅能扩增出3条条带。组合6条带多且背景也较为清晰。综合以上分析结果可知,组合6多态性丰富、条带清晰,可用于后续研究。
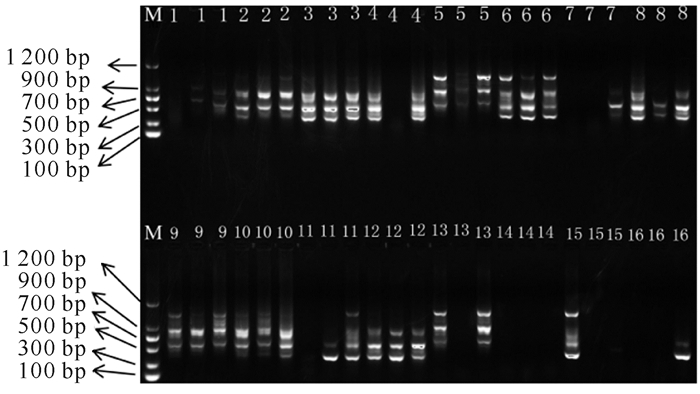
|
| M:DL1200 DNA marker; 1—16 represent 16 groups of orthogonal test 图 1 ISSR-PCR正交试验结果 Fig.1 Orthogonal test results of ISSR-PCR |
2.2 Mg2+浓度对ISSR-PCR扩增效果的影响
由图 2可知,Mg2+浓度低时扩增效果较差。提高Mg2+浓度,其条带数目增加且清晰度也有较大提高。当浓度为3.0 mmol/L时多态性和清晰度最好,故该浓度为最佳Mg2+浓度。
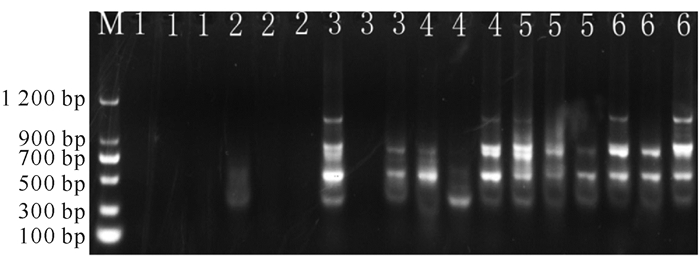
|
| M:DL1200 DNA marker; 1—6 represent Mg2+ concentrations of 0.5, 1.0, 1.5, 2.0, 2.5, 3.0 mmol/L 图 2 Mg2+浓度对ISSR-PCR扩增效果的影响 Fig.2 Effect of Mg2+ concentration on ISSR-PCR amplification |
2.3 dNTPs对ISSR-PCR扩增效果的影响
dNTPs对ISSR-PCR扩增结果的影响如图 3所示。当dNTPs浓度较低时(0.1 mmol/L),扩增条带数较少;提高dNTPs浓度,扩增条带数与清晰度增强,因此dNTPs浓度为0.5 mmol/L时效果最好。
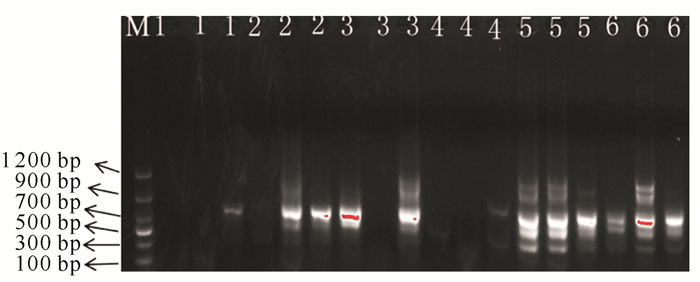
|
| M:DL1200 DNA marker; 1—6 represent dNTPs concentrations of 0.1, 0.2, 0.3, 0.4, 0.5, 0.6 mmol/L 图 3 dNTPs浓度对ISSR-PCR扩增效果的影响 Fig.3 Effect of dNTPs concentration on ISSR-PCR amplification |
2.4 Taq DNA聚合酶对ISSR-PCR扩增效果的影响
不同浓度的Taq DNA聚合酶扩增结果如图 4所示,低浓度的Taq DNA聚合酶基本扩增不出条带。提高Taq DNA聚合酶浓度后,扩增条带数目和清晰度明显改善,且Taq DNA聚合酶浓度为2.5 U/20 μL时扩增效果最好。
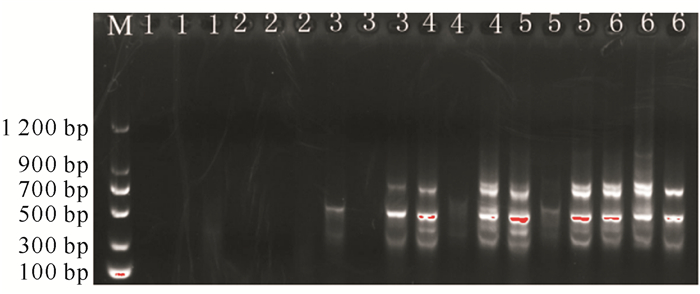
|
| M:DL1200 DNA marker; 1—6 represent Taq polymerase concentrations of 0.25, 0.5, 1.0, 1.5, 2.0, 2.5 U/20 μL 图 4 Taq DNA聚合酶浓度对ISSR-PCR扩增效果的影响 Fig.4 Effect of Taq DNA polymerase concentration on ISSR-PCR amplification |
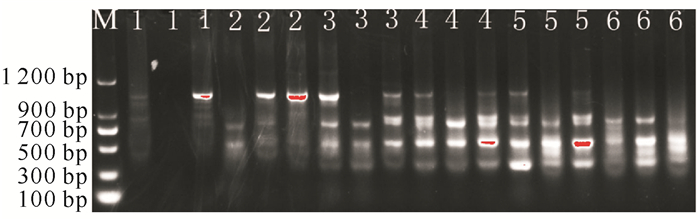
2.5 引物对ISSR-PCR扩增效果的影响
不同浓度引物对ISSR-PCR结果的影响如图 5所示,不同浓度的引物扩增出的条带数基本相同,且以引物浓度为0.8 μmol/L时扩增的条带最为清晰,可确定引物的最佳浓度为0.8 μmol/L。
|
| M:DL1200 DNA marker; 1—6 represent primer concentrations of 0.1, 0.2, 0.4, 0.6, 0.8, 1.0 μmol/L 图 5 引物浓度对ISSR-PCR扩增效果的影响 Fig.5 Effect of primer concentration on ISSR-PCR amplification |
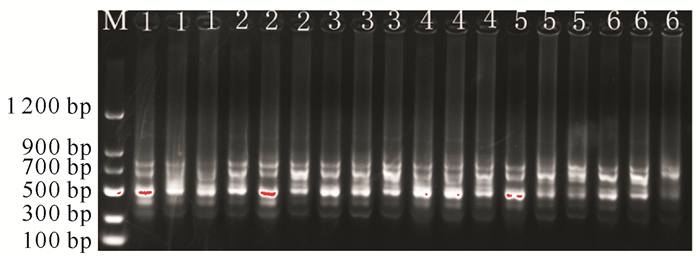
2.6 喙核桃模板DNA浓度对ISSR-PCR扩增效果的影响
喙核桃模板DNA浓度对ISSR-PCR的影响如图 6所示,DNA浓度为15-90 ng时扩增出的带型基本相同,且以45 ng时扩增出的条带强度较高,故该浓度为模板DNA最佳浓度。
|
| M:DL1200 DNA marker; 1—6 represent DNA concentrations of 15, 30, 45, 60, 75, 90 ng 图 6 模板DNA浓度对ISSR-PCR扩增效果的影响 Fig.6 Effect of template DNA concentration on ISSR-PCR amplification |
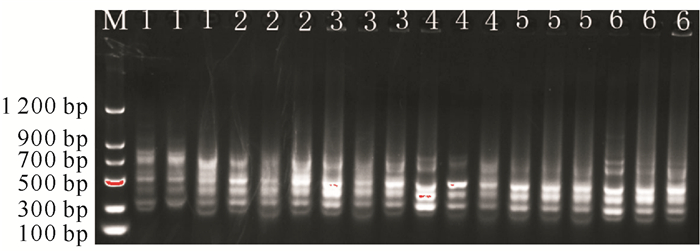
2.7 PCR循环次数对ISSR-PCR扩增效果的影响
PCR循环次数对ISSR-PCR的影响如图 7所示,随着循环次数的增加,条带数目及条带强度逐渐增强。循环次数为40时即可得到清晰的条带,再增加循环次数条带清晰度变化不大。
|
| M:DL1200 DNA marker; 1—6 represent cycles of 20, 25, 30, 35, 40, 45 图 7 循环次数对ISSR-PCR扩增效果的影响 Fig.7 Effect of cycle times on ISSR-PCR amplification |
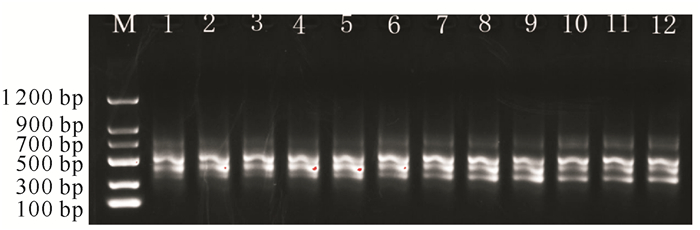
2.8 退火温度对ISSR-PCR扩增效果的影响
退火温度对PCR扩增结果的影响如图 8所示,退火温度升高,扩增出的条带数目呈降低趋势。综合考量条带数和清晰度,本文确定54.4℃为最适退火温度。
|
| M:DL1200 DNA marker; 1—6 represent annealing temperature of 47.0, 47.2, 47.7, 48.5, 49.6, 51.1, 52.9, 54.4, 55.5, 56.3, 56.8, 57.0℃ 图 8 退火温度对ISSR-PCR扩增效果的影响 Fig.8 Effect of annealing temperature on ISSR-PCR amplification |
3 讨论
建立稳定、可靠的ISSR-PCR反应体系对于后续的遗传多样性分析至关重要。单独采用单因素试验优化组合时仅考量了各因素不同水平对试验结果的影响,忽略了各因素间的交互作用,很大程度上降低了最佳反应水平的可靠程度[8-9]。正交试验设计既考虑了多因素各水平的相互作用,且能利用最少的组合数考察因素和水平对结果的影响程度,得出最佳组合,故而越来越多的研究者将该方法用于试验体系建立的研究中[10]。本试验先用正交试验进行初步筛选,再用单因素试验优化,极大地减少了试验次数和时间,快速建立了喙核桃的ISSR-PCR反应体系。
ISSR扩增结果受Taq DNA聚合酶、dNTPs、模板DNA、引物等诸多因素影响,这些因素间也存在较为复杂的相互作用。例如:dNTPs分子含有的磷酸基团可与Mg2+结合,从而降低反应体系中的Mg2+浓度[10],故在试验前需对各因素的比例进行优化组合。试验结果显示,喙核桃的ISSR-PCR反应体系对Mg2+浓度要求严格,浓度低时无法扩增出条带,对其他因素(Taq DNA聚合酶、dNTPs、模板DNA、引物)则要求不太严格。这可能是由于反应体系中其他组分对Mg2+都较为敏感,如Taq DNA聚合酶对Mg2+浓度极为敏感,是Mg2+依赖性酶,故Mg2+可与其他组分结合,最终影响PCR扩增的效率和特异性。
除反应体系中各组分会对ISSR-PCR扩增结果产生重要影响外,扩增程序对扩增结果同样至关重要,尤其是引物退火温度[11]。每条引物虽会提供其理论退火温度,但实际温度与理论值不符的现象也时有发生,故试验前需对引物退火温度值进行筛选。本试验中发现退火温度对扩增结果影响显著,当温度为51.1-57℃,扩增效果好,条带较为清晰。该结果与其他研究结果相一致,即较高的退火温度可提高反应的特异性及清晰度[12]。
4 结论喙核桃的ISSR-PCR反应体系对Mg2+浓度要求严格,其最佳ISSR-PCR扩增体系及程序为20 μL的反应体系含dNTPs 0.5 mmol/L、Mg2+ 3.0 mmol/L、引物0.8 μmol/L、Taq DNA聚合酶2.5 U、模板DNA 45 ng、10×PCR Buffer 2.0 μL。退火温度为54.4℃,循环次数为40次。
| [1] |
覃海宁, 刘演. 广西植物名录[M]. 北京: 科学出版社, 2010.
|
| [2] |
中国科学院中国植物志编辑委员会. 中国植物志:21卷[M]. 北京: 科学出版社, 1979.
|
| [3] |
国家环境保护局, 中国科学院植物研究所. 中国珍稀濒危保护植物名录:第一册[M]. 北京: 科学出版社, 1987.
|
| [4] |
杨金华, 宋宗强, 粟远和, 等. 通道县南部喙核桃群落调查[J]. 绿色科技, 2016(24): 89-93. |
| [5] |
喻诚鸿, 李沛. 喙核桃的木材解剖及其在分类学上的位置[J]. 植物学报, 1954, 3(3): 321-332. |
| [6] |
ZHANG Z Y, PANG X M, HAN J W, et al. Conservation genetics of Annamocarya sinensis (Dode) Leroy, an endangered endemic species[J]. Genetics and Molecular Research, 2013, 12(3): 3965-3974. |
| [7] |
周武, 王驰, 胡娜, 等. 中国沙棘ISSR-PCR反应体系的建立和优化[J]. 分子植物育种, 2019, 17(16): 5357-5367. |
| [8] |
彭昕, 吉庆勇, 李玉兰, 等. 濒危药用植物三叶青ISSR分子标记的建立[J]. 中成药, 2015, 37(7): 1507-1514. |
| [9] |
崔洁, 王丹丹, 王倩玉, 等. 山西与内蒙产蒙古黄芪的ISSR体系优化及遗传多样性分析[J]. 天然产物研究与开发, 2019, 31(11): 1941-1948. |
| [10] |
高慧新, 严炯艺, 王明杰, 等. 白花蛇舌草ISSR反应体系的建立与优化[J]. 江苏农业科学, 2018, 46(23): 72-74. |
| [11] |
余伟军, 姚红, 孙瑞琦, 等. 铁线莲属植物ISSR-PCR反应体系优化及遗传多样性分析[J]. 植物资源与环境学报, 2019, 28(2): 42-48. |
| [12] |
赵琬玥, 冷秋思, 熊健, 等. 全缘叶绿绒蒿ISSR体系的建立与优化[J]. 北方园艺, 2018(13): 80-86. |



