2. 山东滨州北海经济开发区海洋与渔业局, 山东滨州 251907
2. Marine and Fisheries Bureau of Shandong Binzhou Beihai, Binzhou, Shandong, 251907, China
南非斑节对虾(Penaeus monodon)又名金刚对虾,分类学上隶属于节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)对虾科(Penaeidae)对虾属(Penaeus),是对虾属中大型种。原产于非洲莫桑比克等地,具有个体大、肉质鲜美、营养丰富、生长速度快、抗病能力较强、离水后耐力强等优良特性,烹饪后虾体呈鲜红色,品相优良,饲料蛋白含量要求相对较低,更为符合农业绿色环保的要求,适应盐度范围2~30,适宜集约化(工厂化)、生态工业化、淡水半精养、海水生态化等多种养殖模式[1]。
肠道是对虾体内最重要的消化吸收器官,肠道微生物在水产动物生长代谢、营养吸收和免疫抗病等方面发挥着重要作用,与宿主相互依赖、相互制约,在长期的进化过程中形成独特的肠道微生态系统,其结构多样性与组成是影响宿主健康的重要因素[2-4]。肠道正常菌群的结构和功能在对虾养殖中作用突出,其既可以增强对虾机体的免疫机能,又可以与肠道黏膜构成病原菌防控的有力屏障,共同抵御病原微生物的入侵,保持机体内环境的稳定[5-6]。对南非斑节对虾肠道特征的研究有助于了解宿主与菌群间的相互作用关系,并为南非斑节对虾养殖用微生物制剂的研发和环保饲料配方的优化提供理论依据。
1 材料与方法 1.1 材料健康、规格整齐的南非斑节对虾来自山东滨州某养殖场,体长约(5±0.5) cm,随机放入养殖池内,500尾/m2。试验所用基础饲料为大乐饲料有限公司对虾专用配合饲料,主要营养成分见表 1。
| 营养成分 Nutrient ingredients |
质量比 Mass fraction (%) |
| 粗蛋白质 Crude protein |
≥44.0 |
| 粗脂肪 Crude fat |
≥4.0 |
| 粗纤维 Crude fibe |
≤6.0 |
| 粗灰分 Crude ash |
≤16.0 |
| 钙 Calcium |
≤5.0 |
| 总磷 Total phosphorus |
≥1.2 |
| 赖氨酸 Lysine |
≥2.2 |
| 湿度 Moisrure |
≤11 |
1.2 饲养条件
试验水源为自然海水,水温(26±1)℃,pH值为7.2~7.8,24 h充气,溶氧量为5.5~6.5 mg/L,氨氮<0.4 mg/L。养殖池面积40 m2,水深1 m,养殖水源为地下水曝气消毒后经调温直接流入养殖池中,每日添加10%新水作为补充,试验过程中正常管理,每天分别于6:00,14:00,22:00饱食投喂,投饵量以投饵后2 h内吃完为佳。
1.3 样品采集及检测 1.3.1 样品采集正常养殖试验一月后,随机从每个平行中抽取50尾活力健康的南非斑节对虾(按照四角加中心位置,每点随机取10尾对虾,五点共50尾),经本实验室PCR检测,不携带对虾白斑症病毒(WSSV)、对虾桃拉病毒(TSV)、对虾肝胰腺坏死综合症致病性弧菌(AHPND)、对虾肝肠胞虫(EHP)等主要病原。样品在无菌条件下,冰上剖取前中肠样品,无菌预冷生理盐水冲洗、一次性无菌棉球擦拭干燥后,将肠道组织和内容物分别保存,取部分前肠样品置于Bouin氏液中,内容物置于-80℃保存备用。
1.3.2 组织结构静置24 h的组织样品,进行常规石蜡连续横切片,厚度为7 μm,苏木素-伊红染色,光学显微镜(Olympus,BX53)下(100×,400×)进行观察、拍照。
1.3.3 肠道菌群结构特征利用QUAGEN试剂盒提取肠道内容物基因组DNA,扩增V3+V4区(引物319F:5′-ACTCCTACGGGAGGCAGCAG-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′);通过杭州联川生物技术股份有限公司Illumina MiSeq 2×300 bp paired-end测序平台进行分析,步骤如下:(1)将原始数据去除reads的barcode和接头序列,去除含有无法确定碱基信息>5%的序列,去除低质量序列,进行有效序列和优质序列的统计;(2)在97%相似度下将16S rRNA Unique Reads聚类进行Operational Taxonomy Unit (OTU)丰度统计,初步说明样品中物种丰富程度;(3)通过绘制OTU数目变化与聚类similarity值之间的关系图,从中选择最佳的similarity值进行OTU分析和分类学分析;(4)统计Alpha多样性值,包括Shannon、Simpson、Chao1指数,揭示物种群落差异,且从门水平上对不同菌群分布的均匀度进行分析;(5)稀释曲线(Rarefaction curve),对测序序列进行随机抽样,以抽到的序列数与其所能代表OTU的数目构建曲线;(6)将门、目、属水平上的分类信息分别进行聚类分析后作出Heatmap图,能够反应样品的相似性。
1.3.4 肠道微生物代谢特征Average Well Color Development (AWCD)可以用来指示南非斑节对虾肠道微生物随时间的变化的整体代谢平均活性。将3个平行组的随机样品分别低温混合后用于Biolog ECO检测(参照李志斐等[7]方法、结合仪器说明书进行)。BiologTM的ECO测试板(ECO MicroPlate,USA)含有3套31种不同碳源(其中氨基酸类6种、糖类10种、羧酸类7种、聚合物类4种、胺类2种和酚类2种)。将样品混合物按照一定比例用0.9%(W/V)生理盐水稀释后,倒在无菌加样槽中,然后加样于25℃预热的Biolog ECO微平板中,每孔加入150 μL。将加好样的Biolog ECO微平板加盖,28℃恒温培养,每隔24 h读取各孔在590 nm波长下的光密度,连续测定5 d,每个样品做3个重复。肠道微生物的整体代谢活性用平均吸光值AWCD表示,其计算公式为AWCD=∑(Ci-R)/n,式中:Ci为所测定的31个碳源孔的吸光值;R为对照孔的吸光值;n为培养基碳源总数(本研究中为31)。
2 结果与分析 2.1 肠道组织形态特征如图 1所示,南非斑节对虾肠壁结构薄且清晰,由内腔面向外依次为上皮(单层柱状上皮细胞)、基膜、肌层和结缔组织;肠上皮细胞紧密连接,细胞游离面丰富的微绒毛排列整齐、致密;外层结缔组织较厚,可见血窦分布。

|
| 图 1 南非斑节对虾肠道组织形态结构 Fig.1 Intesitnal section morphology of Penaeus monodon |
2.2 肠道菌群结构特征
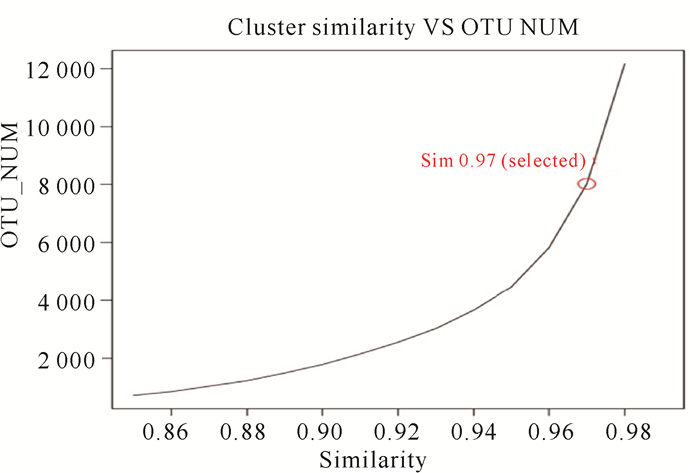
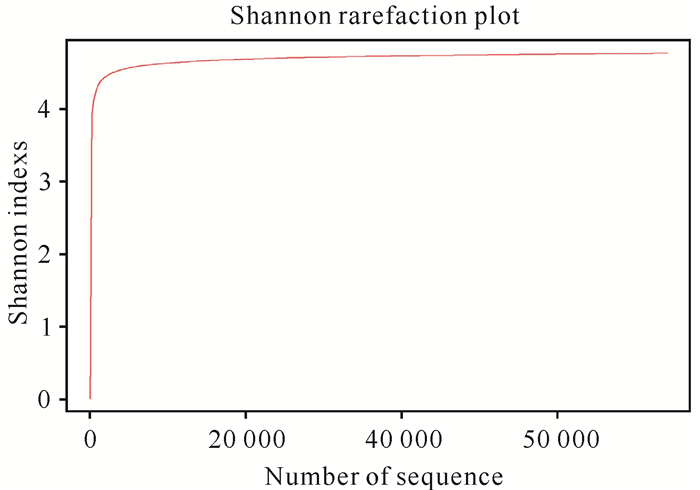
表 2呈现了南非斑节对虾肠道菌群结构特征,反映了肠道中细菌的优势关系。统计获得相似性>97%的OTU数量达4 264。Chao 1指数代表群落丰富度,Shannon、Simpson指数与群落多样性指数呈正比,分别为29 049.62,4.84,0.04。后续进行OTU分析和分类学分析的最佳聚类Similarity值如图 2所示。使用97%相似度的OTU制作的稀释曲线图不仅表现了样本中物种的丰富度,也说明了样本的测序数据量的合理性;曲线趋向平坦时,测序数据量合理,更多的数据量只会产生少量新的OTU(图 3)。
| Valid data | High sequences | OTU | Diversity indexes | ||
| Chao 1 | Simpson | Shannon | |||
| 82 912 | 74 183 | 4 264 | 29 049.62 | 0.04 | 4.84 |
|
| 红字标示的是本次分析使用的Similarity值 The red character indicates the similarity value used in this analysis 图 2 OTU数目与聚类Similarity值(0.86~0.99)关系 Fig.2 Relation of OTU number and cluster similarity value (0.86-0.99) |
|
| 图 3 Alpha指数稀释曲线 Fig.3 Dilution curve of Alpha index |
南非斑节对虾肠道中优势菌门类主要包括变形菌门Proteobacteria、浮霉菌门Planctomycetes、放线菌门Actinobacteria、疣微菌门Verrucomicrobia,其中变形菌门的含有量高达65.69%(表 3)。从目的水平上分析,肠道菌群中比例最高的是红杆菌目Rhodobacterales,占53.97%;其次是浮霉菌目Planctomycetales,占14.86%,再次是酸微菌目Acidimicrobiales,占6.26%(表 4)。从属的水平上分析,含量表现为unclassified>鲁杰氏菌属Ruegeria>玫瑰变色菌属Roseovarius>肠杆菌属Ilumatobacter>红假单胞菌属Rhodopirellula>热带单胞菌Tropicimonas>Thermogutta(表 5)。经聚类分析后heatmap,不同的位置条带表示不同的细菌菌属,聚类分析结果同丰度结果相同(图 4)。
| 门 Phylum |
Frequence(%) |
| 变形菌门 Proteobacteria |
65.69 |
| 厚壁菌门 Firmicutes |
1.44 |
| 放线菌门 Actinobacteria |
9.69 |
| 拟杆菌门 Bacteroidetes |
1.77 |
| 疣微菌门 Verrucomicrobia |
2.23 |
| 浮霉菌门 Planctomycetes |
15.51 |
| 目 Order |
Frequence(%) |
| 红杆菌目 Rhodobacterales |
53.97 |
| 浮霉菌目 Planctomycetales |
14.86 |
| 酸微菌目 Acidimicrobiales |
6.26 |
| 交替单胞菌目 Alteromonadales |
1.93 |
| 黄杆菌目 Flavobacteriales |
1.43 |
| 疣微菌目 Verrucomicrobiales |
1.88 |
| 海洋螺菌目 Oceanospirillales |
1.39 |
| 放线菌目 Actinomycetales |
3.11 |
| 脱硫杆菌目 Desulfobacterales |
2.37 |
| Unclassified | 4.28 |
| 属 Genus |
Frequence(%) |
| Unclassified | 18.91 |
| 鲁杰氏菌属Ruegeria | 14.41 |
| 玫瑰变色菌属Roseovarius | 11.67 |
| Thermogutta | 3.18 |
| 肠杆菌属Ilumatobacter | 5.75 |
| 红假单胞菌属Rhodopirellula | 4.08 |
| Marivita | 2.03 |
| Aliiroseovarius | 1.43 |
| Oceanicola | 2.53 |
| 热带单胞菌Tropicimonas | 3.77 |
| Blastopirellula | 2.21 |
| Gimesia | 2.08 |

|
| 图 4 门、目、属水平物种热图分析 Fig.4 Species heat map analysis at Phyla, Order and Genus level |
2.3 肠道微生物代谢活性变化
通过平均吸光值AWCD显示肠道微生物代谢活性总体变化趋势,24 h呈现较低吸光值(即微生物代谢活性较弱),随时间的延长,吸光值呈上升趋势(即微生物代谢活性逐渐增加),直至144 h后微生物代谢活性趋于平稳(图 5)。

|
| 图 5 南非斑节对虾肠道微生物平均吸光值AWCD变化特征 Fig.5 Variation characteristics of average well color development (AWCD) of intestine microorganism in Penaeus monodon |
3 讨论
南非斑节对虾肠道组织结构和凡纳滨对虾基本一致,其肠道作为对虾消化吸收的主要部位,同时行使着机械屏障、免疫屏障和生物屏障3大功能[8-9]。南非斑节对虾肠上皮细胞发挥着吸收和分泌黏液的功能,表层紧密的微绒毛可通过增大细胞表面积而提高营养物质的吸收和有益微生物的附着,正常的组织结构亦是保证肠道免疫功能、维持肠道健康的基础。当外界有益物质给予或病害入侵时,肠道组织结构可作为反映宿主机体健康的指标之一。熊家等[10]、郑晓婷等[11]分别研究了酵母水解物、植物乳酸杆菌对凡纳滨对虾肠道组织形态的影响,结果均反映了对虾肠道组织结构的重要性以及对外界干预条件的效果评价,为后续研究奠定基础。
肠道微生物研究最早是通过传统培养技术实现的,如微生物富集培养、分离纯化、生化鉴定和血清学鉴定等;然而,传统技术受培养条件的局限性,且只能进行一般的表性特性描述,导致了诸多未可培养微生物占了一定的比例,因此,无法完整地反映出分析样本中的微生物群落结构[12-13]。后来兴起的DGGE和RFLP等技术,是以细菌16S rRNA为基础,但这些方法的分析通量有限,难以揭示肠道微生物的复杂多样性结构或潜在的功能性特征[14-15]。近年来,高通量测序技术迅速发展,借助大数据软件,能够准确地反映出微生物整体的菌群结构,即使含量很少的微生物菌群也能检测到,因此被广泛运用到目前的研究中[16-18]。本研究利用Illumina高通量测序技术分析南非斑节对虾肠道细菌群落组成,更加全面地反映了南非斑节对虾肠道微生物菌群组成及丰度信息,可为后期病害防控、功能预测等奠定基础,为从群落水平上了解认识微生物活动提供了可能性。结果显示,南非斑节对虾肠道菌群结构中门水平上变形菌门含量最多,其次是浮霉菌门,目水平上是红杆菌目、浮霉菌目,而属水平上含量最多的是未分类菌属,其次是鲁杰氏菌属、玫瑰变色菌属。这与凡纳滨对虾的研究结果相似。在本团队以前的研究中发现[19],变形菌是对虾肠道内主要的菌群;杨坤杰等[20]通过对健康和患病凡纳滨幼虾肠道群落分析发现,在健康幼虾肠道中变形菌纲丰度较高,能够维持肠道微生物的多样性,从而可以增强宿主健康,减少病害的发生;尚碧娇等[21]利用高通量测序技术研究益生菌对凡纳滨对虾肠道菌群结果的影响,结果显示,益生菌可以扩增对虾肠道微生物菌群丰度,并能抑制弧菌属等有害菌群的生长,从而提高对虾体质量增加率并降低死亡率。目前,关于南非斑节对虾肠道细菌多样性的研究鲜有报道,本研究的数据能够为南非斑节对虾肠道组织结构及其微生物特性研究提供有效的可靠的参考。在今后的研究中将对优势菌群进行深入分析,发现细菌群落结构在时间或空间上的动态变化,结合大片段基因组文库或组学技术发现新的序列或功能,进而探讨肠道微生物在养殖动物生长、健康方面的作用机制。
微生物代谢功能的研究是环境微生物群落研究的核心内容之一,肠道微生物更是肠道生态环境中的主要角色。Biolog ECO技术是根据环境微生物单一碳源利用活性和类型,对不同微生物群体差异进行分析的方法,因其具有灵敏度高、分辨力强、无须分离纯培养、测定简便等优点而被广泛使用[22-24]。Biolog ECO分析使微生物对不同碳源的代谢能力分析效率大大提高,在微平板上通过平均颜色变化读数反映微生物对不同碳源的整体利用能力。微生物群落水平多样性不仅关系着微生物对营养物质尤其是碳源的利用情况,而且关系着对其中某一营养物质的绝对利用情况,进而更好地了解微生物群落代谢特征[25]。本实验中南非斑节对虾肠道AWCD表现出了代谢活性的变化情况,Biolog ECO微平板培养24 h肠道微生物整体代谢活性较弱,然而随着时间的延长,微生物利用碳源能力逐渐增强,直至144 h后趋于平稳,推测是肠道微生物相关代谢产物提供了一定的营养物质,加速了其对碳源的利用以及对有机物的降解,致使AWCD值逐渐升高,直观地体现微生物群落反应速度和最终达到的程度。这些结果可为后续研究肠道微生物参与机体代谢以及从代谢功能方面评价外源添加剂在养殖中的应用效果提供理论数据参考。
4 结论本研究基于HE染色组织切片、高通量测序、Biolog ECO技术,探讨工厂化养殖模式中南非斑节对虾肠道组织结构形态、菌群特征及肠道微生物代谢活性,本研究结果能够为南非斑节对虾肠道组织结构、微生物特性以及后续代谢研究提供有效的、可靠的参考,对于实际养殖南非斑节对虾具有一定的指导意义。
| [1] |
杨纪忠, 谢林荣, 何家才, 等. 南非斑节对虾低盐度养殖试验[J]. 水产养殖, 2018(5): 41-42. |
| [2] |
王栋栋, 田相利, 汪多, 等. 五种不同添加物对凡纳滨对虾肠道菌群结构影响的研究[J]. 海洋湖沼通报, 2018(3): 132-141. |
| [3] |
CAHENZLI J, KÖLLER Y, WYSS M, et al. Intestinal microbial diversity during early-life colonization shapes long-term IgE levels[J]. Cell Host & Microbe, 2013, 14(5): 559-570. |
| [4] |
陈晓瑛, 王国霞, 孙育平, 等. 饲料中添加低聚木糖对凡纳滨对虾幼虾消化酶活力、肠道形态及细菌数量的影响[J]. 动物营养学报, 2018, 30(4): 1522-1529. |
| [5] |
张家松, 段亚飞, 张真真, 等. 对虾肠道微生物菌群的研究进展[J]. 南方水产科学, 2015, 11(6): 114-119. |
| [6] |
郁维娜, 戴文芳, 陶震, 等. 健康与患病凡纳滨对虾肠道菌群结构及功能差异研究[J]. 水产学报, 2018, 42(3): 399-409. |
| [7] |
李志斐, 谢骏, 郁二蒙, 等. 基于Biolog-ECO技术分析杂交鳢和大口黑鲈高产池塘水体微生物碳代谢特征[J]. 农业环境科学学报, 2014, 33(1): 185-192. |
| [8] |
VAUGHAN E E, SCHUT F, HEILIG H G H J, et al. A molecular view of the intestinal ecosystem[J]. Current Issues in Intestinal Microbiology, 2000, 1(1): 1-12. |
| [9] |
LI X H, ZHOU L, YU Y H, et al. Composition of gut microbiota in the gibel carp (Carassius auratus gibelio) varies with host development[J]. Microbial Ecology, 2017, 74(1): 239-249. |
| [10] |
熊家, 袁野, 罗嘉翔, 等. 酵母水解物对凡纳滨对虾生长、消化酶活性和肠道形态的影响[J]. 中国水产科学, 2018, 25(5): 1012-1021. |
| [11] |
郑晓婷, 段亚飞, 董宏标, 等. 植物乳酸杆菌对凡纳滨对虾生长、消化酶活性和肠道组织形态的影响[J]. 水产科学, 2016, 35(1): 1-6. |
| [12] |
曹荣, 张井, 孟辉辉, 等. 高通量测序与传统纯培养方法在牡蛎微生物群落分析中的应用对比[J]. 食品科学, 2016, 37(24): 137-141. |
| [13] |
AMANN R I, LUDWIG W, SCHLEIFER K H. Phylogenetic identification and in situ detection of individual microbial cellswithout cultivation[J]. Microbiological Reviews, 1995, 59(1): 143-169. |
| [14] |
罗鹏, 胡超群, 张吕平, 等. 凡纳滨对虾海水养殖系统内细菌群落的PCR-DGGE分析[J]. 中国水产科学, 2009, 16(1): 31-38. |
| [15] |
孙庆华, 柏耀辉, 赵翠, 等. DGGE、T-RFLP、LH-PCR对两种活性污泥的微生物种群多样性分析的比较[J]. 环境工程学报, 2009, 3(8): 1365-1370. |
| [16] |
李志勇, 何丽明, 吴杰, 等. 基于PCR-DGGE基因指纹的对虾体内优势细菌组成分析[J]. 微生物学通报, 2005, 32(3): 82-86. |
| [17] |
温崇庆, 何瑶瑶, 薛明, 等. 高通量测序分析DNA提取引起的对虾肠道菌群结构偏差[J]. 微生物学报, 2016, 56(1): 130-142. |
| [18] |
周子寒, 彭绍亮, 伯晓晨, 等. 基于高通量测序技术的微生物检测数据分析方法[J]. 生物化学与生物物理进展, 2017, 44(1): 58-69. |
| [19] |
樊英, 王晓璐, 李乐, 等. 基于高通量测序的不同养殖系统下凡纳滨对虾肠道和水体中微生物的多样性[J]. 广西科学院学报, 2017, 33(4): 261-267, 273.. |
| [20] |
杨坤杰, 王欣, 熊金波, 等. 健康和患病凡纳滨对虾幼虾消化道菌群结构的比较[J]. 水产学报, 2016, 40(11): 1765-1773. |
| [21] |
尚碧娇, 左志晗, 窦春萌, 等. 高通量测序法分析两株益生菌对凡纳滨对虾肠道菌群结构的影响[J]. 水产学报, 2018, 42(12): 113-122. |
| [22] |
席劲瑛, 胡洪营, 钱易. Biolog方法在环境微生物群落研究中的应用[J]. 微生物学报, 2003, 43(1): 138-141. |
| [23] |
Biolog[EB/OL].[2019-10-11].https://www.biolog.com.
|
| [24] |
GARLAND J L, MILLS A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351-2359. |
| [25] |
陈禹竹, 唐琦勇, 顾美英, 等. 盐爪爪根部微生物分布特征及盐浓度对碳源代谢分析的影响[J]. 微生物学通报, 2019, 46(11): 2900-2908. |



