2. 中国科学院海洋研究所, 中国科学院实验海洋生物学重点实验室, 山东青岛 266071;
3. 日照市水产集团总公司, 山东日照 276800
2. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao, Shandong, 266071, China;
3. Rizhao Fisheries Group General Corparation, Rizhao, Shandong, 276800, China
大泷六线鱼(Hexagrammos otakii)隶属鲉形目(Scorpaeniformes),六线鱼科(Hexagrammidae),六线鱼属(Hexagrammos),俗称“海黄鱼”,主要分布于朝鲜、日本以及我国渤海、黄海和东海海域[1-2]。大泷六线鱼属于近海冷温性底栖鱼类,喜欢在白天活动,常栖息在岩礁或者岛屿周边,是我国北方黄渤海地区典型的恋礁性经济鱼类,也是我国重要的海洋牧场资源增殖品种。因大泷六线鱼外形美观,肉质鲜嫩、营养价值高,其市场需求的日益增加,大泷六线鱼捕捞量也随之逐年加大,种群数量和规格变小,野生种质资源水平大幅下降[3]。深入开展山东省内大泷六线鱼种群状况和遗传背景调查,有利于合理开发和利用保护地方渔业种质资源。自20个世纪70年代开始,国内外学者陆续在大泷六线鱼生理学、摄食营养、人工繁育和大规格苗种培育等方面开展系列研究[4-11]。在分子标记方面,Crow等[12]对日本、远东和美国六线鱼属的分子系统和进化情况进行研究,李莹等[13]采用D-loop序列对6个大泷六线鱼不同地理群体进行遗传多样性分析,武世雄等[14]开展基于微卫星标记的大泷六线鱼遗传多样性的微卫星分析。线粒体DNA(Mitochondrial DNA,mtDNA)是细胞核外唯一存在的具有自我复制功能的DNA,其进化效率远高于单拷贝核基因,较少的线粒体DNA样本就能代表一个群体[15-16]。mtDNA具有不编码蛋白质、受进化压力较小、积累了较多的突变、进化速度最快等特点,是开展动物种群遗传学研究的首选[17],其中线粒体基因控制区(Control Region, CR)和细胞色素b基因(Cytb)序列是mtDNA中最常用的两种分子标记,广泛应用于鱼类种群遗传学和系统发育学中[18-20]。本研究通过对山东省近海沿岸3个大泷六线鱼野生群体和北黄海的1个大泷六线鱼野生群体(离岸,靠近辽宁长海县海域)的线粒体CR和Cytb基因序列进行对比,分析山东省内大泷六线鱼的序列特征和遗传多样性背景,了解山东省近岸群体和北黄海群体遗传差异和分化情况,为合理开发保护山东省地方渔业种质资源提供基础性资料。
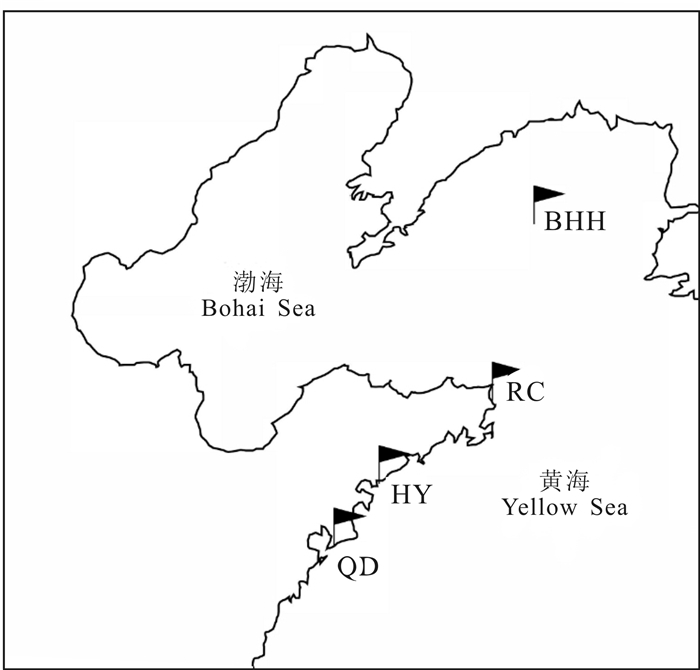
1 材料与方法 1.1 样本采集本研究中采用的大泷六线鱼主要取自青岛(36°5′13.03″N,120°22′59.38″E,下文简称QD)、海阳(36°36′20.63″N,121° 3′7.50″E,下文简称HY)、荣成(37°15′31.46″N,122°35′12.23″E,下文简称RC)近岸沿海及北黄海离岸海域(38°50′41.10″N,123°28′55.56″E,下文简称BHH),共计个数为114尾。4个地理群体样品均为拖网捕获,标本选取体长为10 cm左右的健康、形态完整的大泷六线鱼,取背部肌肉组织存放于无水乙醇中,保存在-20℃冰箱备用。具体采样地点见图 1。
|
| 图 1 4个大泷六线鱼群体的采样地点 Fig.1 Sampling sites of four populations of Hexagrammos otakii |
1.2 基因组DNA提取
取冷冻保存的每条鱼肌肉组织约30 mg,采用海洋动物组织基因组DNA提取试剂盒(北京天根生化科技有限公司)提取基因组DNA,用适量TE溶解沉淀物,充分溶解待用。
1.3 引物设计选取通用引物CR和Cytb,其中CR引物为3′-TAACTCCCACCCCTAACTC-5′、5′-CCATTAACTTATGTAAGCGTCG-3′;Cytb引物:3′-TACGGCTCCTACCTCTACAAA-5′、5′-CTGCGATAAGGGTCCAAAA-3′。引物序列由上海桑尼生物科技有限公司合成。
1.4 PCR扩增反应体系总体积为50 μL, 其中含10×buffer反应缓冲液3.0 μL,3 μL dNTP (2.5 mmol/L),0.4 μmol/L引物,0.25 μL Taq酶(5 U/μL),25 ng DNA,用灭菌双蒸馏水补足体积。反应程序为95℃预变性5 min,95℃变性40 s,58℃退火40 s,72℃延伸50 s,共40个循环;最后72℃延伸10 min,4℃保存。扩增产物用1%琼脂糖凝胶电泳进行检测,选取含有目的条带的PCR扩增产物, 委托上海派森诺生物科技股份有限公司进行直接双向测序。
1.5 数据分析采用Dnastar软件包对测序结果进行双向拼接校对,截取等长的有效片段,并利用Clustal X软件对截取的有效片段进行排列和校正;采用DNASP 5.0软件计算单倍型数(H)、单倍型多样性(h)、核苷酸多样性(π)、平均差异数(k)和错配分析(Mismatch);采用MEGA 7.0软件统计碱基组成、多态位点信息和转换/颠换比,并基于Kimura2-paramter模型,采用邻接法(Neighbor-joining,NJ)构建系统发育树,Bootstrap检验次数为1 000次。采用Arlequin软件计算种群间遗传分化指数Fst,根据公式Nm=[(1/Fst)-1]/2计算基因流值(Nm);并进行种群遗传变异分析(Analysis of molecular variance,AMOVA)和Tajima′s D、Fu′s Fs中性检验。
2 结果与分析 2.1 CR基因序列 2.1.1 序列特征经PCR扩增、测序和序列校对,获得了114条大泷六线鱼野生群体CR基因序列,全部长度为485 bp。碱基A、T、G、C平均含量分别为34.2%、32.9%、14.4%、18.4%,其中A+T含量(67.1%)>G+C含量(32.8%)。遗传多样性参数统计(表 1)显示:114条CR基因同源序列共检测到40个多态位点,其中包括27个简约信息位点和13个单变异位点。大泷六线鱼的平均单倍型多样性指数(h)为0.908,平均核苷酸多样性指数(π)为0.006,山东省近岸野生群体和北黄海群体均呈现了高单倍型多样性(h>0.5)及低核苷酸多样性(π<0.01)的特点。
| 群体 Population |
单倍型数 No.of haplotypes |
单倍型多样性h Haplotype diversity |
平均核苷酸差异数k Mean number of pairwise differences |
核苷酸多样性π Nucletide diversity |
| 荣成 RC |
13 | 0.868 | 2.550 | 0.005 |
| 海阳HY | 18 | 0.915 | 3.533 | 0.008 |
| 青岛QD | 23 | 0.983 | 4.030 | 0.008 |
| 北黄海BHH | 15 | 0.867 | 2.193 | 0.005 |
2.1.2 单倍型分布及系统树
CR基因序列共定义了53种单倍型(h1~h53),独享单倍型数目为38个,占总单倍型的71.7%。其中山东省近岸野生群体有30个独享单倍型,北黄海野生群体占8个。共享单倍型共有15个,其中单倍型h52和h53在4个群体中均有出现,h52分布最广,h53其次,频率分别占25.44%、12.28%(表 2)。
| 单倍型 Haplotype |
RC | HY | QD | BHH |
| h1 | 1 | |||
| h2 | 1 | |||
| h3 | 1 | |||
| h4 | 2 | |||
| h5 | 1 | |||
| h6 | 1 | |||
| h7 | 1 | |||
| h8 | 1 | |||
| h9 | 1 | |||
| h10 | 1 | |||
| h11 | 1 | |||
| h12 | 1 | |||
| h13 | 1 | 1 | 1 | |
| h14 | 2 | |||
| h15 | 1 | |||
| h16 | 1 | |||
| h17 | 1 | |||
| h18 | 1 | |||
| h19 | 1 | |||
| h20 | 1 | |||
| h21 | 1 | 1 | ||
| h22 | 1 | |||
| h23 | 1 | |||
| h24 | 1 | |||
| h25 | 1 | |||
| h26 | 1 | |||
| h27 | 1 | |||
| h28 | 1 | |||
| h29 | 1 | |||
| h30 | 1 | 2 | 2 | |
| h31 | 1 | |||
| h32 | 1 | |||
| h33 | 1 | |||
| h34 | 1 | |||
| h35 | 1 | |||
| h36 | 1 | 1 | ||
| h37 | 2 | |||
| h38 | 2 | |||
| h39 | 1 | |||
| h40 | 1 | 1 | ||
| h41 | 1 | 1 | ||
| h42 | 2 | 1 | 1 | |
| h43 | 3 | |||
| h44 | 1 | |||
| h45 | 1 | |||
| h46 | 1 | |||
| h47 | 1 | |||
| h48 | 1 | |||
| h49 | 1 | |||
| h50 | 1 | |||
| h51 | 2 | |||
| h52 | 9 | 8 | 3 | 9 |
| h53 | 5 | 1 | 1 | 7 |
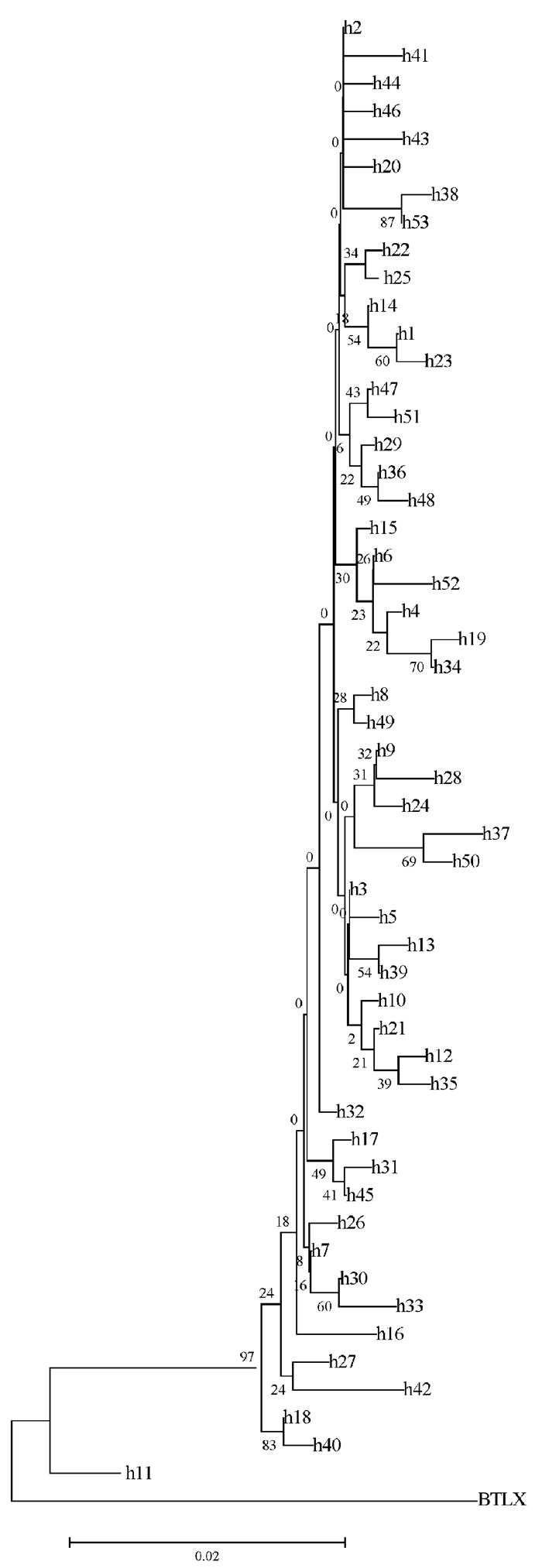
以斑头鱼(Agrammus agrammus)(GenBank登录号:KC262792.1)作为外群,建立的单倍型分子系统进化树(图 2),结果显示进化树不存在群体内个体明显聚在一起的情况,4个野生群体的个体交叉存在于系统树中,频率分布也未出现以某种单倍型为主的明显的地理分支。
|
| 图 2 CR基因单倍型NJ系统发育树 Fig.2 Neighbor-Joining phylogenetic tree based on CR gene haplotype |
2.1.3 群体遗传结构
将4个地理群体CR基因序列归为一组进行AMOVA分析(表 3):群体内个体间占100.48%,群体间变异为负值,仅占-0.48%,表明大泷六线鱼野生群体平均观测杂合度大于平均期望杂合度,群体间遗传结构变异并不明显,群体内变异贡献率最高;将山东省近岸3个群体CR基因序列(青岛、海阳、荣成)分为一组,北黄海野生群体CR基因序列单独为一组进行AMOVA分析,遗传变异主要集中在群体内个体间(100.67%),组群内个体间、两组群间变异均为负值。
| 变异来源 Source of variation |
Group (RC, HY, QD, BHH) |
Group 1 (RC, QD, HY),Group 2 (BHH) | |||||
| 平方和 Sum of squares |
变异成分 Variance components |
变异贡献率 Contribution rate for variation (%) |
平方和 Sum of squares |
变异成分 Variance components |
变异贡献率 Contribution rate for variation (%) |
||
| 组群内 Among groups |
1.124 | -0.006 | -0.39 | ||||
| 组群内群体间 Among populations |
3.902 | -0.007 | -0.48 | 2.779 | -0.004 | -0.28 | |
| 群体内 Within populations |
165.879 | 1.508 | 100.48 | 165.879 | 1.508 | 100.67 | |
| 合计 Total |
169.781 | 1.5 | 169.781 | 1.498 | |||
群体间及群体内遗传距离和遗传分化Fst结果(表 4)显示:4个不同地理野生群体内的平均遗传距离为0.005~0.008,群体间的最大遗传距离是海阳与青岛群体,最小遗传距离是荣成和北黄海群体;Fst值为-0.013 99~0.006 11,反映了群体间遗传分化程度较低。按照Wright方法[21]计算基因流,得出种群间基因流值大于1(Nm=10.35)。Slatkin[22]认为Nm值大于1时基因流会成为种群间遗传分化的主因,阻止由遗传漂变引起的分化。由此推测4个不同地理野生群体间CR基因序列交流频繁有关,降低了群体间的遗传分化。
| 群体 Populations |
RC | QD | HY | BHH | 群体内平均遗传距离 Average genetic distance within populations |
| RC | - | 0.006 | -0.010 | -0.008 | 0.005 |
| QD | 0.007 | - | -0.014 | 0.002 | 0.008 |
| HY | 0.006 | 0.008 | - | -0.008 | 0.007 |
| BHH | 0.005 | 0.006 | 0.006 | - | 0.005 |
| 注:对角线以下为群体间遗传距离,对角线以上为Fst Note:Below the diagonal is the genetic distance between populations, above the diagonal is Fst of pairwise difference |
|||||
2.1.4 种群历史动态
将大泷六线鱼4个野生群体的CR基因序列进行中性检验结果显示(表 5):CR基因序列Tajima′s D值(-1.960)和Fu′s Fs值(-10.810)均为负值,Tajima′s D检验为显著性显著(P<0.05);Fu′s Fs值为极显著差异(P<0.01)。由于Fu′s Fs中性检验法比Tajima′s D对群体近期扩张造成的不平衡较为敏感[23-24],表明4个大泷六线鱼不同地理野生群体偏离中性选择,历史上经历过种群扩张事件的发生。单倍型碱基歧点分布呈现为单峰型曲线图(图 3),表明大泷六线鱼整体在近期可能发生过动态扩张。
| 群体 Populations |
中性检验Neutral test | |||
| Tajima's D | P | Fu's Fs | P | |
| RC | -1.779 | 0.029 | -5.594 | 0.002 |
| HY | -1.654 | 0.040 | -11.069 | 0.000 |
| QD | -1.670 | 0.021 | -17.276 | 0.000 |
| BHH | -1.782 | 0.019 | -9.297 | 0.000 |
| 总体Total | -1.960 | 0.027 | -10.810 | 0.001 |

|
| 图 3 大泷六线鱼CR基因序列错配碱基岐点分布图 Fig.3 Mismatch distribution map of Hexagrammos otakii CR sequences |
根据公式T=Tau/2u对大泷六线鱼种群历史上发生扩张时间进行估算[25],通过核苷酸不配对分析到的大泷六线鱼整体Tau值为2.93,u是线粒体控制区每世代的变异速率5%/百万年[26],世代时间为2年,推算出大泷六线鱼整体扩张时间约发生在12.1万年前。
2.2 Cytb基因序列分析 2.2.1 序列多态性分析通过PCR扩增、测序和校正后,确定Cytb基因同源序列全长为651 bp。其中碱基A、T、G和C平均含量分别为22.6%、27.5%、15.7%和34.2%,A+T含量稍大于G+C含量(50.1%>49.9%)。共检测到56个多态位点,其中包括21个简约信息位点和35个单变异位点,转换颠换比值为19.04。Cytb基因序列的种内平均单倍型多样性指数(h)为0.934,平均单倍型的多样性指数(π)为0.005,4个地理群体均呈现高单倍型多样性(0.892~0.957)和低核苷酸多样性(0.004~0.005)的特点(表 6)。
| 群体 Population |
单倍型数 No.of haplotypes |
单倍型多样性h Haplotype diversity |
平均核苷酸差异数k Mean number of pairwise differences |
核苷酸多样性π Nucletide diversity |
| RC | 10 | 0.892 | 2.346 | 0.004 |
| HY | 18 | 0.957 | 3.516 | 0.005 |
| QD | 17 | 0.952 | 2.997 | 0.005 |
| BHH | 18 | 0.933 | 3.078 | 0.005 |
2.2.2 单倍型分布及系统树
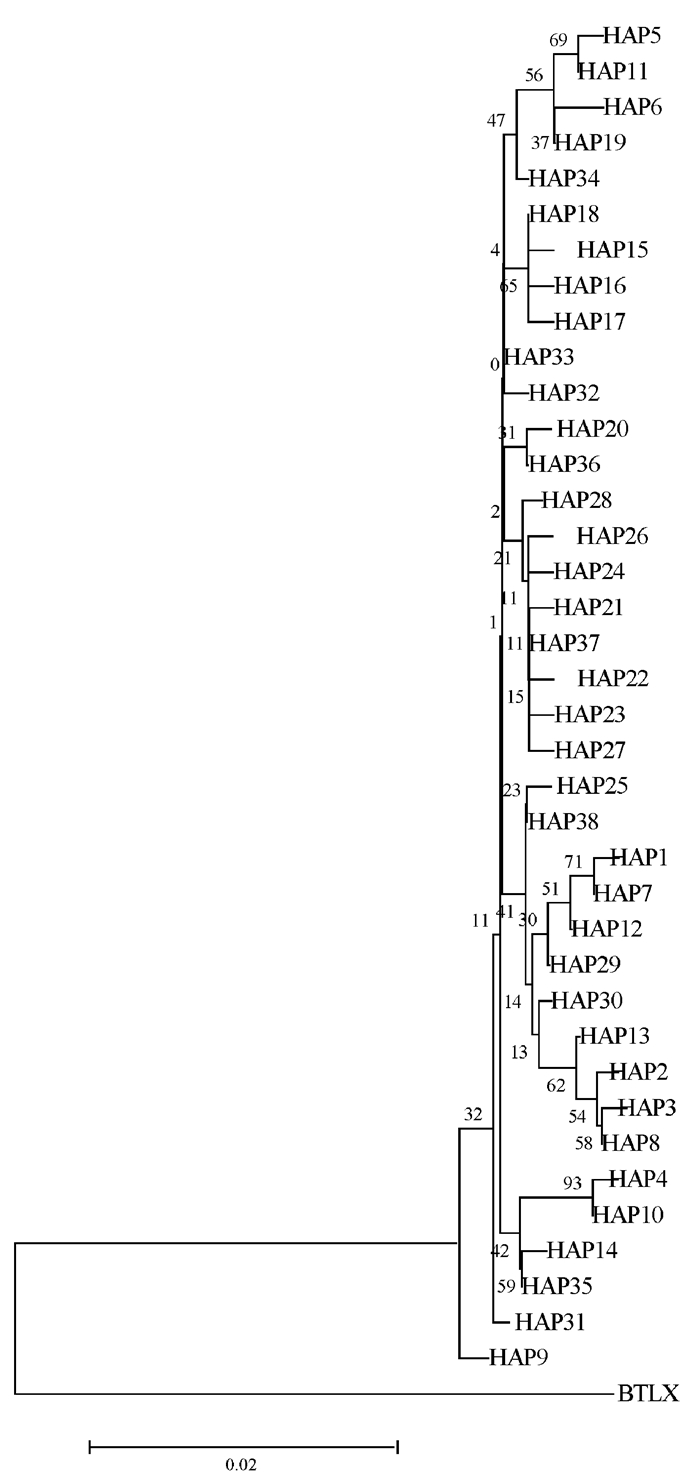
Cytb基因序列共检测定义了38种单倍型(即HAP1~HAP38,见表 7),其中25个单倍型为独享单倍型,占总体的65.79%,山东省近岸3个地理群体独享单倍型为10个,北黄海群体独享单倍型有12个。共享单倍型有13个,其中HAP37为主体单倍型,频率分布占总体的15.00%。以斑头鱼(Agrammus agrammus)(GenBank登录号:LC128734.1)作为外群,构建的大泷六线鱼Cytb基因单倍型分子系统进化树如图 4,显示38个单倍型形成4个支系其中北黄海群体的单倍型全部聚在支系一和支系二,海阳和青岛群体2个独享单倍型分别聚为一支。
| 单倍型 Haplotype |
RC | HY | QD | BHH |
| HAP1 | 1 | |||
| HAP2 | 1 | |||
| HAP3 | 1 | |||
| HAP4 | 1 | |||
| HAP5 | 1 | |||
| HAP6 | 1 | |||
| HAP7 | 1 | |||
| HAP8 | 2 | 1 | 1 | |
| HAP9 | 1 | |||
| HAP10 | 1 | |||
| HAP11 | 1 | |||
| HAP12 | 1 | |||
| HAP13 | 1 | |||
| HAP14 | 2 | |||
| HAP15 | 1 | |||
| HAP16 | 1 | |||
| HAP17 | 1 | |||
| HAP18 | 6 | 1 | 1 | 3 |
| HAP19 | 1 | 1 | 1 | |
| HAP20 | 1 | 1 | ||
| HAP21 | 1 | |||
| HAP22 | 1 | |||
| HAP23 | 2 | |||
| HAP24 | 1 | |||
| HAP25 | 1 | 1 | ||
| HAP26 | 1 | |||
| HAP27 | 2 | |||
| HAP28 | 1 | |||
| HAP29 | 1 | |||
| HAP30 | 2 | 1 | 2 | 3 |
| HAP31 | 1 | |||
| HAP32 | 1 | |||
| HAP33 | 4 | 3 | 2 | 1 |
| HAP34 | 1 | |||
| HAP35 | 2 | 1 | 1 | |
| HAP36 | 2 | 4 | 2 | 2 |
| HAP37 | 2 | 4 | 2 | 7 |
| HAP38 | 1 |
|
| 图 4 大泷六线鱼线粒体Cytb基因单倍型NJ系统发育树 Fig.4 Neighbor-Joining phylogenetic tree based on Cytb gene haplotype in mitochondria of Hexagrammos otakii |
2.2.3 群体遗传结构
AMOVA分析结果(表 8)显示:将大泷六线鱼野生群体整体作为一组,群体内个体间占100.51%,群体间变异为负值(-0.51%),表明4个群体间遗传结构变异并不明显,群体间的基因流相当丰富;将山东省近岸沿海3个不同地理野生群体(青岛、海阳和荣成)分为一组,北黄海野生群体单独为一组,群体内个体间变异贡献率为100.76%,两组群间变异为-0.72%,主要遗传变异来源于群体内个体间。
| 变异来源 Source of variation |
Group (RC,HY,QD,BHH) |
Group 1 (RC,QD,HY), Group 2 (BHH) | ||||
| 平方和 Sum of squares |
变异成分 Variance components |
变异贡献率 Contribution rate for variation (%) |
平方和 Sum of squares |
变异成分 Variance components |
变异贡献率 Contribution rate for variation (%) |
|
| 组群内 Among groups |
1.027 | -0.011 | -0.72 | |||
| 组群内群体间 Among populations |
4.458 | -0.009 | -0.51 | 2.958 | -0.001 | -0.04 |
| 群体内 Within populations |
163.116 | 1.699 | 100.51 | 143.376 | 1.494 | 100.76 |
| 合计 Total |
167.575 | 1.691 | 147.360 | 1.482 | ||
大泷六线鱼群体Cytb基因序列的遗传距离和基因遗传分化指数(Fst)见表 9。群体间的平均遗传距离0.005~0.006,其中海阳与青岛、北黄海与青岛遗传距离最高(0.006),其他遗传距离均为0.005;群体间两两比较的遗传分化指数Fst值为-0.025~0.021 8,青岛和荣成种群间的遗传分化指数最大(Fst=0.021 8),北黄海和荣成种群间遗传分化最小(Fst=-0.025)。经比对发现Cytb基因序列遗传距离和Fst分析结果不一致。计算得出Cytb基因序列的基因流Nm=9.00,表明大泷六线鱼基因交流频繁,群体间遗传分化较小,与遗传分化指数分析结果一致,这可能得益于单倍型HAP18、HAP30、HAP33、HAP36、HAP37为大泷六线鱼种群所有群体共享且拥有相对高的频率,基因流引起了种群间的遗传分化。
| 群体 Populations |
RC | QD | HY | BHH | 群体内平均遗传距离 Average distance within populations |
| RC | - | 0.021 8 | -0.002 | -0.025 | 0.004 |
| QD | 0.005 | - | -0.016 | -0.004 | 0.006 |
| HY | 0.005 | 0.006 | - | -0.008 | 0.005 |
| BHH | 0.005 | 0.006 | 0.005 | - | 0.006 |
| 注:对角线以下为群体间遗传距离,对角线以上为Fst Note:Below the diagonal is the genetic distance between populations, above the diagonal is Fst of pairwise difference |
|||||
2.2.4 种群历史动态
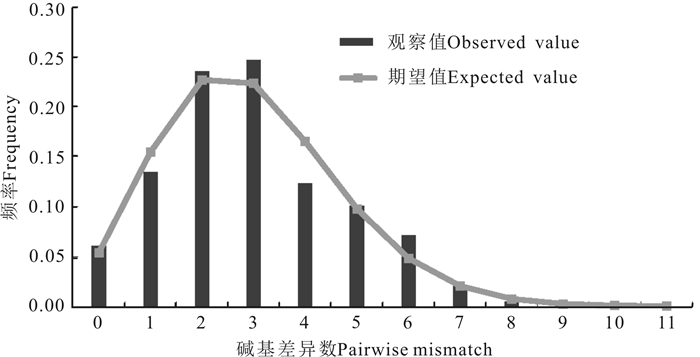
Cytb基因序列中性检验结果(表 10)显示:Tajima′s D值和Fu′s Fs值均为负值,分别为-1.250和-9.022,前者在统计学上不具有显著意义(P>0.05),后者则为差异性极显著(P<0.01)。且由图 5可知大泷六线鱼作为一个整体进行分析时,Cytb基因序列碱基歧点分布分析图谱呈现单峰型。通过核苷酸不配对分析所得大泷六线鱼整体Tau值为2.60,Cytb基因的变异速率为2%/百万年[27],计算出大泷六线鱼整体扩张时间约为19.97万年前。
| 群体 Populations |
中性检验 Neutral test |
|||
| Tajima's D | P | Fu's Fs | P | |
| RC | -0.770 | 0.254 | -3.448 | 0.025 |
| HY | -1.260 | 0.087 | -10.852 | 0.000 |
| QD | -1.501 | 0.037 | -10.557 | 0.000 |
| BHH | -1.468 | 0.039 | -11.232 | 0.000 |
| 总体Total | -1.250 | 0.104 | -9.022 | 0.006 |
|
| 图 5 大泷六线鱼Cytb基因序列错配碱基岐点分布图 Fig.5 Mismatch distribution map of Hexagrammos otakii Cytb sequences |
3 讨论 3.1 大泷六线鱼野生群体遗传多样性特征
本研究分析比较4个野生地理群体的大泷六线鱼CR和Cytb基因序列的碱基差异,发现CR基因序列中碱基A的含量最高,Cytb基因序列中碱基C的含量最高,二者的碱基G含量均较低,且A+T含量高于G+C含量,这符合大部分鱼类线粒体DNA偏好碱基A、T,明显的反G偏倚规律[28-30]。Meyer[31]指出线粒体不同基因进化速率存在差异。线粒体控制区本身不具有编码蛋白,所承受的压力较小,理论上其进化速度比Cytb基因快[32-33]。赵亮等[34]认为线粒体Cytb基因比控制区D-loop基因具有相对较高的进化速率,更适于太湖新银鱼种内及近缘种间分析。本研究Cytb基因序列多态性位点比例和单倍型多样性均明显高于CR序列,Cytb基因序列发现35个变异位点,且转换颠换比值为19.04,符合大部分脊椎动物线粒体控制区变异速率低于Cytb的现象[35-36]。
遗传多样性通常是物种长期进化的结果,是物种或其群体持续生存并适应不断变化的环境而不断进化的前提[37]。通常物种的遗传多样性或变异性越丰富,则表明该物种的进化潜力越大,对环境改变响应的进化能力就越强[38]。单倍型多样性和核苷酸多样性作为衡量种群线粒体遗传变异的重要指标,可根据数值大小反映出遗传多样性的高低。本研究中大泷六线鱼4个不同地理野生群体CR和Cytb基因序列表现出较高的单倍型多样性和低水平的核苷酸多态性的特征,与李莹等[39]获得研究结果相同,符合Grant提出的4种组合中“高h, 低π”的遗传多样性类型,即在种群扩张过程中,种群数量的增加会导致单倍型多样性的提高,但在较短时间内无法积累核苷酸的变异,从而可能产生单倍型多样性较高、核苷酸多样性较低的遗传模式[40]。由此推测大泷六线鱼种群在经历过瓶颈效应后,可能伴随产生了迅速的种群扩张与变异的积累,即提高了单倍型多样性,但没有明显增加核苷酸多态性。
3.2 大泷六线鱼野生群体遗传现状形成机制本研究中性检验结果显示大泷六线鱼4个不同地理野生群体偏离了中性进化选择,种群内部积累了大量的低频率基因突变,种群经历过数量增长或栖息地膨胀。基于期望值持续增长模式下的CR和Cytb基因序列的碱基歧点分布均显示为单峰型,表明大泷六线鱼种群扩张事件可能发生在近期。基于CR和Cytb基因序列构建的系统进化树,可以发现山东省近岸的大泷六线鱼野生群体和北黄海野生群体遗传距离较近,群体间具有一定的遗传相似性,遗传分化程度较低。结合AMOVA分析得到4个不同地理野生群体间Fst值较低,没有明显的遗传分化,遗传变异主要来自群体内个体间。本研究中大泷六线鱼野生群体CR基因序列和Cytb基因序列的基因流均大于1,显示群体间基因交流程度频繁。基因流具有抑制遗传漂变和选择的作用,是使群体遗传均质化的有效力量,能够抵抗群体分化。本研究采集样品点主要集中在黄海区,该区域存在低盐和高盐水系,是多数鱼群产卵场和仔稚鱼聚集区[41-42]。秋冬季节受黄东海沿岸流和暖流影响[43-44],各群体间基因交流频繁,可能是导致遗传分化不明显的原因。同时近年来山东省内大规模开展增殖放流,也可能加大了不同地区苗种基因交流机会,从而减小遗传分化程度[45]。
通过估算得出大泷六线鱼整体扩张时间处于第四纪冰川期的里期-玉木间冰期(10万年—20万年前),属于晚更新世。在间冰期,气候转暖、冰川大量消融、海平面上升,导致海洋生物从一个或多个分离的避难所向新的适宜的栖息地扩张分布,种群遗传结构发生改变。有记载显示晚更新世初以来,我国东部沿海平原发生过3次明显较大规模的海侵和海退[46-49],沿海分布的多种海水鱼类在这一时期都经历过种群扩张事件[50-52]。由此推测,大泷六线鱼种群在冰川期发生瓶颈效应后,间冰期气候条件的改变可能导致种群数量开始快速增长和扩张,使得单倍型多样性升高,但随着末次冰川期到来导致没有足够时间积累核苷酸变异,从而形成现有的遗传多样性模式。
4 结论4个大泷六线鱼不同地理野生群体CR和Cytb基因序列均具有高单倍型多样性和低核苷酸多样性的特征,群体间遗传差异不显著,存在频繁的基因交流,遗传变异主要来源于群体内个体间,未形成一定的遗传分化。在更新世晚期,因间冰期海平面上升、气候变暖等气候条件影响大泷六线鱼经历了快速种群扩张,形成了现有遗传结构特点。山东省内近海沿岸大泷六线鱼野生群体和北黄海离岸野生群体遗传结构之间不存在地理障碍,可能受秋冬季节海流影响或人为增殖放流影响使得山东省近岸群体和北黄海群体之间基因交流广泛。
| [1] |
刘蝉馨, 秦克静. 辽宁动物志:鱼类[M]. 沈阳: 辽宁科学技术出版社, 1987.
|
| [2] |
黄宗国. 中国海洋生物种类与分布[M]. 北京: 海洋出版社, 1994.
|
| [3] |
冯昭信, 韩华. 大泷六线鱼资源合理利用的研究[J]. 大连水产学院学报, 1998, 13(2): 24-28. |
| [4] |
叶青. 青岛近海欧氏六线鱼食性的研究[J]. 海洋湖沼通报, 1992(4): 50-55. |
| [5] |
吴立新, 秦克静, 姜志强, 等. 大泷六线鱼(Hexagrammos otakii)人工育苗初步试验[J]. 海洋科学, 1996(4): 32-34. |
| [6] |
庄虔增, 于鸿仙, 刘岗, 等. 六线鱼苗种生产技术的研究[J]. 中国水产科学, 1999, 6(1): 103-106. |
| [7] |
邱丽华, 姜志强, 秦克静. 大泷六线鱼仔鱼摄食及生长的研究[J]. 中国水产科学, 1999, 6(3): 1-4. |
| [8] |
王连顺.大泷六线鱼繁殖内分泌生理功能及GH基因部分序列的克隆[D].青岛: 中国海洋大学, 2007.
|
| [9] |
温海深, 王连顺, 牟幸江, 等. 大泷六线鱼精巢发育的周年变化研究[J]. 中国海洋大学学报:自然科学版, 2007, 37(4): 581-585. |
| [10] |
CHEN S L, MIAO G D, SHAO C W, et al. Isolation and characterization of polymorphic microsatellite loci from fat greenling (Hexagrammos otakii)[J]. Conservation Genetics, 2009, 10: 1429-1431. |
| [11] |
潘雷, 胡发文, 高凤祥, 等. 大泷六线鱼人工繁殖及育苗技术初步研究[J]. 海洋科学, 2012, 36(12): 39-44. |
| [12] |
CROW K D, KANAMOTO Z, BERNARDI G. Molecular phylogeny of the hexagrammid fishes using a multi-locus approach[J]. Molecular Phylogenetics and Evolution, 2004, 32(3): 986-997. |
| [13] |
李莹, 王伟, 孟凡平, 等. 利用线粒体DNA控制区部分序列分析不同地理群体大泷六线鱼遗传多样性[J]. 海洋科学, 2012, 36(8): 40-46. |
| [14] |
武世雄, 姜欣彤, 王伟, 等. 大泷六线鱼6个群体遗传多样性的微卫星分析[J]. 中国渔业质量与标准, 2018(3): 52-60. |
| [15] |
BROWN W M, WRIGHT J W. Mitochondrial DNA analyses and the origin and relative age of parthenogenetic lizards (genus Cnemidophorus)[J]. Science, 1979, 203(4386): 1247-1249. |
| [16] |
WARD R D, GREWE P M. Appraisal of molecular genetic techniques in fisheries[J]. Reviews in Fish Biology and Fisheries, 1994, 4(3): 300-325. |
| [17] |
陈星, 沈永义, 张亚平. 线粒体DNA在分子进化研究中的应用[J]. 动物学研究, 2012, 33(6): 566-573. |
| [18] |
陈四海, 区又君, 李加儿. 鱼类线粒体DNA及其研究进展[J]. 生物技术通报, 2011(3): 13-20. |
| [19] |
赵凯. 鱼类线粒体DNA (mtDNA)及其在分子系统学中的应用[J]. 青海大学学报:自然科学版, 2006, 24(2): 49-53. |
| [20] |
谢振宇, 杜继曾, 陈学群. 线粒体控制区在鱼类种内遗传分化中的意义[J]. 遗传, 2006, 28(3): 362-368. |
| [21] |
WRIGHT S. The genetical structure of populations[J]. Annals of Eugenics, 1949, 15(1): 323-354. |
| [22] |
SLATKIN M. Gene flow and the geographic structure of natural populations[J]. Science, 1987, 236(4803): 787-792. |
| [23] |
祁得林. 黄河上游花斑裸鲤Cyt b基因的序列变异和遗传多样性[J]. 动物学研究, 2009, 30(3): 255-261. |
| [24] |
TAJIMA F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics, 1989, 123(3): 585-595. |
| [25] |
ROGERS A R, HARPENDING H. Population growth makes waves in the distribution of pairwise genetic differences[J]. Molecular Biology and Evolution, 1992, 9(3): 552-569. |
| [26] |
刘奇.大泷六线鱼(Hexagrammos otakii)生物学特征与遗传多样性研究[D].青岛: 中国海洋大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10423-1011027529.htm
|
| [27] |
吴仁协, 柳淑芳, 庄志猛, 等. 基于线粒体Cytb基因的黄海, 东海小黄鱼(Larimichthys polyactis)群体遗传结构[J]. 自然科学进展, 2009, 19(9): 924-930. |
| [28] |
张迪, 雷光春, 龚成, 等. 基于COI基因序列的太湖新银鱼遗传多样性[J]. 湖泊科学, 2012, 24(2): 299-306. |
| [29] |
胡静, 侯新远, 尹绍武, 等. 基于mtDNA COI和Cytb基因序列对南中国海不同海域唇鱼群体遗传多样性的研究[J]. 水生生物学报, 2014, 38(6): 1008-1016. |
| [30] |
童金苟, 吴清江. 三个鲤品种线粒体基因片段序列保守性[J]. 2001, 水生生物学报, 2001, 25(1): 54-57. |
| [31] |
MEYER A.Evolution of mitochondria DNA in fishes [M]//MOMMSEN T P, HOCHACHKA P W.Biochemistry and molecular biology of fishes.Vol.2.New York: Elsevier, 1993: 1-38.
|
| [32] |
LUNT D H, WHIPPLE L E, HYMAN B C. Mitochondrial DNA variable number tandem repeats (VNTRs):Utility and problems in molecular ecology[J]. Molecular Ecology, 1998, 7(11): 1441-1455. |
| [33] |
CANN R L, BROWN W M, WILSON A C. Polymorphic sites and the mechanism of evolution in human mitochondrial DNA[J]. Genetics, 1984, 106(3): 479-499. |
| [34] |
赵亮, 谢本贵, 刘志瑾, 等. 太湖新银鱼线粒体D-loop和Cyt b片段序列结构与进化速率比较[J]. 动物学杂志, 2010, 45(2): 27-38. |
| [35] |
李大命, 李康, 张彤晴, 等. 洪泽湖大银鱼(Protosalanx hyalocranius) Cytb和COI基因序列多态性分析[J]. 渔业科学进展, 2017, 38(6): 25-31. |
| [36] |
SHEDLOCK A M, PARKER J D, CRISPIN D A, et al. Evolution of the salmonid mitochondrial control region[J]. Molecular Phylogenetics and Evolution, 1992, 1(3): 179-192. |
| [37] |
沈浩, 刘登义. 遗传多样性概述[J]. 生物学杂志, 2001, 18(3): 5-7. |
| [38] |
闫华超, 高岚, 付崇罗, 等. 鱼类遗传多样性研究的分子学方法及应用进展[J]. 水产科学, 2004, 23(12): 44-48. |
| [39] |
李莹, 王伟, 孟凡平, 等. 利用线粒体DNA控制区部分序列分析不同地理群体大泷六线鱼遗传多样性[J]. 海洋科学, 2012, 36(8): 40-46. |
| [40] |
GRANT W S, BOWEN B W. Shallow population histories in deep evolutionary lineages of marine fishes:Insight from sardines and anchovies and lessons for conservation[J]. The Journal of Heredity, 1998, 89(5): 415-426. |
| [41] |
邱道立, 刘效舜, 王遵孝.渤、黄海小黄鱼的洄游与水文环境的关系[C]//1962年海洋渔业资源学术会议论文编审委员会.海洋渔业资源论文选集续集.北京: 农业出版社, 1965: 43-55.
|
| [42] |
卞晓东, 万瑞景, 金显仕, 等. 近30年渤海鱼类种群早期补充群体群聚特性和结构更替[J]. 渔业科学进展, 2018, 39(2): 1-15. |
| [43] |
CHEN C T A. Chemical and physical fronts in the Bohai, Yellow and East China seas[J]. Journal of Marine Systems, 2009, 78(3): 394-410. |
| [44] |
赵骞, 田纪伟, 曹丛华, 等. 渤海、黄海、东海冬季海流场温度场数值模拟和同化技术[J]. 海洋学报, 2005, 27(1): 1-6. |
| [45] |
乐小亮, 章群, 赵爽, 等. 中国近海真鲷遗传变异的线粒体控制区序列分析[J]. 广东农业科学, 2010, 37(2): 136-139. |
| [46] |
蓝东兆, 张维林, 陈承惠, 等. 晚更新世以来台湾海峡西部的海侵及海平面变化[J]. 海洋学报, 1993, 15(4): 77-84. |
| [47] |
李吉均, 康建成. 中国第四纪冰期, 地文期和黄土记录[J]. 第四纪研究, 1989(3): 269-278. |
| [48] |
樊太亮. 塔里木盆地北部古生界密集段分布型式与海平面变化的关系[J]. 地球学报, 1998, 19(3): 308-314. |
| [49] |
薛丹, 章群, 郜星晨, 等. 基于线粒体控制区的粤闽三线矶鲈地理群体的遗传变异分析[J]. 海洋渔业, 2014, 36(6): 496-502. |
| [50] |
LIU J X, GAO T X, ZHUANG Z M, et al. Late Pleistocene divergence and subsequent population expansion of two closely related fish species, Japanese anchovy (Engraulis japonicus) and Australian anchovy (Engraulis australis)[J]. Molecular Phylogenetics and Evolution, 2006, 40(3): 712-723. |
| [51] |
刘至治, 杨金权, 王正琦, 等. 长江口及其南部邻近地区大弹涂鱼种群遗传结构及种群历史分析[J]. 动物学研究, 2009, 30(1): 1-10. |
| [52] |
杨梅, 李新正. 西北太平洋边缘海重要海洋动物分子系统地理学的研究进展[J]. 广西科学, 2016, 23(4): 299-306. |



