2. 广西中医药大学, 广西南宁 530001;
3. 广西卫生职业技术学院, 广西南宁 530023
2. Guangxi University of Traditional Chinese Medicine, Nanning, Guangxi, 530001, China;
3. Guangxi Health College, Nanning, Guangxi, 530023, China
广西产中华芦荟(Aloe vera L.var.chinensis)[1]属于单子叶植物百合科(Liliaceae)芦荟属多年生常绿肉质植物,又称油葱。芦荟属植物具有杀菌、抑制或延缓人体衰老等作用,使用价值高,广泛应用于医药、化妆品、保健食品等方面。目前对芦荟的研究主要集中在芦荟的抑菌作用、药理作用和活性成分方面[1-12],未见有广西产中华芦荟指纹图谱研究的公开报道。而指纹图谱在中药材应用,笔者曾有一定的研究[13-14],因此本文以广西产中华芦荟为研究对象,采用HPLC指纹图谱分析法进行研究,为今后中华芦荟的质量标准研究提供科学依据。
1 材料与方法 1.1 材料仪器:高效液相色谱仪(Alliance e2695,美国沃特世);色谱柱(Phenomenon C18,5 μm,4.6 mm×250 mm);超声波清洗器(昆山市超声仪有限公司);Millipore Simplicity-185超纯水仪(美国密里博公司)。
试剂:乙腈,冰乙酸(色谱纯),水(超纯水),其余试剂均为分析纯。芦荟大黄素(批号:110795—201007,供含量测定用,中国食品药品检定研究院)。
样品:本实验所用中华芦荟药材为10批,经广西一心药业马利飞副主任药师鉴定,均为百合科芦荟属中华芦荟Aloe vera L.var.chinesis的叶,样品药材来源见表 1。样品于60℃以下烘干,粉碎成粗粉备用。
| 编号 Number |
采收时间 Collecting time |
产地Place of origin |
| 1 | 2014.02 | 广西隆安县Long'an County,Guangxi |
| 2 | 2014.04 | 广西南宁Nanning, Guangxi |
| 3 | 2014.05 | 广西武鸣县Wuming County, Guangxi |
| 4 | 2014.06 | 广西梧州Wuzhou, Guangxi |
| 5 | 2014.08 | 广西玉林Yulin, Guangxi |
| 6 | 2014.09 | 广西浦北县Pubei County, Guangxi |
| 7 | 2014.10 | 广西防城港Fangchenggang, Guangxi |
| 8 | 2014.11 | 广西东兴Dongxing, Guangxi |
| 9 | 2014.12 | 广西中医药大学植物园Botanical Garden of Guangxi University of Traditional Chinese Medicine |
| 10 | 2015.01 | 广西药用植物园Guangxi Medicinal Herb Garden |
1.2 方法 1.2.1 色谱柱的选择
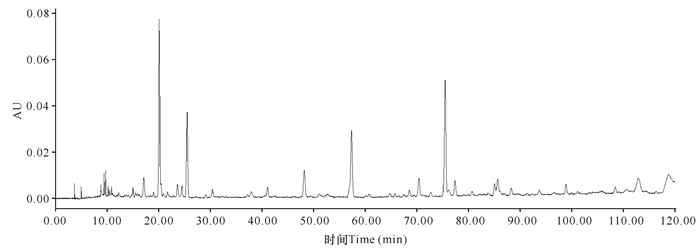
为得到分离效能更好的图谱,本实验分别考察Thermo C18(5 μm,250 mm×4.6 mm)色谱柱,Agilent WondaSil C18-WR (5 μm,250 mm×4.6 mm)色谱柱和Phenomenon C18(5 μm,250 mm×4.6 mm)色谱柱。结果如图 1~3所示,Phenomenon C18(5 μm,250 mm×4.6 mm)色谱柱分离出来的色谱峰比较丰富,且分离效果比较好。
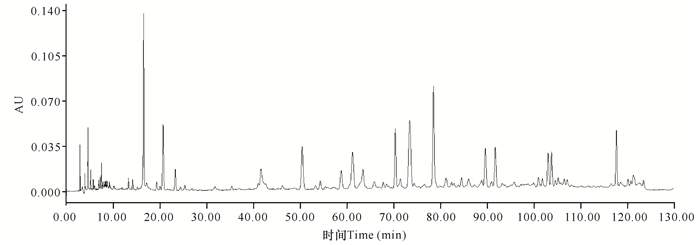
|
| 图 1 Phenomenon C18色谱柱的色谱图 Fig.1 Chromatogram of Phenomenon C18 column |

|
| 图 2 Thermo C18色谱柱的色谱图 Fig.2 Chromatogram of Thermo C18 column |

|
| 图 3 Agilent WondaSil C18-WR色谱柱的色谱图 Fig.3 Chromatogram of Agilent WondaSil C18-WR column |
1.2.2 流动相的选择
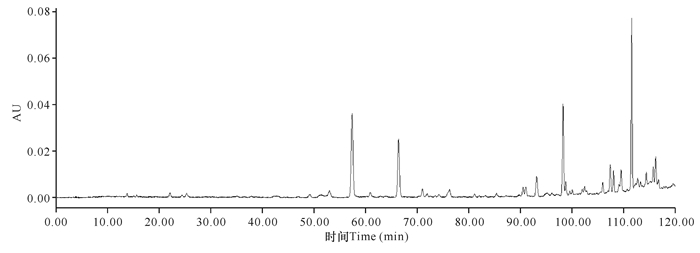
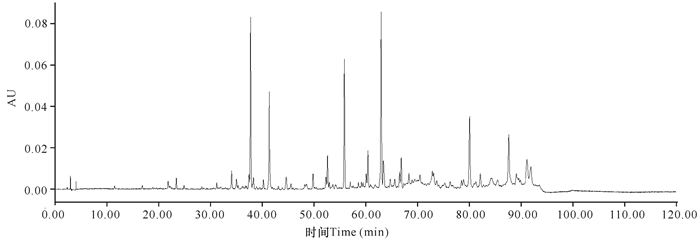
分别以甲醇-水、甲醇-0.1%冰醋酸、乙腈-水和乙腈-0.1%冰醋酸为流动相,对中华芦荟叶进行HPLC图谱考察,分析不同流动相系统的分离图谱。结果显示,以甲醇-水、甲醇-0.1%冰醋酸为流动相所得的色谱信息较少,甲醇-水流动相色谱图整体峰形不均匀,甲醇-0.1%冰醋酸流动相色谱图几乎无峰,未能分离开有关物质。而乙腈-水流动相与乙腈-0.1%冰醋酸流动相的色谱图各有特点,但乙腈-0.1%冰醋酸流动相提供的峰相对集中。因此,确定流动相系统为乙腈-0.1%冰醋酸(图 4~7)。
|
| 图 4 甲醇-水流动相色谱图 Fig.4 Chromatogram of methanol-water mobile phase |
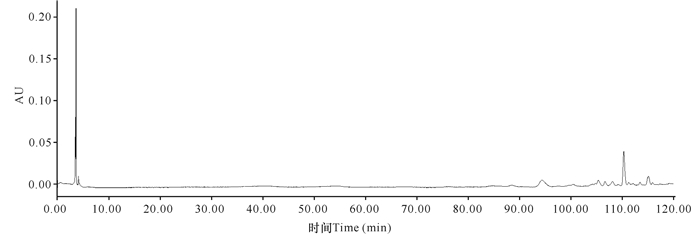
|
| 图 5 甲醇-0.1%冰醋酸流动相色谱图 Fig.5 Chromatogram of methanol-0.1% glacial acetic acid mobile phase |
|
| 图 6 乙腈-水流动相色谱图 Fig.6 Chromatogram of acetonitrile-water mobile phase |
|
| 图 7 乙腈-0.1%冰醋酸流动相色谱图 Fig.7 Chromatogram of acetonitrile-0.1% glacial acetic acid mobile phase |
1.2.3 洗脱程序
采用乙腈-0.1%冰醋酸流动相,按不同时间和比例进行梯度洗脱。梯度洗脱流动相组成如表 2所示。
| 时间 Time (min) |
乙腈 Acetonitrile (%) |
0.1%冰醋酸 0.1% glacial acetic acid (%) |
| 0 | 7 | 93 |
| 10 | 25 | 75 |
| 30 | 25.5 | 74.5 |
| 50 | 26 | 74 |
| 60 | 28 | 72 |
| 65 | 36 | 64 |
| 75 | 39.5 | 60.5 |
| 85 | 47 | 53 |
| 120 | 95 | 5 |
1.2.4 检测波长的选择
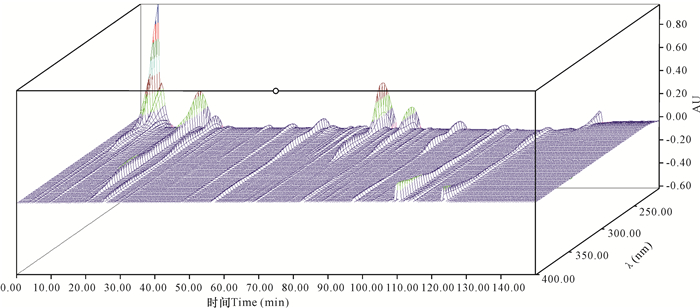
本实验使用二极管阵列检测器(DAD),对样品进行190~400 nm全波长扫描,获得3D图(图 8),并重点考查250 nm、260 nm、280 nm、300 nm、310 nm波长处色谱图。结果显示色谱峰波长为260 nm和280 nm,其分离度和对照品(56 min的峰)出峰相对较好,但280 nm对照品的峰相对高点,最终确定280 nm为本指纹图谱实验的检查波长(图 9)。
|
| 图 8 中华芦荟样品全波长扫描3D色谱图 Fig.8 Full wavelength scanning 3D chromatogram of Aloe vera L.var.chinesis sample |

|
| 图 9 中华芦荟样品各波长下色谱图 Fig.9 Chromatogram of Aloe vera L.var.chinesis samples at different wavelengths |
1.2.5 柱温和流速的选择
柱温25℃与柱温30℃条件下的色谱图总体相差不大,但25℃条件下的色谱图峰形整体好于30℃条件下的色谱图,且基于对色谱柱和仪器的保护,所以选择25℃为检测温度。另外,在其他色谱条件相同情况下,1.0 mL/min流速的色谱图较0.8 mL/min流速的分离效果差,因此选用0.8 mL/min流速。
1.2.6 指纹图谱条件的确定根据上述考察,确定指纹图谱条件:色谱柱为Phenomenon C18(5 μm,250 mm×4.6 mm),流动相系统如表 2所示,检测波长为280 nm,柱温25℃,进样量20 μL,流速0.8 mL/min,理论塔板数大于5 000,分离度大于1.5。
1.3 供试品分析 1.3.1 供试品溶液的制备取中华芦荟药材粉末约2 g,精密称定,置50 mL锤形瓶中,加入30 mL乙酸乙酯溶液,摇匀,于超声波清洗器中超声提取45 min,冷却,过滤,置于水浴(98~100℃)挥干溶剂,加5 mL甲醇溶解,过0.22 μm微孔滤膜,即得供试品溶液。
1.3.2 对照品溶液的配制精密称定中华芦荟对照品5 mg,置25 mL容量瓶中,加甲醇溶解,定容至刻度,摇匀。
1.3.3 精密度试验按1.3.1节供试品溶液制备方法配制供试品溶液,按1.2.6节的色谱条件下连续进样6针,记录色谱图。计算样品保留时间和峰面积的精密度。计算结果相对标准偏差(RSD)符合要求(RSD =0.111%~0.827%,n=8)。
1.3.4 重复性试验取同一产地中华芦荟样品粉末6份,各约2 g,精密称定,按1.3.1节方法制备供试品溶液,并按1.2.6节的色谱条件测定,结果保留时间和峰面积的相对标准偏差(RSD)值均符合要求(RSD为0.122%~0.881%,n=8)。
1.3.5 稳定性试验取中华芦荟1份,约5 g,按1.3.1节下供试品溶液制配方法制配,并按1.2.6节的色谱条件测定,记录图谱。分别在0 h、2 h、4 h、8 h、12 h、24 h检测图谱,考察样品的稳定性。结果,各色谱峰的相对保留时间RSD为0.023%~0.51%,相对峰面积的相对标准偏差(RSD)为0.84%~4.6%,说明稳定性符合要求。
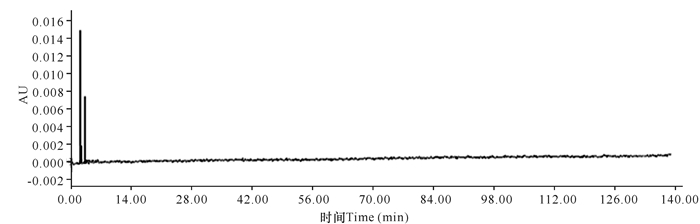
1.3.6 空白试验按1.2.6节的色谱条件测定,以提取溶液为供试品,记录图谱。结果表明提取溶剂及流动相中没有杂质干扰(图 10)。
|
| 图 10 空白溶剂色谱图 Fig.10 Chromatogram of blank solvent |
1.3.7 参照色谱峰的建立
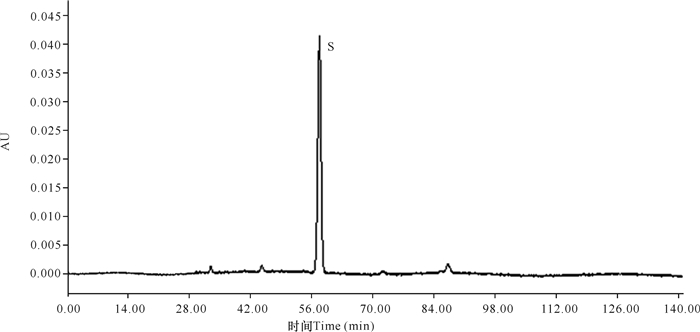
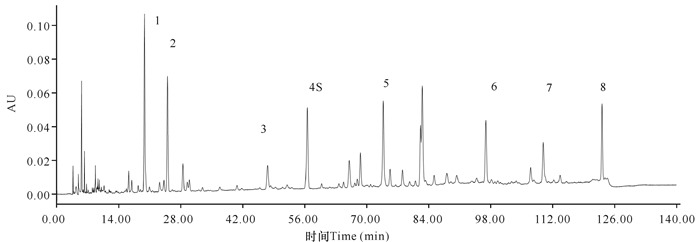
依照中国药典和指纹图谱研究的有关规定,制定指纹图谱必须设立参照物。主要根据供试品中所含化学成分的性质,选择合适的对照品作为参照物。按1.2.6节的色谱条件取对照品溶液和供试品溶液分别进样,结果如图 11~12所示,其中S为参照色谱峰,表明4号峰为芦荟大黄素。
|
| 图 11 中华芦荟对照品(芦荟大黄素)色谱峰 Fig.11 Chromatogram peak of Aloe vera L.var.chinesis reference substance (Aloe emodin) |
|
| 图 12 中华芦荟样品色谱峰 Fig.12 Chromatographic peak of Aloe vera L.var.chinesis |
1.4 各批广西产中华芦荟的指纹图谱的采集
取10批芦荟按1.3.1节供试品溶液制备方法配制供试品溶液,按1.2.6节的色谱条件测定,分别记录各色谱图。采用中国药典颁布的指纹图谱相似度评价(2012.1版本)软件对中华芦荟10批不同产地进行匹配(以平均数,设定时间宽度为0.1 min,系统自动匹配),以1号药材样品作为参照图谱,4号峰作为参照色谱峰,进行共有指纹峰的标定。
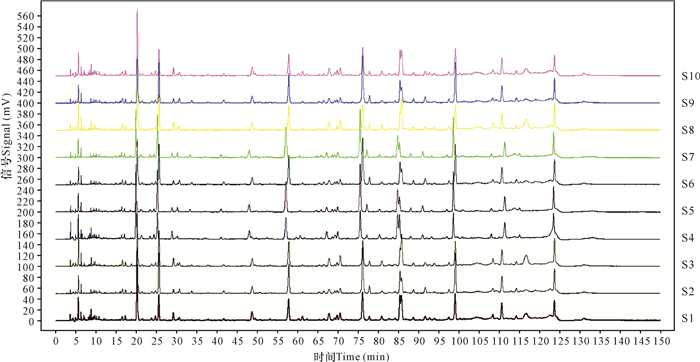
2 结果与分析根据采集得到的10批中华芦荟叠加色谱图(图 13),以1号样品为参照图谱,采用国家药典颁布的指纹图谱相似度评价(2012.1版本)软件,对中华芦荟10批不同产地进行自动匹配,建立中华芦荟药材共有模式的对照指纹色谱图(图 14), 10批药材与对照品指纹图谱相似度经数理统计,平均值达0.9以上,与对照图谱有良好的相似性。匹配结果共标定数目8个共有指纹峰(图 13~14)。10批中华芦荟的相对保留时间RSD为0.246%~0.471%;相对峰面积RSD为16.84%~47.36%。指纹图谱非共有峰面积
|
| 图 13 10批中华芦荟叠加色谱图 Fig.13 chromatogram of 10 batches of Aloe vera L.var.chinesis |

|
| 图 14 共有模式建立对照指纹色谱图 Fig.14 Establishment of reference fingerprint chromatogram in common mode |
占比4.03%~8.84%;共有峰的面积占比为91.16%~95.97 %,说明实验方法重现性较好。
3 结论本实验以实验所得的条件(色谱柱为Phenomenon C18(5 μm,250 mm×4.6 mm),表3的流动相,检测波长为280 nm,柱温为25℃,进样量20 μL,流速0.8 mL/min,理论塔板数大于5 000,分离度大于1.5)为指纹图谱色谱条件。采用《中国药典》颁布的指纹图谱相似度评价(2012.1版本)软件对中华芦荟10批不同产地进行匹配,以1号药材样品作为参照图谱,4号峰作为参照色谱峰,建立中华芦荟药材HPLC指纹图谱,其相似度较好,各批药材指纹图谱间的相似度平均在0.9以上。HPLC指纹图谱标定8个共有峰。本法HPLC指纹图谱的建立,可为今后广西产中华芦荟的质量标准制定提供参考。但本研究的芦荟仅仅是广西产的,如要建立中华芦荟指纹图谱的质量标准,尚需采集全国各产地的中华芦荟并进行研究,这为进一步的研究提够参考。
| [1] |
丁晨, 郭彬歆, 徐琛. 中华芦荟多糖的提取精制和含量测定研究[J]. 安徽农业科学, 2012, 40(28): 14008-14011. |
| [2] |
付小兰. 芦荟凝胶稳定化技术的研究现状[J]. 安徽农业科学, 2006, 34(17): 4411. |
| [3] |
黄河, 金茜, 向文艺, 等. 芦荟叶片中Cu、Zn元素含量的分析[J]. 南方园艺, 2019, 30(4): 5-7. |
| [4] |
张强, 崔君, 顾华, 等. 化妆品中芦荟苷的测定及其稳定性的研究[J]. 日用化学工业, 2019, 49(3): 199-203. |
| [5] |
乐胜锋, 王尉, 王雅萱, 等. 离子色谱-脉冲安培法测定芦荟多糖中7种单糖的含量[J]. 色谱, 2019, 37(3): 319-324. |
| [6] |
林奕云, 郑家概, 付强, 等. UPLC-MS/MS法测定植物饮料中芦荟苷含量[J]. 山东化工, 2019, 48(12): 66-68. |
| [7] |
文花, 刘燕, 董武, 等. HPLC法同时测定蒙药给喜古讷-6中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量[J]. 中国民族医药杂志, 2019, 25(8): 41-43. |
| [8] |
吴旭. HPLC-MS/MS法测定新复方芦荟胶囊中芦荟苷的含量[J]. 中国药物评价, 2018, 35(5): 366-338. |
| [9] |
庄志宏, 吴剑坤, 姜迪, 等. HPLC测定芙蓉散中芦荟大黄素和大黄酸的含量[J]. 首都食品与医药, 2019, 26(10): 174-175. |
| [10] |
王松, 容艳芬, 陈智国, 等. HPLC法测定复方芦荟维U片中芦荟苷含量[J]. 亚太传统医药, 2019, 13(7): 30-32. |
| [11] |
饶楠楠, 张强, 顾华, 等. 高效液相色谱同时测定芦荟中8种蒽醌类物质的含量[J]. 分析试验室, 2018, 37(6): 720-725. |
| [12] |
李恒, 刘冬云, 唐孟秋, 等. UPLC-ESI-MS同时测定大鼠血浆中芦荟大黄素等7种成分的含量[J]. 中国临床药理学杂志, 2018, 34(24): 2865-2869. |
| [13] |
黄红泓, 丘琴, 甄丹丹, 等. 不同产地龙利叶HPLC指纹图谱研究[J]. 广西师范大学学报:自然科学版, 2019, 37(3): 142-147. |
| [14] |
周曙光, 甄丹丹, 陈明伟, 等. 玉米苞叶HPLC指纹图谱的研究[J]. 广西中医药, 2019, 42(2): 65-71. |



