2. 广西壮族自治区海洋研究所, 广西海洋生物技术重点实验室, 广西北海 536000;
3. 广西壮族自治区水产科学研究院, 广西水产遗传育种与健康养殖重点实验室, 广西南宁 530021;
4. 河南师范大学生命科学学院, 河南新乡 453007;
5. 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory for Marine Biotechnology, Guangxi Institute of Oceanography, Beihai, Guangxi, 536000, China;
3. Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Breeding, Guangxi Academy of Fishery Science, Nanning, Guangxi, 530021, China;
4. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
5. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China
石斑鱼肉质细腻,营养丰富,是一种名贵的海水养殖鱼类,在活海鲜市场中的经济价值极高。目前国内石斑鱼养殖年产量已达到10万吨,产业直接产值超过100亿元[1-2]。广西毗邻广东、香港以及东南亚等海水鱼主要的消费市场,发展海水养殖业地域优势明显。近年来随着石斑鱼需求量的不断增加,广西地区的石斑鱼养殖进入了快速发展期,养殖效益极为显著,市场潜力巨大,有可能成为继罗非鱼和对虾养殖后广西的又一大支柱养殖产业[3-7]。石斑鱼的种类较多,全世界有100多种,我国目前已记录36种。珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×E.lanceolatus♂)是以龙胆石斑鱼(E.lanceolatus)为父本(♂),棕点石斑鱼(E.fuscoguttatus)为母本(♀)杂交培育出的新品种,具有肉质细嫩、成长速度快、抗病能力强、饵料系数低等优点,市场潜力巨大,目前珍珠龙胆石斑鱼已成为广东、广西、福建、海南等地重要的海水养殖名优品种,养殖量占我国石斑鱼总养殖量的70%以上[3]。为突破珍珠龙胆石斑鱼工厂化健康育苗的技术瓶颈,我们开展了适合于广西地区的珍珠龙胆石斑鱼工厂化健康育苗技术体系的研究工作,以期推动广西石斑鱼养殖业健康可持续快速发展。在石斑鱼育苗研究领域,国内学者已做了大量研究工作,目前在广东、福建、海南等地区,鞍带石斑鱼(E.lanceol)、云纹石斑鱼(E.moara)、点带石斑鱼(E.malabarius)、棕点石斑鱼(E.fuscoguttatus)等石斑鱼品种的人工育苗已经取得了成功,并且针对这些石斑鱼品种建立了苗种规模化繁殖基地,实现苗种生产自繁自足,极大地推动我国石斑鱼养殖产业的发展[1, 4-8]。此外,林建斌等[3]和王丽娜等[9]分别研究了海带多糖作为饲料添加剂,对珍珠龙胆石斑鱼生长性能和免疫力的影响,以及不同养殖密度对珍珠龙胆石斑鱼摄食行为和生长等的影响。目前,在广西地区开展针对珍珠龙胆石斑鱼人工育苗技术的研究尚未有报道,仅王大鹏等[10]对斜带石斑鱼苗种繁育过程中所需的生物饵料进行了阐述。由于珍珠龙胆石斑鱼工厂化健康育苗技术不成熟,目前广西地区的珍珠龙胆石斑鱼养殖苗种完全依靠从区外购买,不仅苗种质量不稳定,而且漫长的运输过程对苗种造成极为严重的损耗,导致广西石斑鱼产业发展始终落后于广东、海南、福建等海水养殖大省,严重影响着广西石斑鱼养殖业健康可持续发展。为突破广西地区珍珠龙胆石斑鱼工厂化健康育苗的技术瓶颈,本研究设计并验证了一套科学先进的适合于广西地区的珍珠龙胆石斑鱼工厂化健康育苗技术,以达到有效提高石斑鱼苗成活率的目的。
1 材料与方法 1.1 石斑鱼育苗池与材料设施本研究在广西北海市铁山港附近的虾苗场开展。所使用的育苗池、培藻池、轮虫培育池均为室内水泥池,长方形,规格为3.0 m×4.0 m×1.8 m,全池布设24只气石充气,池内具有独立的池底排污口和“上溢下排”式进排水循环系统,能够控温调光。育苗车间的顶部为透光材料,通过使用遮光网来调节室内光照强度。
1.2 鱼苗孵化培育环境条件育苗海水经“沉淀、砂滤、消毒”三级处理后使用。育苗池内水温28~30℃, 盐度28‰~31‰,pH值8.0~8.4,溶解氧5~8 mg/L,氨氮控制在0.2 mg/L以下,光照控制在2 000~3 500 lux。
1.3 育苗池与海水消毒砂滤后的海水经150目筛绢网袋过滤,向育苗池中进水至深度达到80 cm,然后用漂白粉(10 g/m3)彻底消毒,24 h后再用硫代硫酸钠中和余氯后备用。
1.4 方法 1.4.1 培藻在海水养殖中常选择小球藻(Chlorella vulgaris)、牟式角毛藻(Chaetoceros muelleri)、等鞭金藻(Isochrysis galbana)、亚心型扁藻(Platymonas subcordiformis)等微藻作为养殖动物的开口饵料。本研究中,我们选择小球藻作为珍珠龙胆石斑鱼苗的开口饵料,同时小球藻也用于轮虫等生物饵料的培育。向培藻池的海水中按比例施入肥水王(1 g/m3),硫酸铵(5 g/m3),过磷酸钙(0.5 g/m3),然后接入100 L高浓度小球藻进行定向培藻,经过3~5 d后水色呈绿色,透明度20 cm左右,藻体密度维持在约1×1011个/m3,同时每天按比例泼洒EM菌液,然后用于轮虫等生物饵料的培育。
1.4.2 轮虫培育采用逐级放大的模式培育褶皱臂尾轮虫。首先,将轮虫接种入200 L小球藻液,每天按比例泼洒EM菌液和小球藻液,静水充气培养5 d后将此200 L的轮虫,接入轮虫培养池中(规格为3.0 m×4.m×1.8 m),静水充气培养5 d后使用。轮虫培养池要进行日常维护,包括每天补充高浓度小球藻藻液,池底吸污,补充海水以确保水质清新,同时每天按比例泼洒EM菌液,对轮虫数目进行计数。轮虫计数方法是:用1 mL巴氏吸管吸取1 mL海水计算滴数,然后用烧杯在气石周围取样,混匀后用巴氏吸管吸取水样,在玻片上滴加5~10滴,计数轮虫数目后取平均数,乘以滴数,得到轮虫密度(个/mL)。
1.4.3 育苗池布卵放苗前准备育苗池中接入高浓度小球藻进行定向培藻至池水呈微绿色,同时每天按比例向池中投放海洋红酵母(15 g/m3)、泼洒EM菌液,然后可准备布卵放苗。
1.4.4 优良受精卵的筛选与布卵将收集的受精卵置于盐度为32‰的海水中,静置10 min后用80目筛绢网将上层悬浮的优良受精卵捞出,弃去底层鱼卵,如此重复3次,再用白色鱼苗碟盛出受精卵,经过称重后放进孵化池。
1.4.5 放苗与育苗鱼苗培育初期,即受精卵下池孵化到开口前的时间段内(1~3 d),采用微流水。仔鱼开口后(一般为第3日)停止流水,然后孵化池每天逐渐添加5~10 cm小球藻液,直到池水达到1.2 m,同时每天按比例投放15 g/m3海洋红酵母,泼洒EM菌液,并且从培藻池中泵进藻液,以稳定育苗水体生态环境,并且为育苗池中的轮虫和桡足类等饵料生物提供饵料。
1.4.6 生物饵料投喂管理选取褶皱臂尾轮虫、桡足类和卤虫作为生物饵料进行育苗投喂。仔鱼孵出的第一天进行抽样计算刚孵出的仔鱼数量,仔鱼孵出后第3天用烧杯观察已出现“三黑点”的仔鱼,如仔鱼有表现摄食动作时,开始用轮虫进行投喂。投饵量根据育苗池中饵料数量而定,各种饵料的投喂量按少量多次原则,根据稚、幼鱼的胃肠饱满度、残饵量的多少及水质状况及时调整,饵料生物须用清洁海水洗净并消毒后投喂,育苗期间应严格保持良好水质。
鱼苗各时期的饵料投喂种类如下:
(1) 3~6日龄,投喂SS型(超小型)轮虫。SS型轮虫筛选方法为在轮虫培育池中用200目滤网捞取轮虫,投喂前再用100目滤网滤除较大型的饵料生物。
(2) 7~11日龄,轮虫加桡足类幼体混合投喂,其中轮虫70%,桡足类30%,保持育苗池中轮虫的密度为5×106个/m3,保持育苗池中桡足类的密度为1×106~2×106个/m3。该阶段轮虫和桡足类的筛选方法如下:轮虫用200目滤网捞取,投喂前再用100目滤网滤除较大型的饵料生物,桡足类幼体可用150目滤网捞取,投喂前再用100目滤网滤除较大型的饵料生物。
(3) 12~19日龄,轮虫加桡足类幼体混合投喂,其中轮虫50%、桡足类50%,轮虫每天8:00,15:00投饵2次,桡足类每天8:00,11:00,14:00和17:00投饵4次。
(4) 19~35日龄,桡足类成体和卤虫无节幼体混合投喂。桡足类成体使用100目滤网捞取,卤虫无节幼体经卵壳分离器分离后投喂,每天投喂3~4次。
1.4.7 生物饵料的营养强化生物饵料投喂前,使用小球藻和营养强化液对其进行营养强化。具体操作:在营养强化桶中加入高浓度小球藻液,按比例加入鱼肝油的营养强化液,充分曝气使混匀。然后200目筛绢网收集生物饵料,并接入营养强化桶中,微充气培养6~12 h后加入育苗池中进行投喂。强化时需要持续光照。
1.4.8 育苗池日常水质管理每天8:00,14:00和18:00记录各育苗池光照、水温和盐度,不定时测定池水的溶氧量、氨氮和亚硝酸浓度。浮游生物密度测定方法如下:育苗期间,每天取样测定1次轮虫、桡足类、卤虫等浮游生物密度;从第7日后开始换水,换水量为育苗池总水量的1/10;第8-15日每天换水量1/5~1/4,隔天吸污1次;第16-20日,每天换水量1/4~1/3,每天吸污1次;第21-30日,每天换水量1/3~1/2,每天吸污1次;第30-35日,每天换水量50%~100%,每天吸污1次。吸污时要注意先排水,吸取池底污质后,用150目筛绢网袋过滤海水进水,确保水质清新。加水之后再补充藻液。
1.4.9 收获与计数珍珠龙胆石斑鱼鱼卵下池后经过35 d的培育,鱼苗体长为2~3 cm,此时采用拉网收获。采用的捕捞网具为60目围网。具体操作方法是,把围网从育苗池的一侧张开,然后拖围逐渐缩小面积,捕获鱼苗后转移到池塘或网箱内标粗。
2 结果与分析 2.1 受精卵孵化与育苗结果珍珠龙胆石斑鱼受精卵孵化在育苗池中进行。布卵孵化密度为1×104 颗/m3,共投放石斑鱼卵约1×106 颗,孵出约9.6×105 尾仔鱼,孵化率达到96%,经过35 d的培育,共收获幼鱼约1.05×105 尾,成活率为10.5%,幼鱼平均全长25.5 mm。这说明珍珠龙胆石斑鱼工厂化人工健康育苗获得成功。
育苗期间,池中水温保持在28~31℃,pH值8.0左右,盐度28‰~31‰,育苗池水面的光照强度为1 000~5 000 lux,孵化期间池内气石保持微充气状态以避免鱼卵与池壁摩擦而造成损伤。布卵约24 h后,仔鱼陆续破膜而出,初孵仔鱼全身透明,全长1.2~1.4 mm(图 1)。

|
| 图 1 孵化24 h的珍珠龙胆石斑鱼仔鱼 Fig.1 The hybrid grouper larva (E.fuscoguttatus♀×E.lanceolatus♂) after hatching for 24 h |
2.2 光照条件对仔鱼成活率的影响
光照条件对珍珠龙胆石斑鱼仔鱼成活率影响的试验结果如图 2所示,试验组1(Test 1)的光照强度大于1 000 lux,试验组2(Test 2)的光照强度为500 lux,试验组1与试验组2在3日龄时,成活率差别不大,但是试验组1在5日龄、10日龄时的仔鱼成活率分别比试验组2高42.76%和48.39%。
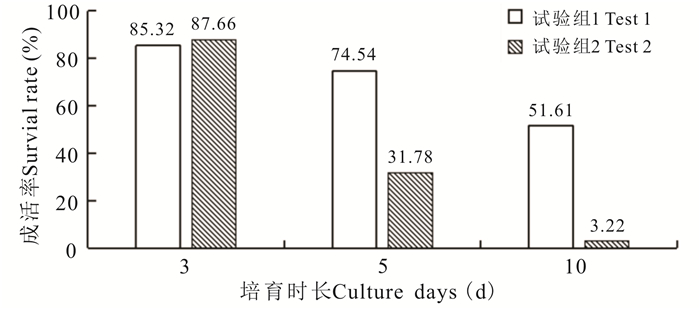
|
| 图 2 光照强度对珍珠龙胆石斑鱼仔鱼成活率具有明显影响 Fig.2 Light intensity has significant effects on survival rate of hybrid grouper larva |
2.3 育苗养殖期间的主要水质指标 2.3.1 光照和盐度变化情况
第1-6日,珍珠龙胆石斑鱼卵放入孵化池内孵化,由于不换水,池水蒸发导致盐度不断升高(图 3)。如图 3所示,35 d的育苗时间内,池中育苗水体的光照强度保持在2 000~3 500 lux(图 3a),盐度保持在28‰~31‰(图 3b),工厂化育苗车间的孵化育苗条件良好,并且保持了较高的稳定性,有利于提高出苗率和成活率。
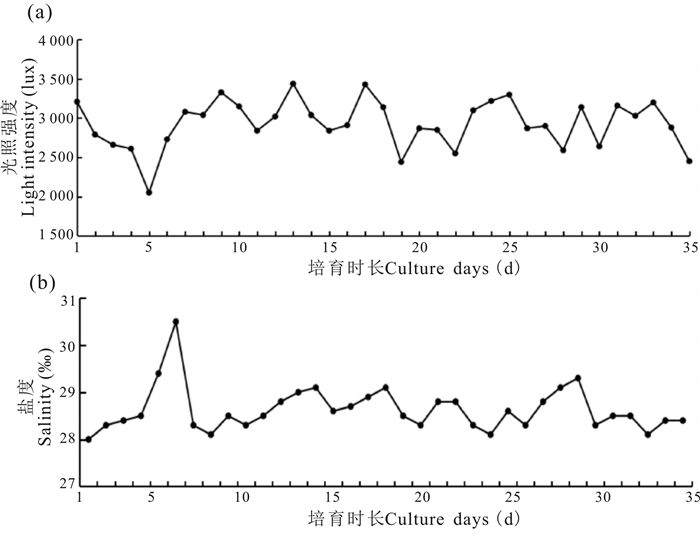
|
| 图 3 育苗水体中光照强度(a)和盐度(b)变化 Fig.3 Variations of light intensity (a) and salinity (b) in breeding water |
2.3.2 温度和溶氧变化情况
如图 4所示,35 d的育苗时间内,池中育苗水体的温度保持在28~31℃,溶氧保持在6.0~9.0 mg/L。第4-7日,由于阳光照射强烈,水体温度有所升高,通过在育苗车间加盖遮阳网的方式,降低了育苗车间的环境温度和水体温度。溶解氧虽然有所下降,但是始终维持在6 mg以上,保持了良好的溶氧。
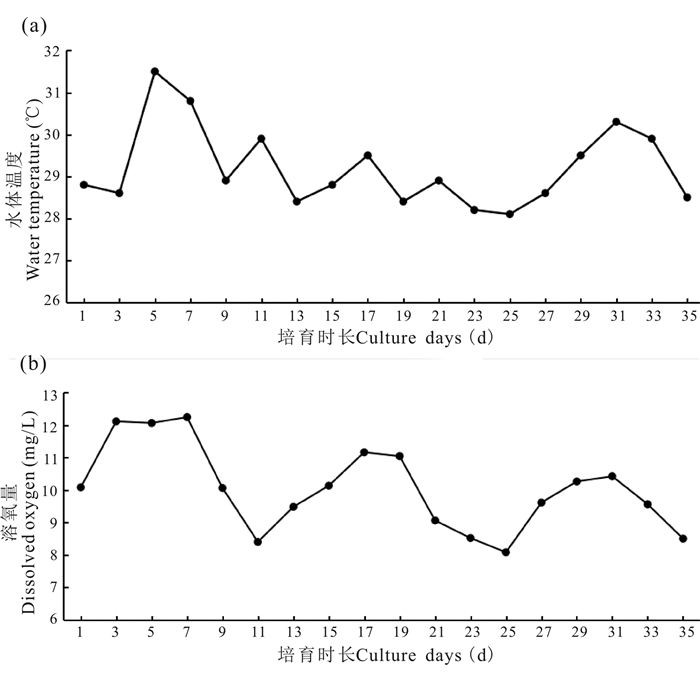
|
| 图 4 育苗水体中温度(a)和溶解氧(b)变化 Fig.4 Variations of temperature (a) and dissolved oxygen (b) in breeding water |
2.3.3 氨氮浓度变化情况
育苗期间对水体的氨氮含量进行了监测。如图 5所示,第1-7日处于孵化池阶段,由于不更换,氨氮含量持续升高,并且在第7日达到最高。第7日移入育苗池后开始换水,氨氮含量下降,随后保持比较平稳的低水平。育苗期间,鱼苗活动无明显异常。
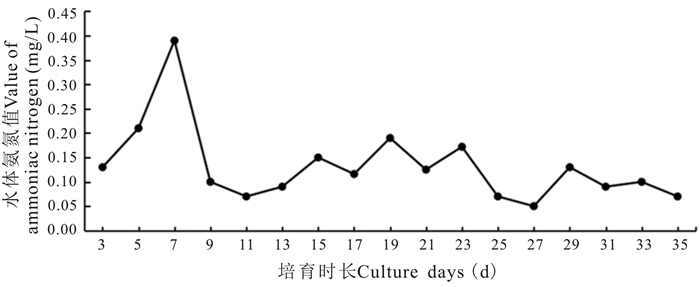
|
| 图 5 育苗水体中氨氮值变化 Fig.5 Variations of ammoniac nitrogen in breeding water |
2.4 生物饵料营养强化对育苗成活率的影响
饵料生物在鱼类苗种培育中具有极为重要的作用。特别是仔稚鱼从吸收卵黄内源营养发育到摄取生物饵料等外源营养的过程中,一些必要营养成分的缺乏可能会导致其大量死亡。研究报道认为,ω-3脂肪酸是海水鱼维持正常生长发育中必需营养成分,其中二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)最为重要,但是石斑鱼苗自身不能合成,只能从饵料中获取足够的DHA和EPA。但是目前海水鱼类人工育苗所投喂的轮虫、桡足类和卤虫等生物饵料体内DHA和EPA含量极低,无法满足仔稚鱼正常生长发育的需要。因此生物饵料营养强化是提高鱼苗成活率的关键因素[11]。
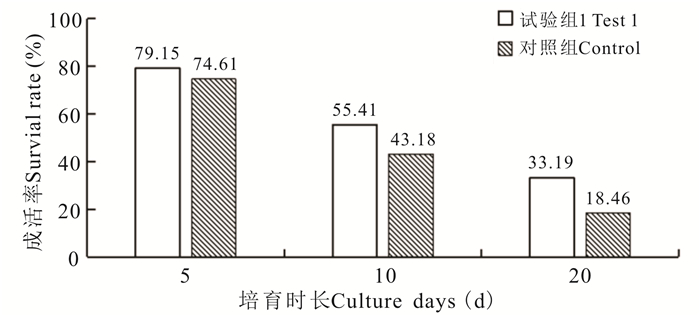
试验表明,对生物饵料营养强化,能够一定程度提高珍珠龙胆石斑鱼仔鱼的成活率(图 6)。如图 6所示,试验组(Test)的鱼投喂经过营养强化的生物饵料,对照组(Control)的鱼投喂的生物饵料没有进行营养强化,试验组与对照组在5日龄时,成活率差别不大,分别为79.15%和74.61%,但是试验组在10日龄、20日龄时的仔鱼成活率分别比对照组高12.23%和14.73%。
|
| 图 6 生物饵料营养强化对珍珠龙胆石斑鱼育苗成活率的影响 Fig.6 Effect of nutritional for tification of biological diet on survivat rate of hybrid grouper larva |
3 讨论
为有效提高石斑鱼苗成活率,本研究设计并验证了一套适合于广西地区的珍珠龙胆石斑鱼工厂化健康育苗技术。根据先前报道,育苗水体的温度、盐度、氨氮浓度和溶解氧是保证育苗高成活率的关键因素。例如,黄宗文等[4]在鞍带石斑鱼的工厂化育苗研究中发现,育苗期间最适水温为28.0~30.7℃,盐度为27.0‰~32.0‰,溶氧量为6 mg/L以上。黄进光等[5]在云纹石斑鱼工厂化健康育苗技术的研究中认为,育苗期间最适水温为22~28℃,盐度25‰~32‰,溶解氧5 mg以上。陈波等[6]关于点带石斑鱼工厂化育苗研究的报道中,水体温度为27.8~28.8℃,盐度保持在29.0‰~29.5‰,溶解氧为5~9 mg/L。在本研究珍珠龙胆石斑鱼育苗期间,我们将育苗水体维持在稳定的范围,包括将光照强度保持在2 000~3 500 lux,水温保持在28~31℃,盐度保持在28‰~31‰,水体的溶氧量始终保持在6 mg/L以上,观察发现,鱼苗的发育基本正常。
珍珠龙胆石斑鱼受精卵的孵化率达到96%,经过35 d的培育,幼鱼成活率为10.5%,损耗率为85.5%,在此过程中,存在4次死亡高峰期。第1次死亡高峰出现在5-8日龄的仔鱼,对死亡仔鱼进行显微镜观察发现,其胃肠中无饵料无内容物,其原因可能是这部分死亡的仔鱼从内源性营养向外源性营养转变的关键时期,没有主动开口摄食,因此在此时期应该提供适口的生物饵料,并且尽量提高生物饵料的数量。同时,必须要重视光照强度对仔鱼开口摄食的影响。光作为自然界重要的生态因子,直接或间接地影响着陆生动物与水生动物的生长、发育、摄食和繁殖等活动。相关研究结果已经证实光照条件在海水鱼类苗种培育中具有极为重要的作用[12]。本研究中我们分别设置了光照强度大于1 000 lux和光照强度为500 lux的两组试验组进行珍珠龙胆石斑鱼的孵化育苗,检测了光照条件对珍珠龙胆石斑鱼仔鱼成活率影响(图 2)。结果发现光照强度为500 lux的试验组,5日龄和10日龄鱼苗的成活率显著低于光照强度大于1 000 lux的试验组,即光照为500 lux时,仔鱼可能无法正常开口摄食。说明光照条件对珍珠龙胆石斑鱼早期仔鱼开口摄食和生长发育具有重要影响,这与前人的研究结果相一致[12]。第2次死亡高峰出现在第10-15日,在此阶段,仔鱼开始发育转变为稚鱼,易受到水质变化、水体波动等环境的影响,因此加强水质管理是关键,应按比例投放海洋红酵母和EM菌液,以调控水质的洁净、稳定育苗水体生态环境。第3次死亡高峰出现在第20-25日,即稚鱼的“收棘期”。此阶段育苗损耗的主要原因是稚鱼鳍棘长,体表黏液多,容易过度密集而互相刺伤。因此,此阶段应加强对生物饵料投喂管理,注意对生物饵料进行营养强化,并且根据稚鱼的胃肠饱满度和残饵量及时调整,保持良好水质。第4次死亡高峰出现在第30-35日,此阶段鱼苗损耗的主要原因是鱼苗处于由稚鱼向幼鱼过渡的变态期,由于个体差异较大而出现互相残杀。因此应及时采用鱼筛过筛分苗,按鱼体的大小分级培育。除此之外,对30日龄石斑鱼幼鱼进行抽样PCR检测发现,部分幼鱼检出神经坏死病毒(Nervous necrosis virus, NNV)。据报道,NNV的传播途径主要包括亲鱼的垂直传播和病毒在养殖水体中的水平传播。其中,亲鱼的垂直传播,即亲鱼自身携带NNV病毒,导致其受精卵和孵化出的幼鱼也携带这种病毒,最终导致NNV病毒爆发、幼鱼大规模死亡。因此我们认为石斑鱼神经坏死病毒病对珍珠龙胆石斑鱼鱼苗成活率影响较大[13]。未来研究中,我们将针对石斑鱼神经坏死病毒,着力研发操作便捷的快速检测技术和高效抗病毒药物,用于石斑鱼育苗中神经坏死病毒等病毒性病害的现场快速诊断和预防治疗,为提高广西珍珠龙胆石斑鱼人工育苗成活率和苗种质量,提供标准化的人工健康育苗技术流程、便捷的病害现场快检试剂盒、高效抗病害药物和生态防控功能产品[2, 13-19]。
4 结论本研究在前人研究的基础上,结合先期试验,设计了一套适合于广西地区的珍珠龙胆石斑鱼工厂化健康育苗技术方案,并对方案进行了试验验证。结果表明,在光照强度为2 000~3 500 lux,水温28~31℃,盐度28‰~31‰,水体的溶氧量>6 mg/L的育苗条件下,石斑鱼鱼苗生长情况良好,35 d育苗成活率达到10.5%,35 d幼鱼平均全长25.5 mm。育苗期间各项水质指标稳定,环境可控性强。对生物饵料进行营养强化有助于提高珍珠龙胆石斑鱼的育苗成活率。实验证明,本研究技术方案安全可靠,有助于推动广西海水养殖业良种化进程、促进广西地区石斑鱼养殖业健康可持续发展。
| [1] |
林浩然. 石斑鱼类养殖技术体系的创建和石斑鱼养殖产业持续发展的思考[J]. 福建水产, 2012, 34(1): 1-10. DOI:10.3969/j.issn.1006-5601.2012.01.001 |
| [2] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [3] |
林建斌, 梁萍, 朱庆国, 等. 海带多糖对珍珠龙胆石斑鱼生长性能和免疫力的影响[J]. 福建农业学报, 2017, 32(1): 17-21. |
| [4] |
黄宗文, 骆剑, 林彬, 等. 鞍带石斑鱼工厂化育苗研究[J]. 海洋科学, 2010, 34(9): 23-29. |
| [5] |
黄进光, 谢恩义. 云纹石斑鱼工厂化健康育苗技术初探[J]. 水产养殖, 2010, 31(4): 8-9. DOI:10.3969/j.issn.1004-2091.2010.04.004 |
| [6] |
陈波, 柳敏海, 罗海忠, 等. 点带石斑鱼Epinehelus malabarius (Schneider)工厂化育苗技术的初步研究[J]. 现代渔业信息, 2006, 21(10): 26-29. DOI:10.3969/j.issn.1004-8340.2006.10.008 |
| [7] |
陈忠国. 土池培育珍珠龙胆石斑鱼苗种技术[J]. 海洋与渔业, 2016(3): 49-51. DOI:10.3969/j.issn.1672-4046.2016.03.021 |
| [8] |
蔡琰, 姚学良, 张振奎. 天津地区珍珠龙胆石斑鱼工厂化健康养殖技术[J]. 天津水产, 2015, 1: 34-35. |
| [9] |
王丽娜, 申玉春, 叶宁, 等. 养殖密度对珍珠龙胆石斑鱼行为活动和生长性能的影响[J]. 南方农业学报, 2017, 48(5): 920-925. DOI:10.3969/j.issn.2095-1191.2017.05.027 |
| [10] |
王大鹏, 谢达祥, 李长伙, 等. 斜带石斑鱼苗种繁育生物饵料选择与培养[J]. 江苏农业科学, 2012, 40(8): 241-243. DOI:10.3969/j.issn.1002-1302.2012.08.096 |
| [11] |
黎祖福, 陈省平, 庄余谋, 等. 鞍带石斑鱼人工繁殖与鱼苗培育技术研究[J]. 海洋水产研究, 2006, 27(3): 78-85. |
| [12] |
秦志清, 林越赳, 张雅芝, 等. 光照对漠斑牙鲆仔鱼摄食、生长与存活的影响[J]. 集美大学学报:自然科学版, 2008, 14(3): 14-18. |
| [13] |
YU Q, LIU M, WEI S, et al. Isolation of nervous necrosis virus from hybrid grouper (Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂) cultured in Guangxi, China[J]. Fish Pathology, 2019, 54(1): 16-19. DOI:10.3147/jsfp.54.16 |
| [14] |
YU Q, LIU M, XIAO H, et al. The inhibitory activities and antiviral mechanism of Viola philippica aqueous extracts against grouper iridovirus infection in vitro and in vivo[J]. Journal of Fish Diseases, 2019, 42(6): 859-868. DOI:10.1111/jfd.12987 |
| [15] |
LI P, ZHOU L, WEI J, et al. Development and characterization of aptamer-based enzyme-linked apta-sorbent assay for the detection of Singapore grouper iridovirus infection[J]. Journal of Applied Microbiology, 2016, 121(3): 634-643. DOI:10.1111/jam.13161 |
| [16] |
LI P, WEI S, ZHOU L, et al. Selection and characterization of novel specific DNA aptamers specifically recognized by Singapore grouper iridovirus-infected fish cells[J]. Journal of General Virology, 2015, 96(11): 3348-3359. DOI:10.1099/jgv.0.000270 |
| [17] |
李鹏飞, 余庆, 李菲, 等. 基于新型核酸适配体-荧光分子检测探针用于石斑鱼虹彩病毒病的快速诊断[J]. 广西科学, 2018, 25(1): 63-67. |
| [18] |
YU Q, LIU M, WEI S, et al. Characterization of ssDNA aptamers specifically directed against Trachinotus ovatus NNV (GTONNV)-infected cells with antiviral activities[J]. Journal of General Virology, 2019, 100(3): 380-391. DOI:10.1099/jgv.0.001226 |
| [19] |
ZHOU L, LI P, NI S, et al. Rapid and sensitive detection of redspotted grouper nervous necrosis virus (RGNNV) infection by aptamer-coat protein-aptamer sandwich enzyme-linked apta-sorbent assay (ELASA)[J]. Journal of Fish Diseases, 2017, 40(12): 1831-1838. DOI:10.1111/jfd.12656 |



