2. 广西科学院, 广西近海海洋环境科学重点实验室, 广西南宁 530007;
3. 河南师范大学生命科学学院, 河南新乡 453007;
4. 广西壮族自治区水产科学研究院, 广西水产遗传育种与健康养殖重点实验室, 广西南宁 530021;
5. 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory of Marine Environmental Science, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
4. Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Breeding, Guangxi Academy of Fishery Science, Nanning, Guangxi, 530021, China;
5. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China
斑点叉尾鮰作为广西大宗淡水养殖鱼类,具有适用范围广、生长速度快、抗病能力强、群体产量高、肉质细腻、营养丰富等诸多优点。然而,近年来在高密度养殖条件和日益恶化的养殖环境下,各种病害频发,给渔业养殖业造成巨大经济损失[1-5]。因此,针对严重危害广西大宗淡水养殖鱼类斑点叉尾鮰养殖的病原,开展疫苗等具有免疫功能产品的研究,可及时干预、控制病害暴发,相关研究成果对提高广西淡水养殖业核心竞争力和整体自主创新能力、促进广西水产养殖结构的调整和优化具有积极意义。嗜水气单胞菌(Aeromonas hydrophila)是一类危害极其严重的水产动物病原菌,其引起的鱼病具有发病迅速、死亡率高、流行面广、流行持续时间长等特点,严重威胁着广西地区水产养殖业的可持续发展[6-10]。目前,治疗细菌性鱼病主要是使用抗生素等化学药物,但是盲目用药、滥用抗生素的现象普遍,不仅造成鱼体中有害药物残留等重大食品安全问题,还导致养殖水体质量不断恶化,限制广西斑点叉尾鮰养殖业健康可持续发展[11-12],所以针对嗜水气单胞菌开发有效防治技术一直是该领域研究的重点。根据前期对广西斑点叉尾鮰养殖区的网箱及池塘等养殖场所开展病原菌的流行病学调查结果可知,嗜水气单胞菌是危害广西斑点叉尾鮰养殖鱼类的主要致病菌之一,且在治疗上已经出现较为严重的病菌耐药性问题。因此,我们针对当地分离到的致病性嗜水气单胞菌,开发区域定制化的灭活疫苗,以实现鱼病的有效预防和控制。通过对嗜水气单胞菌的培养条件和灭活疫苗制备条件的优化,有效提高菌液浓度、缩短培养时间,降低并优化甲醛使用浓度,制备出安全性高、免疫保护率强的广西斑点叉尾鮰源嗜水气单胞菌灭活疫苗。
1 材料与方法 1.1 材料300尾健康斑点叉尾鮰(长8~10 cm)由广西南宁金陵的淡水鱼养殖企业提供。从患病斑点叉尾鮰中分离得到的嗜水气单胞菌和草鱼胸鳍组织细胞系(GCPF cell line)保存于本实验室。0.22 μm微孔滤柱购自Millipore公司, 96孔细胞培养板购自康宁公司, 测细胞活性的CCK-8试剂盒购自碧云天生物技术有限公司, 水浴锅和生化培养箱购自上海博迅公司, 酶标仪购自Thermo公司,超净工作台购自苏净安泰公司,Olympus CX41倒置光学显微镜;LB培养基和琼脂平板购自广州环凯微生物有限公司, 福尔马林等生化试剂均为国产分析纯。
1.2 方法 1.2.1 嗜水气单胞菌浓度与菌液OD值回归方程的计算嗜水气单胞菌从患病斑点叉尾鮰的肝、脾、肾和体表溃烂组织中分离纯化,保存于本实验室[13]。菌种接种于1 mL LB培养基中,28℃、180 r/min培养18 h后,用灭菌生理盐水5 000 r/min、10 min离心清洗2次后,混匀于1 mL灭菌生理盐水。细菌悬液稀释以后,以平板法培养计数。另外,参考先前的报道,使用分光光度计测定细菌悬液在各浓度梯度下的吸光值, 具体操作如下:使用灭菌生理盐水将细菌悬液进行浓度梯度稀释,以灭菌生理盐水作为对照,用分光光度计分别测定600 nm处吸光值,计算回归方程[14]。
1.2.2 细菌生长曲线测定将活化后的菌株接种于LB培养基中,28℃、180 r/min培养,每隔2 h取样至24 h。将样品用灭菌生理盐水5 000 r/min、10 min离心清洗2次后,混匀于灭菌生理盐水。以灭菌生理盐水作为对照,测定OD600。然后以时间为横坐标,以OD值为纵坐标绘制嗜水气单胞菌的生长曲线图。重复实验3次。
1.2.3 嗜水气单胞菌培养基的优化(1) pH值
将LB培养基的pH值分别调整为6.0,6.5,7.0,7.5,8.0和8.5,将菌种接种于培养基中,28℃、180 r/min培养24 h后,用灭菌生理盐水5 000 r/min、10 min离心清洗,然后混匀于灭菌生理盐水中,以灭菌生理盐水作为对照,测定OD600,每次实验重复3次。
(2) 蔗糖的添加
蒋启欢等[14]认为,添加蔗糖可以明显提高嗜水气单胞菌的生长速度。因此在LB培养基中加入蔗糖,使其浓度分别为0.1%、0.5%、1.0%和5.0%(W:W)。将菌种接种于不同浓度蔗糖的培养基中,28℃、180 r/min培养。在第8 h、12 h、16 h、24 h分别取500 μL菌液,用灭菌生理盐水清洗后,溶于500 μL灭菌生理盐水中,以灭菌生理盐水作为对照,测定OD600。然后以时间为横坐标,以OD值为纵坐标绘制嗜水气单胞菌的生长曲线图,重复实验3次。
1.2.4 LB培养基与营养肉汤培养基对嗜水气单胞菌生长速度的比较分别将菌株接种于营养肉汤培养基(Nutrient Broth, NB)和LB培养基(含0.5%蔗糖)中,28℃、180 r/min培养,在第8 h、12 h、16 h、24 h分别取500 μL菌液,用灭菌生理盐水离心清洗后,溶于500 μL灭菌生理盐水中。以灭菌生理盐水作为对照,测定OD600,然后绘制嗜水气单胞菌的生长曲线图。
1.2.5 嗜水气单胞菌疫苗灭活条件的研究与优化将嗜水气单胞菌接种LB培养基(0.5%蔗糖)中,28℃、180 r/min培养16 h后,用灭菌生理盐水离心清洗并混匀于灭菌生理盐水中,设定不同的灭活温度(28℃,37℃)、灭活时间(24 h、36 h、48 h)和甲醛溶液终浓度(0.05%、0.10%、0.15%、0.20%、0.25%,V:V)共30组,分别取菌液涂平板,用菌落总数检测其灭活效果,活菌数越少表示灭活效果越好。
1.2.6 嗜水气单胞菌灭活疫苗的安全性实验分别在细胞水平和鱼活体水平研究嗜水气单胞菌灭活疫苗的安全性。
将嗜水气单胞菌接种LB培养基(0.5%蔗糖)中,28℃、180 r/min培养16 h后,用灭菌生理盐水离心清洗并混匀于灭菌生理盐水中,加入终浓度为0.15%的甲醛溶液,28℃灭活24 h,使用涂平板法证实菌体已经被灭活后,用灭菌生理盐水离心清洗3次,即为实验用疫苗。
在细胞水平的安全性实验。参考文献[15]相关实验方案并优化,具体操作如下:取草鱼胸鳍组织细胞GCPF,按照2×104 CFU /孔的细胞量接入96孔细胞培养板,28℃培养24 h。实验设置如下:试验组1(Test 1, T1),每孔细胞接入10 μL实验用疫苗;试验组2(Test 2, T2),每孔细胞接入20 μL实验用疫苗;试验组3(Test 3, T3),每孔细胞接入30 μL实验用疫苗;对照组1(Con 1),每孔细胞接入30 μL无菌生理盐水;对照组2(Con 2),细胞不做处理。各组细胞继续培养48 h后在光学显微镜下观察。然后分别加入20 μL CCK-8溶液继续在28℃培养3 h,然后用酶标仪测定OD450,实验分别重复3次。
在鱼活体水平的安全性实验。将斑点叉尾鮰分为4组,每组10尾。实验设置如下:试验组1(Test 1, T1),斑点叉尾鮰腹腔注射200 μL 1×107 CFU/mL的灭活疫苗;试验组2(Test 2, T2),斑点叉尾鮰腹腔注射200 μL 1×108 CFU/mL的灭活疫苗;对照组1(Con 1),斑点叉尾鮰腹腔注射200 μL灭菌生理盐水;对照组2(Con 2),斑点叉尾鮰不作任何处理。各组鱼在28℃继续培养10 d,记录各组鱼的死亡情况,统计10 d内的累计死亡率。
1.2.7 嗜水气单胞菌灭活疫苗的免疫保护实验用LB培养基培养嗜水气单胞菌,获得细菌培养液(浓度为1×109 CFU/mL),依次10倍递进稀释8个梯度(102~109 CFU/mL),取40尾斑点叉尾鮰,每个稀释度腹腔注射5尾(100 μL/尾)。对照组共5尾,于腹腔注射100 μL灭菌生理盐水。28℃饲养15 d,记录斑点叉尾鮰的死亡情况,用Reed-Muench法计算确定嗜水气单胞菌细菌半数致死量(Lethal Dose, LD50)为1×106.58 CFU/mL。用50倍LD50浓度进行免疫保护实验。将斑点叉尾鮰分为3组,每组20尾,第1组腹腔注射100 μL灭活疫苗,第2组腹腔注射100 μL灭菌生理盐水,第3组不作处理为空白组。在免疫第10 d,用浓度为2×108 CFU/mL的嗜水气单胞菌菌液浸泡1~3组的斑点叉尾鮰,观察鱼的生长状况,攻毒7 d内统计死亡鱼的尾数,计算相对免疫保护率。以对照组鱼死亡60%以上,疫苗保护率≥70%为合格。相对免疫保护率(%)=(2个对照组死亡率的平均值-免疫组死亡率)/2个对照组死亡率的平均值×100%。
2 结果与分析 2.1 菌液OD值回归方程的计算如图 1所示,嗜水气单胞菌的细菌浓度和菌液OD值间具有较好的线性关系,其回归方程为y=2E-10x+0.1399,R2=0.975 4。由于菌液的OD值能够指示嗜水气单胞菌的浓度,在后续试验中,均通过测定菌液的OD值,结合回归方程来计算细菌嗜水气单胞菌的实际浓度。
|
| 图 1 嗜水气单胞菌细菌浓度和菌液OD值的回归方程 Fig.1 The regression equation of bacteria concentration and OD value of Aeromonas hydrophila |
2.2 嗜水气单胞菌的生长曲线
如图 2所示,从广西患病斑点叉尾鮰中分离获得的嗜水气单胞菌在LB培养基中培养时,在0~4 h时菌液OD值迅速增长,菌液浓度不断增加。4~12 h,菌液OD值略有增加;12~24 h,可能由于培养基营养不足,菌液OD值逐渐降低。综合以上结果,嗜水气单胞菌在LB培养基中培养时,在0~4 h是对数生长期,菌液浓度迅速增长; 随后进入稳定期,菌液OD值在12 h达到最高,此时菌液浓度约为7.87×108 CFU/mL。

|
| 图 2 嗜水气单胞菌的生长曲线 Fig.2 The growth curve of Aeromonas hydrophila |
2.3 嗜水气单胞菌培养基的优化
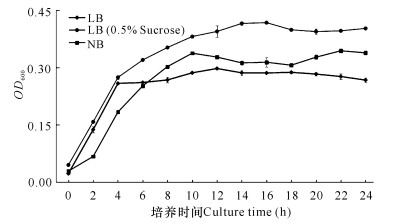
由图 3a可知,LB培养基pH值为7.0~7.5时,最适宜嗜水气单胞菌的生长。当培养基的pH值小于6.5或大于7.5时,嗜水气单胞菌的生长明显减慢。LB培养基中添加蔗糖可以显著促进嗜水气单胞菌的生长并提高产量。将嗜水气单胞菌分别在蔗糖的质量分数为0.5%、1.0%和5.0%的LB培养基中培养至16 h时,各组中嗜水气单胞菌的产量没有明显差异(图 3b)。
|
| 图 3 嗜水气单胞菌培养基的最适pH测定以及培养基中添加蔗糖对嗜水气单胞菌生长的影响 Fig.3 Determination of the optimum pH of Aeromonas hydrophila medium and the effect of adding sucrose in the medium on the growth of Aeromonas hydrophila |
2.4 嗜水气单胞菌在两种培养基中生长速度的比较
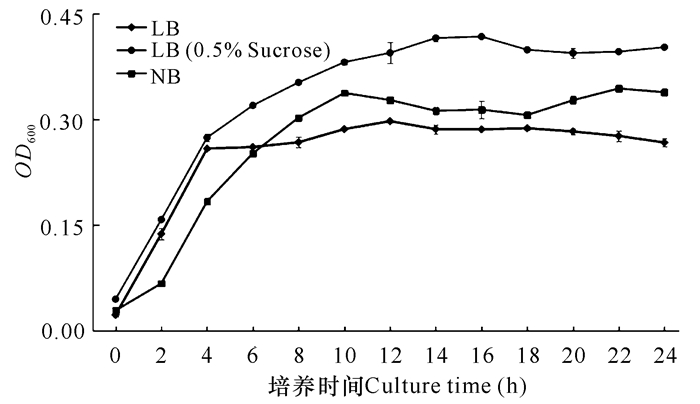
嗜水气单胞菌在普通LB培养基中培养时,0~4 h是对数生长期。如果在LB培养基中添加0.5%蔗糖,0~14 h是对数生长期,菌液浓度不断增加;在营养肉汤培养基中培养时,0~10 h是对数生长期(图 4)。综合以上结果可以发现,嗜水气单胞菌在LB培养基(0.5%蔗糖)中的生长速度和产量均优于营养肉汤培养基。
|
| 图 4 嗜水气单胞菌在两种培养基中的生长速度比较 Fig.4 Comparison of growth rate of Aeromonas hydrophila growth in two culture medium |
2.5 嗜水气单胞菌灭活疫苗的制备条件
甲醛具有毒性,为控制疫苗中甲醛的残留,根据“甲醛使用浓度低、疫苗灭活温度接近室温、灭活时间短”的原则确定并优化嗜水气单胞菌灭活疫苗的制备条件。如表 1所示,疫苗的最优制备条件为0.15%甲醛溶液、28℃条件下灭活24 h。
| 甲醛溶液终浓度 Final concentration of formaldehyde solution (%) |
灭活温度 Inactivation temperature (℃) |
灭活时间 Inactivation time (h) |
||
| 24 | 36 | 48 | ||
| 0.05 | 28 | ++ | ++ | ++ |
| 37 | ++ | ++ | ++ | |
| 0.10 | 28 | + | + | - |
| 37 | + | - | - | |
| 0.15 | 28 | - | - | - |
| 37 | - | - | - | |
| 0.20 | 28 | - | - | - |
| 37 | - | - | - | |
| 0.25 | 28 | - | - | - |
| 37 | - | - | - | |
| 注:“++”表示大量菌落,“+”表示少量菌落,“-”表示无菌落 Notes:"++"means many bacterial colonies, "+"means a few bacterial colonies, "-"means no bacterial colonies |
||||
2.6 嗜水气单胞菌灭活疫苗的安全性
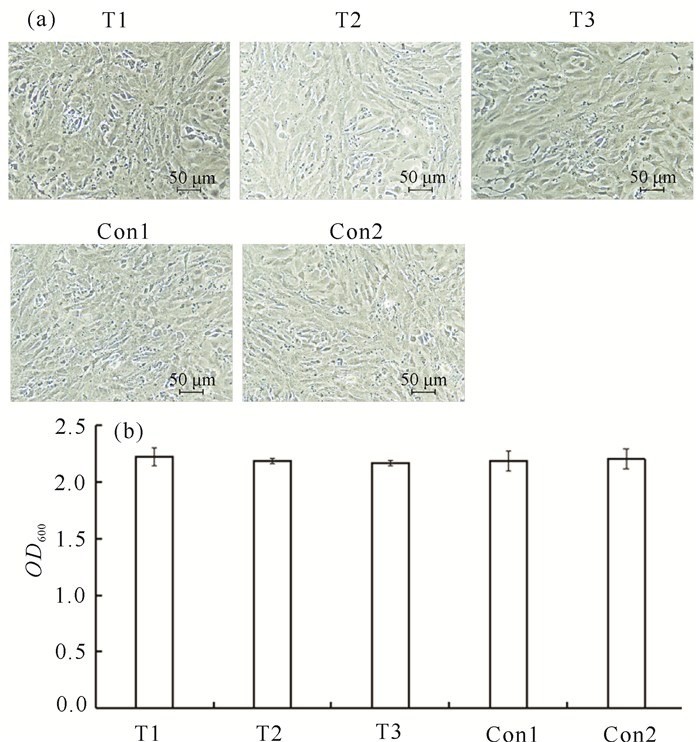
如图 5a所示,将实验用疫苗分别加入各组的GCPF细胞中,与对照组相比,实验组的细胞形态没有发生明显变化。另外,细胞活性检测结果也证实,与对照组相比,实验组中的细胞活性没有降低(图 5b),即嗜水气单胞菌灭活疫苗在细胞水平是安全无毒的。
|
| 图 5 嗜水气单胞菌灭活疫苗在细胞水平的安全性评价 Fig.5 Safety evaluation of Aeromonas hydrophila inactivated vaccine in the cell line |
如表 2所示,用200 μL不同浓度的实验用疫苗注射斑点叉尾鮰腹腔,然后继续观察10 d,注射不同浓度灭活疫苗的斑点叉尾鮰状态良好,没有出现死亡或其他不良反应,由此证实本研究中制备的嗜水气单胞菌灭活疫苗在鱼活体水平的安全性良好。
| 组别 Groups |
总数 Total number |
死亡数 Dead number |
死亡率 Mortality(%) |
| 试验组 Test group |
10 | 0 | 0 |
| 试验组2 Test group 2 |
10 | 0 | 0 |
| 对照组1 Control group 1 |
10 | 0 | 0 |
| 对照组2 Control group 2 |
10 | 0 | 0 |
2.7 嗜水气单胞菌灭活疫苗的免疫保护实验
在本研究中制备的灭活疫苗免疫保护实验中,我们采用腹腔注射的方式接种嗜水气单胞菌灭活疫苗。如表 3所示,未接种疫苗的对照组鱼死亡率高达90%,而经过腹腔注射免疫的试验组中,斑点叉尾鮰累计死亡5尾,存活率为75%,免疫保护率为75%。
| 分组 Groups |
总数 Total number |
死亡数 Dead number |
死亡率 Mortality(%) |
免疫保护率 Immune pro-tection rate (%) |
| 试验组 Test group |
20 | 5 | 75 | 75 |
| 对照组1 Control group 1 |
20 | 20 | 100 | 0 |
| 对照组2 Control group 2 |
20 | 20 | 100 | 0 |
3 讨论
致病性嗜水气单胞菌主要流行于春末夏初和秋季,无论哪种规格的斑点叉尾鮰均会感染。在感染早期,会引起病鱼的下颌、口腔、体表充血,随着病情的加剧,病鱼体表严重充血,眼球突出,肝脏、脾脏、肾脏肿大,肠道出现大量淡黄色黏液,腹腔充满腹水。作为一类危害严重的水产动物病原菌,嗜水气单胞菌引起的鱼病具有发病迅速、死亡率高、流行面广、流行持续时间长等特点。目前治疗嗜水气单胞菌鱼病,主要以饲料拌喂抗生素和泼洒化学药物为主,但是抗生素的盲目使用易导致严重的病菌耐药性,而化学药物的残留会造成重大食品安全问题,导致水环境质量的恶化。目前疫苗作为控制病原最有力的预防手段,是当前发展水产病害防控技术的主要趋势,研究制备出适合规模化生产渔用疫苗意义重大[12, 16]。
本研究中,我们对嗜水气单胞菌的培养条件和细菌培养基成分进行优化研究。其中培养基最适pH值研究结果显示,当培养基的pH值小于6.5或大于7.5时,嗜水气单胞菌的生长明显减慢,这说明过酸或过碱性环境均会影响嗜水气单胞菌的生长。当培养基pH值为6.5~7.5时,嗜水气单胞菌生长速度快、细菌数目多,而培养基pH值为7.0~7.5时最适于嗜水气单胞菌的生长,这与先前蒋启欢等[14]的研究结果一致(图 3a)。通过在培养基中添加蔗糖,能显著提高嗜水气单胞菌的生长速度和活菌数目。培养时间为0~16 h时,嗜水气单胞菌在蔗糖质量分数为0.5%、1.0%与5.0%的培养基中的生长速度基本相同,培养时间为16~24 h时,嗜水气单胞菌在蔗糖质量分数为1.0%与5.0%的培养基中的生长速度基本相同,仅略高于蔗糖浓度为0.5%的实验组(图 3b)。综合考虑成本因素,在随后的研究中均使用蔗糖浓度为0.5%的LB培养基。通过在LB培养基中添加蔗糖,能够有效延长嗜水气单胞菌的对数生长期,并且在嗜水气单胞菌在LB培养基(0.5%蔗糖)中的生长速度和产量均优于营养肉汤培养基(图 4),因此从缩短培养时间、节约原料成本、提高细菌产量等方面综合考虑,确定嗜水气单胞菌在pH值为7的LB培养基中进行培养,并且在LB培养基中添加0.5%蔗糖,培养时间为16 h。
在对斑点叉尾鮰进行疫苗接种前,我们对制备的嗜水气单胞菌灭活疫苗的安全性进行全面分析。鱼类细胞系可用于评估细菌性病原的代谢产物对鱼类的毒性,作为一种有效的监测手段,能够显著减少对有毒有害物质的评估时间[17-19]。细胞水平的灭活疫苗细胞毒性检测结果显示,与对照组相比,试验组中的细胞状态良好,细胞活性没有降低(图 5)。随后对斑点叉尾鮰注射该疫苗后,在10 d的观察期内,斑点叉尾鮰状态良好,没有出现死亡或其他不良反应(表 2)。综上结果说明,本研究中制备的嗜水气单胞菌灭活疫苗安全性好,在细胞水平和鱼活体水平均是安全无毒的。进一步的免疫保护试验中,对斑点叉尾鮰进行腹腔注射疫苗免疫,结果显示疫苗对试验组中斑点叉尾鮰的免疫保护率达到75%,即本研究制备的斑点叉尾鮰源嗜水气单胞菌灭活疫苗对于病原菌的入侵产生了明显的防御作用,能够有效保护斑点叉尾鮰,提高其存活率。
4 结论本实验通过对嗜水气单胞菌的培养条件和灭活疫苗制备条件进行优化,成功制备出成本较低、安全性高、免疫保护率强的斑点叉尾鮰源嗜水气单胞菌灭活疫苗。未来我们将继续对疫苗的制备工艺进行优化,以期制备出成本低廉、免疫保护力高、保护时间长、可以规模化生产的区域定制化斑点叉尾鮰源嗜水气单胞菌灭活疫苗。
| [1] |
陶建军. 斑点叉尾鮰产业发展情况综述[J]. 渔业致富指南, 2017(13): 14-17. |
| [2] |
陈昌福. 陈昌福:我们应该如何反思斑点叉尾鮰大量死亡的现象?[J]. 当代水产, 2017(6): 77-78. DOI:10.3969/j.issn.1674-9049.2017.06.026 |
| [3] |
蔡焰值, 肖友红. 目前我国斑点叉尾鮰产业趋势分析与应对新检测规程的措施[J]. 中国水产, 2016(7): 62-65. DOI:10.3969/j.issn.1002-6681.2016.07.028 |
| [4] |
陈意明, 陈君. 广西桂江箱养斑点叉尾鮰细菌性病害频发原因分析与防控研究[J]. 现代农业科技, 2015(10): 263-264. DOI:10.3969/j.issn.1007-5739.2015.10.151 |
| [5] |
黎小正, 吴祥庆, 庞燕飞, 等. 广西淡水池塘养殖环境影响分析与评价[J]. 广西农业科学, 2010, 41(9): 987-990. |
| [6] |
CITTERIO B, BIAVASCO F. Aeromonas hydrophila virulence[J]. Virulence, 2015, 6(5): 417-418. DOI:10.1080/21505594.2015.1058479 |
| [7] |
STRATEV D, ODEYEMI O A. Antimicrobial resist- ance of Aeromonas hydrophila isolated from different food sources:A mini-review[J]. Journal of Infection and Public Health, 2016, 9(5): 535-544. DOI:10.1016/j.jiph.2015.10.006 |
| [8] |
沈锦玉. 嗜水气单胞菌的研究进展[J]. 浙江海洋学院学报:自然科学版, 2008, 27(1): 78-86. |
| [9] |
RASMUSSEN-IVEY C R, FIGUERAS M J, MC- GAREY D, et al. Virulence factors of Aeromonas hydrophila:In the wake of reclassification[J]. Frontiers in Microbiology, 2016, 7: 1337. |
| [10] |
张德锋, 刘礼辉, 李宁求, 等. 我国南方地区鱼源气单胞菌不同种类的流行特征[J]. 水产科学, 2015, 34(11): 672-682. |
| [11] |
PARVATHI A, MENDEZ D, ANTO C. Distribution of putative virulence genes and antimicrobial drug resistance in Vibrio harveyi[J]. Indian Journal of Microbiology, 2011, 51(3): 332-337. DOI:10.1007/s12088-011-0128-z |
| [12] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [13] |
余庆, 李菲, 王一兵, 等. 广西北部湾大宗海水养殖鱼类卵形鲳鲹感染溶藻弧菌及其致病性的研究[J]. 广西科学, 2018, 25(2): 68-73. |
| [14] |
蒋启欢, 叶应旺, 胡王, 等. 草鱼嗜水气单胞菌L1灭活疫苗培养条件的优化[J]. 生物技术进展, 2012, 2(3): 206-211. DOI:10.3969/j.issn.2095-2341.2012.03.09 |
| [15] |
LI P, ZHOU L, YANG M, et al. Establishment and characterization of a cell line from the head kidney of golden pompano (Trachinotus ovatus), and its application in toxicology and virus susceptibility[J]. Journal of Fish Biology, 2017, 90(5): 1944-1959. DOI:10.1111/jfb.13277 |
| [16] |
陈昌福. 我国水产养殖动物病害防治研究的主要成就与当前存在的问题[J]. 饲料工业, 2007, 28(10): 1-3. |
| [17] |
LI P, ZHOU L, NI S, et al. Establishment and characterization of a novel cell line from the brain of golden pompano (Trachinotus ovatus)[J]. In Vitro Cellular & Developmental Biology-Animal, 2016, 52(4): 410-418. |
| [18] |
ZHOU L, LI P, NI S, et al. Establishment and characterization of a mid-kidney cell line derived from golden pompano Trachinotus ovatus, a new cell model for virus pathogenesis and toxicology studies[J]. In Vitro Cellular & Developmental Biology - Animal, 2017, 53(4): 320-327. |
| [19] |
余庆, 李菲, 覃仙玲, 等. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析[J]. 广西科学, 2018, 25(1): 74-79. |



