2. 广西壮族自治区海洋研究所, 广西海洋生物技术重点实验室, 广西北海 536000;
3. 河南师范大学生命科学学院, 河南新乡 453007;
4. 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007;
5. 华南农业大学海洋学院, 广东广州 510642
2. Guangxi Key Laboratory for Marine Biotechnology, Guangxi Institute of Oceanography, Beihai, Guangxi, 536000, China;
3. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
4. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China;
5. College of Marine Sciences, South China Agricultural University, Guangzhou, Guangdong, 510642, China
海洋渔业是现代农业和海洋经济的重要组成部分,促进海洋渔业的健康可持续发展,对于促进沿海地区经济的发展具有重要意义[1]。赤潮灾害是海洋养殖业健康可持续发展的制约因素之一,近年来,养殖水域污染加重,导致赤潮频发,对沿海的养殖业带来巨大影响。尤其是有毒的赤潮种类,它们不仅能够造成缺氧的环境、分泌黏性物质堵塞鱼鳃以及释放活性氧等,还会产生藻毒素,这些藻毒素对海域生态环境造成严重破坏,会造成鱼虾、贝类的大量死亡甚至通过食物链危害人类的身体健康[2]。
米氏凯伦藻(Karenia mikimotoi)是近年来我国典型的赤潮原因种,其爆发赤潮时往往造成大量鱼类和贝类的死亡。2012年米氏凯伦藻赤潮的大规模发生导致福建沿海贝类养殖的大量死亡,造成了高达20亿元的经济损失[3],自此,米氏凯伦藻引起国内外的广泛关注。米氏凯伦藻对多种海洋生物的生长都有不利影响,包括鱼类、贝类及无脊椎生物,甚至会导致它们的死亡[4]。米氏凯伦藻赤潮对海洋生物的毒性作用研究已成热点,但关于其导致海洋生物死亡的途径尚存争议[5]。已有研究表明米氏凯伦藻可以产生溶血毒素和鱼毒素,其主要成分为糖脂类和不饱和脂肪酸等[6-8]。这些溶血毒素和鱼毒素,可溶解鱼类的鳃组织细胞,从而影响鱼类的呼吸、分泌、排泄等功能,最终造成鱼类死亡[9-10]。
由于米氏凯伦藻溶血毒素成分和结构复杂,而不同藻类的溶血毒素作用机理不同,这导致对米氏凯伦藻危害机制的研究比较困难[11]。目前对于米氏凯伦藻对海洋生物的致毒致死机理多集中在对鱼[12]、贝类[13]以及浮游动物[14]等活体及鱼鳃组织[9-10]的研究上,而其对鱼类的其他组织器官是否也能产生毒理作用及其相关细胞通路问题,尚需进一步的研究。鱼类细胞培养由于具有成本低,重复性好,实验条件可以精确控制等优点,已经成为一种重要的研究手段,广泛应用于病毒学、环境毒理学、细胞生物学等方面的研究[15]。本研究采用体外培养的胖头鲤(Fathead minnow, FHM)细胞为材料,分析米氏凯伦藻对于鱼类细胞的毒性作用和致死机制,以期为赤潮灾害的防控技术提供数据支持和科学依据。
1 材料与方法 1.1 藻种和细胞米氏凯伦藻分离自东海海域,保存于北部湾海洋研究中心藻种资源库,编号为BBGA-9002。FHM细胞为本实验室保存。
1.2 主要试剂和仪器试剂:MEM细胞培养基和胎牛血清(FBS)均购自Gibco公司;Cell counting kit-8(CCK-8)试剂盒、Hoechst 33342荧光染料以及caspase-3活性检测试剂盒均购自碧云天。
仪器:离心机(型号:3-18KS,Sigma);超声破碎仪(Sonics);生化培养箱(型号:SPX-100B-Z,上海博迅);倒置显微镜(型号:Ts2, Nikon);激光共聚焦显微镜(型号:Ti2-S-HU, Nikon);多功能酶标仪(Thermo公司)。
1.3 方法 1.3.1 细胞培养与传代FHM细胞用含有10% FBS血清的MEM培养基培养,培养温度为25℃,细胞生长3 d后使用胰蛋白酶消化,进行传代。
1.3.2 米氏凯伦藻细胞提取物取50 mL处于稳定生长期的米氏凯伦藻,在4℃、5 000 g下离心5 min。将上清用0.45 μm过滤器过滤,收集滤液并分装于灭菌的2 mL冻存管中,-20℃保存备用,此即为米氏凯伦藻培养液(Karenia mikimotoi culture solution, KMCS)。在沉淀中加入10 mL的无菌PBS缓冲溶液,重新悬浮,在冰水浴条件下超声破碎细胞(15 min,22%,转3 s停2 s)后,在4℃、15 000 g下离心5 min,上清用0.45 μm过滤器过滤,收集滤液于-20℃保存待用,此滤液为米氏凯伦藻细胞提取物(Karenia mikimotoi cell extracts, KMCE)。
1.3.3 细胞病变观察与活力检测在96孔板中,每个孔培养100 μL FHM细胞,28℃培养18 h。然后移除细胞培养基,加入100 μL不同稀释倍数的KMCS和KMCE,每种处理设置4个平行,每隔2 h观察细胞形态,并拍照。正常培养的FHM细胞作为对照组。
待细胞出现明显的病变效应(Cytopathic effect, CPE)后,在每个孔中加入10 μL的CCK-8溶液,置于培养箱中继续培养1 h,用酶标仪测定A450。
1.3.4 Hoechst 33342染色将FHM细胞在28℃培养18 h,然后细胞分别与KMCS和KMCE孵育处理,正常培养的FHM细胞作为对照组。4 h后,小心吸出培养液,各加入200 μL的Hoechst 33342染料,3 min后,用PBS缓冲溶液清洗细胞,置于激光共聚焦显微镜下观察并拍照。
1.3.5 Caspase-3活性检测将细胞分别与KMCS和KMCE孵育处理4 h,然后将细胞转移到1.5 mL离心管中,在4℃、600 g下离心5 min,小心移除上清。用PBS缓冲溶液重悬细胞,重复上述离心步骤,按照caspase-3活性检测试剂盒的使用说明进行后续步骤,完成caspase-3活性的检测。
1.3.6 数据处理与统计分析实验数据采用IBM SPSS Statistics 19软件进行分析,利用单因素方差分析进行统计差异性分析,根据P值判断实验组与对照组之间有无显著差异(P < 0.05表示与对照组有显著差异,P < 0.01表示与对照组有极显著差异,P>0.05表示与对照组无显著差异)。采用Sigmaplot 12.0绘图分析软件对实验结果进行制图。
2 结果与分析 2.1 KMCS和KMCE对FHM细胞的毒性作用稀释两倍的KMCS和KMCE与FHM细胞孵育处理4 h,通过显微镜观察发现,对照组FHM细胞形态正常(图 1a和图 1c)。而KMCS孵育处理后的FHM细胞出现明显的细胞病变,大量细胞皱缩,并且部分细胞裂解(图 1b);KMCE孵育处理后,大量FHM细胞变圆皱缩,但与KMCS孵育处理后的FHM细胞相比,几乎无细胞发生裂解(图 1d)。
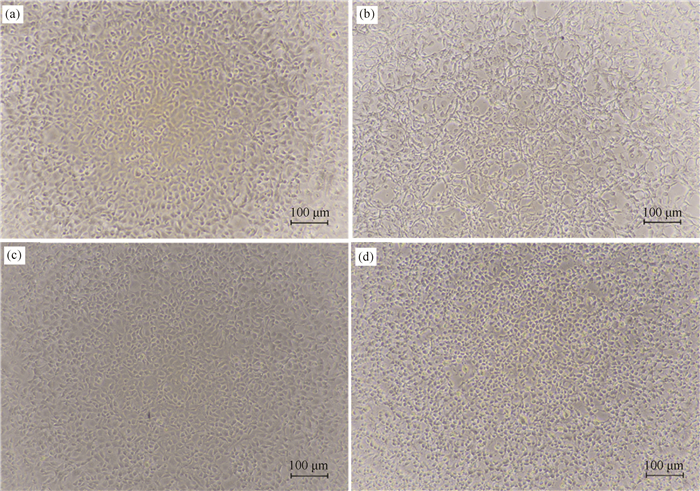
|
| (a)正常FHM细胞;(b)稀释两倍的KMCS感染4 h后的FHM细胞;(c)正常FHM细胞;(d)稀释两倍的KMCE感染4 h后的FHM细胞 (a)Normal FHM cells; (b)Diluted twice the amount of KMCS after 4 h of infection with FHW cells; (c)Normal FHM cells; (d)Diluted twice the amount of KMCE after 4 h of infection with FHW cells 图 1 KMCE和KMCE对FHM细胞的毒性作用 Fig.1 Cytopathic effect of KMCS and KMCE on FHM cells |
2.2 KMCS和KMCE对FHM细胞活力的影响
用CCK-8法检测不同稀释倍数的KMCS和KMCE对细胞活力的影响(图 2),结果表明,未稀释的和稀释两倍的KMCS在感染FHM细胞4 h后,导致细胞活力显著下降,细胞存活率分别下降了63.6%和22.2%,与对照组相比差异性显著(P < 0.05)。在2.1节中用两倍稀释的KMCE和FHM细胞孵育4 h后,细胞病变程度不如KMCS处理组,所以在测细胞活力时,稀释了两倍的KMCE处理时间延长至24 h,结果细胞的存活率下降了26.7%,与对照组相比有显著差异(P < 0.01)。为使实验组处理时间一致,在后续的实验中,毒性实验的浓度分别选择稀释两倍的KMCS以及未稀释的KMCE,作用时间均为4 h。
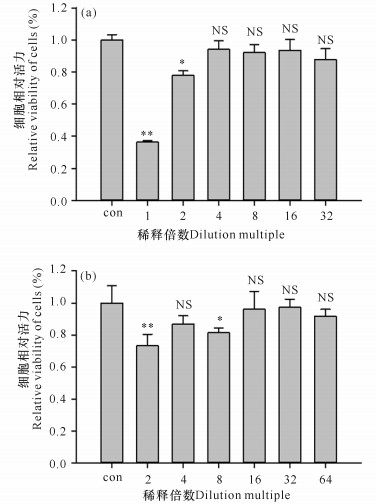
|
| (a)不同稀释倍数的KMCS感染4 h后FHM细胞的相对活力, (b)不同稀释倍数的KMCE感染24 h后的FHM细胞的相对活力; *P < 0.05, **P < 0.01;NS:无显著差异 (a)Relative viability of FHM cells after 4 h of infection with different dilutions of KMCS, (b)Relative viability of FHM cells after 24 h of infection with different dilutions of KMCE; *P < 0.05, **P < 0.01;NS:No significant difference 图 2 不同稀释倍数的KMCS和KMCE感染FHM细胞后的细胞相对活力 Fig.2 Relative viability of cells after infected with FHM cells by different dilution multiple of KMCS and KMCE |
2.3 KMCS和KMCE导致FHM细胞死亡的机制研究 2.3.1 Hoechst 33342染核观察
KMCS和KMCE与FHM细胞孵育处理4 h后,用Hoechst 33342染料染色,观察被感染细胞是否发生凋亡。结果表明,对照组没有凋亡小体,两个实验处理组均观察到明显的凋亡小体,即KMCS和KMCE可能会导致FHM细胞发生细胞凋亡(图 3)。
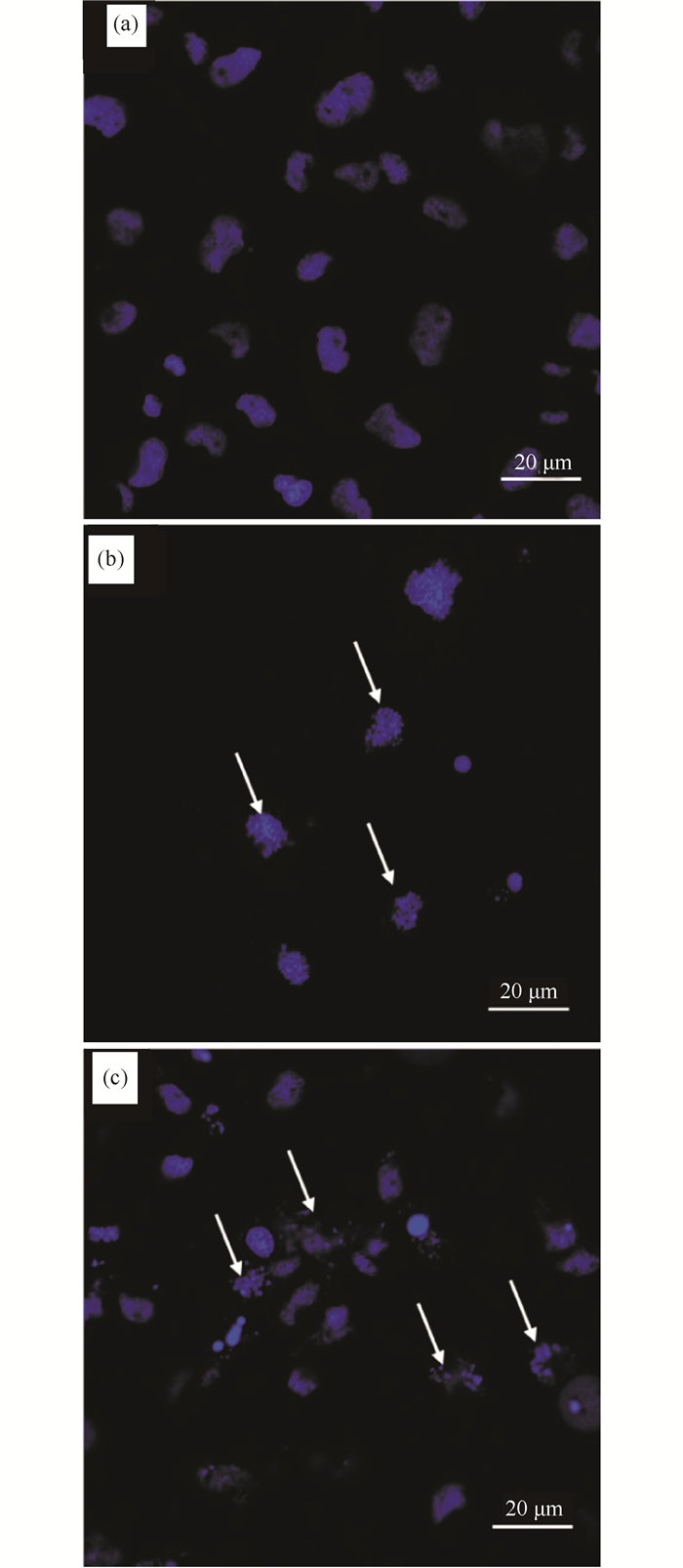
|
| (a)正常FHM细胞, (b)KMCS感染4 h后的FHM细胞, (c)KMCE感染4 h后的FHM细胞;箭头表示凋亡小体 (a)Normal FHM cells, (b)FHM cells after 4 h of KMCS infection, (c)FHM cells after 4 h of KMCE; Arrows indicate apoptotic bodies 图 3 Hoechst 33342染色观察KMCS和KMCE孵育处理后的FHM细胞 Fig.3 Detection of apoptosis in FHM cells by Hoechst 33342 staining |
2.3.2 Caspase-3活性检测
为了探讨KMCS和KMCE是否导致FHM细胞发生凋亡,用caspase-3活性检测试剂盒检测细胞凋亡途径典型蛋白caspase-3的活性。结果如图 4显示,与对照组相比,两个实验处理组的caspase-3活性水平均显著上调(P < 0.01),KMCS和KMCE实验组的caspase-3活性分别是对照组的2.32和1.49倍。
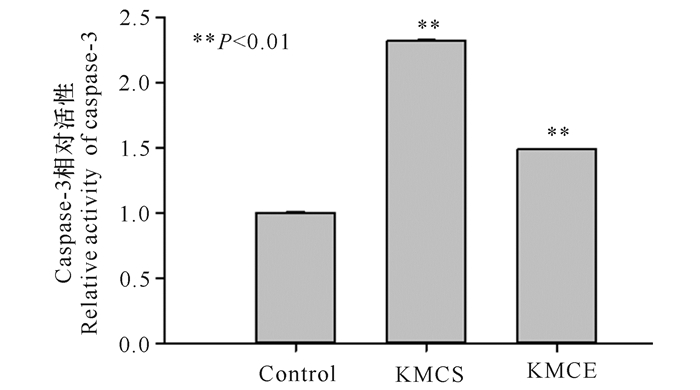
|
| 图 4 KMCS和KMCE感染FHM细胞后的caspase-3相对活性 Fig.4 Relative activity of caspased-3 after infection of FHM cells by KMCS and KMCE |
3 讨论
米氏凯伦藻是一种全球广泛分布的典型有毒藻,在世界各海域频频暴发赤潮,导致鱼类、贝类与其他无脊椎生物在内的大量海洋生物死亡[11]。溶血毒素被认为是米氏凯伦藻赤潮引发鱼类和无脊椎动物大量死亡的主要原因[16],但溶血毒素的定义较为模糊,只要能够破坏血细胞,导致溶血效应的物质都可以称为溶血毒素,所以溶血毒素的成分和结构很复杂。张勇等[17]通过室内模拟培养实验,发现直接接触活的米氏凯伦藻的浮游动物的摄食率和存活率比远低于只接触其培养液的实验组,推断认为米氏凯伦藻胞内存在的、在水体中极不稳定的某些毒性成分是导致浮游动物中毒和死亡的原因。但是对于贝类,米氏凯伦藻藻细胞、细胞裂解液与除藻过滤液均能够直接导致南非鲍幼虫死亡[18],表明米氏凯伦藻的毒性成分不仅存在于胞内,还存在于其培养液中。张勇等则证实米氏凯伦藻的提取物对哺乳类细胞包括肿瘤细胞具有显著的生长抑制和致畸作用[16, 19]。
对鱼类而言,在米氏凯伦藻赤潮暴发的海域,大部分养殖区的鱼类会迅速死亡[9, 20-21]。通过解剖观察,发现受米氏凯伦藻影响的鱼鳃组织结构出现明显的病变,包括鳃小片尾端肿大,上皮细胞受到损坏甚至完全脱落,导致泌氯细胞严重损伤[10]。综上所述,米氏凯伦藻的毒理研究主要集中在分析藻细胞本身的毒性,其导致鱼类死亡的机制也多集中在对鱼体行为和组织病变的观察,相关细胞通路尚不明确。近年来,体外稳定传代培养的鱼类细胞系在环境污染物的毒性检测和毒理学研究中发挥着越来越重要的作用,广泛应用于海水中各种环境污染物的快速检测和毒理效应分析[22-26]。为了研究米氏凯伦藻对鱼类细胞的致死机理,本研究分别用KMCS及KMCE对FHM细胞进行孵育处理,发现这两种物质都具有明显的细胞毒性。相对于KMCE而言,FHM细胞对KMCS更敏感,KMCS稀释两倍后仅感染4 h,FHM细胞形态变化明显,细胞皱缩并且部分裂解。CCK法检测细胞活力发现了两者均能导致FHM细胞活力的显著下降。结合Hoechst 33342染色及caspase-3活性检测结果,我们认为米氏凯伦藻的胞内成分和培养液中的毒性成分均能诱导鱼类FHM细胞发生细胞凋亡。
本研究初步证实了米氏凯伦藻培养液和细胞水溶性提取物均具有细胞毒性,会诱导鱼类FHM细胞发生细胞凋亡,这种凋亡与caspase-3介导的细胞程序性死亡有关。研究结果从细胞水平上为赤潮生物对鱼类的致死机理提供了相关数据支持和理论依据。
| [1] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [2] |
华泽爱. 赤潮藻类的毒素成份及其影响[J]. 海洋湖沼通报, 1994, 3: 74-82. |
| [3] |
福建省海洋与渔业厅.2012年福建省海洋灾害公报[M].2013.
|
| [4] |
林佳宁.东海大规模赤潮危害的现场及实验研究[D].北京: 中国科学院大学, 2015.
|
| [5] |
陈宝红, 谢尔艺, 高亚辉, 等. 米氏凯伦藻对海洋生物致毒作用的研究进展[J]. 福建水产, 2015, 37(3): 241-250. |
| [6] |
PARRISH C C, BODENNEC G, GENTIEN P. Haemolytic glycoclycerolipids from Gymondinium species[J]. Phytochemistry, 1998, 47(5): 783-787. DOI:10.1016/S0031-9422(97)00661-4 |
| [7] |
SELLEM F, PESANDO D, BODENNEC G, et al. Toxic effects of Gymnodinium cf.mikimotoi unsaturated fatty acids to gametes and embryos of the sea urchin Paracentrotus lividus[J]. Water Research, 2000, 34(2): 550-556. DOI:10.1016/S0043-1354(99)00181-5 |
| [8] |
MOONEY B D, NICHOLS P D, DE SALAS M F, et al. Lipid, fatty acid, and sterol composition of eight species of Kareniaceae (Dinophyta):Chemotaxonomy and putative lipid phycotoxins[J]. Journal of Phycology Banner, 2007, 43(1): 101-111. DOI:10.1111/j.1529-8817.2006.00312.x |
| [9] |
王朝辉, 尹伊伟, 齐雨藻, 等. 珠海桂山岛米氏裸甲藻赤潮对鱼鳃损伤的病理学组织观察[J]. 海洋学报, 2001, 23(1): 133-137. DOI:10.3321/j.issn:0253-4193.2001.01.018 |
| [10] |
欧祥亚.米氏凯伦藻赤潮对东海养殖鱼类鳃组织结构损害作用的研究[D].广州: 暨南大学, 2006.
|
| [11] |
BRAND L E, CAMPBELL L, BRESNAN E. Karenia:The biology and ecology of a toxic genus[J]. Harmful Algae, 2012, 14: 156-178. DOI:10.1016/j.hal.2011.10.020 |
| [12] |
ROBERTS R J, BULLOCK A M, TUNER M, et al. Mortalities of Salmo gairdneri exposed to cultures of Gyrodinium aureolum[J]. Journal of the Marine Biological Association of the United Kingdom, 1983, 63(4): 741-743. DOI:10.1017/S0025315400071186 |
| [13] |
MIZUNO K, WAKANO M, TAKATSUJI H, et al. Effects of the dinoflagellate Karenia mikimotoi on larval settlement of Pacific oyster Crassostrea gigas[J]. Nippon Suisan Gakkaishi, 2015, 81(5): 811-816. DOI:10.2331/suisan.81.811 |
| [14] |
DANG L X, LI Y, LIU F, et al. Chemical response of the toxic dinoflagellate Karenia mikimotoi against grazing by three species of zooplankton[J]. Journal of Eukaryotic Microbiology, 2015, 62(4): 470-480. DOI:10.1111/jeu.12201 |
| [15] |
张博, 陈松林. 近10年鱼类细胞培养研究进展及应用展望[J]. 海洋科学, 2011, 35(7): 113-121. |
| [16] |
史战鹏.米氏凯伦藻提取物的溶血作用及细胞毒性研究[D].广州: 暨南大学, 2011.
|
| [17] |
张勇, 杨维东, 李宏业, 等. 米氏凯伦藻对蒙古裸腹溞的毒性及致毒途径分析[J]. 生态毒理学报, 2011, 6(1): 94-98. |
| [18] |
BOTES L, SMIT A J, COOK P A. The potential threat of algal blooms to the abalone (Haliotis midae) mariculture industry situated around the South African coast[J]. Harmful Algae, 2003, 2(4): 247-259. DOI:10.1016/S1568-9883(03)00044-1 |
| [19] |
CHEN Y, YAN T, YU R, et al. Toxic effects of Karenia mikimotoi extracts on mammalian cells[J]. Chinese Journal of Oceanoloy and Limnology, 2011, 29(4): 860-868. DOI:10.1007/s00343-011-0514-8 |
| [20] |
TANGEN K. Blooms of Gyrodinium-aureolum (Dinophyceae) in North European waters, accompanied by mortality in marine organisms[J]. Sarsia, 1977, 63(2): 123-133. DOI:10.1080/00364827.1977.10411330 |
| [21] |
LI J, GLIBERT P M, ZHOU M J, et al. Relationships between nitrogen and phosphorus forms and ratios and the development of dinoflagellate blooms in the East China Sea[J]. Marine Ecology Progress Series, 2009, 383: 11-26. DOI:10.3354/meps07975 |
| [22] |
ZHOU L, LI P, NI S, et al. Establishment and characterization of a mid-kidney cell line derived from golden pompano Trachinotus ovatus, a new cell model for virus pathogenesis and toxicology studies[J]. In Vitro Cellular & Developmental Biology-Animal, 2017, 53(4): 320-327. |
| [23] |
YU Q, LI F, WANG Y B, et al. Isolation, Identification and pathogenicity of Vibrio alginolyticus from marine cultured Trachinotusovatus in Beibu Gulf, Guangxi[J]. Guangxi Sciences, 2018, 25(1): 68-73. |
| [24] |
LI P, ZHOU L, WEI S, et al. Establishment and characterization of a cell line from the head kidney of Golden pompano Trachinotus ovatus, and its application in toxicology and virus susceptibility[J]. Journal of Fish Biology, 2017, 90(5): 1944-1959. DOI:10.1111/jfb.13277 |
| [25] |
余庆, 李菲, 覃仙玲, 等. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析[J]. 广西科学, 2018, 25(1): 74-79. |
| [26] |
LI P, ZHOU L, NI S, et al. Establishment and characterization of a novel cell line from the brain of golden pompano (Trachinotus ovatus)[J]. In Vitro Cellular & Developmental Biology-Animal, 2016, 52(4): 410-418. |



