2. 广西科学院, 广西近海海洋环境科学重点实验室, 广西南宁 530007;
3. 河南师范大学生命科学学院, 河南新乡 453007;
4. 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007;
5. 北部湾大学海洋学院, 广西北部湾海洋生物多样性养护重点实验室, 广西钦州 535011
2. Guangxi Key Laboratory of Marine Environmental Science, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
4. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China;
5. Guangxi Key Laboratory of Beibu Gulf Marine Biodiversity Conservation, College of Marine Sciences, Beibu Gulf University, Qinzhou, Guangxi, 535011, China
草鱼(Ctenopharyngodon idellus)是典型的草食性鱼类,具有生长速度快、营养需求低以及肉质鲜美等特点,是我国重要的淡水经济鱼种[1-2]。但近年来随着集约化养殖方式的发展,养殖密度增加导致养殖环境恶化,各种水产疫病不断爆发,对水产养殖造成严重的危害,而且对人类的食用安全也存在潜在的威胁[3-5]。维氏气单胞菌(Aeromonas veronii)是一种革兰氏阴性菌,普遍分布于淡水等环境,主要活跃于6—9月,是一种人畜共患的条件致病菌,能够感染多种水产动物并导致出血病等[2-3, 6-7]。细菌导致宿主细胞死亡主要方式包括主动性死亡和被动性死亡,主动性死亡是细胞在受外界刺激时,自身为保护其他细胞而选择自杀的行为;被动性死亡则多是由于外界刺激导致细胞膜被破坏,细胞内容物外泄,从而导致细胞大量死亡[8-11]。已有研究报道细菌分泌的黏附因子是用来定植于宿主细胞的,而其分泌的溶血素、气溶素等是导致宿主细胞死亡的主要因素[6-7]。本研究将从发病草鱼中分离获得的维氏气单胞菌胞外分泌物(Extracellular products, ECPs)作用回草鱼源背鳍组织细胞系中,用以评估维氏气单胞菌的细胞毒性;然后通过Hoechst 33342染核观察以及TdT-mediated dUTP Nick-End Labeling (TUNEL)检测,确定草鱼源维氏气单胞菌导致宿主细胞死亡的方式。本文通过对细胞凋亡的一系列指标检测,来探索维氏气单胞菌诱导宿主细胞在体外的死亡机制,为今后探索维氏气单胞菌对活体动物的作用奠定理论基础,并为开发针对维氏气单胞菌的抗菌功能产品提供数据支持和理论依据。
1 材料与方法 1.1 材料本研究所用的维氏气单胞菌(编号为CWAV1)分离自广西南宁池塘养殖中发病的草鱼,保存于本实验-80℃冰箱中;所用细胞为本实验室已建立的草鱼背鳍组织细胞系(GCPF cell line);0.22 μm微孔滤柱购自Millipore公司;96孔细胞培养板、玻底皿、60 mm×15 mm细胞培养皿购自康宁公司;LB培养基、LB琼脂培养基以及TCBS培养基等购自广州环凯微生物有限公司;MEM培养基购自Thermo公司;BCA蛋白浓度测定试剂盒、CCK-8活细胞检测试剂盒、Hoechst 33342细胞核检测试剂、TUNEL检测试剂盒等购自碧云天生物技术有限公司;生化培养箱购自上海博迅; 超净工作台购自苏净安泰;观察细胞用的倒置光学显微镜为Olympus CX41;酶标仪购自Thermo公司; 电泳仪购自Biorad公司; 激光共聚焦显微镜购自Nikon公司。
1.2 方法 1.2.1 维氏气单胞菌胞外分泌物的制备及蛋白浓度的测定将保存的维氏气单胞菌用三区划线法接种于LB琼脂平板,28℃倒置培养24 h,再挑取单菌落接入LB液体培养基中28℃、180 r/min培养12 h,3 000 g离心5 min,将上清液用0.22 μm滤膜过滤于已灭菌的15 mL干净离心管中,所得滤液即为维氏气单胞菌的ECPs原液,将其分装至1.5 mL EP管中,封口,-20℃保存备用。
取一管已分装的维氏气单胞菌ECPs按照BCA蛋白浓度测定试剂盒中的测定方法测定胞外产物中可溶性蛋白浓度,同时制作标准曲线,每个实验重复3次。
1.2.2 维氏气单胞菌ECPs对细胞毒性的研究(1) 草鱼背鳍组织细胞系的培养
GCPF细胞传代所用培养基为含有10%胎牛血清的MEM培养基,28℃恒温培养;测定ECPs毒性时,按照4×104细胞/孔的细胞量接入96孔细胞培养板中过夜培养[12-14]。
(2) 维氏气单胞菌ECPs对细胞毒性的测定
将维氏气单胞菌ECPs原液蛋白用磷酸盐缓冲液(PBS)稀释至1 mg/mL,然后用无血清MEM培养基进行2倍稀释,即实验组浓度分别为原液(A组)、1 000 μg/mL(B组)、500 μg/mL(C组)、250 μg/mL(D组)、125 μg/mL(E组),对照组(Con)为接入等体积的无血清MEM培养基。将过夜培养的GCPF细胞用维氏气单胞菌ECPs处理24 h,用光学显微镜观察并拍照。待细胞出现变圆、皱缩或空泡等现象即为出现细胞病变(Cytopathic effect, CPE),便可测定细胞活性。具体操作如下:移除细胞上清液,用磷酸缓冲液(PBS,pH值为7.4)洗涤1次,加入CCK-8溶液,室温避光孵育4 h,测定OD450。
1.2.3 维氏气单胞菌ECPs对宿主细胞毒性机制的研究(1) Hoechest 33342染核观察
将4×104个GCPF细胞接入玻底皿中,过夜培养,用维氏气单胞菌ECPs原液处理2 h后进行Hoechest 33342染核,观察细胞核形态变化;其中对照组用无血清MEM培养基处理2 h。细胞核染色的具体操作如下:
① 将处理好的GCPF细胞用PBS轻轻洗涤2次;
② 沿边缘缓慢加入100 μL的1 μg/mL Hoechest 33342,避光3 min;
③ 将用Hoechest 33342处理好的GCPF细胞用PBS轻轻洗涤2次,加入200 μL的PBS放于激光共聚焦显微镜下观察并拍照。
(2) TUNEL测定具体细胞培养及处理方法同Hoechst 33342染核观察。染色操作方法如下:
① 将处理好的GCPF细胞用PBS轻轻洗涤1次;
② 用100 μL固定液固定30 min;
③ PBS轻轻洗涤1次,加入100 μL通透液,5 min;
④ PBS轻轻洗涤2次,加入50 μL TUNEL染色液,37℃避光静置1 h;
⑤ PBS轻轻洗涤2次,加入100 μL PBS,然后于荧光显微镜下观察。
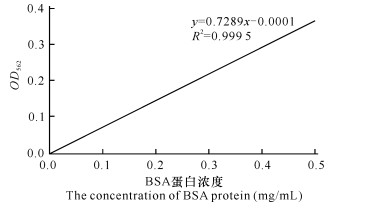
2 结果与分析 2.1 维氏气单胞菌ECPs胞外蛋白浓度的测定图 1为BSA蛋白标准曲线,其回归方程为y=0.7289x-0.0001,R2=0.999 5。根据该回归方程求得维氏气单胞菌ECPs蛋白浓度为1 473 μg/mL。
|
| 图 1 BSA蛋白浓度标准曲线 Fig.1 Standard curve of BSA protein concentration |
2.2 维氏气单胞菌ECPs对宿主细胞形态的影响
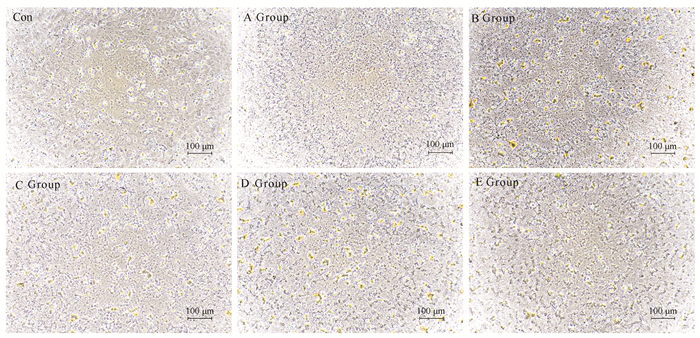
如图 2所示,维氏气单胞菌ECPs原液(A组)对GCPF细胞形态的影响较大,大部分出现皱缩,当ECPs蛋白浓度为1 000 μg/mL(B组)时细胞也出现了一定程度的皱缩变圆,但是没有原液明显,当浓度为500 μg/ml(C组)时,细胞出现空泡但是细胞形态没有太大改变。D组和E组的细胞形态无明显变化,与对照组细胞形态相似。
|
| 图 2 维氏气单胞菌ECPs对GCPF细胞毒性的影响 Fig.2 Effect of Aeromonas veronii ECPs on GCPF cells toxicity |
2.3 维氏气单胞菌ECPs对宿主细胞存活率的影响
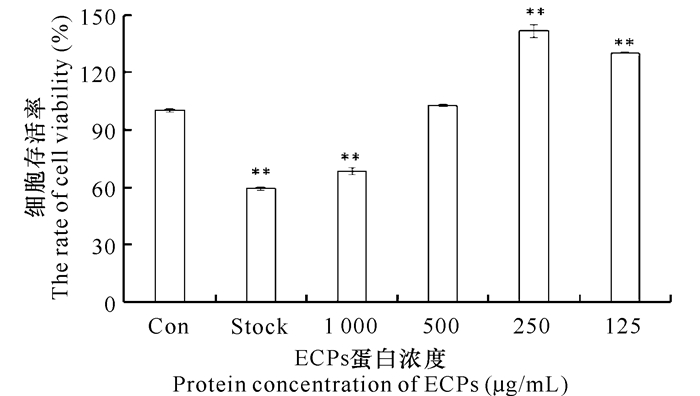
从图 3中可以看出当使用原液以及ECPs蛋白浓度为1 000 μg/mL时,细胞活性受到显著性影响;ECPs蛋白浓度为500 μg/mL时,细胞活性没有受到影响,而当ECPs的浓度达到250 μg/mL或者更低时,不仅细胞活性没有影响反而一定程度上促进细胞的生长。
|
| 图 3 维氏气单胞菌ECPs对GCPF细胞的毒性分析 Fig.3 Toxicity analysis of Aeromonas veronii ECPs to GCPF cells |
2.4 维氏气单胞菌ECPs对宿主细胞产生凋亡小体的检测 2.4.1 Hoechst 33342的染色结果
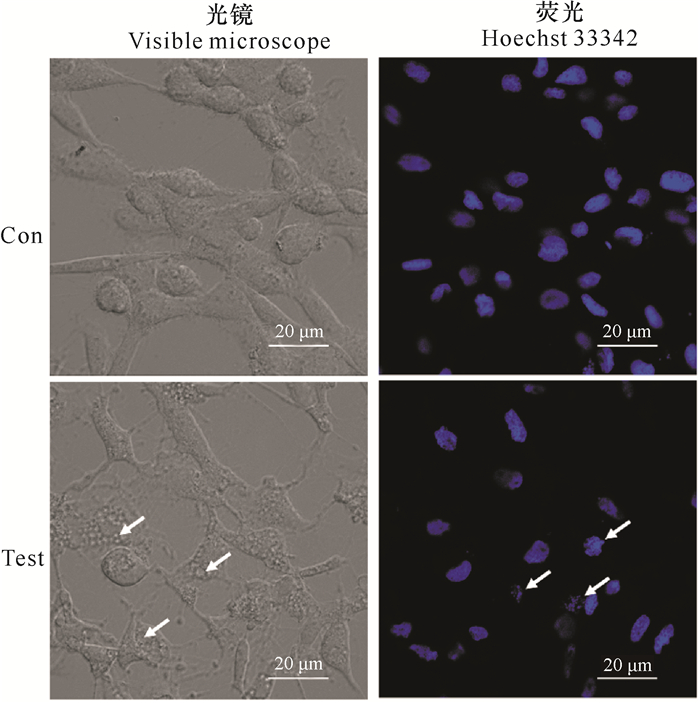
如图 4所示,光镜下可观察到实验组细胞表面出现明显的空洞,图中光镜照片箭头所指即为出现空洞细胞,而对照组细胞的形态比较完整。根据Hoechst 33342检测,正常的GCPF细胞培养2 h后细胞核仍为完整,但是实验组细胞已经出现明显的细胞核碎裂(荧光照片中箭头所指处),这种碎裂的细胞核即为凋亡小体。
|
| 图 4 Hoechst 33342检测维氏气单胞菌ECPs对GCPF细胞凋亡的影响 Fig.4 Effect of Aeromonas veronii ECPs on apoptosis of GCPF cells by Hoechst 33342 |
2.4.2 TUENL检测结果
判定细胞凋亡的另外一种方法是观察细胞DNA是否出现片段化。由图 5可知, 在相同的激发光下,对照组在光镜下可以明显看到完整的细胞形态,但却不能染上颜色,荧光显微观察下为全黑色;实验组在光镜下已经出现明显的皱缩、变圆,甚至出现空泡化,在荧光显微镜下可以明显地看到绿色荧光(如箭头所示即为发生凋亡的细胞)。
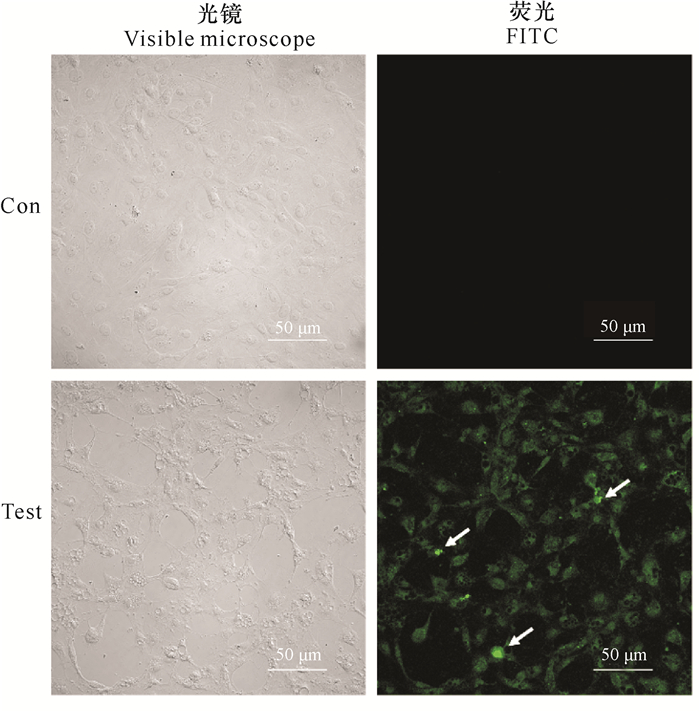
|
| 图 5 TUNEL技术检测维氏气单胞菌ECPs对GCPF细胞凋亡的影响 Fig.5 Effect of Aeromonas veronii ECPs on apoptosis of GCPF cells by TUNEL technique |
3 讨论
近些年气单胞菌属中的细菌越来越受到学者的关注,主要原因是气单胞菌属中的部分细菌会导致人畜共患病,如嗜水气单胞菌(Aeromonas hydrophila)、维氏气单胞菌和豚鼠气单胞菌(Aeromonas caviae)等。被气单胞菌属细菌感染的人类,轻则患肠炎,重则导致伤口感染甚至败血症等[15-19]。维氏气单胞菌是近些年水产常见病原菌,常见于淡水养殖,分布广泛并且具有很强的致病性,鱼感染后的主要症状为厌食、腹腔肿大积水和内脏器官广泛出血等[16, 20]。鉴于维氏气单胞菌的广泛致病性,所以有必要研究其对宿主细胞的毒性作用及导致宿主细胞死亡的机制。本研究将草鱼源维氏气单胞菌的细胞外分泌物ECPs(≥500 μg/mL)作用回宿主细胞,发现其对GCPF细胞具有明显的破坏;而当ECPs浓度低于500 μg/mL时,ECPs不会导致宿主细胞形态发生明显变化。该细胞的光镜观察结果与利用CCK-8检测的细胞活性结果一致,说明维氏气单胞菌的细胞外分泌物ECPs在高浓度时才会对细胞产生损伤,但是是否随着时间的延长对细胞伤害越大,仍需要进一步研究;当浓度低于250 μg/mL时,维氏气单胞菌的细胞外分泌物ECPs对GCPF细胞生长具有促进作用,这可能是因为在ECPs浓度没有达到致死浓度,细胞为自我保护的反馈机制,以抵消外界压力。另外有报道称,气单胞菌属如维氏气单胞菌、嗜水气单胞菌等在人类肠道内均有分布,这就表示维氏气单胞菌可能是一个条件致病菌,也就是说只有达到一定条件下才会导致疾病的发生及生物体的死亡[7, 21-22]。
在明确草鱼源维氏气单胞菌ECPs对宿主细胞具有毒性作用后,本研究使用Hoechst 33342进行染核观察。Hoechst 33342染料是一种可透过细胞膜对细胞核进行染色的蓝色荧光染料。从图 4中可以看出对照组在光镜下为完整的细胞,在荧光显微镜下可以观察到完整的细胞核;而实验组在光镜下观察其细胞内部出现明显的空泡,Hoechst 33342荧光染料显示宿主细胞的细胞核发生碎裂,出现凋亡小体,表明细胞出现早期凋亡现象。细胞在发生凋亡时,一些DNA内切酶被激活,将核小体间的基因组DNA切断,从而暴露3′-OH,并在脱氧核苷酸转移酶的催化下与带有荧光的dUTP结合[23-24]。从图 5结果中可以看出对照组细胞没有被TUNEL荧光染色,并且光镜观察结果显示其细胞形态无明显变化,表明细胞仍然处于正常状态;实验组细胞中出现明显的绿色荧光,并且光镜观察结果显示试验组细胞出现不同程度的破坏,表明细胞中出现3′-OH,进一步说明细胞的基因组DNA被切断。
根据上述结果可以初步判定致病性草鱼源维氏气单胞菌会导致宿主细胞发生细胞凋亡。细菌在自然界中广泛存在,并且在适宜条件下会大量繁殖,其产生的胞外产物更是具有一定的毒性,所以深入研究其导致宿主细胞死亡的机制,对于开发高效的抗病功能产品具有重要意义。
4 结论致病性草鱼源维氏气单胞菌细胞外分泌物ECPs在高浓度时对草鱼背鳍细胞具有明显的破坏作用。而Hoechst 33342及TUNEL技术检测,初步确定草鱼源维氏气单胞菌导致宿主细胞死亡是通过凋亡途径发生的,即维氏气单胞菌对宿主细胞具有明显的毒性,而且会导致宿主细胞发生细胞凋亡。
| [1] |
DAI J, ZHANG L, ZHANG P, et al. Ginsenoside Rg3 inhibits grass carp reovirus replication in grass carp ovarian epithelial cells[J]. GSL J Clin Microbiol, 2018, 1(1): 2-6. |
| [2] |
ZHAO H, CHONG J, TANG R, et al. Metabolomics investigation of dietary effects on flesh quality in grass carp (Ctenopharyngodon idellus)[J]. Gigascience, 2018, 7(10): 1-18. |
| [3] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [4] |
余庆, 李菲, 王一兵, 等. 广西北部湾大宗海水养殖鱼类卵形鲳鰺感染溶藻弧菌及其致病性研究[J]. 广西科学, 2018, 25(1): 68-73. |
| [5] |
LI P, YU Q, LI F, et al. First identification of the nervous necrosis virus isolated from cultured golden pompano (Trachinotus ovatus) in Guangxi, China[J]. Journal of Fish Diseases, 2018, 41(7): 1177-1180. DOI:10.1111/jfd.12805 |
| [6] |
高彩霞, 任燕, 王庆, 等. 草鱼源致病性维氏气单胞菌的分离鉴定及药物敏感性分析[J]. 安徽农业大学学报, 2018, 46(3): 409-415. |
| [7] |
吴同垒, 单晓枫, 孟庆峰, 等. 维氏气单胞菌研究进展[J]. 中国兽药杂志, 2011, 45(7): 41-44. DOI:10.3969/j.issn.1002-1280.2011.07.012 |
| [8] |
SGONC R, GRUBER J. Apoptosis detection:An overview[J]. Experimental Gerontology, 1998, 33(6): 525-33. DOI:10.1016/S0531-5565(98)00031-X |
| [9] |
ZHIVOTOVSKY B, ORRENIUS S. Carcinogenesis and apoptosis:Paradigms and paradoxes[J]. Carcinogenesis, 2006, 27(10): 1939-1945. DOI:10.1093/carcin/bgl035 |
| [10] |
HIPFNER D, COHEN S M. Connecting proliferation and apoptosis in development and disease[J]. Nature Reviews Molecular Cell Biology, 2004, 5(10): 805-815. DOI:10.1038/nrm1491 |
| [11] |
WHITE E. Life, death, and the pursuit of apoptosis[J]. Genes & Development, 1996, 10(1): 1-15. |
| [12] |
余庆, 李菲, 覃仙玲, 等. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析[J]. 广西科学, 2018, 25(1): 74-79. |
| [13] |
ZHOU L, LI P, LIU J, et al. Establishment and characterization of a mid-kidney cell line derived from golden pompano Trachinotus ovatus, a new cell model for virus pathogenesis and toxicology studies[J]. In Vitro Cellular & Developmental Biology-Animal, 2017, 53(4): 320-327. |
| [14] |
LI P, ZHOU L, NI S, et al. Establishment and characterization of a novel cell line from the brain of golden pompano (Trachinotus ovatus)[J]. In Vitro Cellular & Developmental Biology-Animal, 2016, 52(4): 410-418. |
| [15] |
王魁云, 蒋霞云, 江小妹, 等. 团头鲂和草鱼肠道纤维素酶产生菌的筛选和鉴定[J]. 上海海洋大学学报, 2018, 27(4): 624-632. |
| [16] |
HICKMAN-BRENNER F W, MACDONALD K L, STEIGERWALT A G, et al. Aeromonas veronii, a new ornithine decarboxylase-positive species that may cause diarrhea[J]. Journal of Clinical Microbiology, 1987, 25(5): 900-906. |
| [17] |
SKWOR T, SHINKO J, AUGUSTYNIAK A, et al. Aeromonas hydrophila and Aeromonas veronii Predominate among potentially pathogenic ciprofloxacin- and tetracycline-resistant aeromonas isolates from Lake Erie[J]. Applied and Environmental Microbiology, 2014, 80(3): 841-848. DOI:10.1128/AEM.03645-13 |
| [18] |
DEODHAR L P, SARASWATHI K, VARUDKAR A. Aeromonas spp.and their association with human diarrheal disease[J]. Journal of Clinical Microbiology, 1991, 29(5): 853-856. |
| [19] |
GONZÁLEZ-SERRANO C J, SANTOS J A, GARCÍA-LÓPEZ M L, et al. Virulence markers in Aeromonas hydrophila and Aeromonas veronii biovar sobria isolates from freshwater fish and from a diarrhoea case[J]. Journal of Applied Microbiology, 2002, 93(3): 414-419. DOI:10.1046/j.1365-2672.2002.01705.x |
| [20] |
黄小丽, 吴春艳, 邓永强, 等. 斑点叉尾鮰维氏气单胞菌病的病理组织学观察[J]. 中国兽医科学, 2010, 40(7): 738-742. |
| [21] |
CHI-JUNG W, JIUNN-JONG W, JING-JOU Y, et al. Clinical significance and distribution of putative virulence markers of 116 consecutive clinical Aeromonas isolates in southern Taiwan[J]. Journal of Infection, 2007, 54(2): 151-158. DOI:10.1016/j.jinf.2006.04.002 |
| [22] |
BORRELL N, FIGUERAS M J, GUARRO J. Phenotypic identification of Aeromonas genomospecies from clinical and environmental sources[J]. Canadian Journal of Microbiology, 1998, 44(2): 103-108. DOI:10.1139/w97-135 |
| [23] |
HUANG X, HUANG Y, OUYANG Z, et al. Singapore grouper iridovirus, a large DNA virus, induces nonapoptotic cell death by a cell type dependent fashion and evokes ERK signaling[J]. Apoptosis, 2011, 16(8): 831-845. DOI:10.1007/s10495-011-0616-y |
| [24] |
CHEN S P, YANG H L, HER G M, et al. Betanodavirus induces phosphatidylserine exposure and loss of mitochondrial membrane potential in secondary necrotic cells, both of which are blocked by bongkrekic acid[J]. Virology, 2006, 347(2): 379-391. DOI:10.1016/j.virol.2005.11.052 |



