2. 河南师范大学生命科学学院, 河南新乡 453007;
3. 广西壮族自治区海洋研究所, 广西海洋生物技术重点实验室, 广西北海 536000;
4. 广西壮族自治区水产科学研究院, 广西水产遗传育种与健康养殖重点实验室, 广西南宁 530021;
5. 广西民族大学海洋与生物技术学院, 广西南宁 530006;
6. 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
3. Guangxi Key Laboratory for Marine Biotechnology, Guangxi Institate of Oceanography, Beihai, Guangxi, 536000, China;
4. Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Breeding, Guangxi Academy of Fishery Science, Nanning, Guangxi, 530021, China;
5. School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi, 530006, China;
6. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China
卵形鲳鲹(Trachinotus ovatus)主要生活在热带及亚热带地区,在我国主要分布于粤、琼、闽等省的沿海城市[1-2]。卵形鲳鲹由于其肉质鲜美生长迅速,所以作为一种重要的海水经济鱼类被人们广泛喜爱[3-4]。然而近些年随着集约化养殖的出现,各种病害层出不穷[1, 5-9],不仅造成巨大的经济损失,同时也严重威胁着人类的生命安全。创伤弧菌(Vibrio vulnificus)是自然界菌群中的一部分,常分布在沿海地区,是一种嗜盐菌株,能够感染人、鱼、虾等[3, 10-12]。由创伤弧菌引发的鱼病具有发病迅速、死亡率高、流行面广等特点,给人类带来了巨大的经济损失以及潜在危险。人类由于食用未加工过的海鲜产品或者是伤口接触海水而引发的创伤弧菌感染,轻则胃肠炎,严重者可出现败血症和坏死性筋膜炎,更有文献提及由其感染所致的败血症死亡率可达到50%[10, 13-14]。细菌导致宿主细胞死亡主要有两种方式,一种为与宿主进行营养竞争,另外一种为分泌胞外毒素抑制或破坏宿主的正常生长,而胞外产物(Extracellular products, ECPs)的分泌往往是最具有致病性的,因为这种胞外产物的分泌不仅是代谢的一部分同时也是抑制其他细菌或宿主的生长的重要因素[13]。所以深入研究弧菌导致宿主死亡的作用机理,有利于实现从根源上控制病菌对养殖行业的危害,是实现高效水产养殖的重要发展方向,而这种研究就主要体现在胞外产物对宿主细胞的影响。我们利用前期在发病的卵形鲳鲹中分离得到的具有致病性的创伤弧菌为研究对象,将其接入宿主卵形鲳鲹细胞中,选取具有明显影响细胞形态的浓度,进一步测定凋亡相关的一系列的生理生化指标,从而推测创伤弧菌导致宿主细胞死亡的作用机理。通过对卵形鲳鲹源创伤弧菌作用回原宿主细胞进行研究,了解创伤弧菌导致宿主细胞凋亡的作用机制,为今后水产养殖从根源上抵抗创伤弧菌所带来的危害提供理论依据。
1 材料与方法 1.1 材料本研究所用的创伤弧菌(编号为F4-1)分离自广西钦州湾网箱养殖的发病卵形鲳鲹,超低温保存于本实验室;所用细胞为本实验已建立并保存的卵形鲳鲹背鳍组织细胞系(TOPF cell line)以及胖头鲤上皮细胞系(FHM cell line);0.22 μm微孔滤柱购自Millipore;96孔细胞培养板、玻底皿、6 cm dish细胞培养皿购自康宁公司;LB培养基、LB琼脂以及TCBS培养基等购自广州环凯微生物有限公司;L15培养基购自Thermo;PBS缓冲液(NaCl 8 g;KCl 0.2 g;Na2HPO4 1.42 g;KH2PO4 0.27 g;H2O 1 L);BCA蛋白浓度测定试剂盒、CCK-8活细胞检测试剂盒、Hoechst 33342细胞核检测试剂、DNA Ladder核小体检测试剂盒等购自碧云天生物技术有限公司;生化培养箱购自上海博迅,超净工作台为AIRTECH;观察细胞用的倒置光学显微镜为Olympus CX41,酶标仪购自Thermo公司,电泳仪购自Biorad公司。
1.2 方法 1.2.1 创伤弧菌ECPs的制备及蛋白浓度的测定将-80℃冰箱保存的创伤弧菌划线接种于LB琼脂平板,28℃倒置培养24 h后,挑取单菌落接入LB培养基中28℃振荡培养12 h,3 000 g离心5 min,取上清液用0.22 μm滤膜过滤,所得滤液即为创伤弧菌的ECPs,将其分装至Ep管中,-20℃保存。
取分装后的ECPs用BCA蛋白浓度测定试剂盒测定创伤弧菌胞外产物中可溶性蛋白含量,同时制作标准曲线,每个实验重复3次。
1.2.2 创伤弧菌ECPs对细胞毒性的研究 1.2.2.1 细胞的培养TOPF细胞传代所用培养基为含有10%胎牛血清的L15培养基,培养温度为28℃;用于测定ECPs毒性时,按照4×104个/孔的细胞量接入96孔细胞培养板中过夜培养[4, 15-17]。
1.2.2.2 创伤弧菌ECPs对细胞毒性的测定将ECPs原液蛋白浓度稀释至1 mg/mL,然后用无血清L15培养基进行半倍稀释,实验组浓度分别为1 mg/mL(A组)、0.5 mg/mL(B组)、0.25 mg/mL(C组)、0.125 mg/mL(D组)、0.062 5 mg/mL(E组)、0.031 3 mg/mL(F组),对照组(Control)为接入等体积的无血清L15;每1 h光镜下观察一次,待出现明显细胞病变(Cytopathic effect, CPE)测定细胞活性。细胞活性的测定:将卵形鲳鲹源创伤弧菌ECPs处理2 h后的细胞弃掉上清液,用PBS (pH 7.4)洗涤一次,加入10% CCK-8溶液(用PBS稀释),室温避光孵育4 h,测定OD450。
1.2.3 创伤弧菌ECPs导致宿主细胞凋亡的作用机制 1.2.3.1 DNA ladder的测定将TOPF/FHM细胞以1×106 个/板传至6 cm dish中,28℃过夜培养。阴性对照组(Control 1)为无血清L15培养TOPF细胞,阳性对照组2(Control 2)为FHM细胞用2 mmol/L星形胞菌素(Staurosporine, STS)处理2 h,实验组(Test)为TOPF细胞用创伤弧菌的ECPs处理2 h。细胞处理方法具体操作如下:
(1) 将处理好的各实验组细胞用细胞刮刀轻轻刮至1.5 mL离心管中,3 000 g离心5 min,弃上清,用PBS洗涤一次;
(2) 加入200 μL的PBS使细胞重悬,按照DNA ladder试剂盒的使用说明书进行后续操作。
(3) 将提取后的DNA进行琼脂糖凝胶电泳,50 V电泳1 h;剩余样品放于-20℃保存。
1.2.3.2 Hoechest 33342染核将TOPF细胞以4×104个/皿接入至玻底皿中,过夜培养。TOPF细胞用创伤弧菌ECPs处理2 h后进行细胞核染色,用来观察细胞核形态变化;在处理的同时使用2 μmol/L STS作用FHM细胞用以阳性对照(Control 1);用无血清L15处理的为阴性对照(Control 2)。染色的具体操作如下:
① 将处理好的TOPF细胞用PBS轻轻洗涤2次;
② 加入100 μL的1 μg/mL的DNA荧光染料Hoechest 33342避光染色3 min;
③ 用PBS洗涤两次,放于荧光显微镜下观察细胞核的变化,并拍照。
2 结果与分析 2.1 创伤弧菌ECPs蛋白浓度的标准曲线对创伤弧菌ECPs蛋白浓度进行测定,其回归方程为y=0.894x-0.007 5,R2=0.999 2,如图 1所示。根据该回归方程,创伤弧菌ECPs蛋白浓度为2.91 mg/mL。
|
| 图 1 BSA蛋白浓度标准曲线 Fig.1 Standard curve of BSA protein concentration |
2.2 创伤弧菌ECPs对宿主细胞毒性作用的CCK检测结果
利用CCK-8试剂检测创伤弧菌ECPs对宿主细胞的毒性作用。从图 2结果可以看出创伤弧菌的ECPs对TOPF细胞有很强的毒性,蛋白浓度越高毒性越强,随着稀释倍数的增加毒性随之降低,最终确定选用31.3 μg/mL作为后续卵形鲳鲹源创伤弧菌ECPs对细胞致死机制研究的实验浓度。

|
| 图 2 创伤弧菌ECPs对TOPF细胞的毒性分析 Fig.2 Toxicity analysis of Vibrio vulnificus ECPs on TOPF cells |
2.3 创伤弧菌ECPs对宿主细胞毒性作用的光镜观测结果
使用光学显微镜观察创伤弧菌ECPs对宿主细胞的毒性作用。从图 3上可以看出在浓度为1 000 μg/mL时细胞出现的CPE最多,其中浓度为31.3 μg/mL时细胞出现CPE最少,并且可以明显看到细胞上出现的空泡,即ECPs浓度越高对细胞的毒性作用越强。

|
| (a)1 mg/mL,(b)0.5 mg/mL,(c)0.25 mg/mL,(d)0.125 mg/mL,(e)0.0625 mg/mL,(f)0.0313 mg/mL 图 3 创伤弧菌ECPs对TOPF细胞毒性的影响 Fig.3 Effects of Vibrio vulnificus ECPs on TOPF cells toxicity |
2.4 DNA ladder检测结果
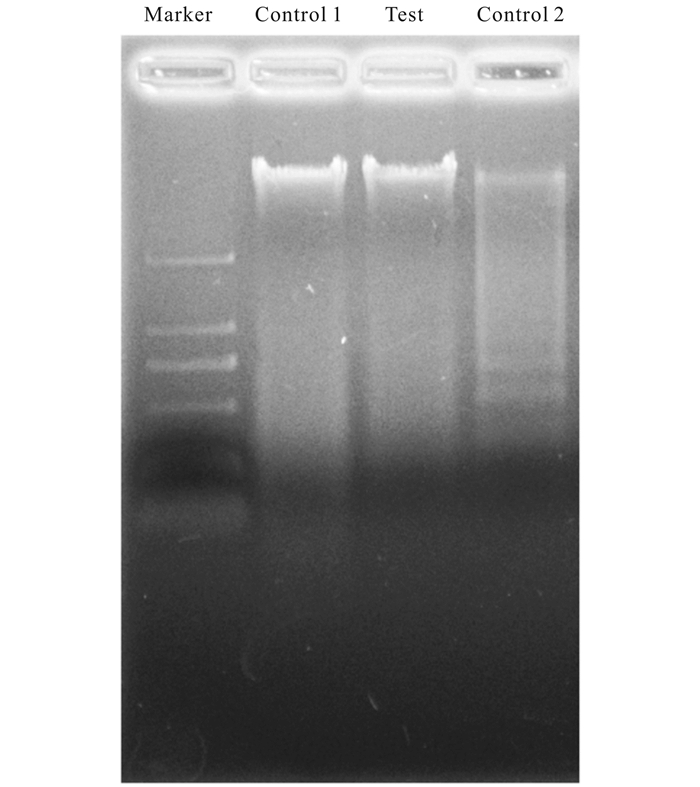
如图 4所示,对照组1(Control 1)是提取正常组细胞的总DNA,对照组2(Control 2)是提取星形孢菌素(Staurosporine, STS)处理2 h后的FHM细胞的总DNA。电泳检测发现对照组2出现明显的DNA Ladder,而对照组1(Control 1)、创伤弧菌ECPs处理2 h后的TOPF细胞(Test组)均未出现明显阶梯状条带。
|
| 图 4 DNA ladder结果测定 Fig.4 The results determination of DNA ladder |
2.5 凋亡小体检测结果
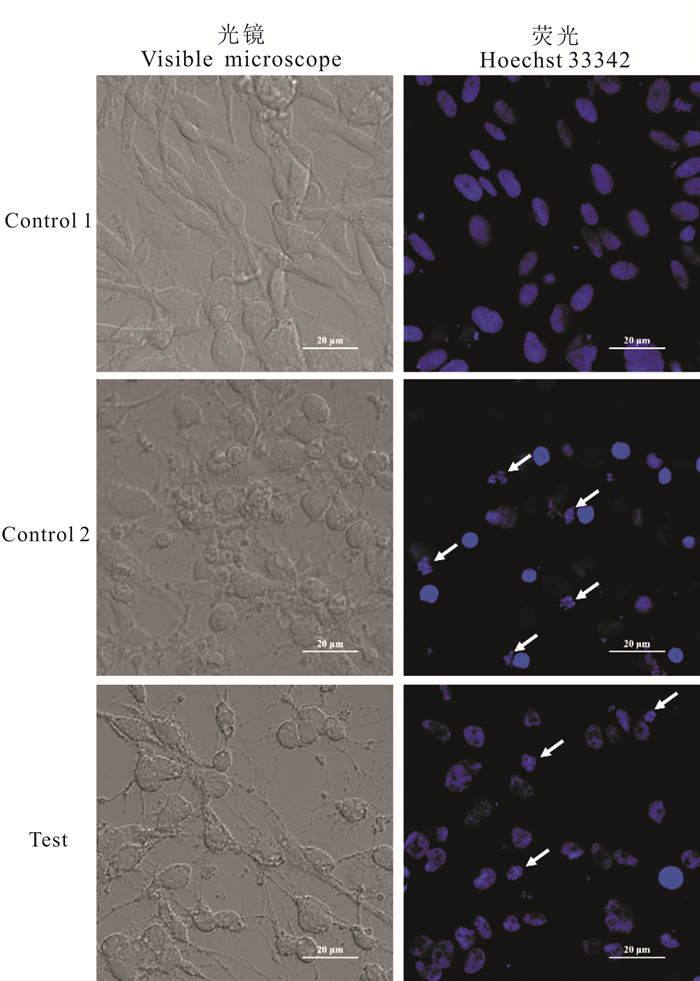
利用Hoechst 33342对各处理组细胞进行染核观察。图 5为Hoechst 33342染核结果,箭头所指为已出现凋亡特征的核小体部分。在图上可以看出正常组细胞具有完整的细胞核;星形孢菌素(STS)处理后的TOPF细胞(阳性对照组Control 2)出现了明显的核小体,说明其出现了细胞凋亡情况;卵形鲳鲹源创伤弧菌ECPs处理后的TOPF细胞(实验组Test)也出现了明显的核小体,与阳性对照组结果相一致,说明发生了细胞凋亡。
|
| 图 5 创伤弧菌ECPs导致TOPF细胞凋亡的荧光结果 Fig.5 Fluorescence results of Vibrio vulnificus ECPs leading to apoptosis in TOPF cells |
3 讨论
细胞死亡是真核生物在生命过程中重要的生理或病理现象,细胞死亡分为主动性程序死亡和被动性非程序死亡。被动性非程序死亡是细胞在受到外界刺激后导致的细胞损伤死亡;而主动性程序死亡是细胞的一种“自杀”行为,这种死亡方式可能是因为机体细胞生长到某一阶段,为达到更好的生长而出现的自我调节作用,例如胚胎发育、组织分化等[18-19];或者是机体在受到外界刺激时,为维持细胞内环境稳定的一种程序性死亡方式,如自身免疫疾病、病毒感染、细菌感染等[20-21]。目前程序性死亡主要包括4种方式:凋亡、自噬性细胞死亡、促炎症细胞死亡和胀亡。本研究中,将卵形鲳鲹源创伤弧菌ECPs对宿主细胞进行孵育处理,通过检测细胞死亡后的各项指标来判断ECPs导致宿主细胞死亡的机理。从图 2和图 3中我们可以看出创伤弧菌ECPs对细胞具有明显的毒性作用,并且创伤弧菌ECPs浓度为31.3~1 000 μg/mL时,细胞活性均比较低,且各浓度处理组的细胞活性之间没有显著性差异(P>0.05),说明创伤弧菌ECPs在一定的浓度范围内具有较强的细胞毒性,其毒力作用不随ECPs浓度的降低而降低;创伤弧菌ECPs浓度在31.3~125 μg/mL时,随着ECPs浓度的降低,ECPs对宿主细胞的毒性作用逐步减弱。利用光学显微镜能够直观地观察到细胞的病变情况,如图 3所示,实验各组均出现了不同程度的细胞病变(CPE)。综上,我们认为创伤弧菌ECPs对卵形鲳鲹鳍细胞具有很强的毒性,在ECPs浓度为1 000 μg/mL时就导致细胞的死亡率超过80%。
我们随后探究了创伤弧菌ECPs对宿主细胞的致死机制。细胞开始凋亡的一个重要信号是出现凋亡小体。凋亡小体是由于细胞受到损伤后为维持细胞内环境的稳定,自身细胞膜皱缩,细胞膜磷脂酰丝氨酸外翻,细胞膜包裹细胞器而形成[22]。本实验用创伤弧菌ECPs处理TOPF细胞后,利用激光共聚焦显微镜观察细胞核,发现其出现了明显的凋亡小体(图 5箭头所示),并且伴有染色质凝集。星形胞菌素(STS)是一种分离的天然产物,其作用于细胞会导致细胞出现明显的细胞凋亡[23]。本研究中,创伤弧菌ECPs处理后的TOPF细胞与STS处理后的细胞均出现了明显的凋亡小体,因此可以初步确定创伤弧菌ECPs会导致宿主细胞出现细胞凋亡。随后我们提取了各处理组细胞的总DNA进行琼脂糖凝胶电泳检测,如图 4所示,阳性对照组STS处理后的FHM细胞总DNA在180~200 bp出现明显的条带,即DNA ladder现象明显,而创伤弧菌ECPs处理后的TOPF组,在180~200 bp没有出现明显的条带。我们分析,出现这种情况可能有两种情况,一是创伤弧菌ECPs处理后的TOPF细胞中的凋亡小体被巨噬细胞吞噬,所以在180~200 bp检测不到阶梯状条带,二是ECPs处理后的宿主细胞虽然发生了细胞凋亡,但是由于宿主细胞中没有相应的DNA酶,所以核小体没有发生断裂,染色体直接被包裹排出细胞外[24]。
4 结论致病性创伤弧菌是危害巨大的水产疫病病原,探究创伤弧菌对宿主细胞的致死机制将为未来研发抗创伤弧菌的专用药物提供重要的理论依据和数据支持。本研究将卵形鲳鲹源创伤弧菌细胞外分泌物ECPs作用于宿主卵形鲳鲹细胞中,发现其具有明显的细胞毒性,Hoechst 33342染核结果和DNA Ladder检测结果初步证实创伤弧菌ECPs会导致卵形鲳鲹背鳍细胞发生细胞凋亡。
| [1] |
余庆, 李菲, 王一兵, 等. 广西北部湾大宗海水养殖鱼类卵形鲳鰺感染溶藻弧菌及其致病性研究[J]. 广西科学, 2018, 25(1): 68-73. |
| [2] |
李远友, 李孟孟, 汪萌, 等. 卵形鲳鲹营养需求与饲料研究进展[J]. 渔业科学进展, 2019, 40(1): 167-177. |
| [3] |
BELÉN F, CARMEN A. Isolation of a new serovar of Vibrio vulnificus pathogenic for eels cultured in freshwater farms[J]. Aquaculture, 2003, 217(1/2/3/4): 677-682. |
| [4] |
LI P, ZHOU L, NI S, et al. Establishment and characterization of a novel cell line from the brain of golden pompano ( Trachinotus ovatus)[J]. In Vitro Cellular & Developmental Biology-Animal, 2016, 52(4): 410-418. |
| [5] |
LI G F, ZHAO D H, HUANG L, et al. Identification and phylogenetic analysis of Vibrio vulnificus isolated from diseased Trachinotus ovatus in cage mariculture[J]. Aquaculture, 2006, 261(1): 17-25. |
| [6] |
LI P, YU Q, LI F, et al. First identification of the nervous necrosis virus isolated from cultured golden pompano (Trachinotus ovatus) in Guangxi, China[J]. Journal of Fish Diseases, 2018, 41(7): 1177-1180. |
| [7] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [8] |
NASCIMENTO S M M D, VIEIRA R H S F, THEOPHILO G N D, et al. Vibrio vulnificus as a health hazard for shrimp consumers[J]. Revista do Instituto de Medicina Tropical de São Paulo, 2001, 43(5): 263-266. |
| [9] |
YU Q, LIU M Z, SU H F, et al. Selection and characterization of ssDNA aptamers specifically recognizing pathogenic Vibrio alginolyticus[J]. Journal of Fish Diseases, 2019, 42(10): 851-858. |
| [10] |
HORSEMAN M A, SURANI S. A comprehensive review of Vibrio vulnificus:an important cause of severe sepsis and skin and soft-tissue infection[J]. International Journal of Infectious Diseases, 2011, 15(3): e157-e166. |
| [11] |
LO W S, CHEN H, CHEN C Y, et al. Complete genome sequence of Vibrio vulnificus 93U204, a bacterium isolated from diseased tilapia in Taiwan[J]. Genome Announc, 2014, 2(5): e01005-14. DOI:10.1128/genomeA.01005-14 |
| [12] |
MANILAL A, SUJITH S, SELVIN J, et al. Virulence of vibrios isolated from diseased black tiger shrimp, penaeus monodon, fabricius[J]. Journal of the World Aquaculture Society, 2010, 41(3): 332-343. |
| [13] |
JONES M K, OLIVER J D. Vibrio vulnificus:disease and pathogenesis[J]. Infection and Immunity, 2009, 77(5): 1723-1733. |
| [14] |
OLIVER J D. Wound infections caused by Vibrio vulnificus and other marine bacteria[J]. Epidemiology and Infection, 2005, 133(3): 383-391. |
| [15] |
LI P, ZHOU L, WEI S, et al. Establishment and characterization of a cell line from the head kidney of golden pompano Trachinotus ovatus and its application in toxicology and virus susceptibility[J]. Journal of Fish Biology, 2017, 90(5): 1944-1959. |
| [16] |
LI P, ZHOU L, NI S, et al. Establishment and characterization of a novel cell line from the brain of golden pompano (Trachinotus ovatus)[J]. In Vitro Cell Dev Biol Anim, 2016, 52(4): 410-418. |
| [17] |
余庆, 李菲, 覃仙玲, 等. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析[J]. 广西科学, 2018, 25(1): 74-79. |
| [18] |
SGONC R, GRUBER J. Apoptosis detection:an overview[J]. Experimental Gerontology, 1998, 33(6): 525-533. |
| [19] |
WHITE E. Life, death, and the pursuit of apoptosis[J]. Genes & Development, 1996, 10(1): 1-15. |
| [20] |
HIPFNER D R, COHEN S M. Connecting proliferation and apoptosis in development and disease[J]. Nature Reviews Molecular Cell Biology, 2004, 5(10): 805-815. |
| [21] |
ZHIVOTOVSKY B, ORRENIUS S. Carcinogenesis and apoptosis:paradigms and paradoxes[J]. Carcinogenesis, 2006, 27(10): 1939-1945. |
| [22] |
CEREGHETTI G M, SCORRANO L. The many shapes of mitochondrial death[J]. Oncogene, 2006, 25(34): 4717-4724. |
| [23] |
NARITA Y, ASAI A, KUCHINO Y, et al. Actinomycin D and staurosporine, potent apoptosis inducers in vitro, are potentially effective chemotherapeutic agents against glioblastoma multiforme[J]. Cancer Chemotherapy and Pharmacology, 2000, 45(2): 149-156. |
| [24] |
胡庆柳, 丁振华, 谭小华. 凋亡而不出现DNA梯形带一例[J]. 中国细胞生物学学报, 1998, 20(2): 76-78. |



