2. 广西科学院, 广西壮族自治区海洋研究所, 广西海洋生物技术重点实验室, 广西北海 536000
2. Guangxi Key Laboratory for Marine Biotechnology, Guangxi Institute of Oceanography, Guangxi Academy of Sciences, Beihai, Guangxi, 536000, China
近年来,随着农业集约化的迅猛发展,重金属污染已成为水体环境污染的公害之一[1]。当重金属离子进入生物圈后会对水生动物的亚细胞结构、细胞结构、器官协调甚至个体发育产生影响[2-3],从而对水生生物健康和水生生态系统造成严重的威胁[4]。重金属离子因此也成为水域环境保护的重要水质监测指标和水生动物生态毒理学研究的重要因子[5]。有研究表明,阐明环境胁迫因子(包括重金属)与病原菌致病力和水产动物抗病力的相互关系是解决水产动物养殖病害的关键与核心[6]。目前,广泛应用于工业生产上的铁、铜、镉、铅等有害金属对生物机体或组织结构的影响已成为金属环境毒理学研究的热点[7]。铜离子是动物体内的必需微量元素,并参与机体多种生理代谢活动[8]。通常情况下地表水中的铜离子含量较低,但由于工业废水、城市污水及农业活动中过度使用的含铜离子肥料和杀虫剂不断流入地表水甚至渗入地下水,从而导致铜离子对水生生物造成严重的毒害效应[9]。先前的研究表明,高浓度的铜离子胁迫会对水生动物造成抗氧化系统损伤[10]、组织结构发生病理变化[11]和遗传毒性作用[12]。中国大鲵(Andrias davidianus)隶属于有尾目、隐鳃鲵科、大鲵属,是世界上现存个体最大和最为珍稀的两栖类物种[13]。中国大鲵对生活水质要求较高,适宜栖息于阴暗、清洁和流动的水体环境中[14]。由于具有较高的食用、药用和科研价值,大鲵的人工养殖在我国陕西、湖南、四川、贵州、河南等地迅速发展,并逐步形成地方精准扶贫的特色产业[15]。作为一种优良的特色养殖品种,大鲵的种群分布和生态保护、人工繁育[16]、免疫防治[17]与病毒病理损伤[18-19]等方面已经进行过较为深入的研究,然而重金属污染物对大鲵的毒性损伤研究尚未有研究报道。本研究以中国大鲵幼体为研究对象,采用慢性染毒法,研究铜离子对大鲵的行为表征及其体内组织器官结构的毒性效应,从而深入了解铜离子对大鲵的毒性作用和为重金属污染生物学提供理论数据,为促进大鲵人工养殖的健康稳定发展和建立高剂量重金属对水生生态的危险评价指标提供重要参考。
1 材料和方法 1.1 实验用水和动物实验用水:采用充分曝气2 d的地下井水,pH值为7.3~7.5,水温为15℃左右。实验动物:大鲵幼体购自栾川大鲵养繁有限公司,并放于水产动物养殖实验室暂养1周;随机挑选健康、体表无伤、大小相似的个体用于实验,实验用鲵体长15 cm左右,体重80 g左右。为避免摄食强度不同对实验结果的影响,实验期间不进行投喂。
1.2 主要试剂和仪器试剂:硫酸铜、苏木精、曙红、硫酸铝钾、碘酸钠、浓盐酸、氨水、无水氯化钙、95%乙醇、无水乙醇、冰醋酸、甘油、苦味酸(2, 4, 6-三硝基苯酚)、甲醛40%(福尔马林)、二甲苯、石蜡、蒸馏水等。
仪器:电子天平、电炉、水浴锅、包埋机、摊片机、切片机、拍照显微镜等。
1.3 方法 1.3.1 铜离子慢性染毒实验采用50 L白色塑料整理箱作为实验容器,每个整理箱放入5 L养殖用水(采自地下)并放养3尾大鲵幼体;将硫酸铜配制成母液后按照比例稀释成实验所需要浓度,药液现配现用;设置4个铜离子浓度梯度组:0 mg/L、1.0 mg/L、1.5 mg/L和3.0 mg/L。实验天数为30 d,每天下午18:00时观察并记录各组大鲵的行为状态、黏液分泌及体表症状等。
1.3.2 剖检观察与样品采集慢性染毒30 d后,各浓度梯度组选取3尾大鲵幼体用鱼安定麻醉后,解剖观察其内脏器官组织结构(包括皮肤、肝脏、胰脏、小肠和膀胱)。观察后迅速采集部分皮肤、肝脏、胰脏和小肠放入10 %中性甲醛溶液进行固定待用。
1.3.3 组织病理损伤观察取出固定好的皮肤、肝脏、胰脏和小肠组织样本,通过乙醇脱水、二甲苯透明、石蜡包埋、HE染色和封片后,利用光学显微镜观察并进行拍照。
2 结果与分析 2.1 铜离子胁迫下大鲵幼体的临床症状养殖过程中的大鲵除产生代谢物外,其皮肤表面分布着大量的呼吸腺体和黏液腺,有助于大鲵进行皮肤呼吸和排泄废物。本实验中,未浸染铜离子的对照组(0 mg/L)大鲵幼体在30 d内的行为特征表现及体表黏液分泌均为正常;而浸染铜离子的实验组(1.0 mg/L,1.5 mg/L和3.0 mg/L)大鲵幼体在第1天就出现不同程度的异常表现,如躁动不安、急剧游动或侧游等,3 d后游动变为缓慢,反应也较为迟钝;5 d后,和对照组相比,实验组中的大鲵幼体体表黏液分泌明显增多,该现象一直持续到第30天;30 d后,和对照组一样,实验组中的大鲵幼体外层皮肤表面均未出现任何溃烂、发炎等中毒症状。该实验结果表明:30 d内,铜离子对大鲵幼体行为特征表现及体表黏液分泌具有一定的影响,其异动现象和体表黏液分泌与铜离子浓度呈正相关(图 1)。

|
| 红色箭头为体表分泌物 Red arrows represent mucous secretion 图 1 不同浓度铜离子对大鲵幼体行为特征及体表黏液分泌的影响 Fig.1 The effects of different concentrations of copper ions on behavioral characteristics and mucous secretion of juvenile Chinese giant salamander |
2.2 铜离子胁迫下大鲵幼体的解剖学特征
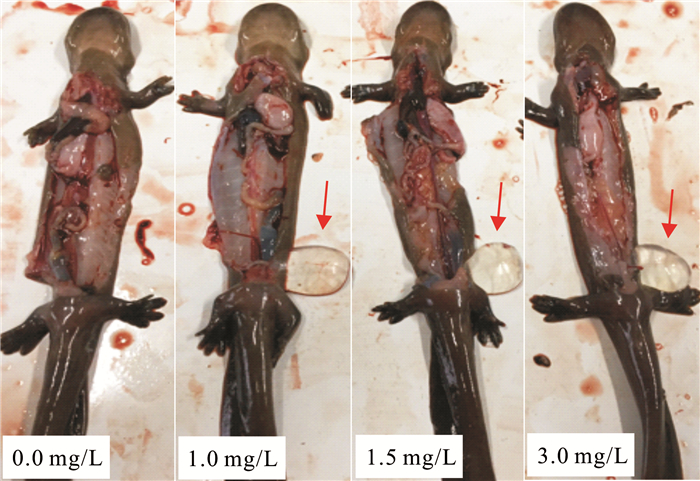
对比观察对照组和实验组大鲵幼体的临床症状后进行解剖检查内脏器官,剖检结果显示,30 d后,和对照组一样,各实验组中大鲵幼体的皮肤内层、肝脏、胰脏和小肠组织均没有发生明显的病理变化;但从排泄系统来看,除对照组中的大鲵幼体膀胱体积很小外,各实验组大鲵幼体的膀胱均出现明显的异常,具体表现为膀胱显著膨大并充斥大量尿液(图 2)。
|
| 红色箭头代表膀胱结构 Red arrows represent Bladder structure 图 2 不同浓度铜离子对大鲵幼体排泄系统的的影响 Fig.2 The effects of different concentrations of copper ions on the excretory system of juvenile Chinese giant salamander |
2.3 铜离子胁迫下大鲵幼体的组织病理变化 2.3.1 铜离子胁迫对大鲵幼体皮肤组织结构的影响
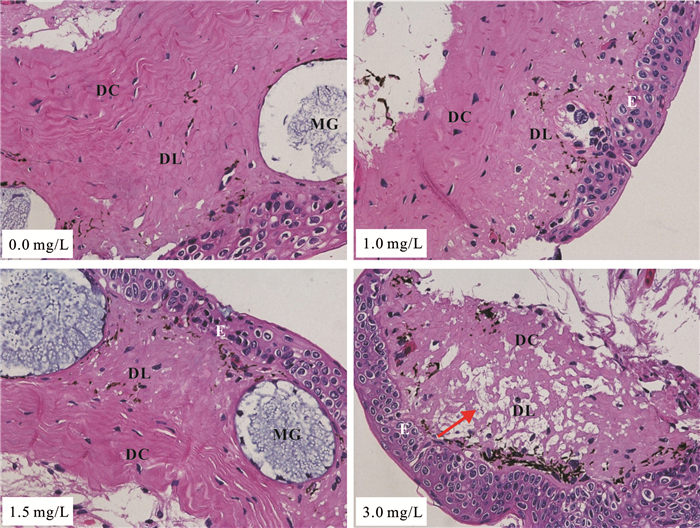
大鲵皮肤组织由表皮、真皮(疏松层和致密层)和皮肤腺(颗粒腺和黏液腺)等结构组成。利用光学显微镜进行镜检后发现:未浸染铜离子的对照组(0 mg/L)和浸染铜离子的实验组(1.0 mg/L,1.5 mg/L和3.0 mg/L)大鲵幼体在30 d后其皮肤的表皮细胞结构均为正常;然而和对照组相比,各实验组真皮结构部分发生了显著的病理损伤,即真皮的疏松层部分出现明显的解体和大量空泡结构。实验结果表明,铜离子对大鲵真皮结构存在一定的毒害效应,其毒害程度与铜离子的浓度呈正相关,但大鲵幼体皮肤组织结构并未出现病理损伤症状(图 3)。
|
| 红色箭头代表受损伤的真皮疏松层,E:表皮;DL:真皮疏松层;DC:真皮致密层;MG:黏液腺 Red arrows represent the damaged dermal loose layer; E:Epidermis, DL:Dermal loose layer, DC:Dermal compact layer, MG:Mucous gland 图 3 不同浓度铜离子对大鲵幼体皮肤组织结构的影响(放大倍数:200倍) Fig.3 The effects of different concentrations of copper ions on the skin tissue structure of juvenile Chinese giant salamander (Magnification power:200×) |
2.3.2 铜离子胁迫对大鲵幼体肝脏组织结构的影响
正常大鲵肝脏细胞呈近圆形或多边形,胞核呈圆形并位于细胞中央,染色后胞核呈紫色,胞质呈红色,如对照组(0 mg/L)所示;与对照组相比,浸染铜离子的实验组(1.0 mg/L,1.5 mg/L和3.0 mg/L)大鲵幼体在30 d后其部分肝脏细胞形态结构出现异常,如细胞核略肿胀或者消失、胞浆结构松散、细胞轮廓逐渐模糊不清并发生破裂等现象;对照组和各实验组大鲵幼体在30 d后其肝脏组织结构也均为正常。实验结果表明:铜离子对大鲵肝脏细胞存在一定的毒害效应,其毒害程度与铜离子的浓度呈正相关,但大鲵幼体肝脏组织结构并未出现病理损伤症状(图 4)。

|
| 红色箭头代表受损伤的肝脏细胞 Red arrows represent the damaged liver cells 图 4 不同浓度铜离子对大鲵幼体肝脏组织结构的影响(放大倍数:200倍) Fig.4 The effects of different concentrations of copper ions on the liver tissue structure of juvenile Chinese giant salamander(Magnification power:200×) |
2.3.3 铜离子胁迫对大鲵幼体胰脏组织结构的影响
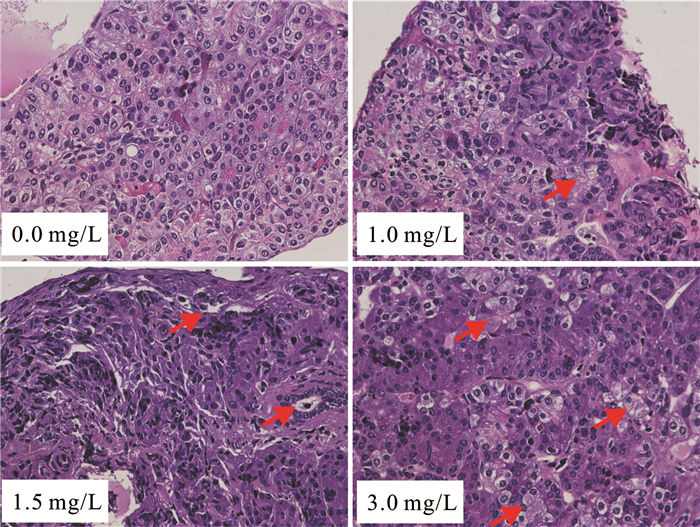
正常大鲵胰脏细胞呈圆形或椭圆形并均匀分布,胞核基本位于细胞中央,染色后胞核呈深紫色,胞质呈紫红色,如对照组(0 mg/L)所示;与对照组相比,浸染铜离子的实验组(1.0 mg/L,1.5 mg/L和3.0 mg/L)大鲵幼体在30 d后其部分胰脏细胞形态结构出现异常,如细胞核萎缩甚至消失、细胞结构解体并出现空泡等现象;对照组和各实验组大鲵幼体在30 d后其胰脏组织结构也均为正常。实验结果表明:铜离子对大鲵胰脏细胞存在一定的毒害效应,其毒害程度与铜离子的浓度呈正相关关系,但大鲵幼体胰脏组织结构并未出现病理损伤症状(图 5)。
|
| 红色箭头代表受损伤的肝脏细胞 Red arrows represent the damaged liver cells 图 5 不同浓度铜离子对大鲵幼体胰脏组织结构的影响(放大倍数:200倍) Fig.5 The effects of different concentrations of copper ions on the pancreas tissue structure of juvenile Chinese giant salamander (Magnification power:200×) |
2.3.4 铜离子胁迫对大鲵幼体小肠组织结构的影响
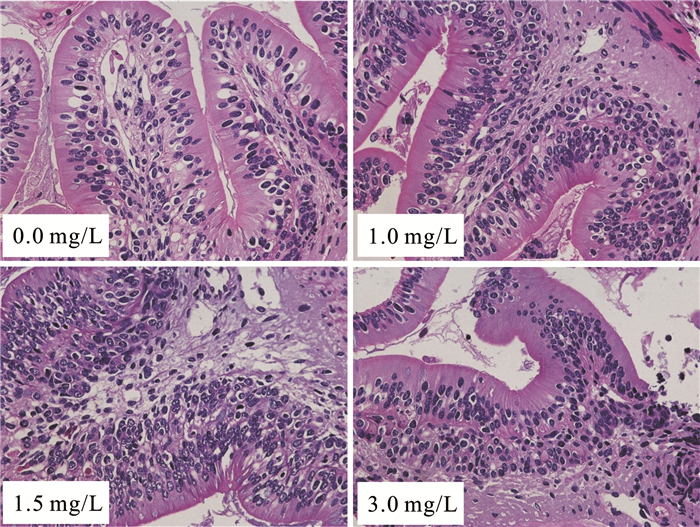
正常大鲵小肠绒毛表面附有近似柱状的上皮细胞,胞核近椭圆形位于细胞的基部,相邻细胞界限明显;分泌细胞位于上皮细胞之间,外形近酒杯状或椎体装,顶部宽而基部窄,胞核也位于细胞基部,如对照组(0 mg/L)所示;未浸染铜离子的对照组(0 mg/L)和浸染铜离子的实验组(1.0 mg/L,1.5 mg/L和3.0 mg/L)大鲵幼体在30 d后其小肠上皮细胞和分泌细胞均正常,并未出现细胞无核或多核、细胞肿胀破裂或坏死等异常症状;此外,大鲵幼体小肠组织也未出现明显的病理损伤症状。因此,实验结果表明,铜离子胁迫对大鲵的小肠组织及其细胞形态没有显著的影响(图 6)。
|
| 图 6 不同浓度铜离子对大鲵幼体小肠组织结构的影响(放大倍数:200倍) Fig.6 The effects of different concentrations of copper ions on the small intestine tissue structure of juvenile Chinese giant salamander (magnification power:200×) |
3 讨论
作为大量存在于自然界的一种金属离子,铜离子既是水生动物必需的营养物质,也是许多重要酶类的组成成分[20]。然而,一旦铜离子在动物体内富集达到一定浓度后就会变成毒性物质,从而对机体产生毒害作用[21]。近年来,硫酸铜作为水产养殖中最常用的药物之一,其导致水生动物铜离子中毒的现象屡有发生,铜离子已成为养殖水体重要的重金属污染物[22]。先前的研究结果表明,高浓度的铜离子会损伤鱼体的神经系统并导致其运动机能发生减退甚至死亡,同时其体表黏液等分泌物也显著增多[23-24]。本实验中浸染铜离子的大鲵幼体也表现出异常游动和体表黏液分泌增多的症状,并且其异常游动的强弱和其体表黏液分泌的多少与铜离子的浓度呈正相关关系。这与贺诗水[23]、王利等[24]的研究结果较为一致,其原因可能是铜离子对大鲵幼体神经系统造成了一定的损伤,使其运动机能减退。大鲵的排泄系统包括肾脏、中肾导管、膀胱和泄殖腔,幼体时其膀胱壁薄且为半透明状,并具有储尿和保持体内水分平衡的功能[25]。本实验中发现大鲵幼体的膀胱壁薄且为半透明状,并且铜离子使其膀胱的储尿能力明显增强,这与陈献雄[25]之前的研究结果也较为相似。许多动物都具有高渗透性皮肤和对水依赖性强等生物学特征,因此极易受到包括重金属在内的各种环境污染物的影响。先前的研究表明,重金属离子对环毛蚓皮肤的表皮结构具有严重的毒性作用,其毒害效应与染毒浓度和时间成正相关[26]。大鲵皮肤柔软、潮湿而光滑,存在丰富的皮肤呼吸结构,如表皮的表皮细胞、皮肤腺和真皮都与呼吸功能关系密切[27]。在本实验中发现,铜离子对大鲵幼体皮肤组织中的真皮结构造成了明显损伤,这与吴波等[26]的研究结果也较为一致。这一结果暗示大鲵幼体的皮肤呼吸功能可能会受到一定的损伤,然而其皮肤组织并未出现病理症状。作为大鲵重要的消化与解毒器官,肝脏结构与其他动物存在显著不同,这可能与其具有造血、内分泌和外分泌功能有关[28]。先前的研究发现肝脏是动物后期铜富集的主要部位,因此也是铜离子毒害较为严重的器官[29]。赖力英等[30]发现铜离子在短期内就可导致兔肝脏发生严重的病理损伤。Liu等[31]和朱友芳等[8]都发现铜离子会损害鱼体肝脏的抗氧化系统并导致肝脏出现组织溶解性坏死。本实验结果表明铜离子对大鲵肝脏细胞存在一定的毒害作用,这与Liu等[31]和朱友芳等[8]的研究结果类似,但并未出现Liu等[31]和朱友芳等[8]研究中发现的肝脏组织结构出现病变症状,这可能与不同动物对铜离子的耐受程度不同相关。先前的研究表明,大鲵胰脏腺管系统丰富并具有较强的合成和分泌能力,因此具有较强的消化功能[32]。本实验结果发现,虽然铜离子对大鲵幼体的胰脏组织结构并未产生任何影响,但却对其胰脏细胞产生了一定的毒害作用,这暗示着大鲵幼体的消化能力可能会受到一定的影响。小肠的主要功能是消化和吸收食物,并为有机体提供营养和能量。王尚洪等[32]研究发现大鲵小肠具有较强的消化、吸收、合成和分泌功能。先前的研究发现,金属汞对蟾蜍蝌蚪的小肠组织结构毒害作用较强[33]。而本实验中发现铜离子对大鲵幼体的小肠细胞和组织结构未产生任何毒害作用,这可能与小肠并不是铜离子的主要富集部位有关。
4 结论本实验研究结果如下,临床特征上:铜离子胁迫下,大鲵幼体的行为特征和体表分泌物受到显著的影响;组织结构解剖上:铜离子胁迫下,大鲵幼体膀胱的储尿能力受到影响,但其皮肤、肝脏、胰脏和小肠组织结构并未产生任何病理损伤;细胞结构上:铜离子胁迫下,大鲵幼体皮肤的真皮结构、肝脏细胞和胰脏细胞均受到一定的毒性损伤,但其小肠细胞未受到毒害作用。因此,本研究表明,铜离子胁迫30 d后会对大鲵幼体产生一定的毒性效应,并且毒性程度与铜离子的浓度呈正相关关系。
| [1] |
林芃, 任宏伟, 茹炳根. 鱼体内金属硫蛋白与水环境关系的研究[J]. 北京大学学报:自然科学版, 2001, 37(6): 779-784. |
| [2] |
LIU H, WANG W, ZHANG J, et al. Effects of copper and its ethylenediaminetetraacetate complex on the antioxidant defenses of the goldfish, Carassius auratus[J]. Ecotoxicology and Environmental Safety, 2006, 65(3): 350-354. DOI:10.1016/j.ecoenv.2005.09.002 |
| [3] |
王学锋, 陈海刚, 蔡文贵, 等. 汞离子胁迫对红鳍笛鲷抗氧化酶及乙酰胆碱酯酶活性的影响[J]. 水产学报, 2010, 34(12): 1829-1836. |
| [4] |
康维钧, 孙汉文. 环境重金属污染水体及土壤的生态毒理诊断及修复研究进展[J]. 河北工业科技, 2006, 23(1): 61-64. DOI:10.3969/j.issn.1008-1534.2006.01.019 |
| [5] |
王志铮, 王伟定, 杨阳, 等. 4种重金属离子对彩虹明樱蛤(Moerella iridescens)的急性致毒效应[J]. 海洋与湖泊, 2007, 38(4): 373-378. |
| [6] |
曲凌云, 孙修勤, 相建海, 等. 热休克蛋白研究进展[J]. 海洋科学进展, 2004, 22(3): 385-391. DOI:10.3969/j.issn.1671-6647.2004.03.019 |
| [7] |
王学锋, 李纯厚, 贾晓平, 等.重金属污染对鱼类的胁迫效应研究进展[C].呼和浩特: 第四届全国农业环境科学学术研讨会论文集, 2011.
|
| [8] |
朱友芳, 洪万树, 林金忠. 铜离子对中国花鲈幼鱼的毒性研究[J]. 生态毒理学报, 2011, 6(3): 31-336. |
| [9] |
周雪瑞, 沈后方, 潘正军, 等. Pb2+和Cu2+诱发蝌蚪红细胞微核及核异常的研究[J]. 安徽农业科学, 2008, 36(14): 5842-5843, 5912. DOI:10.3969/j.issn.0517-6611.2008.14.085 |
| [10] |
贾秀英, 施蔡雷. 水体二价铜离子致蟾蜍蝌蚪DNA损伤和氧化损伤[J]. 环境科学学报, 2008, 28(10): 2095-2100. DOI:10.3321/j.issn:0253-2468.2008.10.026 |
| [11] |
王利, 汪开毓. 鲤鱼亚急性铜中毒的病理组织学观察[J]. 中国兽医科学, 2008, 38(12): 1089-1092. |
| [12] |
王利, 汪开毓. 硫酸铜诱发鲤鱼红细胞微核和核异常的研究[J]. 湖北农业科学, 2008, 47(11): 1336-1337. DOI:10.3969/j.issn.0439-8114.2008.11.039 |
| [13] |
章克家, 王小明. 大鲵, 你还好吗?[J]. 森林与人类, 2001, 3: 43-45. |
| [14] |
孙宝岚. 蓝田县大鲵养殖存在的问题及应对措施[J]. 陕西水利, 2016(2): 158-159. DOI:10.3969/j.issn.1673-9000.2016.02.079 |
| [15] |
罗庆华, 谢文海, 王朝群, 等. 张家界大鲵产业发展战略分析[J]. 中国农学通报, 2013, 29(23): 39-43. |
| [16] |
侯进慧, 朱必才, 童玉玮, 等. 中国大鲵研究进展[J]. 四川动物, 2004, 23(3): 272-276. |
| [17] |
曾宪辉, 曾令兵, 周勇, 等. 大鲵虹彩病毒主衣壳蛋白MCP基因DNA疫苗的构建及其免疫效果[J]. 中国水产科学, 2015, 22(5): 1055-1067. |
| [18] |
JIANG N, FAN Y, ZHOU Y, et al. Characterization of Chinese giant salamander iridovirus tissue tropism and inflammatory response after infection[J]. Diseases of Aquatic Organiams, 2015, 114: 229-237. DOI:10.3354/dao02868 |
| [19] |
刘丹, 耿毅, 汪开毓, 等. 大鲵蛙病毒感染大鲵的动态病理损伤及病原的组织分布[J]. 中国水产科学, 2017, 24(1): 146-155. |
| [20] |
STOHS S J, BAGCHI D. Oxidative mechanisms in the toxicity of metal ions[J]. Free Radical Biology and Medicine, 1995, 18(2): 321-336. DOI:10.1016/0891-5849(94)00159-H |
| [21] |
LINDER M C, HAZEGH-AZAM M. Copper biochemistry and molecular biology[J]. American Journal of Clinical Nutrition, 1996, 63(5): 797S-811S. |
| [22] |
李达, 陈道印, 肖秀兰. 硫酸铜引起鱼类中毒的原因初析[J]. 淡水渔业, 2000, 30(5): 38-39. DOI:10.3969/j.issn.1000-6907.2000.05.018 |
| [23] |
贺诗水. 铜离子对锦鲤的急性毒性及安全浓度评价[J]. 贵州农业科学, 2010, 38(2): 205-207. DOI:10.3969/j.issn.1001-3601.2010.02.064 |
| [24] |
王利, 汪开毓. 鲤鱼急性铜中毒的病理学研究[J]. 安徽农业科学, 2008, 36(16): 6818-6820. DOI:10.3969/j.issn.0517-6611.2008.16.085 |
| [25] |
陈献雄. 中国大鲵(Andrias davidianus)排泄系统形态解剖及组织观察[J]. 深圳特区科技, 1998, 3: 31-35. |
| [26] |
吴波, 李薇, 付玉梅, 等. 重金属镉对参环毛蚓表皮结构的损伤[J]. 广州医学院学报, 2011, 39(3): 5-7. DOI:10.3969/j.issn.1008-1836.2011.03.002 |
| [27] |
唐以杰, 曾小龙, 方昆阳. 中国大鲵皮肤的组织学观察[J]. 广东科技, 1999, 7: 26-27. |
| [28] |
方展强. 中国大鲵肝脏的超微结构[J]. 四川动物, 2006, 25(2): 228-230. DOI:10.3969/j.issn.1000-7083.2006.02.006 |
| [29] |
马莉芳, 蒋晨, 高春生. 水体铜对水生动物毒性的研究进展[J]. 江西农业学报, 2013, 25(8): 73-76. DOI:10.3969/j.issn.1001-8581.2013.08.020 |
| [30] |
赖力英, 杨旭, 李代强, 等. 铜负荷饲养兔肝、肾组织含铜量和组织病理学观察[J]. 动物学杂志, 2004, 39(6): 96-98. DOI:10.3969/j.issn.0250-3263.2004.06.021 |
| [31] |
LIU X J, LUO Z, XIONG B X, et al. Effect of waterborne copper exposure on growth, hepatic enzymatic activities and histology in Synechogobius hasta[J]. Ecotoxicology and Environmental Safety, 2010, 73(6): 1286-1291. DOI:10.1016/j.ecoenv.2010.06.019 |
| [32] |
王尚洪, 余扬帆, 王芳. 中国大鲵小肠和胰脏的超微结构观察[J]. 中国农学通报, 2012, 28(35): 87-91. DOI:10.3969/j.issn.1000-6850.2012.35.018 |
| [33] |
王爱民. 四种重金属对绿蟾蜍蝌蚪的急性毒性研究[J]. 新疆大学学报:自然科学版, 1990(1): 60-64. |



