2. 广西壮族自治区海洋研究所, 广西海洋生物技术重点实验室, 广西北海 536000;
3. 河南师范大学生命科学学院, 河南新乡 453007;
4. 北部湾大学海洋学院, 广西北部湾海洋生物多样性养护重点实验室, 广西钦州 535011;
5. 广西民族大学海洋与生物技术学院, 广西南宁 530006;
6. 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007
2. Guangxi Key Laboratory for Marine Biotechnology, Guangxi Institute of Oceanography, Guangxi Academy of Sciences, Beihai, Guangxi, 536000, China;
3. Guangxi Key Laboratory of Marine Environmental Science, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
4. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China;
5. School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi, 530006, China;
6. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China
石斑鱼(Epinephelus tauvina)主要分布于热带及温带海洋,是礁栖暖水性鱼类,属脊索动物门(Chordata)、脊椎动物亚门(Vertebrata)、硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、鮨科(Serranidae)、石斑鱼亚科(Epinephelinae)、石斑鱼属(Epinephelus)。石斑鱼肉质肥美鲜嫩,蛋白质含量高,具有较高的经济价值和营养价值,是我国东南沿海各省及东南亚各国名贵的海水养殖鱼类。近年来,由于供不应求的市场关系,石斑鱼养殖业迅猛发展,但是随之而来的各类疫病病原的频繁暴发,严重影响石斑鱼养殖产业的发展。其中,石斑鱼虹彩病毒(Grouper iridovirus, SGIV)是严重威胁石斑鱼养殖的高致病性传染性病毒,因此研发可以快速、便捷检测虹彩病毒感染的实用型病毒检测技术,有助于及时确定病原、进而采取有效措施控制病毒的爆发[1-3]。
虹彩病毒粒子在宿主体细胞内排列整齐,形成晶格平面并互相交叠。虹彩病毒粒子形成二十面体的晶格结构,病毒粒子经斜射光反射出蓝色或紫色的虹彩,因此被命名为虹彩病毒。虹彩病毒粒子直径约为120~300 nm,主要由中央核心体、衣壳和脂质膜3个部分组成。中央核心体含有致密且不规则的双链DNA;衣壳由衣壳亚单位紧密连接形成,包被着内层脂质膜(Internal lipid membrane),衣壳亚单位的数量直接决定病毒粒子的直径大小[4]。目前,基于虹彩病毒的宿主范围和全基因组测序信息,在全球范围内已发现和鉴定出60多种虹彩病毒,且多数无致病性。虹彩病毒被划分为5个属:虹彩病毒属(Iridovirus)、绿虹彩病毒属(Chloriridovirus)、淋巴囊肿病毒属(Lymphocystivirus)、蛙虹彩病毒属(Ranavirus)和肿大细胞病毒属(Megalocytivirus)[3]。Qin等[1]从患病石斑鱼肝脾肾中分离获得虹彩病毒,通过与其他虹彩病毒属的主要衣壳蛋白氨基酸进行序列比对,分析出与其具有较高同源性的是蛙虹彩病毒属,因此石斑鱼虹彩病毒属于蛙虹彩病毒属,并被命名为新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus, SGIV)。电子显微镜观察可清晰观测SGIV侵入宿主细胞、复制、成熟、装配、释放的感染行为[5]。
目前针对水产养殖动物病害发展的检测方法包括:基于病毒学、细菌学、组织病理学及寄生虫学的传统观察法,基于抗体的免疫学检测方法以及基于分子生物学的PCR技术等[1, 5-7]。这些方法具有较高的灵敏性和精确性等优点,也存在操作繁琐、检测耗时长、试剂难以长期保存等缺点,因而仅局限于在实验室内对少量样品的精确检测,难以实现在养殖现场大范围快速准确检测诊断石斑鱼虹彩病毒感染的要求。因此,迫切需要开发出一种操作便捷、准确性高、耗时短的新型的石斑鱼虹彩病毒病快速检测诊断技术或产品[8-9]。
近年来,核酸适配体在鱼类病害检测及防控研究领域广受关注[10-13]。指数富集配基系统进化技术(System evolution of ligands by exponential enrichment, SELEX)是一类将PCR扩增技术与生物文库筛选技术相结合的前沿技术。SELEX技术筛选的过程就是将随机寡核苷酸文库(1015)与靶物质在适宜的条件下孵育结合,再通过滤膜过滤、亲和层析、离心分离等方法去除未与靶物质特异性结合的核酸单链,然后分离获得靶物质上面与其特异性结合的核酸单链,通过PCR扩增得到特异性较高的次级文库,经过一轮轮的筛选最后得到与靶物质特异性结合能力最强的核酸单链,即核酸适配体[14]。核酸适配体具有优良的性质,例如特异性强、亲和性高,能够直接在体外大量化学合成,易筛选且成本较低等。利用核酸适配体开发出的病害快速检测试剂盒,具有较好的发展前景。在先前的研究中,我们基于细胞-指数富集配基系统进化技术(Cell-SELEX),以石斑鱼虹彩病毒感染的石斑鱼脾细胞(GS)为靶标进行Cell-SELEX筛选,获得了高特异性识别石斑鱼虹彩病毒感染的核酸适配体Q5[15]。本研究利用核酸适配体Q5构建能够高特异性识别石斑鱼虹彩病毒感染的核酸适配体Q5-荧光分子检测探针(Aptamer Q5-based fluorescent molecular probe,Q5-AFMP),并对Q5-AFMP检测石斑鱼虹彩病毒感染的特异性和灵敏性进行分析,以期针对石斑鱼虹彩病毒病开发出实用的快速检测产品。
1 材料与方法 1.1 材料珍珠龙胆石斑鱼虹彩病毒广西株(SGIV-Gx)、石斑鱼脾细胞(GS);细胞培养瓶和6孔板、12孔板购自康宁公司;胎牛血清(Fetal bovine serum, FBS)购自GIBCO公司;异硫氰酸荧光素(Fluorescein isothiocyanate, FITC)标记的核酸适配体Q5。本实验使用的仪器包括Beckman流式细胞仪、Nikon激光扫描共聚焦显微镜、生物安全柜、无菌操作台、多功能酶标仪、Nikon倒置显微镜、Thermo PCR仪、生化培养箱、Thermo高速离心机、水浴锅、斑马鱼循环养殖系统。
1.2 方法 1.2.1 SGIV-Gx感染细胞的准备与处理把石斑鱼脾细胞(GS)转入细胞培养瓶,瓶底基本铺满细胞后,实验组细胞接入SGIV-Gx,对照组为正常细胞不作任何处理,继续培养36~48 h后,将收集到的实验组和对照组细胞用磷酸缓冲盐溶液PBS(2 mmol/L KH2PO4,10 mmol/L Na2HPO4,137 mmol/L NaCl,pH值7.2)轻轻洗涤1次后备用。
1.2.2 Q5-AFMP检测SGIV-Gx感染细胞的激光共聚焦显微镜观察GS用玻底皿培养24 h,同时将Q5-AFMP (200 nmol/L)在92℃恒温水浴锅变性5 min,变性后迅速插入到冰中复性5 min,将Q5-AFMP溶于L15培养基中。实验组为SGIV-Gx感染的GS与Q5-AFMP冰上避光孵育结合40 min。设置3组对照:CON1为正常GS;CON2为SGIV-Gx感染的GS;CON3为正常GS与Q5-AFMP冰上避光孵育结合。孵育结合后将4组样品分别用MEM培养基轻轻洗涤一次,加入Hoechst染液避光染色3 min后,用MEM培养基轻轻洗去染液,然后将玻底皿置于激光共聚焦显微镜下观察拍照。
1.2.3 流式细胞仪分析Q5-AFMP检测SGIV-Gx感染的特异性GS用12孔板培养24 h,同时将Q5-AFMP进行变复性处理。实验组为SGIV-Gx感染的GS与Q5-AFMP冰上避光孵育结合40 min。设置4组对照组:CON1为Q5-AFMP与正常GS孵育结合;CON2为SGIV-Gx感染的GS;CON3为GNNV-Gx感染的GS与Q5-AFMP孵育结合。孵育结合40 min后离心终止结合,用PBS轻轻洗涤一次,除去上清,将样品溶于PBS中,使用流式细胞仪检测样品的荧光值。每个反应均做3个重复。
1.2.4 Q5-AFMP检测SGIV-Gx感染细胞的数量灵敏性分析GS用6孔板培养24 h,同时将Q5-AFMP进行变复性处理后备用。将SGIV-Gx感染的GS逐级稀释为5×104个/mL,2×104个/mL,1×104个/mL,5×103个/mL,1×103个/mL,5×102个/mL;对照组为5×104个/mL的正常GS。将1 mL稀释好的细胞样品分别与Q5-AFMP孵育结合40 min后离心去除上清,用PBS轻轻洗涤细胞两次,除去上清,将样品溶于PBS中,使用荧光酶标仪检测样品的荧光值。每个反应均做3个重复。
1.2.5 Q5-AFMP检测SGIV-Gx感染的时间灵敏性分析GS用12孔板培养24 h,同时取Q5-AFMP进行变复性处理后备用。对照组为正常GS与Q5-AFMP孵育结合,实验组为SGIV-Gx感染的GS与Q5-AFMP孵育结合。对照组和实验组的细胞在冰上与Q5-AFMP分别结合60 min,40 min,20 min,10 min,5 min和1 min。离心终止结合,用PBS轻轻洗涤一次,除去上清,将样品溶于PBS中,使用流式细胞仪检测样品的荧光值。每个反应均做3个重复。
1.2.6 斑马鱼活体感染与RT-qPCR检测取体型相近的斑马鱼,空腹24 h后腹腔注射SGIV-Gx病毒。分别在24 h和48 h解剖斑马鱼得到肝脾肾,以健康斑马鱼作为对照组。使用RNA提取试剂盒从斑马鱼肝脾肾组织中提取出总RNA,再用PCR仪将其反转录成cDNA,然后用荧光定量PCR仪检测组织中的石斑鱼虹彩病毒主要衣壳蛋白MCP和囊膜蛋白VP19的表达情况。
1.2.7 Q5-AFMP在活体水平检测SGIV-Gx感染取体型相近的斑马鱼,空腹24 h后腹腔注射SGIV-Gx病毒。24 h后取斑马鱼肝组织进行后续实验,健康斑马鱼作为对照组。将各组组织样品分别用PBS漂洗后切碎,然后用PBS洗涤3次,离心去除上清。取Q5-AFMP进行变复性处理后,分别与样品孵育结合40 min后离心终止结合,用PBS轻轻洗涤2次,除去上清,将样品重悬于PBS中,使用荧光酶标仪检测样品的荧光值,每个反应均做3个重复。
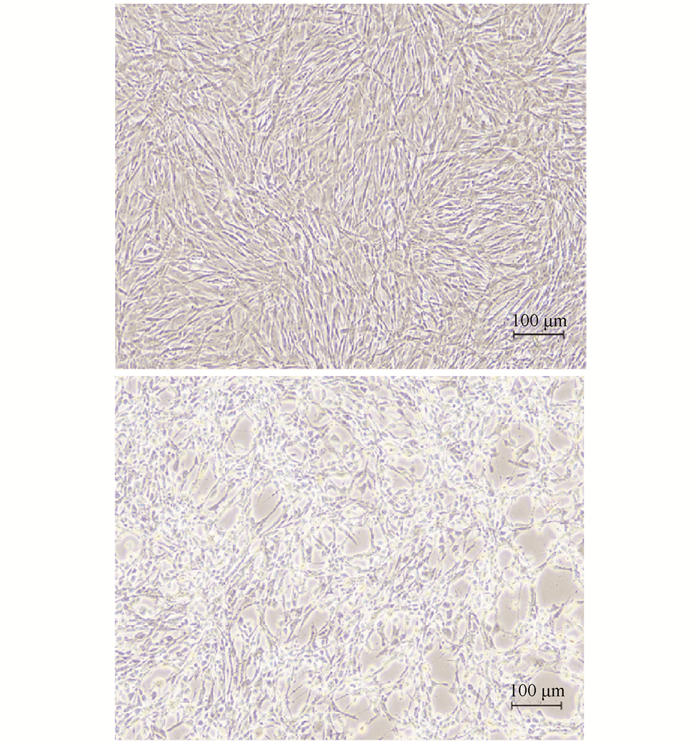
2 结果与分析 2.1 Q5-AFMP检测SGIV-Gx感染的激光共聚焦显微镜观察如图 1所示,实验组细胞接入SGIV-Gx后,与对照组中正常细胞相比,细胞变圆、坏死并脱落,出现大量空泡,出现明显的细胞病变(Cytopathic effects, CPEs)。随着感染时间的增长,细胞层也会逐渐松散并最终裂解崩坏。核酸适配体Q5的序列如表 1所示。激光共聚焦显微镜观测结果显示,Q5-AFMP能够特异性识别SGIV-Gx感染的GS,而对正常细胞无识别(图 2)。
|
| 图 1 GS被虹彩病毒SGIV-Gx感染前(上)与感染后(下)对比 Fig.1 The comparision of pre- (Above) and post- (Below) SGIV-Gx infected GS |
| 核酸适配体 Aptamer |
核苷酸序列 Nucleotide sequences |
| Q5 | 5′-GACGCTTACTCAGGTGTGACTCGTATTCG- GGTTATTGCTCCTCTTTATTGTCACCTGGA- TGTATGATCGTGTAGCGAAGGACGCAGAT- GAAGTCTC-3′ |

|
| 图 2 激光共聚焦显微镜观察结果 Fig.2 The fluorescent imaging results by laser confocal microscopy |
2.2 流式细胞术检测Q5-AFMP识别SGIV-Gx感染细胞的特异性
流式细胞仪检测结果显示:对照组正常细胞的荧光值较低,实验组细胞的荧光值高;显著性分析结果显示:实验组与对照组的数据差异极显著,说明Q5-AFMP识别SGIV-Gx感染的细胞具有较强的特异性(图 3)。

|
| **P < 0.01差异极显著 **P < 0.01 was considered extremely different 图 3 Q5-AFMP特异性识别SGIV-Gx感染细胞的结果 Fig.3 The results of Q5-AFMP specifically recognizing SGIV-Gx infected cells |
2.3 Q5-AFMP检测SGIV-Gx感染细胞的数量灵敏性
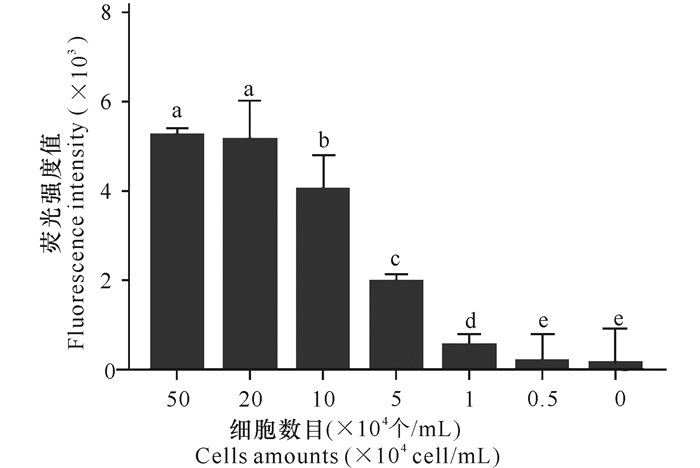
荧光检测结果显示:正常GS与Q5-AFMP结合后荧光值很低,而SGIV-Gx感染的GS与Q5-AFMP结合的荧光值较高;随着SGIV-Gx感染GS数目不断增加,荧光值也不断增加;当SGIV-Gx感染的GS数目减少至1 000个/mL时,Q5-AFMP对SGIV-Gx感染细胞的检测仍具有较好的灵敏性(图 4)
|
| 不同字母上标表示组间差异极显著(P < 0.01) Bars with different superscript are significantly different (P < 0.01) 图 4 Q5-AFMP检测SGIV-Gx感染细胞的数量灵敏性 Fig.4 The amounts sensitivity of Q5-AFMP recognizing SGIV-Gx infected cells |
2.4 Q5-AFMP检测SGIV-Gx感染细胞的时间灵敏性
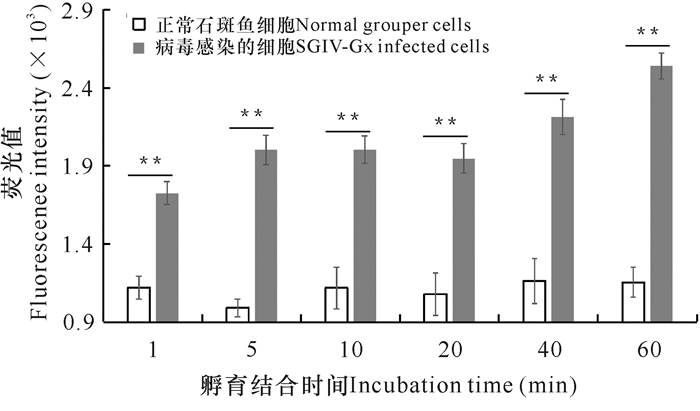
流式细胞仪检测结果显示:Q5-AFMP与正常GS在不同的孵育时长下所检测的荧光强度值均较低,各对照组之间荧光值没有明显差异;Q5-AFMP与SGIV-Gx感染的GS孵育结合的时间越长,荧光强度值就越高;由显著性分析可知,实验组与各自的对照组相比数值差异极显著;Q5-AFMP与SGIV-Gx感染的GS结合时间为1 min时,Q5-AFMP仍可较为灵敏地检测到SGIV-Gx感染(图 5)。
|
| **P < 0.01差异极显著 **P < 0.01 was considered extremely different 图 5 Q2-AFMP检测SGIV-Gx感染细胞的时间灵敏性 Fig.5 The time sensitivity of Q5-AFMP for detection of SGIV-Gx infected cells |
2.5 Q5-AFMP对感染SGIV-Gx的斑马鱼活体组织检测结果
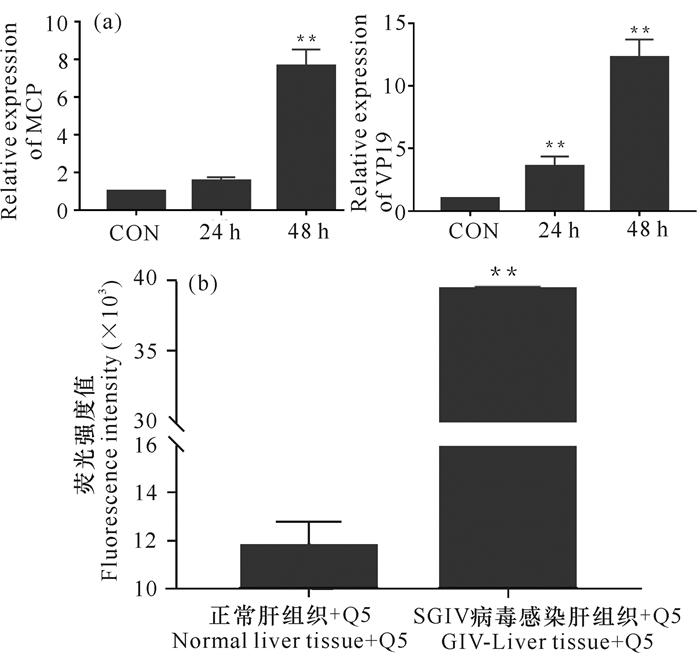
腹腔注射石斑鱼虹彩病毒SGIV-Gx的斑马鱼,表现为活力下降,解剖鱼体对组织进行观察后发现,组织出现脾脏肿大等疑似病变。RT-qPCR检测发现,在注射病毒24 h和48 h后,斑马鱼肝脾组织中MCP和VP19表达量持续增加,证实SGIV-Gx在斑马鱼体内进行了大量复制(图 6a)。应用Q5-AFMP对组织样品进行检测后发现,与对照组相比,感染SGIV-Gx 24 h的斑马鱼组织样品与Q5-AFMP孵育结合后荧光值很高,显著高于对照组正常组织与Q5-AFMP孵育结合后的荧光值,证实Q5-AFMP可以在鱼活体水平特异性检测石斑鱼虹彩病毒的感染(图 6b)。
|
| **P < 0.01差异极显著 **P < 0.01 was considered extremely different 图 6 Q5-AFMP对人工感染SGIV-Gx的斑马鱼组织的检测分析 Fig.6 Detection and analysis of Q5-AFMP on zebrafish tissue which artificially infected SGIV-Gx |
3 讨论
虹彩病毒属的病毒可侵染不同的宿主,侵染范围广泛,其中绿虹彩病毒属感染昆虫,而淋巴囊肿病毒属和肿大细胞病毒属感染鱼类,蛙虹彩病毒属则可感染两栖类、爬行类和鱼类[5]。虹彩病毒在水产养殖鱼类中频繁暴发,对鱼类的致死率极高,幼鱼被侵染后死亡率可达到90%,造成重大经济损失[1, 4]。但是目前市场上仍缺少能够有效防治石斑鱼虹彩病毒的技术或功能产品,只能通过积极预防来控制虹彩病毒的侵染,如引进无携带病毒、细菌、寄生虫等的鱼苗,实时监测养殖场环境以及养殖用水,确保水体无污染以及尽可能地保证鱼用饲料清洁无毒等[1-2]。因此需要研发快速便捷的检测方法,使虹彩病毒在爆发之前能被及时发现并得到有效控制[2, 8, 10]。核酸适配体作为一种分子探针,易于筛选、合成和修饰,并能与靶物质高特异性地结合[16]。核酸适配体与靶物质的结合方式和抗体与抗原识别模式很相似,不过核酸适配体分子量更小,在分子水平上能更好地识别不同靶物质的细微差别。例如,在检测茶碱时,传统的检测方法不能区分与茶碱仅相差一个碱基的咖啡因以及茶碱的同分异构体可可碱,因此检测结果往往会比实际偏高,而通过SELEX技术特异性筛选出来的核酸适配体只对茶碱具有亲和性,无法与咖啡因或可可碱相结合,从而大大提高了检测结果的准确性[17]。核酸适配体目前已经可以替代传统抗体,在基础研究、临床诊断、快速检测等技术方面具有较好的应用前景[18]。据报道,核酸适配体可以与目标物质特异性结合,且结构稳定,常用于生物传送领域。核酸适配体与药物结合后,可将药物定向传送至病灶部位,降低药物非特异性靶向引起的其他副作用,且核酸适配体没有免疫原性,不会引起机体的免疫反应。核酸适配体可定位到病毒感染的部位,与病毒结合阻断其增值过程,抑制病毒的侵染[19-23]。Li等[15]在此前应用SELEX技术筛选出了以石斑鱼虹彩病毒感染的石斑鱼细胞作为靶物质的核酸适配体,并经过实验验证了筛选出的核酸适配体可以高特异性与石斑鱼虹彩病毒感染的石斑鱼细胞结合。核酸适配体的筛选时间短,可以反复回收使用,而且核酸适配体没有明显的免疫原性和细胞毒性,便于长时间保存和长途运输,高温条件下引起的核酸适配体变性是可逆的,核酸适配体在后期易于化学合成和配基修饰[24]。因此利用核酸适配体开发病害快检试剂盒具有广阔的发展前景。
本研究应用一种新型的核酸适配体Q5-荧光分子检测探针(Aptamer Q5-based fluorescent molecular probe,Q5-AFMP)对石斑鱼虹彩病毒进行快速检测。首先分析了Q5-AFMP检测石斑鱼虹彩病毒感染的石斑鱼细胞的特异性和灵敏性。实验结果表明Q5-AFMP能够特异性检测到感染石斑鱼虹彩病毒的GS,并且检测灵敏度可以达到1 000个病毒感染细胞/mL。当Q5-AFMP与病毒感染细胞孵育结合时间短至1 min时,Q5-AFMP均可灵敏地检测到石斑鱼虹彩病毒。活体感染实验则表明,Q5-AFMP可以特异性检测石斑鱼虹彩病毒感染的石斑鱼组织。综上所述,Q5-AFMP具有很强的特异性和很高的灵敏度,可用于快速便捷检测石斑鱼病毒的感染。在未来的研究中,将进一步优化探针的结构,降低Q5-AFMP的生产成本,优化检测步骤,将这种快速检测技术推广应用到石斑鱼养殖现场的快速检测。并且,我们将会把核酸适配体与纳米金技术等相结合,以期研发出操作更简单、稳定性更强、灵敏度更高的检测功能产品,最终实现对虹彩病毒在感染早期的快速检测,以期达到对石斑鱼病毒感染的实时监测和及时防控。
4 结论Q5-AFMP能够在在细胞水平和组织水平检测出石斑鱼虹彩病毒的感染,具有特异性强、灵敏度高的优点,因此能够用于石斑鱼养殖中石斑鱼虹彩病毒的快速检测诊断和精准用药。
| [1] |
QIN Q W, CHANG S F, NGOH L G H, et al. Characterization of a novel ranavirus isolated from grouper Epinephelus tauvina[J]. Diseases of Aquatic Organisms, 2003, 53(1): 1-9. |
| [2] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [3] |
YU Q, LIU M, WEI S, et al. .Isolation and characterization of nervous necrosis virus in cultured hybrid grouper (Epinephelus fuscoguttatus♀×E.lanceolatus♂) in Guangxi, China[J]. Fish Pathology, 2019, 54(1): 16-19. DOI:10.3147/jsfp.54.16 |
| [4] |
QIN Q W, LAM T J, SIN Y M, et al. Electron microscopic observations of a marine fish iridovirus isolated from brown-spotted grouper, Epinephelus tauvina[J]. Journal of Virological Methods, 2001, 98(1): 17-24. DOI:10.1016/S0166-0934(01)00350-0 |
| [5] |
CHINCHAR V G, HYATT A, MIYAZAKI T, et al. Family iridoviridae:Poor viral relations no longer[J]. Lesser Known Large dsDNA Viruses, 2009, 328: 123-170. |
| [6] |
QIN Q W, GIN K Y H, LEE L Y, et al. Development of a flow cytometry based method for rapid and sensitive detection of a novel marine fish iridovirus in cell culture[J]. Journal of Virological Methods, 2005, 125(1): 49-54. DOI:10.1016/j.jviromet.2004.12.005 |
| [7] |
SHI C, QIN Q W, GIN K Y H, et al. Production and characterization of monoclonal antibodies to a grouper iridovirus[J]. J Virol Methods, 2003, 107: 147-154. DOI:10.1016/S0166-0934(02)00212-4 |
| [8] |
李鹏飞, 余庆, 李菲, 等. 基于新型核酸适配体-荧光分子检测探针的石斑鱼虹彩病毒病快速诊断[J]. 广西科学, 2018, 25(1): 63-67. |
| [9] |
LI P, YU Q, LIU M, et al. Selection and application of novel ssDNA aptamers specially recognized aquatic viral pathogens[J]. Earth and Environmental Science, 2018, 216: 012048. |
| [10] |
LI P, ZHOU L, WEI J, et al. Development and characterization of aptamer-based enzyme-linked apta-sorbent assay for the detection of Singapore grouper iridovirus infection[J]. Journal of Applied Microbiology, 2016, 121(3): 634-43. DOI:10.1111/jam.13161 |
| [11] |
ZHOU L, LI P, NI S, et al. Rapid and sensitive detection of redspotted grouper nervous necrosis virus (RGNNV) infection by aptamer-coat protein-aptamer sandwich enzyme-linked apta-sorbent assay (ELASA)[J]. Journal of Fish Diseases, 2017, 40(12): 1831-1838. DOI:10.1111/jfd.12656 |
| [12] |
YU Q, LIU M, XIAO H, et al. The inhibitory activities and antiviral mechanism of Viola philippica aqueous extracts against grouper iridovirus infection in vitro and in vivo[J]. Journal of Fish Diseases, 2019, 42(6): 859-868. DOI:10.1111/jfd.12987 |
| [13] |
LI P, YU Q, ZHOU L, et al. Probing and characterizing the high specific sequences of ssDNA aptamer against SGIV-infected cells[J]. Virus Research, 2018, 246: 46-54. DOI:10.1016/j.virusres.2018.01.006 |
| [14] |
ELLINGTON A D, SZOSTAK J W. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346(6287): 818-22. DOI:10.1038/346818a0 |
| [15] |
LI P, WEI S, ZHOU L, et al. Selection and characterization of the novel DNA-aptamers specifically recognized Singapore grouper iridovirus (SGIV) infected fish cells[J]. The Journal of General Virology, 2015, 96(11): 3348-3359. DOI:10.1099/jgv.0.000270 |
| [16] |
DUAN N, WU S, DAI S, et al. Advances in aptasensors for the detection of food contaminants[J]. The Analyst, 2016, 141(13): 3942-3961. DOI:10.1039/C6AN00952B |
| [17] |
JENISON R D, GILL S C, PARDI A, et al. High-resolution molecular discrimination by RNA[J]. Science, 1994, 263(5152): 1425-1429. DOI:10.1126/science.7510417 |
| [18] |
BUNKA D H J, PLATONOVA O, STOCKLEY P G. Development of aptamer therapeutics[J]. Current Opinion in Pharmacology, 2010, 10(5): 557-562. DOI:10.1016/j.coph.2010.06.009 |
| [19] |
LI P, YAN Y, WEI S, et al. Isolation and characterization of a new class of DNA aptamers specific binding to Singapore grouper iridovirus (SGIV) with antiviral activities[J]. Virus Research, 2014, 188: 146-154. DOI:10.1016/j.virusres.2014.04.010 |
| [20] |
YU Q, LIU M, WEI S, et al. Characterization of ssDNA aptamers specifically directed against Trachinotus ovatus NNV (GTONNV)-infected cells with antiviral activities[J]. Journal of General Virology, 2019, 100(3): 380-391. DOI:10.1099/jgv.0.001226 |
| [21] |
ZHOU L, LI P, YANG M, et al. Generation and characterization of novel DNA aptamers against coat protein of grouper nervous necrosis virus (GNNV) with antiviral activities and delivery potential in grouper cells[J]. Antiviral Research, 2016, 129: 104-114. DOI:10.1016/j.antiviral.2016.02.009 |
| [22] |
YU Q, LIU M, SU H, et al. Selection and characterization of ssDNA-aptamers specifically recognized pathogenic Vibrio alginolyticus[J]. Journal of Fish Diseases, 2019, 42(6): 851-858. DOI:10.1111/jfd.12985 |
| [23] |
LI P, ZHOU L, YU Y, et al. Characterization of DNA aptamers generated against the soft-shelled turtle iridovirus with antiviral effects[J]. BMC Veterinary Research, 2015, 11(1): 245. DOI:10.1186/s12917-015-0559-6 |
| [24] |
ZHOU J, ROSSI J J. Therapeutic potential of aptamer- siRNA conjugates for treatment of HIV-1[J]. BioDrugs, 2012, 26(6): 393-400. DOI:10.1007/BF03261896 |



