2. 广西科学院, 广西壮族自治区海洋研究所, 广西海洋生物技术重点实验室, 广西北海 536000;
3. 广西科学院, 广西近海海洋环境科学重点实验室, 广西南宁 530007;
4. 广西海洋天然产物与组合生物合成化学重点实验室, 广西南宁 530007;
5. 广西民族大学海洋与生物技术学院, 广西南宁 530006
2. Guangxi Key Laboratory for Marine Biotechnology, Guangxi Institute of Oceanography, Guangxi Academy of Sciences, Beihai, Guangxi, 536000, China;
3. Guangxi Key Laboratory of Marine Environmental Science, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
4. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynthesis Chemistry, Nanning, Guangxi, 530007, China;
5. School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi, 530006, China
石斑鱼营养丰富,肉质肥美鲜嫩,是一种低脂肪、高蛋白的优质食用鱼类,是海水养殖最名贵的种类之一[1]。我国大部分种类的石斑鱼分布于南海,随着人工苗种繁育技术取得重大突破,苗种培育和成鱼养殖技术迅速发展,我国石斑鱼产业逐步进入规模化养殖阶段,2017年我国石斑鱼养殖总量超过13万吨,经济价值极高[2]。然而,伴随着石斑鱼养殖规模的迅速扩大,鱼类病毒性疾病暴发频繁,危害日益严重[1]。石斑鱼虹彩病毒(Grouper iridovirus)是一种高致病性的鱼类传染性病毒,导致我国的石斑鱼养殖业损失严重[3-4]。石斑鱼虹彩病毒可感染石斑鱼宿主细胞并诱导其发生明显的细胞病变效应,在被感染的石斑鱼细胞中可观察到直径约200 nm、呈六边形的病毒颗粒[5-8]。石斑鱼感染虹彩病毒后,会表现出典型的食欲不振和肝脾肿大等症状,最终导致鱼大量死亡[5]。因此,开发高效的抗病毒药物对控制石斑鱼虹彩病毒的感染、降低石斑鱼养殖业损失极为重要。先前有研究发现,对感染石斑鱼虹彩病毒的石斑鱼进行腹腔注射病毒灭活疫苗,可以对感染虹彩病毒的石斑鱼产生一定的保护作用[9]。但是全病毒灭活疫苗也有一定的缺点,例如病毒灭活可能不完全而导致鱼病的风险、操作繁琐和疫苗生产成本高等[10-11]。因此,开发绿色、高效的新型抗病毒渔用药物,对防治石斑鱼养殖中虹彩病毒的感染具有重要意义。我国在运用中草药预防和治疗病毒性疾病方面有着悠久的历史与丰富的经验。中草药大多具有天然、高效、价廉、毒副作用小、不易产生抗药性等特点,中草药中含有生物碱、苷类、糖类、有机酸、挥发油、黄酮类、氨基酸和多种常量及微量元素,这些成分既能补充动物营养,促进动物的生长,又具有抑菌、抗病毒、驱虫等免疫作用,同时还能增强机体的免疫和抗病能力,在水产养殖中得到越来越广泛的应用[12]。败酱草为我国传统中药,始载于《神农本草经》,属罂粟目菥蓂属植物,具有清热解毒、祛瘀排脓等多种功效。现代药理学研究证实,败酱草含有多种化学成分,具有抑菌、抗病毒等广泛的药理作用和很高的临床药用价值[13]。本研究采用败酱草水提取物对石斑鱼虹彩病毒的抗病毒活性进行研究,以期为开发绿色、高效、安全的抗石斑鱼虹彩病毒渔用药物提供理论依据。
1 材料与方法 1.1 材料本研究所使用的中药败酱草购于广西南宁一心大药房(产地为湖北十堰);石斑鱼虹彩病毒分离自广西人工养殖的珍珠龙胆石斑鱼(Grouper iridovirus isolated from Guangxi, SGIV-Gx);所用细胞为本实验室已建立并保存的石斑鱼脾脏组织细胞系(Grouper spleen cell line, GS);RT-qPCR所使用的石斑鱼虹彩病毒主要衣壳蛋白引物(Major capsid protein,MCP)和内参基因β-actin引物由上海生工合成;0.22 μm微孔滤柱购自Millipore公司;CCK-8活细胞检测试剂购自碧云天(上海)生物技术有限公司;RNA提取试剂盒、96孔细胞培养板以及12孔细胞培养板均购自康宁公司,胰酶购自Gibco公司,流式细胞仪购自美国BD公司。
1.2 方法 1.2.1 败酱草水提物的制备将败酱草粉碎成粉末。称取25 g粉末浸泡在水中,4℃浸泡12 h,然后将败酱草水溶液煎煮至100 mL,即败酱草水提取物浓度达到250 mg/mL,通过3层孔径为0.15 mm的无菌尼龙网布粗过滤得到败酱草粗水提物。将败酱草粗水提物12 000 g离心10 min,收集上清液,再用0.22 μm滤膜过滤得到败酱草水提物母液,-20℃保存备用。
1.2.2 细胞活力测定GS细胞接至96孔板中,在28℃恒温培养箱中培养。实验组的细胞分别与梯度稀释的败酱草水提物(1.25 mg/mL、2.50 mg/mL、5.00 mg/mL、10.00 mg/mL、20.00 mg/mL)进行孵育培养,无任何处理的GS细胞作为对照组(Control)。48 h后对细胞形态进行光镜观察,再除去细胞上清,用磷酸缓冲液(PBS)漂洗一次,然后每孔加入100 μL CCK-8稀释液(CCK-8:PBS=1:10),室温避光放置4 h,用酶标仪测定450 nm处的吸光值。细胞存活率按以下公式计算:细胞存活率=实验组OD450/对照组OD450×100%,每个处理3个重复。
1.2.3 病毒MCP基因表达的检测GS细胞接至12孔板中,在28℃恒温培养箱中培养18 h。实验组(Test)细胞中加入安全浓度的败酱草水提物和SGIV-Gx,感染48 h后用胰酶消化并收集细胞。用RNA提取试剂盒提取感染病毒的细胞总RNA,并将其反转录成cDNA;然后以cDNA为模板,β-actin基因作为内参基因,利用RT-qPCR技术检测MCP基因的表达量,此结果用于分析败酱草水提物对SGIV-GX病毒是否有抑制作用。本实验设置两个对照组:对照组1(Control 1)的细胞不做处理,对照组2(Control 2)细胞中仅加入SGIV-Gx。每个实验做3次重复。
1.2.4 基于核酸适配体Q5的荧光分子探针(Aptamer Q5-based fluorescent molecular probe assay, Q5-AFMP)的病毒检测已经有学者报道筛选获得特异性识别石斑鱼虹彩病毒感染的核酸适配体Q5[4],进而利用核酸适配体构建了荧光分子探针Q5-AFMP,用于石斑鱼虹彩病毒的高灵敏、高特异性检测诊断[14]。本研究利用Q5-AFMP检测石斑鱼虹彩病毒的感染。具体操作如下:首先将GS细胞接种于12孔板上,实验组(Test)细胞中加入安全浓度的败酱草水提物和SGIV-Gx,对照组1(Control 1)细胞不做处理,对照组2(Control 2)细胞中仅加入SGIV-Gx。48 h后收集各组细胞,分别与FAM标记的Q5探针在4℃下孵育30 min。然后用PBS洗涤两次后,将细胞沉淀重新悬浮于400 μL PBS中,利用流式细胞仪对各组细胞进行荧光值(495/535 nm)检测分析。
2 结果与分析 2.1 败酱草水提物的细胞工作浓度根据图 1a的光镜观察结果发现,不同浓度的败酱草提取物与GS细胞孵育培养48 h后, 对照组GS细胞无明显变化,而加入20.00 mg/mL、10.00 mg/mL和5.00 mg/mL的败酱草水提物的实验组GS细胞出现明显的形态变化和细胞病变,包括细胞变圆、皱缩、从细胞培养面上脱落等。2.50 mg/mL败酱草水提取物中的实验组细胞保持正常生长,与对照组细胞形态相比无明显变化。CCK-8溶液测定细胞活力结果显示,48 h后败酱草水提取物浓度为1.25 mg/mL和2.50 mg/mL组的实验组细胞存活率超过80%(图 1b)。结合光镜观察结果,将2.50 mg/mL作为败酱草水提取物的最高安全工作浓度。
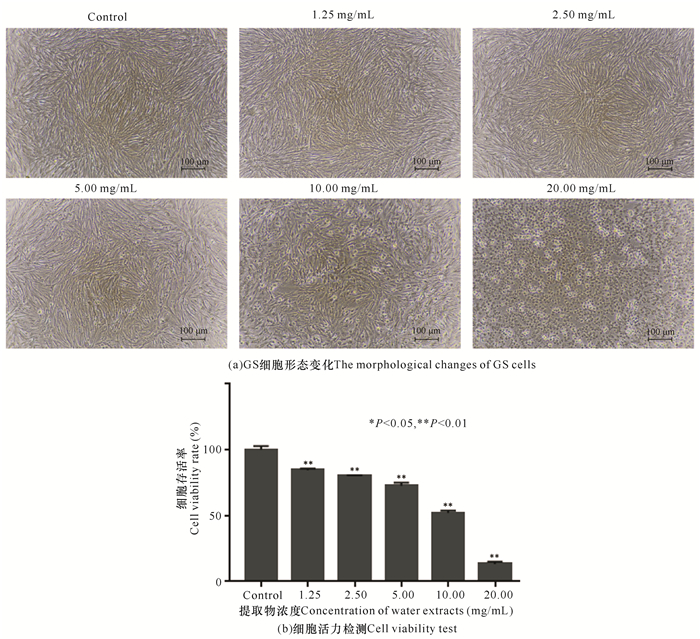
|
| 图 1 败酱草水提物安全工作浓度的确定 Fig.1 The determination of suitable working concentration of the water extracts of Thlaspi arvense Linn. |
2.2 败酱草水提物对石斑鱼虹彩病毒的抗病毒效果分析
本研究分别用光学显微镜观察、细胞活性测定、RT-qPCR和Q5-AFMP分析了败酱草水提物抗SGIV-Gx感染的抗病毒活性。
2.2.1 败酱草水提物抗病毒效果的光学显微镜观察对细胞的光镜观察结果(图 2)显示,加入石斑鱼虹彩病毒SGIV-Gx的GS细胞出现明显的细胞病变效应(箭头所示),而同时加入SGIV-Gx和细胞安全浓度的败酱草水提物(0.625 mg/mL、1.25 mg/mL和2.50 mg/mL)的细胞中,病毒感染导致的细胞病变显著减少。
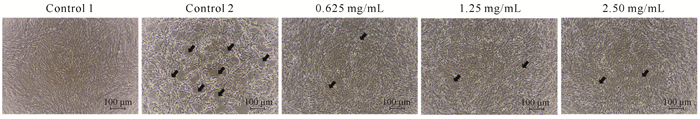
|
| 箭头所示为细胞病变效应 The arrow represents a cytopathic effect 图 2 光学显微镜观察结果 Fig.2 The observation results by optical microscopy |
2.2.2 败酱草水提物抗病毒效果的细胞活力试验分析
如图 3所示,细胞存活率测定结果表明,与仅加入SGIV-Gx的对照组2(Control 2)相比,实验组中同时加入SGIV-Gx和安全浓度的败酱草水提物(0.625 mg/mL、1.25 mg/mL和2.50 mg/mL),细胞存活率显著提高。
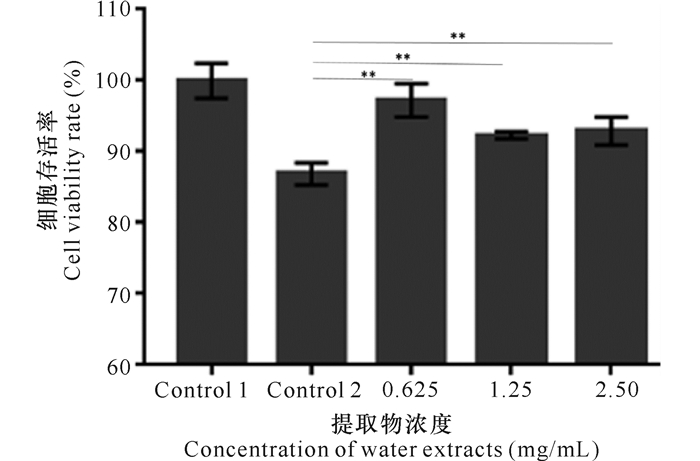
|
| *P < 0.05差异显著, **P < 0.01差异极显著 *P < 0.05 was considered significantly different, **P < 0.01 was considered extremely different 图 3 败酱草水提取物对SGIV-Gx感染的抑制作用的细胞活力试验分析 Fig.3 Evaluation on the inhibitory effects of the water extracts from Thlaspi arvense Linn.against SGIV-Gx infection by cell viability assay |
2.2.3 败酱草水提物抗病毒效果的RT-qPCR分析
如图 4所示,RT-qPCR技术检测MCP基因表达结果显示,与仅加入SGIV-Gx的对照组2细胞中MCP基因表达量相比,实验组细胞中同时加入SGIV-Gx和安全浓度梯度的败酱草水提物(0.625 mg/mL、1.25 mg/mL和2.50 mg/mL),MCP基因的表达量明显降低。
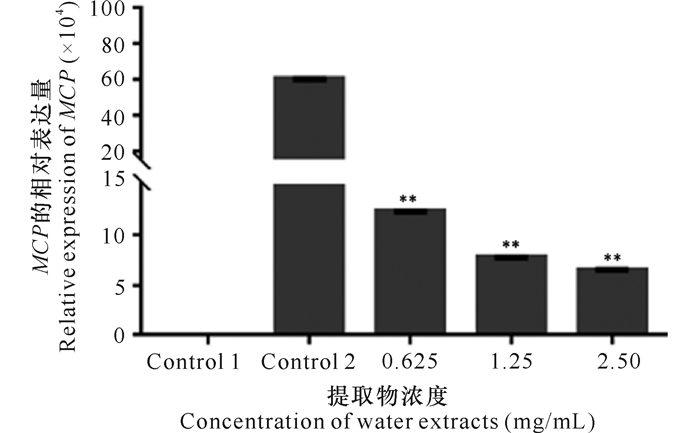
|
| *P < 0.05差异显著,**P < 0.01差异极显著 *P < 0.05 was considered significantly different, **P < 0.01 was considered extremely different 图 4 败酱草水提物的抗病毒效果的RT-qPCR分析 Fig.4 Evaluation on the antiviral effects of the water extracts from Thlaspi arvense Linn.against SGIV-Gx infection by RT-qPCR |
2.2.4 败酱草水提物抗病毒效果的Q5-AFMP分析
Q5-AFMP能够特异性识别SGIV-Gx感染的细胞,而且随着SGIV-Gx感染时间的延长、感染细胞数目的增加,流式细胞仪检测到的荧光值也持续增加[14]。如图 5所示,实验组细胞中同时加入SGIV-Gx和安全浓度梯度的败酱草水提物(0.625 mg/mL、1.25 mg/mL和2.50 mg/mL)孵育48 h后,将细胞与FAM-Q5孵育结合并使用流式细胞仪检测荧光值,结果显示,与仅加入SGIV-Gx的对照组相比,实验组的荧光值显著降低,说明败酱草水提物能有效抑制石斑鱼虹彩病毒的感染,这与光学显微镜观察、细胞活力测定和RT-qPCR检测方法的结果一致。

|
| *P < 0.05差异显著, **P < 0.01,差异极显著 *P < 0.05 was considered significantly different, **P < 0.01 was considered extremely different 图 5 败酱草水提物抗病毒效果的Q5-AFMP分析 Fig.5 Antiviral analysis of the water extracts from Thlaspi arvense Linn.against SGIV-Gx infection by Q5-AFMP assay |
3 讨论
水产疫病防控的原则是“以防为主,防治结合”[2]。渔用药物是控制水产疫病的主要手段。由于抗生素等化学药物会导致病原菌耐药性、威胁生态平衡等严重问题,因此亟需开发绿色、安全、高效的渔用药物。药用植物已有数千年的使用历史,广泛应用于多种疾病的治疗[15-16]。药用植物中含有种类繁多的天然活性成分,这些成分由于其结构多样化和生物活性多样化,能够通过分解破坏细菌细胞壁、影响病原遗传物质的合成、改变蛋白功能来抑制病原对宿主的侵染[12, 17]。据报道,药用植物具有抑菌、驱虫、抗病毒、促进养殖动物生长、增重、成熟和提高免疫力等诸多功能,而且在自然环境中容易降解,不会对生态环境造成污染破坏,因此利用药用植物活性成分研发天然植物源渔用药物是实现高效、绿色、无污染的水产高质化生态养殖的重要发展方向[18-19]。目前,世界各国学者开展了大量将药用植物提取物作为鱼类饲料添加剂来开发抗病害功能产品的系列研究[20-21]。
败酱草始载于《神农本草经》,含有黄酮类、三萜类、环烯醚萜类、挥发油类、有机酸类、甾醇类、香豆素类等多种活性成分,具有清热解毒、消痈排脓、祛瘀止痛等多种功效。近年来,学者对败酱草的研究越来越深入,发现其不仅含有丰富的化学成分还具有广泛的药理作用和临床应用,具有很高的药用价值,有研究已确定其主要有效成分为黄酮类、三萜皂苷类、环烯醚萜类、挥发油类、甾醇类和苯丙素类(香豆素类和木脂素类)等[22]。其中,香豆素类化合物基于其化学结构中的π-π共轭体系,能够通过多种非共价作用方式与靶标的活性位点结合,因此具有抗病毒[23]、抗肿瘤[24]、抗菌[25]等广泛的生物学活性。
石斑鱼虹彩病毒是严重危害我国石斑鱼养殖的一种病毒性病原,具有致病性强、致死率高的特点。目前,利用药用植物提取物开展抗石斑鱼虹彩病毒的研究还比较少。本文在近年来有关败酱草药效的研究基础上,首次提出使用中药败酱草水提物来对抗石斑鱼虹彩病毒,并利用多种方法分析研究了败酱草水提物对石斑鱼虹彩病毒的抗病毒效果,为进一步开发水产养殖抗病毒药物提供数据支持和理论依据。
细胞系作为实验动物的理想替代品,在研究发病机制、免疫学和生物技术发展方面得到了广泛的应用[26-29]。本研究首先利用石斑鱼脾脏组织细胞系分析败酱草水提物的安全工作浓度。结果(图 1)显示,败酱草水提物浓度高于5.00 mg/mL时,会导致细胞发生明显的细胞病变、细胞活力显著降低。这表明败酱草水提取物浓度高于5.00 mg/mL时对细胞具有明显毒性,而当败酱草水提物浓度低于2.50 mg/mL时,不会导致细胞形态发生明显变化,即败酱草水提物的细胞安全浓度为≤2.50 mg/mL。
在确定了败酱草水提取物的细胞安全工作浓度后,我们进一步分析败酱草提取物(0.625 mg/mL、1.25 mg/mL和2.50 mg/mL)对石斑鱼虹彩病毒的抑制活性。为保证结果的准确性和稳定性,我们分别采用光学显微镜观察(图 2)、细胞活力测定(图 3)、RT-qPCR技术(图 4)和基于核酸适配体Q5-AFMP技术(图 5)4种方法,在细胞水平检测败酱草水提物对石斑鱼虹彩病毒SGIV-Gx的抗病毒作用。4种方法的结果均表明,败酱草水提物能有效抑制石斑鱼虹彩病毒的感染,其中浓度为2.50 mg/mL的败酱草水提物具有最佳的抗病毒效果。而且,在本研究中我们创新性地利用Q5-AFMP技术评估败酱草水提物的抗病毒效果。Q5-AFMP技术的核心元件是核酸适配体。核酸适配体是一种新型的分子探针,具有易筛选获得、易于合成和修饰、高特异性和高亲和性识别并结合靶物质的优良性质。在先前的研究中以石斑鱼虹彩病毒为研究对象,基于细胞-指数富集配基系统进化技术(Cell-SELEX),以被虹彩病毒感染的石斑鱼细胞为靶标,利用Cell-SELEX技术筛选获得一系列ssDNA核酸适配体。筛选得到的核酸适配体具有诸多优良的特性,例如能够高特异性、高灵敏的识别虹彩病毒感染,在石斑鱼虹彩病毒感染宿主细胞2 h后就能够精确地检测到病毒感染,而且随着病毒感染时间越长,核酸适配体的结合量越多[30-33]。基于核酸适配体的这些特点,在先前的研究中已构建了核酸适配体的荧光分子探针检测技术AFMP,用于石斑鱼虹彩病毒的高灵敏、高特异性检测诊断[14]。本研究结果显示,Q5-AFMP技术检测结果与RT-qPCR检测结果一致,而Q5-AFMP技术与qPCR技术相比,操作简单、检测过程耗时短(≤1 h),因此基于核酸适配体的Q5-AFMP技术是一种有效的监测病毒感染、筛选抗病毒药物及评估药物抗病毒效果的方法。
4 结论本研究确定败酱草水提物的细胞安全浓度和适宜工作浓度,并且在宿主细胞水平分析了败酱草水提物对石斑鱼虹彩病毒的抗病毒作用,证明败酱草水提物对石斑鱼虹彩病毒具有良好的抗病毒效果,因此败酱草具有开发高效的抗病毒渔用药物的潜力。
| [1] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展[J]. 广西科学, 2018, 25(1): 15-25. |
| [2] |
张显良, 肖放, 李书民, 等. 2018中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2018.
|
| [3] |
LI P, YU Q, ZHOU L, et al. Probing and characterizing the high specific sequences of ssDNA aptamer against SGIV-infected cells[J]. Virus Research, 2018, 246: 46-54. DOI:10.1016/j.virusres.2018.01.006 |
| [4] |
LI P, WEI S, ZHOU L, et al. Selection and characterization of the novel DNA-aptamers specifically recognized Singapore grouper iridovirus infected fish cells[J]. Journal of General Virology, 2015, 96(11): 3348-3359. DOI:10.1099/jgv.0.000270 |
| [5] |
QIN Q W, CHANG S F. Characterization of a novel ranavirus isolated from grouper Epinephelus tauvina[J]. Diseases of Aquatic Organisms, 2003, 53(1): 1-9. |
| [6] |
CHAO C B, CHEN C Y, LAI Y Y, et al. Histological, ultrastructural, and in situ hybridization study on enlarged cells in grouper Epinephelus hybrids infected by grouper iridovirus in Taiwan (TGIV)[J]. Diseases of Aquatic Organisms, 2004, 58(2/3): 127-142. |
| [7] |
LU L, ZHOU S Y, CHEN C, et al. Complete genome se- quence analysis of an iridovirus isolated from the orange-spotted grouper, Epinephelus coioides[J]. Virology, 2005, 339(1): 81-100. DOI:10.1016/j.virol.2005.05.021 |
| [8] |
HUANG X, HUANG Y, XU L, et al. Identification and characterization of a novel lymphocystis disease virus isolate from cultured grouper in China[J]. Journal of Fish Diseases, 2015, 38(4): 379-387. DOI:10.1111/jfd.12244 |
| [9] |
OUYANG Z, WANG P, HUANG X, et al. Immunogenicity and protective effects of inactivated Singapore grouper iridovirus (SGIV) vaccines in orange-spotted grouper, Epinephelus coioides[J]. Developmental and Comparative Immunology, 2012, 38(2): 254-261. DOI:10.1016/j.dci.2012.07.004 |
| [10] |
DAVIS H L, MCCLUSKIE M J. DNA vaccines for viral diseases[J]. Microbes and Infection, 1999, 1(1): 7-21. DOI:10.1016/S1286-4579(99)80009-4 |
| [11] |
SOMMERSET I, KROSSOY B, BIERING E, et al. Vaccines for fish in aquaculture[J]. Expert Review of Vaccines, 2005, 4(1): 89-101. DOI:10.1586/14760584.4.1.89 |
| [12] |
YU Q, LIU M, XIAO H, et al. The inhibitory activities and antiviral mechanism of Viola philippica aqueous extracts against grouper iridovirus infection in vitro and in vivo[J]. Journal of Fish Diseases, 2019, 42(6): 859-868. DOI:10.1111/jfd.12987 |
| [13] |
LI Y, LI X, TIP P, et al. Use of a novel herbal medicine in a 75-year-old woman with multi-metastatic pancreatic cancer:A case report and review of the literature[J]. Oncology Letters, 2015, 10(1): 263-267. DOI:10.3892/ol.2015.3237 |
| [14] |
李鹏飞, 余庆, 李菲, 等. 基于新型核酸适配体-荧光分子检测探针的石斑鱼虹彩病毒病快速诊断[J]. 广西科学, 2018, 25(1): 63-67. |
| [15] |
SHI K Q, FAN Y C, LIU W Y, et al. Traditional Chinese medicines benefit to nonalcoholic fatty liver disease:A systematic review and meta-analysis[J]. Molecular Biology Reports, 2012, 39(10): 9715-9722. DOI:10.1007/s11033-012-1836-0 |
| [16] |
WANG L, YANG R, YUAN B, et al. The antiviral and antimicrobial activities of licorice, a widely-used Chinese herb[J]. Acta Pharmaceutica Sinica B, 2015, 5(4): 310-315. DOI:10.1016/j.apsb.2015.05.005 |
| [17] |
刘明珠, 肖贺贺, 余庆, 等. 黄连对广西卵形鲳鲹源溶藻弧菌的抑菌作用研究[J]. 广西科学院学报, 2019, 35(2): 119-123. |
| [18] |
吴淑勤, 王亚军. 我国水产养殖病害控制技术现状与发展趋势[J]. 中国水产, 2010(8): 9-10. DOI:10.3969/j.issn.1002-6681.2010.08.003 |
| [19] |
NEWAJFYZUL A, AUSTIN B. Probiotics, immunostimulants, plant products and oral vaccines, and their role as feed supplements in the control of bacterial fish diseases[J]. Journal of Fish Diseases, 2015, 38(11): 937-955. DOI:10.1111/jfd.12313 |
| [20] |
AWAD E, AWAAD A. Role of medicinal plants on growth performance and immune status in fish[J]. Fish & Shellfish Immunology, 2017, 67: 40-54. |
| [21] |
GALINA J, YIN G, ARDÓ L, et al. The use of immunostimulating herbs in fish.An overview of research[J]. Fish Physiology and Biochemistry, 2009, 35(4): 669-676. DOI:10.1007/s10695-009-9304-z |
| [22] |
张一芳. 败酱草研究进展[J]. 中药材, 2009, 32(1): 148-152. DOI:10.3321/j.issn:1001-4454.2009.01.051 |
| [23] |
BATISTIC ' I, STOJANOVSKI J.Nucleoside coumarin derivatives: Synthesis, antiviral and antitumor activity evaluation[C].Hrvatska Znanstvena Bibliografija I Mzos-svibor, 2012.
|
| [24] |
SALEM M A, MARZOUK M I, EL-KAZAK A M. Synthesis and characterization of some new coumarins with in vitro antitumor and antioxidant activity and high protective effects against DNA damage[J]. Molecules, 2016, 21(2): 249. DOI:10.3390/molecules21020249 |
| [25] |
DANDRIYAL J, SINGLA R, KUMAR M, et al. Recent developments of C-4 substituted coumarin derivatives as anticancer agents[J]. European Journal of Medicinal Chemistry, 2016, 119(30): 141-168. |
| [26] |
ZHOU L, LI P, LIU J, et al. Establishment and characterization of a mid-kidney cell line derived from golden pompano Trachinotus ovatus, a new cell model for virus pathogenesis and toxicology studies[J]. In Vitro Cellular & Developmental Biology - Animal, 2016, 53(4): 320-327. |
| [27] |
余庆, 李菲, 覃仙玲, 等. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析[J]. 广西科学, 2018, 25(1): 74-79. |
| [28] |
LI P, ZHOU L, NI S, et al. Establishment and characterization of a novel cell line from the brain of golden pompano (Trachinotus ovatus)[J]. In Vitro Cellular & Developmental Biology-Animal, 2016, 52(4): 410-418. |
| [29] |
LI P, ZHOU L, WEI S, et al. Establishment and characterization of a cell line from the head kidney of Golden pompano Trachinotus ovatus and its application in toxicology and virus susceptibility[J]. Journal of Fish Biology, 2017, 90(5): 1944-1959. DOI:10.1111/jfb.13277 |
| [30] |
DUAN N, WU S J, WANG Z P, et al. An aptamer-based fluorescence assay for Ochratoxin A[J]. Chinese Journal of Analytical Chemistry, 2011, 39(3): 300-304. DOI:10.1016/S1872-2040(10)60423-9 |
| [31] |
LI P, YAN Y, WEI S, et al. Isolation and characterization of a new class of DNA aptamers specific binding to singapore grouper iridovirus (SGIV) with antiviral activities[J]. Virus Research, 2014, 188: 146-154. DOI:10.1016/j.virusres.2014.04.010 |
| [32] |
YU Q, LIU M, WEI S, et al. Characterization of ssDNA aptamers specifically directed against Trachinotus ovatus NNV (GTONNV)-infected cells with antiviral activities[J]. Journal of General Virology, 2019, 100(3): 380-391. DOI:10.1099/jgv.0.001226 |
| [33] |
ZHOU L, LI P, YANG M, et al. Generation and characterization of novel DNA aptamers against coat protein of grouper nervous necrosis virus (GNNV) with antiviral activities and delivery potential in grouper cells[J]. Antiviral Research, 2016, 129: 104-114. DOI:10.1016/j.antiviral.2016.02.009 |



