2. 上海海洋大学农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306;
4. 广西壮族自治区海洋研究所, 广西海洋生物技术重点实验室, 广西北海 536000
2. Key Laboratory of Aquaculture Ministry for Freshwater Aquatic Genetic Resources, Shanghai Ocean University, Shanghai, 201306, China;
3. National Experimental Teaching Demonstration Center for Fishery Sciences, Shanghai Ocean University, Shanghai, 201306, China;
4. Guangxi Key Lab for Marine Biotechnology, Guangxi Institute of Oceanography, Beihai, Guangxi, 536000, China
Grass carp reovirus-104 (GCRV-104)是草鱼Ⅲ型呼肠孤病毒的代表株也是其唯一成员,2009年分离于湖北一养殖场患病草鱼[1]。与以GCRV873为代表株的草鱼Ⅰ型呼肠孤病毒相比,GCRV-104不编码时能够使感染细胞膜融合形成合胞体的FSAT蛋白,而编码后能负责吸附识别宿主的纤维样蛋白VP55,同时二者在毒性以及感染特性方面也存在较大的差异[2]。VP38是由GCRV-104 s10片段编码的大小为346 aa的外衣壳蛋白,作为GCRV外衣壳蛋白的主要成分之一,有保护病毒粒子、维持结构稳定的作用[3]。序列分析表明VP38与Ⅱ型GCRVs11编码的VP35和Ⅰ型GCRVs10编码的VP7为同源蛋白,均含有保守的CxxC-n16-HxC锌结合基序(Zinc-binding motif),该基序负责与另外一个外衣壳蛋白相互作用[4];此外MRV和ARVs10编码的蛋白与VP38在N端具有相同的亲水性谱,呈疏水-亲水-疏水-亲水的顺序[1]。
草鱼Ⅰ型呼肠孤病毒外衣壳蛋白由VP5和VP7组成,三维结构显示,两者在病毒颗粒中呈现相同的等价比,即各由200个三聚体亚单位组成,且VP5组分的含量在衣壳蛋白中所占的比例最大[5]。本实验室前期利用酵母双杂交技术以及Dot Blot等技术验证了VP5与VP7在体外的相互作用[6]。利用胰蛋白酶和糜蛋白酶对草鱼Ⅰ型呼肠孤病毒颗粒进行酶解实验的结果表明,病毒颗粒的VP7蛋白经消化后,能够明显提高病毒的感染效率,推测相对于VP7蛋白,VP5蛋白在病毒感染过程中起到识别和吸附缩主的作用[4];有研究者利用酵母双杂交系统对能够与VP7相互作用的宿主蛋白进行筛选,发现核糖体蛋白S20(RPS20)以及真核翻译起始因子3亚基b((eIF3b)与VP7存在潜在的相互作用,但该研究仅利用生物信息学分析进一步预测了VP7与这两种蛋白之间的相互作用,并未通过其他有说服力的实验进行深入的验证[7]。相对于草鱼Ⅰ型及Ⅱ型呼肠孤病毒,草鱼Ⅲ型呼肠孤病毒分离时间较晚,且研究相对滞后,对外衣壳蛋白VP38的研究尚不深入。
在前期的研究中,我们利用酵母双杂交系统筛选了能与GCRV-104夹层蛋白VP6和外衣壳蛋白VP38相互作用的宿主蛋白[8],发现VP38与宿主可能存在相互作用的蛋白有:剪切与多聚腺苷酸化特异性因子5(CPSF5)、高迁移率组蛋白核小体结合结构域2(HMGN2)、葡萄糖转运体X(GLUTX)和蛋白酶体β2亚基(PSMB7);后期的定向酵母双杂交实验也证实了VP38与PSMB7之间的相互作用。为了深入开展VP38蛋白的功能研究,本研究在原核表达系统中诱导表达了重组His-VP38蛋白,并免疫小鼠制备多克隆抗体,获得了具有较高效价以及较好特异性的多克隆抗体,为后续的研究工作做了良好的铺垫,同时该研究也为构建草鱼Ⅲ型呼肠孤病毒的免疫学检测方法提供了良好的技术路线。
1 材料与方法 1.1 材料 1.1.1 试剂与耗材PrimeSTARⓇ Max DNA Polymerase,DNA Ligation Kit(Mighty Mix),限制性内切酶等均购自TAKARA;WizardⓇ SV Gel and PCR Clean-Up System试剂盒、WizardⓇ Plus SV Minipreps DNA Purification Systems试剂盒购自Promega公司;Bradford蛋白浓度测定试剂盒、尿素、水合氯醛购自生工生物工程(上海)股份有限公司;2×SDS-PAGE蛋白上样缓冲液、考马斯亮蓝快速染色液购自碧云天生物技术有限公司。
1.1.2 实验动物4只8周龄Babl/c小鼠购自虔碧生物科技(上海)有限公司,暂养于本实验室动物房。所有动物操作均遵守实验动物福利操作技术规范[9]。
1.1.3 细胞与病毒株GCRV-104病毒株由中国水产科学研究院长江水产研究所曾令兵研究员惠赠;草鱼肾脏(Ctenopharyngodon idellus kidney,CIK)细胞系及草鱼性腺(Grass carp ovary,GCO)细胞系保存于上海海洋大学国家水生动物病原库;大肠杆菌感受态DH5α、BL21(DE3)购自上海近岸生物科技有限公司。
1.2 方法 1.2.1 基因的扩增及重组质粒的构建根据草鱼Ⅲ型呼肠孤病(GCRV-104)的s10片段基因序列,使用Primer Premier 5.0软件设计ORF上游引物与下游引物,并分别插入限制性酶切位点和保护性碱基(引物序列见表 1);PCR反应为50 μL体系,其中2×PrimeSTAR Max Premix 25 μL,上下游引物各1 μL(浓度为10 nmol/L),cDNA模板(GCRV-104感染的CIK细胞cDNA为模板)1 μL,无菌水22 μL;按照98℃预变性3 min,98℃、10 s,55℃、5 s,72℃、5 s,35个循环的程序进行PCR;用1%琼脂糖凝胶电泳对PCR产物进行分析;利用WizardⓇ SV Gel and PCR Clean-Up System对与目的基因大小一致的阳性条带进行割胶回收。
| 引物名称 Primer name |
序列 Sequence |
酶切位点 Cutting site |
应用 Application |
| pET28a-VP38-F | CCG GAATTC ATGGAGACCCCACGCTTACC | EcoRⅠ | 原核表达 Prokaryotic expression |
| pET28a-VP38-R | CCC AAGCTT GTGAACCCTCCTACTCACCC-AG | Hind Ⅲ | 原核表达 Prokaryotic expression |
| pEGFP-N1-VP38-F | CCC AAGCTT ATGGAGACCCCACGCTTACC | Hind Ⅲ | 真核表达 Eukaryotic expression |
| pEGFP-N1-VP38-R | CGG GGTACC GAACCCTCGTACTCACCCAG | Kpn Ⅰ | 真核表达 Eukaryotic expression |
| 注:斜体碱基代表对应的酶切位点 Note:The italic part of the sequence represents the corresponding enzyme cutting site |
|||
pET-28a-VP38与pEGFP-N1-VP38的重组质粒按照传统双酶切的方法进行构建;将纯化后的PCR产物以及pET-28a、pEGFP-N1载体使用表 1中所列的限制性内切酶进行酶切反应,37℃酶切1 h;对酶切产物进行纯化回收,回收后的目的片段和载体质粒使用DNA Ligation Kit试剂盒16℃连接30 min;将10 μL连接产物转化入E.coli DH5α感受态细胞中,涂到含有卡那霉素(Kan+)的LB平板筛选阳性菌落,对阳性菌落微量(1 mL)扩增3 h后进行PCR检测,对PCR验证正确的阳性菌大量扩增并使用WizardⓇ Plus SV Minipreps DNA Purfication System试剂盒提取重组质粒,送测序鉴定。
1.2.2 蛋白的诱导表达及可溶性分析将测序验证后的pET-28a-VP38重组质粒转化至BL21感受态细胞中,涂布至LB (Kan+)平板筛选阳性克隆,利用微量移液器挑取单菌落到1 mL LB(Kan+)液体培养基中,37℃、150 r/min恒温摇床培养过夜。将培养菌液转移至新鲜的20 mL LB(Kan+)液体培养基中,37℃、150 r/min恒温摇床培养5 h后,菌液中加入20 μL 1 mol/L IPTG (Isopropyl β-D-Thiogalactoside)(培养液中IPTG终浓度为1 mmol/L)诱导蛋白表达;37℃、150 r/min恒温摇床培养5 h后,收集菌体沉淀;4℃、8 500 r/min离心20 min,弃上清;用1×Phosphate buffer saline Tween-20 (PBST)溶液重悬洗涤1次,离心弃去上清。将菌体在-80℃冷冻30 min后,在室温中融化,反复冻融3次;冻融后的菌体中加入20 mL Phosphate buffer saline (PBS)重悬,并加入Phenylmethanesulfonyl fluoride (PMSF)使其终浓度达到工作浓度(100 μg/mL)。将重悬的菌液在冰上进行超声破碎(超声6 s间隔6 s,功率300 W),直至溶液澄清;4℃、8 500 r/min离心20 min,分别收集上清和沉淀。蛋白诱导表达过程中应在加入IPTG诱导剂之前、诱导5 h后分别取200 μL菌液离心,弃上清后加入20 μL 2×SDS-PAGE上样缓冲液制样,同时取裂解后上清20 μL,并加入20 μL 2×SDS-PAGE上样缓冲液制样,进行SDS-PAGE凝胶电泳,并使用考马斯亮蓝染色分析目的蛋白的表达情况及可溶性。
1.2.3 利用尿素溶液溶解包涵体蛋白将尿素溶解于PBS中配制浓度为8 mol/L的尿素溶液。对于超声裂解后离心得到的沉淀,先使用PBS重悬,冰上摇动20 min,8 500 r/min离心20 min,弃上清收集沉淀。在沉淀中加入5 mL 8 mol/L尿素,使用微量移液器反复吹打重悬直至沉淀完全溶解,冰上摇动20 min,8 500 r/min离心20 min,收集上清,并取20 μL制样,进行SDS-PAGE凝胶电泳,并使用考马斯亮蓝染色分析目的蛋白在8 mol/L尿素中的溶解性;使用Bradford蛋白浓度测定试剂盒测定蛋白浓度。
1.2.4 实验动物的免疫以及多克隆抗体的收集使用溶解于8 mol/L尿素的目的蛋白免疫小鼠,每只小鼠免疫目的蛋白的质量约为200 μg。首次免疫时,将目的蛋白溶液与等体积的弗氏完全佐剂混合,并利用一次性注射器完全乳化,在小鼠腹腔内注射;第2次与第3次免疫时,使用弗氏不完全佐剂与目的蛋白溶液混合乳化,腹腔注射;第4次直接腹腔注射目的蛋白溶液。每次腹腔注射免疫间隔1周,期间注意观察小鼠的生理状态。最后一次免疫3~4 d后,对小鼠腹腔注射10%(W:V)水合氯醛溶液(水合氯醛稀释于生理盐水中,按每20 g小鼠体重100 μL的剂量)进行麻醉处理;待小鼠深度麻醉后,进行眼角取血,将全血在37℃放置2 h,4℃静置过夜,离心收集血清,取少量保存于4℃用于后续实验,其他-20℃保存备用。
1.2.5 病毒感染与样品收集草鱼CIK细胞传至12孔细胞培养板,至细胞单层铺满后,使用无血清M199稀释GCRV-104病毒,使感染复数MOI=10;27℃孵育细胞过夜后,换含有10%(W:V)胎牛血清、青霉素100 U/mL、链霉素0.1 mg/mL的M199完全培养基,每12 h收集细胞样品(移去培养基后,每孔加入50 μL 2×SDS-PAGE蛋白上样缓冲液,使用细胞刮刀将贴壁细胞完全刮下,转移至1.5 mL离心管中,-20℃保存)。
1.2.6 VP38的亚细胞定位将草鱼GCO细胞传至12孔细胞培养板中,至细胞单层铺满60%~90%左右,利用Lipofectamine 3000转染试剂盒将1 μg pEGFP-N1-VP38质粒转染至GCO细胞中;27℃培养24 h后,移去培养基,使用灭菌的PBS漂洗一遍,4%(W:V)多聚甲醛固定10 min,PBS漂洗2次,每次10 min;免疫染色通透液(碧云天生物技术有限公司)处理10 min,PBS漂洗2次,每次10 min;5 μg/mL DAPI(4', 6-diamidino-2-phenylindole)染色液处理10 min,PBS漂洗3次,每次10 min;使用奥林帕斯IX17荧光显微镜对样品进行图片采集及处理。
1.2.7 免疫印迹法(Western blot)分析蛋白样品在100℃变性5 min后,进行SDS-PAGE电泳,然后采用湿转法转至PVDF(polyvinylidene fluoride)膜上,用含5%(W:V)脱脂牛奶的PBST溶液室温震荡封闭1 h;实验制备的多克隆抗体1:5 000稀释于含有2.5%(W:V)脱脂牛奶的PBST溶液中,室温孵育2 h或4℃过夜;用PBST溶液漂洗5次,每次5 min;HRP(Horse radish peroxidase)标记的羊抗鼠的IgG单克隆抗体(ABmart)作为二抗1:5 000稀释于含有2.5%脱脂牛奶的PBST溶液中,室温孵育2 h或37℃孵育1 h;PBST漂洗7次,每次5 min;使用天能ECL化学发光成像系统对PVDF膜进行信号捕获和图片处理。
1.2.8 间接免疫荧光分析(IFA)GCRV-104感染CIK细胞72 h后,移去培养基,PBS漂洗2次;4%(W:V)多聚甲醛固定10 min,PBS漂洗2次,每次10 min;免疫染色通透液处理10 min,PBS漂洗2次,每次10 min;含5%脱脂牛奶的PBS溶液室温封闭1 h;实验制备的鼠抗VP38多克隆抗体1:500稀释于含有2.5%脱脂牛奶的PBS溶液中,室温孵育2 h或4℃过夜;用PBS溶液漂洗5次,每次5 min;红色荧光标记的羊抗鼠单克隆抗体(ABmart)1:500稀释于含有2.5%脱脂牛奶的PBS溶液中,室温孵育2 h或37℃孵育1 h;PBS漂洗4次,每次5 min;5 μg/mL DAPI染色液处理10 min,PBS漂洗3次,每次10 min;使用奥林帕斯IX17荧光显微镜对样品进行图片采集及处理。
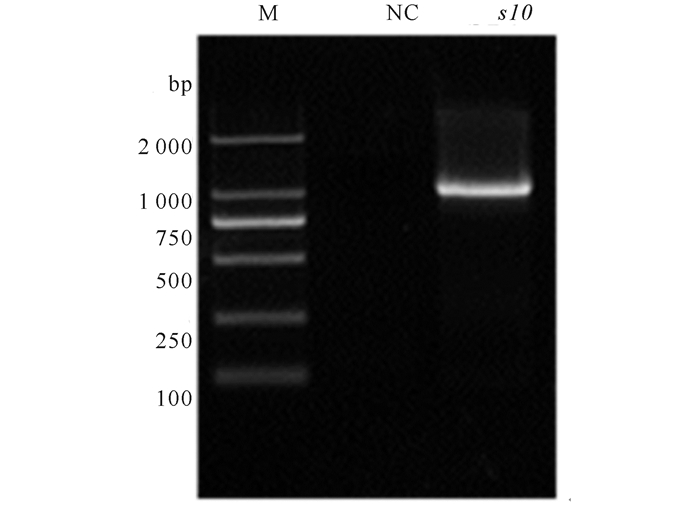
2 结果与分析 2.1 基因的扩增与质粒的构建利用RT-PCR技术成功获得相应的基因片段,1%(W:V)琼脂糖凝胶电泳结果显示扩增VP38的样品在约1 000 bp处出现一条特异性条带,与GCRV-104 s10片段编码VP38的ORF(1 041 bp)大小一致(图 1);重组质粒pET-28a-VP38以及pEGFP-N1-VP38的测序结果表明两个重组质粒插入片段序列及酶切位点序列完全正确,无突变或移码现象,可用于后续实验。
|
| M:DL2000 Maker; NC: 阴性对照; s10: GCRV-104 s10 基因序列 M: DL2000Maker; NC: Necgetivecontrol; s10: GCRV-104 s10 gen esequence 图 1 扩增产物电泳图 Fig.1 Electropherogram of amplification product |
2.2 重组蛋白的诱导表达及可溶性分析
VP38重组蛋白样品经10% SDS-PAGE凝胶电泳后使用考马斯亮蓝染色分析。相对于未诱导的菌体样品,经IPTG诱导的菌体样品在48~35 kDa出现一条明显的条带;而超声裂解后的离心上清中在此处没有明显的条带,因此重组His-VP38蛋白主要以包涵体的形式存在;在8 mol/L尿素中,His-VP38包涵体蛋白能够良好溶解,且主条带明显杂带较少(图 2)。

|
| 图 2 重组蛋白His-VP38的诱导表达及可溶性分析 Fig.2 Induced expression and soluble analysis of recombinant protein His-VP38 |
2.3 多克隆抗体的分析
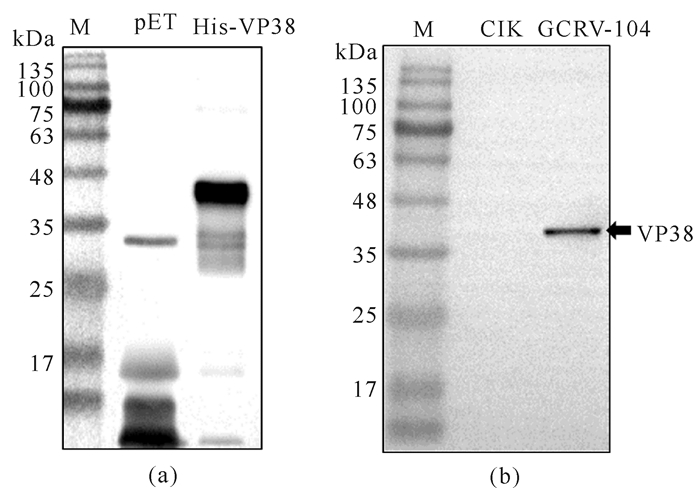
Western blot检测结果显示本实验制备的鼠抗VP38多克隆抗体在稀释比例为1:5 000时,既能识别原核表达的His-VP38重组蛋白,也能够特异性识别CIK细胞感染GCRV-104 72 h后合成的病毒蛋白VP38 (图 3),表明本实验制备的鼠抗VP38多克隆抗体具有较高的效价和较好的特异性。
|
| (a)鼠抗VP38多克隆抗体可识别原核表达的His-VP38蛋白;(b)鼠抗VP38多克隆抗体可识别感染GCRV-104的CIK样品中的VP38蛋白 (a)Mouse anti-VP38 polyclonal antibody can recognize His-VP38 protein expressed in prokaryotes; (b)Mouse anti-VP38 polyclonal antibody recognizes VP38 protein in CIK samples infected with GCRV-104 图 3 鼠抗VP38多克隆抗体的分析 Fig.3 Analysis of mouse anti-VP38 polyclonal antibody |
2.4 VP38在GCRV-104感染过程中翻译水平的表达动力学
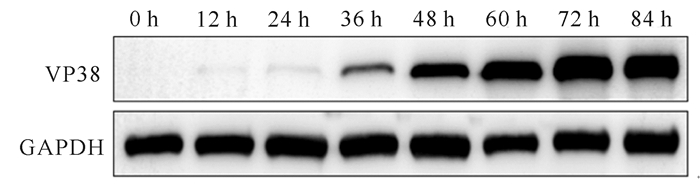
分别在GCRV-104感染CIK细胞0 h,12 h,24 h,36 h,48 h,60 h,72 h,84 h取细胞蛋白样品,利用实验制备的鼠抗VP38多克隆抗体和商品化内参抗体鼠抗GAPDH单克隆抗体(Santa Cruz Biotechnology)进行Western blot检测,结果显示在GCRV-104感染后12 h VP38即出现了微量的表达,但在36 h后才随着感染时间的延长表达量逐渐增高(图 4)。
|
| 图 4 VP38在GCRV-104感染过程中的表达动力学 Fig.4 Expression dynamics of VP38 during GCRV-104 infection |
2.5 间接免疫荧光分析(IFA)
间接免疫荧光结果显示(图 5),感染GCVR-104病毒72 h后的草鱼CIK细胞出现特异性的荧光信号,而未感染病毒的正常细胞则无荧光信号;VP38蛋白主要分布于细胞质内;IFA的结果也表明本研究制备的鼠抗VP38多克隆抗体具有较高的效价以及较好的特异性。

|
| 图 5 GCRV-104感染CIK细胞样品的间接免疫荧光分析 Fig.5 Indirect immunofluorescence analysis of GCRV-104 infected CIK cells with mouse anti-VP38 polyclonal antibody |
2.6 VP38在GCO细胞中的亚细胞定位
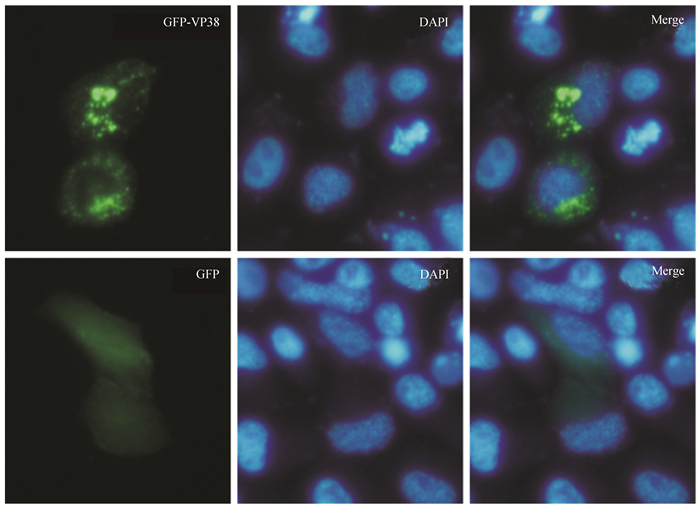
在GCO细胞中转染pEGFP-N1-VP38质粒24 h后,对细胞核进行DAPI染色,在荧光显微镜下拍照并利用配套的软件对图片进行处理。结果显示,GFP-VP38蛋白主要分布在细胞质中,局部有高表达(图 6),该结果与IFA实验结果基本一致。
|
| 图 6 GFP-VP38在GCO细胞中的亚细胞定位 Fig.6 Subcellular localization of GFP-VP38 in GCO cells |
3 讨论
病毒入侵宿主的过程,是宿主与病毒之间的博弈。作为具有细胞结构的高等生物,在亿万年与病原体的“军备竞赛”中,无论原核生物还是真核生物,都进化出了复杂的抗病毒免疫系统,依赖这些抗病毒系统,宿主能够将病毒清除保证个体的健康[10];而作为体型较小,看起来较为弱势的病毒,却又能通过一些狡猾的手段逃避这些抗病毒机制,最终取得博弈的胜利[10-11]。作为主要的生物功能的执行者,蛋白质及其之间的相互作用对于各种生物学进程至关重要。目前已经鉴定的草鱼来源的呼肠孤病毒其编码的蛋白也仅有10~13个[3, 12-13],在病毒与宿主的博弈中,病毒蛋白与宿主蛋白之间必定存在纷繁复杂的相互作用,而各个病毒蛋白也必定通过与宿主的相互作用承担着多种多样生物学功能。为了保证顺利复制、装配和传播,病毒会编码一些非结构蛋白在病毒感染复制过程中行使重要的调控作用[14-18];而结构蛋白除了组成病毒颗粒的特定结构外,也会行使一些特定的生物学功能,Wang等[19]发现VP5能够与细胞表面的LamR分子相互作用,而利用抗体封闭LamR后能够降低GCRV病毒的感染,该结果也一定程度上证实了VP5在识别宿主方面的功能;VP7通过与VP5形成三聚体复合物,构建了病毒粒子外层的三聚体网络,维持病毒粒子的稳定性[5],同时保护病毒粒子[4];除了黏附以及识别受体外,VP55和VP56还是类泛素化系统中SUMO连接酶Ubc9的底物,病毒可能利用类泛素化修饰保证了病毒的正常复制[20-21];本实验室近期的研究结果也显示,一种细胞外基质蛋白Fibulin-4能够与VP7、VP56以及VP55相互作用。这些证据都说明了除了行使结构上的功能外,草鱼呼肠孤病毒的外衣壳蛋白还具有一些特定的生物学功能。
目前对于草鱼的3种呼肠孤病毒的外衣壳蛋白质研究主要集中在其结构上的功能、宿主细胞受体的识别以及在免疫学检测方法的构建[4-7, 22],对于其在病毒感染过程中执行的生物学功能缺乏深入的研究。尽管有学者利用酵母双杂交系统筛选了能与草鱼Ⅰ型呼肠孤病毒的外衣壳蛋白VP7以及草鱼Ⅱ型呼肠孤病毒外衣壳蛋白VP35相互作用的宿主蛋白,但相关的结果并未利用其他实验进行验证,也并未深入探究外衣壳蛋白与宿主蛋白相互作用对病毒或者宿主产生的影响[7]。前期的研究中,我们在酵母双杂交系统发现VP38与PSMB7之间的相互作用,尽管酵母双杂交是一种比较可靠且较为灵敏的蛋白互作系统,但也具有假阳性率高的缺点[23]。为了深入开展VP38蛋白的功能研究,本研究制备了具有较高效价以及较好特异性的鼠抗VP38多克隆抗体,利用该抗体我们同时探究了GCRV-104感染CIK细胞后VP38在翻译水平上的表达动力学,VP38在感染后12 h即出现了微量的表达,12~24 h间并未出现明显的增加,直到36 h后才随着感染进程表达量逐步增高,因此我们推测前期表达的微量蛋白可能执行了一些调控功能,而后期大量表达的VP38蛋白则用于病毒颗粒的组装。
除了国内分离的3种基因型的草鱼呼肠孤病毒病外,再加上由美国分离的AGCRV-PB01-155/PB04-123/PB04-151等[12],能够感染草鱼的呼肠孤病毒总共可分为4类群。不同基因型草鱼呼肠孤病毒间基因组序列同源性较低[3],在病毒毒力、感染特性上具有较大的差异[24-27],但能够出现混合感染的情况[28],因此区分病原,选择合适的草鱼出血病疫苗等防控方法,对于草鱼出血病的防控具有重要意义。外衣壳蛋白处于病毒颗粒的最外侧,且相对于其他病毒蛋白表达量较高,因此常常作为开发亚单位疫苗[29]、构建免疫学检测方法的首选目标。本研究通过制备鼠抗VP38多克隆抗体,构建了一种草鱼Ⅲ型呼肠孤病毒的免疫学检测方法,对于草鱼出血病病原的区分以及疾病防控具有一定的意义。
| [1] |
FAN Y, RAO S, ZENG L, et al. Identification and genomic characterization of a novel fish reovirus, Hubei grass carp disease reovirus, isolated in 2009 in China[J]. Journal of General Virology, 2013, 94(Pt10): 2266-2277. |
| [2] |
NIBERT M L, DUNCAN R. Bioinformatics of recent aqua- and orthoreovirus isolates from fish:Evolutionary gain or loss of fast and fiber proteins and taxonomic implications[J]. PLoS ONE, 2013, 8(7): e68607. DOI:10.1371/journal.pone.0068607 |
| [3] |
FANG Q, SENG E K, DING Q Q, et al. Characterization of infectious particles of grass carp reovirus by treatment with proteases[J]. Archives of Virology, 2008, 153(4): 675-682. DOI:10.1007/s00705-008-0048-3 |
| [4] |
PEI C, KE F, CHEN Z Y, et al. Complete genome sequence and comparative analysis of grass carp reovirus strain 109 (GCReV-109) with other grass carp reovirus strains reveals no significant correlation with regional distribution[J]. Archives of Virology, 2014, 159(9): 2435-2440. DOI:10.1007/s00705-014-2007-5 |
| [5] |
QIN F, SHAH S, LIANG Y, et al. 3D reconstruction and capsid protein characterization of grass carp reovirus[J]. Science in China Series C:Life Sciences, 2005, 48(6): 593-600. DOI:10.1360/062004-105 |
| [6] |
LIU W, WANG H, YU F, et al. Grass carp reovirus outer capsid proteins VP5 and VP7 interact in vitro[J]. Archives of Virology, 2017, 162(8): 2375-2380. DOI:10.1007/s00705-017-3354-9 |
| [7] |
YAN X, XIE J, LI J, et al. Screening and analysis on the protein interaction of the protein VP7 in grass carp reovirus[J]. Virus Genes, 2015, 50(3): 425-433. DOI:10.1007/s11262-015-1193-x |
| [8] |
王龙龙, 邱军强, 喻飞, 等. 利用酵母双杂交技术筛选草鱼Ⅲ型呼肠孤病毒VP6和VP38相互作用蛋白的研究[J]. 生物学杂志, 2018, 35(4): 16-20. DOI:10.3969/j.issn.2095-1736.2018.04.016 |
| [9] |
英国纽卡斯尔大学.实验动物福利操作技术规范网站[EB/OL].[2019-04-18].http://pwc.cnilas.org/.
|
| [10] |
YOULIANG R, JIANGUO S. Insights into the antiviral immunity against grass carp (Ctenopharyngodon idella) reovirus (GCRV) in grass carp[J]. Journal of Immunology Research, 2015, 670437. DOI:10.1155/2015/670437 |
| [11] |
GACK M U, DIAMOND M S. Innate immune escape by Dengue and West Nile viruses[J]. Current Opinion in Virology, 2016, 20: 119-128. DOI:10.1016/j.coviro.2016.09.013 |
| [12] |
JAAFAR F M, GOODWIN A E, BELHOUCHET M, et al. Complete characterisation of the American grass carp reovirus genome (genus Aquareovirus:Family Reoviridae) reveals an evolutionary link between aquareoviruses and coltiviruses[J]. Virology, 2008, 373(2): 310-321. DOI:10.1016/j.virol.2007.12.006 |
| [13] |
WANG Q, ZENG W, LIU C, et al. Complete genome sequence of a reovirus isolated from grass carp, indicating different genotypes of GCRV in China[J]. Journal of Virology, 2012, 86(22): 12466. DOI:10.1128/JVI.02333-12 |
| [14] |
LU J, WANG H, ZHANG Y, et al. Grass carp reovirus NS26 interacts with cellular lipopolysaccharide-induced tumor necrosis factor-alpha factor, LITAF[J]. Virus Genes, 2016, 52(6): 789-796. DOI:10.1007/s11262-016-1370-6 |
| [15] |
GUO H, SUN X, YAN L, et al. The NS16 protein of aquareovirus-C is a fusion-associated small transmembrane (FAST) protein, and its activity can be enhanced by the nonstructural protein NS26[J]. Virus Research, 2013, 171(1): 129-137. |
| [16] |
CAI L, SUN X, SHAO L, et al. Functional investigation of grass carp reovirus nonstructural protein NS80[J]. Virology Journal, 2011, 8(1): 168. |
| [17] |
ZHANG J, GUO H, CHEN Q, et al. The N-terminal of aquareovirus NS80 is required for interacting with viral proteins and viral replication[J]. PLoS ONE, 2016, 11(2): e0148550. DOI:10.1371/journal.pone.0148550 |
| [18] |
LU L F, LI S, WANG Z X, et al. Grass carp reovirus VP41 targets fish MITA to abrogate the Interferon Response[J]. Journal of Virology, 2017, 91(14): JVI.00390-17. DOI:10.1128/JVI.00390-17 |
| [19] |
WANG H, YU F, LI J, et al. Laminin receptor is an interacting partner for viral outer capsid protein VP5 in grass carp reovirus infection[J]. Virology, 2016, 490: 59-68. DOI:10.1016/j.virol.2016.01.011 |
| [20] |
YU F, WANG H, WANG L, et al. Orthoreovirus outer-fiber proteins are substrates for SUMO-conjugating enzyme Ubc9[J]. Oncotarget, 2016, 7(48): 79814-79827. |
| [21] |
YU F, WANG L, WANG H, et al. Repression of SUMOylation pathway by grass carp reovirus contributes to the upregulation of PKR in an IFN-independent manner[J]. Oncotarget, 2017, 8(42): 71500-71511. |
| [22] |
XU S Y, LI J H, ZOU Y, et al. Development and efficacy of a grass carp reovirus (GCRV) outer capsid protein VP7 subunit vaccine[J]. Journal of Hunan Agricultural University(Natural Sciences), 2011, 37(6): 659-664. |
| [23] |
FIELDS S, SONG O K. A novel genetic system to detect protein-protein interactions[J]. Nature, 1989, 340(6230): 245-246. DOI:10.1038/340245a0 |
| [24] |
RAO Y, SU J. Insights into the antiviral immunity against grass carp (Ctenopharyngodon idella) reovirus (GCRV) in grass carp[J]. Journal of Immunology Research, 2015, 2015(2): 1-18. |
| [25] |
WANG Q, ZENG W, LIU C, et al. Complete genome sequence of a reovirus isolated from grass carp, indicating different genotypes of GCRV in China[J]. Journal of Virology, 2012, 86(22): 12466. DOI:10.1128/JVI.02333-12 |
| [26] |
张超, 王庆, 石存斌, 等. 草鱼呼肠孤病毒HZ08株的分离与鉴定[J]. 中国水产科学, 2010, 17(6): 1257-1263. |
| [27] |
徐洋, 郝贵杰, 沈锦玉, 等. 两株草鱼呼肠孤病毒江西株的分离与鉴定[J]. 淡水渔业, 2010, 40(3): 44-49. DOI:10.3969/j.issn.1000-6907.2010.03.008 |
| [28] |
WANG T, LI J, LU L. Quantitative in vivo and in vitro characterization of co-infection by two genetically distant grass carp reoviruses[J]. Journal of General Virology, 2013, 94(Pt6): 1301-1309. |
| [29] |
刘世旭, 王庆, 常藕琴, 等. 基因Ⅰ型草鱼呼肠孤病毒VP7蛋白合成肽抗体的制备及应用[J]. 南方农业学报, 2018, 49(9): 173-181. |



